斑马鱼成骨细胞体外培养方法
文献发布时间:2023-06-19 11:47:31
技术领域
本发明属于细胞培养技术领域,具体涉及一种斑马鱼脊椎骨组织成骨细胞的培养方法。
背景技术
斑马鱼在上世纪60年代由乔治·史特里辛格(George Streisinger)首次用于医学研究,并创造了第一个成功的脊椎动物克隆。斑马鱼与哺乳动物之间的许多信号通路高度保守,是发育生物学、医学研究中出色的动物模型之一。近年来,斑马鱼基因突变体和转基因品系在涉及骨发育系统的信号传导途径以及骨疾病研究和治疗中提供了极大的帮助。随着生物技术的不断发展鱼类细胞体外培养逐渐发展起来并且广泛应用,斑马鱼细胞体外培养也愈发重要。
成骨细胞是结缔组织细胞的一种,在骨生成和代谢过程中起关键作用,其分化、成熟是骨形成的前提,维持着骨形成的动态平衡。成骨细胞及骨细胞的培养技术在哺乳动物已经较成熟,但斑马鱼成骨细胞还未建立细胞系。
发明内容
本发明提供了一种利用斑马鱼脊椎组织进行成骨细胞体外培养的方法,建立了斑马鱼脊椎组织成骨细胞系,为斑马鱼骨发育机制及骨疾病研究提供工具。
本发明斑马鱼成骨细胞体外培养方法为:
一、斑马鱼成鱼消毒、麻醉;
二、获取斑马鱼脊椎;
三、斑马鱼脊椎用添加有5%青链霉素双抗(100×)的PBS缓冲液冲洗去除多余肌肉组织及结缔组织,再在添加有5%青链霉素双抗(100×)的M-199培养基中平衡2次、每次30分钟,然后将斑马鱼脊椎剪小成组织块,再将组织块在鲤鱼血清中浸润,之后接种于培养瓶瓶底,放入含有5%CO
四、细胞融合80%以上再用胰酶进行细胞消化,计数并传代,完成斑马鱼成骨细胞系的制备;
其中,步骤三中M-199完全培养基由M-199培养基、青链霉素双抗、庆大霉素、胎牛血清、鲤鱼血清、表皮细胞生长因子和碱性成纤维细胞生长因子组成,M-199完全培养基中青链霉素双抗的体积浓度为1%、庆大霉素的浓度为5μg/mL、胎牛血清的体积浓度为20%、鲤鱼血清的体积浓度为0.25%、表皮细胞生长因子的浓度为25ng/mL、碱性成纤维细胞生长因子的浓度为25ng/mL。
本发明方法的优点:
1、方法简单易行且成本较低,减少了鱼使用数量、避免使用胶原酶;
2、有效避免了原代组织用酶消化培养方法作用时间长、对细胞损伤大、影响细胞贴壁及成活的能力的问题;
3、优化培养基,筛选出培养基相对最适培养成分,能提供大量优质斑马鱼成骨细胞;
4、所得斑马鱼成骨细胞生物学特性稳定且增殖能力强,为斑马鱼成骨细胞体外实验提供稳定的基础材料。
附图说明
图1是实施例1中组织块细胞培养15天后在放大倍数为10倍的光镜下显示的细胞生长情况,大量细胞已从脊椎组织块边缘迁出,汇聚融合至80%以上;
图2是实施例1中步骤四细胞传代,P2细胞在10倍的光镜下拍摄的细胞照片,细胞形态成长梭形或多角形;
图3是实施例1中P10细胞碱性磷酸酶试剂盒染色后在放大倍数为40倍的光镜下拍摄的染色照片,通过多聚赖氨酸包被培养板使细胞形态及染色更明显,碱性磷酸酶染色后,细胞胞浆呈蓝色及深蓝色着染,显示ALP染色阳性(箭头标注胞浆蓝色深染);
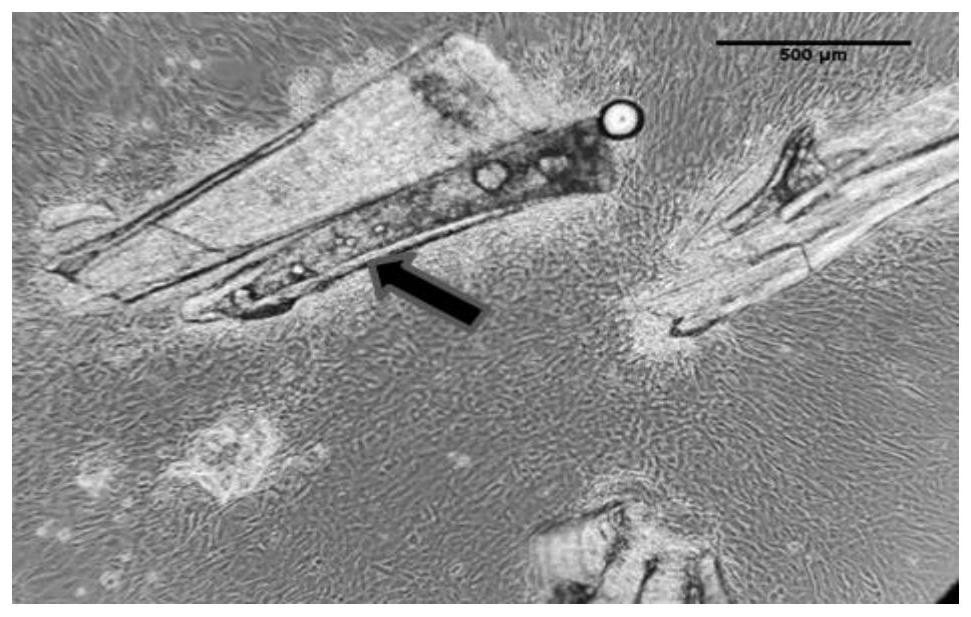
图4是实施例1中P10细胞茜素红染色后放大倍数为40倍的光镜下细胞染色照片,通过多聚赖氨酸包被培养板使细胞形态伸展,钙化部分成被红色深染(箭头所指为阳性区域);
图5是实施例1中P10细胞Von Kossa’s染色后在放大倍数为20倍的光镜下显示的细胞染色效果图,矿化结节被染成黑色(箭头所指为阳性区域);
图6是实施例1中P10细胞Geimsa染色后在放大倍数为40倍的光镜下细胞染色照片,可见细胞核呈蓝色深染,位于细胞中央;
图7是实施例1中P10细胞用鱼骨钙素(OT)ELISA试剂盒检测骨钙素含量的标准曲线示意图;
图8是实施例1中P10细胞秋水仙素处理后,染色体中期分裂相图及制备的染色体模型图,计数得成骨细胞中期分裂相的染色体数目2n=50,进行核型分析后结果显示,斑马鱼成骨细胞50条染色体中有5对中部着丝粒染色体(m),15对亚中部着丝粒染色体(sm)及5对亚端部着丝粒染色体(st),核型公式为2n=10m+30sm+10st,符合斑马鱼的染色体特征;
图9是实施例1中用CCK-8试剂盒对细胞培养基成分影响细胞生长进行检验培养96h结果图;
图10是实施例1中runx2a,bglapl和ALP在斑马鱼成骨细胞P30细胞RNA的半定量表达分析结果(β-actin为内参基因)图;
图11是实施例1中runx2a,bglapl和ALP在斑马鱼成骨组织细胞P30及斑马鱼肌肉细胞中的定量表达分析结果图;
图12是实施例1采用流式RNA-FISH技术检测本实施例P20细胞sp7基因表达情况结果图。
具体实施方式
本发明技术方案不局限于以下所列举具体实施方式,还包括各具体实施方式间的任意组合。
具体实施方式一:本实施方式斑马鱼成骨细胞体外培养方法按以下步骤进行:
一、斑马鱼成鱼消毒、麻醉;
二、获取斑马鱼脊椎;
三、斑马鱼脊椎用添加有5%青链霉素双抗(100×)的PBS缓冲液冲洗去除多余肌肉组织及结缔组织,再在添加有5%青链霉素双抗(100×)的M-199培养基中平衡2次、每次30分钟,然后将斑马鱼脊椎剪小成组织块,再将组织块在鲤鱼血清中浸润,之后接种于培养瓶瓶底,放入含有5%CO
四、细胞融合80%以上再用胰酶进行细胞消化,计数并传代,完成斑马鱼成骨细胞系的制备;
其中,步骤三中M-199完全培养基由M-199培养基、青链霉素双抗、庆大霉素、胎牛血清、鲤鱼血清、表皮细胞生长因子和碱性成纤维细胞生长因子组成,M-199完全培养基中青链霉素双抗的体积浓度为1%、庆大霉素的浓度为5μg/mL、胎牛血清的体积浓度为20%、鲤鱼血清的体积浓度为0.25%、表皮细胞生长因子的浓度为25ng/mL、碱性成纤维细胞生长因子的浓度为25ng/mL。
具体实施方式二:本实施方式与具体实施方式一的不同点是:步骤一斑马鱼成鱼消毒、麻醉:将斑马鱼成鱼用0.01%的高锰酸钾溶液浸泡,然后冰浴再放入酒精溶液浸泡,之后放入添加有抗生素的PBS中缓冲液。其它步骤及参数与实施方式一相同。
具体实施方式三:本实施方式与具体实施方式一的不同点是:步骤一斑马鱼成鱼消毒、麻醉:将4月龄斑马鱼成鱼用体积浓度为0.01%的高锰酸钾溶液浸泡20分钟,然后冰浴麻醉1分钟再放入75%酒精溶液浸泡1分钟,之后放入添加有5%青链霉素双抗(100×)的PBS缓冲液中。其它步骤及参数与实施方式一相同。
具体实施方式四:本实施方式与具体实施方式一至三之一的不同点是:步骤二获取斑马鱼脊椎:用灭菌手术刀自泄殖孔后方切下尾部,剥离尾部鱼体表皮肤并去除尾椎周围的肌肉组织,仅留脊椎部分。其它步骤及参数与实施方式一至三之一相同。
本实施方式步骤二在无菌操作台中操作。
具体实施方式五:本实施方式与具体实施方式一至四之一的不同点是:步骤三用添加有5%青链霉素双抗的PBS缓冲液冲洗组织块3次,每次冲洗5min,组织块大小约为2mm
具体实施方式六:本实施方式与具体实施方式一至五之一的不同点是:步骤四细胞融合80%以上再用0.25%胰酶进行细胞消化2~3min,之后用M-199完全培养基终止消化、离心、计数,每50万细胞传至1个T25培养瓶中,为P1细胞;P1细胞融合80%以上后用0.25%胰酶进行细胞消化2~3min,之后用M-199完全培养基终止消化、离心、计数,每50万细胞传至1个T25培养瓶中为P2细胞;以此类推传代至P30完成细胞系的制备。其它步骤及参数与实施方式一至五之一相同。
本实施方式中离心转速为1300r/min,离心时长为5分钟。
具体实施方式七:本实施方式与具体实施方式一至六之一的不同点是:将制备的斑马鱼成骨细胞系细胞冻存液处理后放入4℃预冷的冻存盒中然后放入-80℃冰箱,第二天转至液氮冷冻保存;其中,冻存液由DMSO和胎牛血清按1∶9的体积比组成;冻存液处理:冻存前一天,斑马鱼成骨细胞系细胞更换M-199完全培养基,冻存当天用PBS缓冲液洗涤细胞2次、再用0.25%胰酶消化,并吹打混匀成单细胞悬液后离心再用冻存液重悬。其它步骤及参数与实施方式一至六之一相同。
本实施方式中离心转速为1300r/min,离心时长为5分钟。
冻存的细胞计数4×10
具体实施方式八:本实施方式与具体实施方式七的不同点是:冻存的斑马鱼成骨细胞系细胞复苏方法:取出冻存的斑马鱼成骨细胞系细胞迅速放入38℃水浴锅,不断摇动至融化,转入含M-199完全培养基的离心管内1000r/min离心5min;去除上清,再加M-199完全培养基5ml,重悬细胞转至T25培养瓶内,摇晃均匀后置于含5%CO
复苏换液后约3天,斑马鱼成骨细胞系细胞长成单层,细胞状态良好。
实施例1
本发明斑马鱼成骨细胞体外培养的方法:
一、将4月龄斑马鱼成鱼用体积浓度为0.01%的高锰酸钾溶液浸泡20分钟,然后冰浴1分钟麻醉再放入75%酒精溶液浸泡1分钟,之后放入添加有青链霉素双抗(100×)的PBS缓冲液中;
二、获取斑马鱼脊椎:处理后成鱼转入无菌操作台内,用灭菌手术刀自泄殖孔后方切下整个尾部,剥离尾部鱼体表皮肤并去除尾椎周围的肌肉组织,仅留脊椎部分;
三、斑马鱼脊椎用添加有5%青链霉素双抗(100×)的PBS缓冲液冲洗3次,去除多余肌肉组织及结缔组织,再在添加有5%青链霉素双抗(100×)的M-199培养基中平衡2次、每次30分钟,然后用眼科剪将斑马鱼脊椎剪成2mm
四、组织块细胞融合至80%以上(15~20天),如图1所示,用0.25%胰酶进行细胞消化2~3min,之后用M-199完全培养基终止消化、离心、计数,每50万细胞传至1个T25培养瓶中,为P1细胞;P1细胞融合80%以上后用0.25%胰酶进行细胞消化2~3min,之后用M-199完全培养基终止消化、离心、计数,每50万细胞传至1个T25培养瓶中为P2细胞(如图2所示);以此类推传代至P30完成细胞系的制备。
成骨细胞系生化指标染色分析:
取本实施例P10细胞,接种于6孔细胞培养板,每孔10万细胞,每2天换液,待细胞融合至80%时,PBS洗2次,固定备用。其中,碱性磷酸酶染色及茜素红钙化结节染色细胞使用体积分数95%乙醇固定30min后染色;von kossa’s矿化结节染色使用多聚甲醛固定15min后染色;Giemsa细胞核染色使用甲醇固定10min后染色进行鉴定。
碱性磷酸酶试剂盒(碧云天C3206)染色显示细胞胞浆呈蓝色及深蓝色着染,即碱性磷酸酶染色结果阳性,结果如图3所示。茜素红染色后,钙化部分成被红色深染,结果如图4所示。Von Kossa’s染色后矿化结节被染成黑色块状,结果如图5所示。Giemsa染色结果如图6所示,显示斑马鱼脊椎骨组织细胞细胞核位于细胞中央,成骨细胞生物学特性鉴定结果呈大量阳性区域。
鱼骨钙素分泌分析:
根据上海双赢生物鱼骨钙素ELISA试剂盒使用说明,检测本实施例斑马鱼P10成骨细胞骨钙素的分泌情况。使用鱼骨钙素ELISA试剂盒对本实施例斑马鱼P10成骨细胞骨钙素含量进行测定,抗体-抗原-酶标抗体复合物使底物显色后,使用酶标仪在450nm波长下测定吸光度,得到标准曲线为:y=0.0007x+0.0034,R
成骨细胞系核型分析:
取本实施例P10细胞,传代1天后,更换10mL新鲜培养液,加入2μL秋水仙素(50μg/mL)培养16小时,胰蛋白酶消化重悬后,进行染色体制片,高倍显微镜下观察并统计染色体数目,结果显示斑马鱼P10成骨细胞50条染色体中有5对中部着丝粒染色体(m),15对亚中部着丝粒染色体(sm)及5对亚端部着丝粒染色体(st),核型公式为2n=10m+30sm+10st,NF=90,符合斑马鱼的染色体特征(如图8所示)。
成骨细胞增长曲线分析:
使用CCK-8试剂盒对细胞培养基成分影响细胞生长进行检验,分别验证20%血清、10%血清、5%血清及EGF、bFGF、鲤鱼血清和L-谷氨酰胺缺失对细胞生长速率及数量的影响,细胞的生长对L-谷氨酰胺缺失、鲤鱼血清及b-FGF敏感,受鲤鱼血清影响最明显,并且受胎牛血清含量影响,细胞在含有20%胎牛血清、0.25%鲤鱼血清的培养基中条件下,生长最快(如图9所示);
成骨细胞基因表达量分析:
取汇合度达到80%的本实施例P30细胞,PBS洗涤两次后,每个T75培养瓶内加入1ml Trizol,采用Trizol法提取RNA,采用RevertAid First Strand cDNA Synthesis Kit(Thermo Fisher,CA,USA)合成cDNA,以β-actin为内参,进行骨发育相关基因表达量分析。利用Primer Premier 5.0设计runx2a,bglapl,ALP上下游引物(如表1所示),通过琼脂糖电泳条带亮度初步判断基因表达情况,用PCR产物进行电泳以验证引物特异性和产物纯度(如图10所示),三个基因在斑马鱼成骨细胞中均有一定表达。使用Luna Universal qPCRMaster Mix(NEB,MA,USA)在ABI
表1
斑马鱼成骨细胞纯度分析:
采用流式RNA-FISH技术检测本实施例P20细胞sp7基因表达情况,上排为无sp7基因mRNA探针杂交的阴性对照,下排为sp7基因mRNA探针杂交的实验组;RNA-FISH流式细胞仪分析表明98%以上的成骨细胞均可表达sp7基因,显示所培养的P20斑马鱼成骨细胞具有较高的纯度(如图12所示)。
- 斑马鱼成骨细胞体外培养方法
- 兔软骨下骨成骨细胞体外扩增培养方法及应用
