一种基于调控信号通路的小鼠模型的构建方法及其应用
文献发布时间:2023-06-19 11:11:32
技术领域
本发明涉及生物技术领域,具体涉及一种基于调控信号通路的小鼠模型的构建方法及其应用。
背景技术
目前,耳聋问题受到人们的关注。2015年,约有5亿人听力丧失,约占世界人口的6.8%。这些数字远远高于2013年之前公布的估计数字,显示听力损失的人数在逐渐增加,说明全球听力保健的重要性日益突出。另外据WHO2018年数据显示有超过4.32亿成年人和3400万儿童患有致残性听力丧失,使其成为一个影响社会健康和经济的主要负担。听力障碍会导致社交孤立、抑郁和专业能力下降。
目前临床上尚无疗效确切的内耳靶向性药物可用于治疗感音神经性聋。由于哺乳动物耳蜗毛细胞不可再生,因此如何使毛细胞在损伤后修复和再生,从而在根本上治疗感音神经性聋是近年来听觉领域研究的重点。而提供一种非人类的动物模型作为研究与试验平台以表征毛细胞的修复与再生,同样具有重要的意义。
发明内容
针对现有技术的不足,本发明提出了一种基于调控信号通路的小鼠模型的构建方法及其应用。
本发明的目的可以通过以下技术方案实现:
一种小鼠模型的构建方法,包括以下步骤:
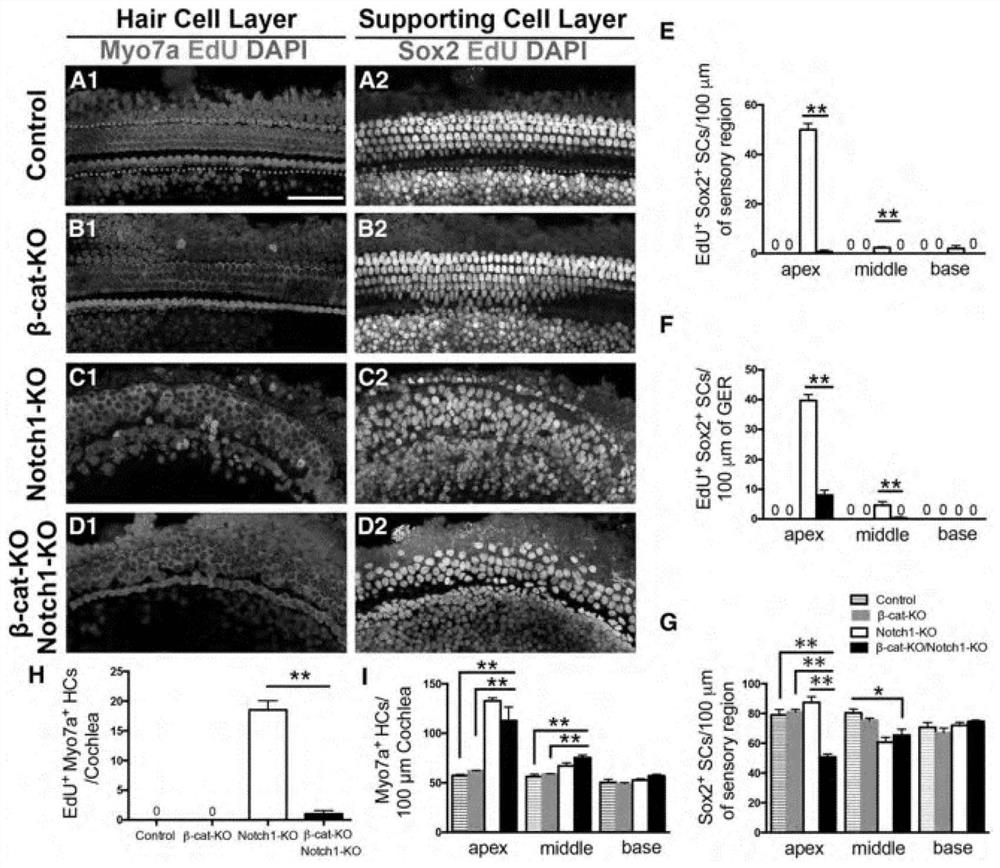
构建β-catenin敲除、Notch1敲除、以及两者双敲除的小鼠模型。在鼠龄为0或1天的时候,注射tamoxifen与EdU,鼠龄为7天时,解剖所述小鼠的基底膜进行免疫荧光实验,用myosin7a抗体标记毛细胞,用Sox2抗体标记支持细胞,并且对EdU+Sox2与EdU+Myo7a均阳性的细胞进行计数统计;
分别分离野生型对照组、β-catenin过表达(β-cat OE)、Notch1-KO以及β-cat OE/Notch1-KO鼠龄7天天小鼠基底膜,分别提取其RNA进行测序;
构建Atoh1过表达的小鼠,注射tamoxifen,小鼠取出基底膜进行免疫荧光实验,用myosin7a抗体标记毛细胞,用Sox2抗体标记支持细胞,并且对于EdU/Myo7a双阳性的细胞进行计数统计;
通过抑制YAP的表达调控Hippo信号通路,成球实验分析Hippo信号通路对表达Lgr5的祖细胞的增殖能力;
可选地,还包括以下步骤:
从Lgr5-EGFP-IRES-CreERT2、Lgr5-EGFP-CreERT2和Foxg1-loxp/loxp均阳性的小鼠耳蜗基底膜消化制成的单细胞悬液中,分选出表达Lgr5的内耳干细胞进行培养,对所述表达Lgr5的内耳干细胞进行细胞成球实验,进行免疫荧光染色检测所述表达Lgr5的内耳干细胞的增殖情况;
对鼠龄为30天的小鼠进行ABR检测;
鼠龄为2天的Sox2-CreERT2阳性;R26SmoM2转基因小鼠耳蜗在PBS培养液中分离培养,并进行新霉素损伤,在所述耳蜗中分离RNA,进行定量实时PCR检测。
可选地,所述分选出表达Lgr5的内耳干细胞的方法为细胞流式分选法。
可选地,所述抑制YAP的方法为:通过verteporfin、dobutamine作为YAP抑制剂抑制YAP表达。
可选地,所述ABR检测的实验条件为:将三个细针电极插入小鼠的颅顶、被测耳朵下方和背部靠近尾巴的位置。产生了4kHz、8kHz、12kHz、16kHz、24kHz和32kHz的ABR音点。
可选地,所述耳蜗的培养条件为:在37℃、5%CO2下,分别添加1%N2、2%B27和50μg/ml氨苄青霉素培养于DMEM/F12中。
另外本发明还提出了所述的小鼠模型研究在毛细胞再生中的应用
本发明的有益效果:
综上所述,通过调控Wnt、Notch、Atoh1信号通路后,探究对于毛细胞的再生是否有促进作用以及了解其调控机制,同时利用Lgr5-EGFP-CreERT2工具小鼠筛选出Lgr5+祖细胞,通过调控Hippo信号来促进内耳祖细胞的增殖或者分化能力,从而使这些调控信号通路的方法应用到促进活细胞毛细胞的再生。为了确定Foxg1参与HC再生的机制,用流式细胞术分离tdTomato+/Sox 2+干细胞,并提取mRNA进行实时定量qPCR,检测相关基因表达水平。调控HC生成的两个转录因子Atoh1和Gfi1 mRNA表达上调,Notch信号通路如Notch 1-3、Hes1、Hes5、Jag2、Hey1均显著下调,其他基因没有明显变化。因此敲除Foxg1主要通过下调细胞周期通路和Notch信号通路而产生新的HCS。本申请的小鼠模型反映的毛细胞的增殖与再生的情况,为Foxg1调控新生小鼠耳蜗支持细胞和祖细胞的HC再生提供了新的证据,具有重要的研究意义。
附图说明
下面结合附图对本发明作进一步的说明。
图1为本申请的敲除基因后对小鼠毛细胞增殖情况对比示意图;
图2为本申请的四种不同转基因小鼠基因表达的整体比较及基因表达模式的层次;
图3为本申请中β-cat OE/Notch1 KO/Atoh1 OE小鼠中促进毛细胞再生形况示意图;
图4为本申请中调控Hippo信号通路探究对流式分选出的内耳祖细胞增殖分化情况示意图;
图5为本申请的小鼠模型特异敲除Foxg1再生内毛细胞免疫荧光图;
图6为本申请中的小鼠模型Foxg1特异敲除后Lgr5细胞成球实验明场图及数量、直径统计图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
如图1~6所示,本发明的一个实施例中,提出了一种基于调控信号通路的小鼠模型的构建方法及其应用,可以包括以下步骤。
一、Wnt和Notch信号通路之间的相互作用
构建β-catenin敲除(β-cat KO),Notch1敲除(Notch1-KO),以及两者双敲除的小鼠。在鼠龄0天或鼠龄1天的时候注射tamoxifen,从鼠龄1天到鼠龄6天中每两天注射一次EdU,鼠龄7天解剖小鼠基底膜进行免疫荧光实验,用myosin7a抗体标记毛细胞,用Sox2抗体标记支持细胞,并且对EdU/Sox2双阳性与EdU/Myo7a双阳性的细胞进行计数统计。
二、对Wnt,Notch信号通路的调控进行了转录组学分析,具体步骤可以是分别分离野生型对照组、β-catenin过表达(β-cat OE)、Notch1-KO以及β-cat OE/Notch1-KO鼠龄7天天小鼠基底膜,每组取6-8个基底膜使用Trizol提取RNA后,进行RNA测序。将得到的RNA测序结果进行生物信息学分析,找出明显差异基因以及涉及的生物学功能。
三、Wnt、Notch、Atoh1共调控促进毛细胞再生
构建Atoh1过表达(Atoh1-OE)的小鼠,以及Atoh1-OE/β-cat OE、Atoh1-OE/β-catOE/Notch1-KO,在鼠龄0或鼠龄1天的时候注射tamoxifen,然后在鼠龄5天时分别解剖这些不同基因型小鼠取出基底膜进行免疫荧光实验,用myosin7a抗体标记毛细胞,用Sox2抗体标记支持细胞,并且对于EdU/Myo7a双阳性的细胞进行计数统计。
四、调控Hippo信号通路探究对流式分选出的内耳祖细胞增殖分化的影响
1)小分子药物通过激活或抑制YAP的表达调控Hippo信号通路
利用小分子药物verteporfin、dobutamine作为YAP抑制剂,XMU-MP-1作为YAP激活剂,用这三种小分子药物不同剂量体外处理鼠龄3天的基底膜后,提取蛋白,通过Westernblotting实验确定一个合适的实验浓度;
2)成球实验分析Hippo信号通路对Lgr5+祖细胞的增殖能力
通过流式分选在Lgr5-EGFP-CreERT2小鼠耳蜗中分离出Lgr5+祖细胞,然后将分选出的祖细胞放入96孔板,每孔平均细胞个数为200个培养5天,设计四个组分别为0.5μMVerteporfin、1μM dobutamine、0.5μM XMU-MP-1三个实验组和一个DMSO作为对照组,从种细胞第一天开始连续5天加入药物培养。第5天进行明场拍摄对细胞球的数量以及直径进行统计;
3)Hippo信号通路对Lgr5+祖细胞的分化能力影响
通过流式分选在Lgr5-EGFP-CreERT2小鼠耳蜗中分离出Lgr5+祖细胞,将分选出的Lgr5+祖细胞每孔5000个加入到laminin-coated的四孔皿中培养10天,在第4到7天中加入10μM EdU,与成球实验一样的小分子药物从第3到9天加入。第10天培养结束后进行免疫荧光实验,用myosin7a抗体标记毛细胞,对毛细胞数目、细胞球数目、EdU+/Myo7a+毛细胞数目进行统计。
五、Foxg1信号通路促进内耳干细胞转分化为毛细胞
1)条件性敲除Foxg1。
采用Sox2CreER/+Foxg1loxp/loxp小鼠和Lgr5-EGFPCreER/+Foxg1loxp/loxp小鼠交配得到三阳性子代,再通过注射Tamoxifen在支持细胞和内耳干细胞中特异性敲除Foxg1。在不同时间点处死小鼠,进行耳蜗检测。利用免疫荧光技术检测毛细胞生长、内耳干细胞增殖等情况,用分别用Myosin7a、Sox2、EDU标记毛细胞、支持细胞和增殖的细胞。新生小鼠(鼠龄0-7天)免疫荧光检测Myosin7a、Sox 2、Foxg 1、Ctbp 2、PSD 95、Tuj1。
2)通过ABR实验对小鼠进行听力阈值检测。
ABR试验在隔音室进行,三个细针电极插入小鼠颅尖、耳底和尾部附近。产生4kHz、8kHz、12kHz、16kHz、24kHz和32kHz的ABR音调点。听觉阈值是通过将声强从90dB减为10dB,直至识别出第一波的最低声强来确定的。利用GraphPad Prism 6软件对ABR数据进行分析。
3)使用成球实验检测细胞增殖情况。
Lgr5-EGFPCreER/+Foxg1loxp/loxp小鼠和Lgr5-EGFPCreER/+对照组于鼠龄1天注射Tamoxifen,鼠龄3天时处死。解剖耳蜗,用胰蛋白酶消化成单细胞,对Lgr5+细胞进行FAC分选。筛选的细胞在DMEM/F12的全培养基中,分别以2细胞/μ1的密度培养5d。然后用胰蛋白酶消化成单细胞,并以同样的方式培养下一代。在培养结束时,用蔡司显微镜(HAL 100)对每一代每孔内的所有球体进行图像拍摄,并对球体数目和直径进行量化。
4)使用细胞球分化实验检测分化情况。
与成球实验很相似。在培养的第2、3、4天在培养液中加入EdU来检测Lgr5阳性内耳干细胞的增殖情况。
5)采用Q-PCR等技术探究Foxg1基因参与毛细胞再生的分子机制。
六、Shh基因对于Lgr5内耳干细胞增殖以及分化的影响
1)从Lgr5-EGFP-IRES-CreERT2、Lgr5-EGFP-CreERT2和Foxg1-loxp/loxp均阳性的小鼠耳蜗基底膜消化制成的单细胞悬液中,利用流式细胞仪分选出表达Lgr5的内耳干细胞进行培养。
2)细胞成球实验
加入不同梯度的Shh重组蛋白,然后统计细胞球的数目和大小,从而观察Shh基因的存在对细胞成球能力的影响。同时观察来自于Foxg1 cKD的Lgr5阳性细胞的成球能力,量化其数目与大小。
3)进行免疫荧光染色
Myosin7a、Sox2、Foxg1、Ctbp2、PSD95和Tuj-1,在blocking后加入EdU来检测表达Lgr5的内耳干细胞的增殖情况。同时,通过分化实验,观察,毛细胞数目、细胞球数目、以及EdU、Myo7a、Sox2均显示阳性的毛细胞数目的变化。
4)对鼠龄为30天的小鼠进行ABR检测,ABR测试在隔音室进行,将三个细针电极插入小鼠的颅顶、被测耳朵下方和背部靠近尾巴的位置。产生了4kHz、8kHz、12kHz、16kHz、24kHz和32kHz的ABR音点。听阈的确定是通过将声强从90分贝以10分贝的步长降低到可以识别第一波的最低声强来确定的。
5)耳蜗外植体培养,并进行新霉素损伤。
鼠龄为2天的Sox2-CreERT2阳性;R26SmoM2转基因小鼠耳蜗在PBS培养液中分离培养,在37℃、5%CO2条件下,分别添加1%N2、2%B27和50μg/ml氨苄青霉素培养于DMEM/F12中。用4-OH三苯氧胺诱导Cre活性,EDU标记增殖细胞。在新霉素处理组,移植的耳蜗上皮细胞用0.5mM硫酸新霉素处理,培养24h后,再加入0.5mM硫酸新霉素。以不含SmoM2等位基因的窝产仔耳蜗外植体为对照。
6)从耳蜗中分离总RNA。
以1μg总RNA为模板,采用GoScriptTM反向转录系统逆转录合成cDNA,并进行定量实时PCR。
综上所述,通过调控Wnt、Notch、Atoh1信号通路后,探究对于毛细胞的再生是否有促进作用以及了解其调控机制,同时利用Lgr5-EGFP-CreERT2工具小鼠筛选出Lgr5+祖细胞,通过调控Hippo信号来促进内耳祖细胞的增殖或者分化能力,从而使这些调控信号通路的方法应用到促进活细胞毛细胞的再生。为了确定Foxg1参与HC再生的机制,用流式细胞术分离tdTomato+/Sox 2+干细胞,并提取mRNA进行实时定量qPCR,检测相关基因表达水平。调控HC生成的两个转录因子Atoh1和Gfi1 mRNA表达上调,Notch信号通路如Notch 1-3、Hes1、Hes5、Jag2、Hey1均显著下调,其他基因没有明显变化。因此敲除Foxg1主要通过下调细胞周期通路和Notch信号通路而产生新的HCS。本申请的小鼠模型反映的毛细胞的增殖与再生的情况,为Foxg1调控新生小鼠耳蜗支持细胞和祖细胞的HC再生提供了新的证据,具有重要的研究意义。因此,本实施例中的一小鼠模型的构建方法能够应用在毛细胞再生的研究中。
在本说明书的描述中,参考术语“一个实施例”、“示例”、“具体示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。
- 一种基于调控信号通路的小鼠模型的构建方法及其应用
- 一种基于Wnt/β-catenin信号通路的药物筛选模型的构建方法和应用
