一种促进DNT细胞扩增与活化的方法
文献发布时间:2023-06-19 11:26:00
技术领域
本发明属于生物领域,涉及免疫细胞培养,具体涉及一种促进DNT细胞扩增与活化的方法。
背景技术
双阴性T(Double Negative T,DNT)细胞是指人外周血中正常存在的CD3+CD4-CD8-的T细胞亚群,占T细胞总数1-5%。过去,DNT细胞被视为一种调节性T细胞,过继转移DNT细胞可以防止同种异体移植物排斥反应、移植物抗宿主病和自身免疫性糖尿病。后来,科学家逐渐发现DNT细胞对肿瘤细胞具有杀伤作用。
JB·李(lee JB)等研究表明健康志愿者来源的同种异体DNT细胞可以靶向急性髓细胞白血病(Acute Myelocytic Leukemia,AML)细胞,与传统化疗有着协同的抗肿瘤作用。KJ·杨(Young KJ)等将淋巴瘤细胞与主要组织相容性复合体(major histocompatibilitycomplex,MHC)Ⅰ类分子不匹配的脾细胞一同注入小鼠,发现超过75%的小鼠幸存下来,幸存小鼠与罹患淋巴瘤小鼠相比,外周血中DNT细胞增加了15倍。接下来的实验证明DNT细胞对A20淋巴瘤细胞具有杀伤作用,初步证明了DNT细胞的抗肿瘤作用。S·沃尔克在淋巴瘤患者和外周血中分离出一群DNT细胞,它们可以特异性识别淋巴瘤相关抗原GP100,对于表达GP100的靶细胞和HLA-A2+GP100淋巴瘤细胞具有细胞毒作用。有学者发现体外扩增的γδ+DNT细胞对肺癌细胞具有杀伤作用。最新研究表明DNT细胞对肺癌和白血病患者标本来源的异种移植肿瘤模型有显著的抗肿瘤作用,并且输注同种异体的DNT细胞不会诱发移植物抗宿主病。
DNT细胞表面表达CD3分子和αβ-或γδ-T细胞受体(T Cell Receptor,TCR),但不表达CD4和CD8分子,也不结合恒定型自然杀伤T(invariant Nature Killer T,iNKT)细胞特异性αGalCer加载的CD1d四聚物,因此不同于常规的T细胞、NK细胞和NKT细胞,DNT细胞具有NK细胞不具备的T细胞受体TCR活性,能为特异性抗原活化,具有更长的体内持续时间,是一种极有希望用于治疗临床多种肿瘤的通用型T细胞药物。
树突状细胞(Dendritic Cells,DC)是目前发现的功能最强的抗原递呈细胞。DC细胞能摄取、加工及呈递抗原,启动T细胞介导的免疫反应。成熟DC细胞可有效的诱导抗原特异性T细胞增殖和活化,是机体抗肿瘤免疫反应的主要启动者和参与者。
DNT细胞表面表达TCR受体能识别主要组织相容性复合体分子,还能够以非肿瘤抗原限制性的方式杀伤肿瘤细胞,同时防止同种异体移植物排斥反应、移植物抗宿主反应,这为采用DNT细胞治疗肿瘤开辟了一条新途径。
传统的DNT细胞培养方法大多依靠CD3抗体和CD28抗体等来模拟抗原呈递过程刺激单个核细胞向DNT细胞转化、增殖和活化,不具备抗原特异性。本发明将DNT细胞与DC细胞联合培养,通过DC细胞以主要组织相容性抗原与肿瘤抗原复合体的形式呈递抗原,特异性地促进了DNT细胞的增殖和活化。模拟了从特异辨别肿瘤细胞到消灭肿瘤细胞的全过程,即利用肿瘤细胞抗原来激活DC细胞,使其特异性地吞噬和呈递多种肿瘤抗原,进一步刺激DNT细胞的增殖和活化,提升DNT细胞的杀瘤作用。
发明内容
发明目的:针对上述现有技术的不足,本发明提供了一种利用肿瘤膜抗原负载DC细胞外囊泡促进DNT细胞扩增与活化的方法,该方法通过提取肿瘤细胞膜抗原促进DC细胞成熟与活化,再利用肿瘤膜抗原负载DC细胞外囊泡促进DNT细胞扩增,提高DNT细胞杀伤肿瘤的活性。
技术方案:一种促进DNT细胞扩增与活化的方法,包括以下步骤:
(1)、制备肿瘤细胞膜抗原粗液;
(2)、肿瘤细胞膜抗原负载DC细胞培养;
(3)、肿瘤细胞膜抗原负载DC细胞外囊泡制备;
(4)、利用肿瘤细胞膜抗原负载DC细胞外囊泡促进DNT细胞扩增与活化。
进一步地,步骤(1)包括以下步骤:
(11)、对于来自外科手术或活检瘤组织,用生理盐水清洗2~3次后,在无菌条件下用灭菌的剪刀和镊子剔除脂肪、筋膜和大血管,称重后用手术剪刀将肿瘤组织切成1~5立方毫米的小块后,放入无菌的组织研磨器中,加入1~5倍肿瘤组织重量/体积的预冷细胞裂解液,将组织研磨器置于冰水浴中进行肿瘤组织的研磨和均质,得到组织均浆,其中:
肿瘤组织的重量以克计;
预冷细胞裂解液以毫升计;
(12)、将步骤(11)所得的组织匀浆经300~500目无菌细胞筛网过滤,滤液收集在无菌离心管中,滤渣置于研磨器中加入1~3倍肿瘤组织重量/体积的预冷细胞裂解液再次进行研磨,再经300~500目细胞筛网过滤,用1~3倍肿瘤组织重量/体积预冷细胞裂解液淋洗研磨器,并经筛网滤入离心管中得到肿瘤组织裂解液,其中:
肿瘤组织的重量以克计;
预冷细胞裂解液以毫升计;
(13)、将步骤(12)所得盛放有肿瘤组织裂解液的离心管连续冷冻融化2~3次,完成后将该离心管置于离心机中以500~1000转/分钟离心10~15分钟,收集上清液,其中:
冷冻融化的条件为:将盛放有肿瘤组织裂解液的离心管置于-80℃~-60℃条件下冷冻存储8~24小时后,转移到4℃~9℃条件下融解18~48小时;
(14)、在步骤(13)所得的上清液中,按重量/体积0.5%~2%的比例加入脱氧胆酸钠离子去污剂,然后在1~8℃的条件下连续搅拌1~3小时后,40000~100000转/分钟离心20~60分钟,吸去表层的油脂后,收集提取液,无菌密封后置-80℃~-60℃冰箱中保存,得到肿瘤细胞膜抗原粗液。
更进一步的,步骤(11)中的外科手术或活检瘤组织取材时避免用退变组织。
更进一步地,步骤(11)中的细胞裂解液的制备包括以下步骤:
(111)配置含有0.05%~0.2%苯甲基磺酰氯、0.1%~0.6%氯化钠的水溶液;
(112)经115~125℃灭菌30~60分钟后,预冷至1~5℃存放即可。
进一步地,步骤(1)包括以下步骤:
S11、将采集的胸腹水经200~400目无菌细胞筛网过滤,分装在称过重量的刻度离心管中,用2500~3500转/分钟的转速离心10-30分钟,弃上清并称重计算沉淀物重量后,在沉淀物中加入3~10倍重量/体积的预冷细胞裂解液,用吸管吹打混合均匀,其中:
胸腹水的沉淀物以克计;
预冷细胞裂解液以毫升计;
S12、将步骤S11的离心管密封后置冰水浴中孵育10-30分钟,用组织匀浆器以2500~3500转/分钟的转速上下匀浆粉碎4~8次后,然后反复冻融三次使滤液中的细胞完全裂解得到细胞冻融液,其中:冻融包括以下步骤:
将离心管放入-80℃~-60℃冰箱中冻存8~24小时,取出后置4℃~9℃水浴中融解18~48小时;
S13、将步骤S12所得的细胞冻融液分装在高速离心管中,在1~5℃以500~1000转/分钟的转速离心10-15分钟,吸取上层液体分装在已确定重量的高速离心管中,按重量/体积0.5%~2%的比例加入脱氧胆酸钠离子去污剂,在1℃~8℃的条件下连续搅拌1~3小时后,以20000~50000转/分钟的转速离心20~60分钟,吸去表层的油脂和上清液,收集沉淀物,无菌密封后置-80℃~-60℃冰箱中保存,得到肿瘤细胞膜抗原粗液。
进一步地,肿瘤细胞包括卵巢癌细胞、黑色素瘤细胞、乳腺癌细胞、肺癌细胞、胃癌细胞、结肠癌细胞、肝癌细胞、膀胱癌细胞、白血病细胞、胶质瘤细胞中的一种或多种。
更进一步地,步骤S11中的细胞裂解液的制备包括以下步骤:
(111)配置含有0.05%~0.2%苯甲基磺酰氯、0.1%~0.6%氯化钠的水溶液;
(112)经115~125℃灭菌30~60分钟后,预冷至1~5℃存放即可。
进一步地,步骤(2)包括以下步骤:
(21)、无菌抽取健康人的外周血30~200ml,肝纳素抗凝并充分混匀,避免凝血;
(22)、在室温条件下,将外周血600~2000转/分钟的转速在1~10℃条件下离心10~20分钟,收集上层血浆于离心管中,置50℃~60℃水浴中加热20~60分钟后,在1℃~4℃条件下静置8~24小时,经1000~2500转/分钟的转速离心10~30分钟,收集上层的灭活血浆于无菌密封容器中,置1℃~4℃条件下保存待用,然后向细胞沉淀中加入生理盐水至外周血等体积,缓缓重悬外周血细胞;
(23)、准备50毫升无菌离心管2~10支,无菌条件下在其中分别加入20毫升的淋巴细胞分离液,并在淋巴分离液的上面分别加入20~25毫升步骤(22)所得重悬外周血细胞,配平离心管后,600~2000转/分钟的转速在1~10℃条件下离心10~20分钟,弃去上清,用灭菌毛细吸管收集淋巴细胞分离液表层细胞;
(24)、将步骤(23)所得的淋巴细胞分离液表层细胞移至50ml—次性无菌离心管中,用生理盐水反复洗涤并离心收集白色细胞层2~4次,即得到外周血单个核细胞,其中:收集白色细胞层包括以下步骤:
向所述—次性无菌离心管中加入3~10倍体积的预冷至1~10℃的生理盐水进行重悬和洗涤,600~2000转/分钟的转速在1~10℃条件下离心10~20分钟,收集白色细胞层;
(25)、将步骤(24)所得外周血单个核细胞用3~8倍体积的RPMI1640培养基重悬后,置细胞培养瓶中于37℃、5%CO
(26)、在步骤(25)处理后的原培养瓶中加入1~5毫升生理盐水,润洗贴壁的DC细胞,吸出弃掉洗液后,在培养瓶中加入条件培养基于37℃、5%CO
所述条件培养基为含有5~20%胎牛血清的RPMI1640培养基,其中还添加有终浓度为500~2500U/mL的GM-CSF、500~2500U/mL的IL-4;
贴壁的DC细胞于37℃、5%CO
更进一步地,步骤(3)包括以下步骤:
(31)、在步骤(26)的贴壁DC细胞培养的第4天~第6天,在培养基中加入步骤S13得到的肿瘤细胞膜抗原粗液至体积比0.1~2.0:100,每天按质量体积浓度500~2500U/mL分别补充GM-CSF和IL-4,同时分别加入TNF-α和自体灭活血浆至质量体积浓度20~200ng/mL和1~5%;
(32)、在贴壁DC细胞培养的第7天,显微镜下观察肿瘤细胞膜抗原负载DC细胞的数量、形态特征和分布情况后,将细胞培养瓶置于紫外线下照射30~120分钟,紫外线辐射能量为8~16mj/cm
(33)、用与上清液等体积的1℃~4℃PBS缓冲液重悬高速离心管中的沉淀物,以14000~100000g转速离心50~120分钟,弃上清,收集沉淀并再次洗涤和离心后,称重计算所得沉淀重量,用PBS缓冲液分散备用,即得肿瘤细胞膜抗原负载DC细胞外囊泡悬液。
更进一步地,步骤(4)包括以下步骤:
(41)、取步骤(25)所得存放有非贴壁外周血单个核细胞细胞悬液的离心管,600~2000转/分钟的转速在1℃~10℃条件下离心10~20分钟,取细胞沉淀,然后通过细胞负性分选法去除该细胞沉淀中的CD8+T细胞、CD4+T细胞、CD56+NK细胞,收集CD8-、CD4-和CD56-的单个核细胞悬液进行培养;
(42)、用商业化的磁珠分选缓冲液MACS重悬细胞沉淀,调节浓度为1~2×10
经600~2000转/分钟的转速在1℃~10℃条件下离心10~20分钟,弃上清,用等量1~4℃预冷的MACS重悬并洗涤细胞1~3次,重悬细胞后按每10
经600~2000转/分钟的转速在1℃~10℃条件下离心10~20分钟,弃上清,用等量1℃~4℃预冷的MACS重悬并洗涤细胞1~3次,弃上清;
用1℃~4℃预冷的MACS重悬并调整细胞浓度在1~2×10
(43)、将步骤(42)所得DNT细胞悬液经600~2000转/分钟的转速在1℃~10℃条件下离心10~20分钟,弃上清,用DNT条件培养液重悬细胞,调整浓度为1~2×10
所述CD3抗体包被细胞培养瓶为提前1~3小时加入抗人CD3抗体的125ml培养瓶,每瓶加CD3抗体2~5ml,CD3抗体浓度为2~10ug/ml,放置于37℃培养箱静置孵育,取出时吸去瓶中液体;
所述DNT条件培养液采用x-vivo 15培养基,在其中添加灭活血浆1~5%,添加CD3抗体终浓度至500~5000ng/ml,添加重组人白介素IL-2至20~200ng/ml;
在细胞培养的第2天和第3天,每天补充添加灭活血浆至1~5%,添加卡介苗至2~10ug/ml,添加重组人白介素IL-2至20~200ng/ml;
在细胞培养的第4天,添加一倍体积的DNT条件培养液,同时补充添加灭活血浆至1~5%,添加CD3抗体终浓度至500~5000ng/ml,添加卡介苗至2~10ug/ml,添加重组人白介素IL-2至20~200ng/ml,添加重组人白介素IL-4至10~50ng/ml;
在细胞培养的第5~6天,每天添加CD28抗体至终浓度500~5000ng/ml,补充添加灭活血浆至1~5%,添加CD3抗体终浓度至500~5000ng/ml,添加重组人白介素IL-2至20~200ng/ml,添加重组人白介素IL-4至10~50ng/ml;
在细胞培养的第7天,对DNT细胞进行细胞计数,加入DNT条件培养基调整终浓度为1~2×10
(44)从培养瓶中取出细胞悬液分装于50毫升无菌离心管中,600~2000转/分钟的转速在1℃~10℃条件下离心10~20分钟,弃上清,用10~20ml生理盐水重悬、洗涤细胞后,600~2000转/分钟的转速在1℃~10℃条件下离心10~20分钟,如此重悬、洗涤2~3次后,用10ml注射器抽取人血清白蛋白1~5ml加入细胞沉淀表面,同时加入生理盐水至10~50ml重悬细胞,即得到DNT细胞。
进一步地,在步骤(43)的连续培养过程中,每隔3天进行一次细胞计数,根据细胞数量添加DNT条件培养液,调整终浓度为1~2×10
进一步地,在步骤(43)的连续培养过程中,每天在显微镜下观察DNT细胞的形态学特征和生长情况;在培养结束时,用细胞计数仪进行计数,同时在培养结束时,在显微镜下观察DNT细胞的形态学特征,用细胞计数仪进行计数并计算细胞活率。
有益效果:本发明公开的一种促进DNT细胞扩增与活化的方法具有以下有益效果:
1、传统肿瘤抗原制备方法大多使用了肿瘤细胞裂解后的水溶性内含物,其中胞内抗原占据大多数,由此激活的特异性细胞免疫难以对完整的肿瘤细胞表面进行识别和发动攻击,本发明利用肿瘤细胞膜碎片来提供肿瘤细胞膜抗原。
2、DC细胞是已知体内功能最强、唯一能活化静息T细胞的专职抗原提呈细胞,是启动、调控和维持免疫应答的中心环节,本发明利用肿瘤细胞膜抗原粗液来激活DC细胞,制备肿瘤细胞膜抗原负载DC细胞及其外分泌囊泡,使其特异性地呈递多种肿瘤细胞膜抗原。
3、在DNT细胞培养体系中加入肿瘤细胞膜抗原负载DC细胞外囊泡,拟合从DC细胞特异辨别肿瘤细胞膜抗原到特异性呈递抗原并活化DNT细胞消灭肿瘤细胞的生物效应过程,即利用肿瘤细胞膜抗原来激活DC细胞,使其吞噬、处理并以胞外囊泡和外泌体等形式呈递多种肿瘤细胞膜抗原,进一步刺激DNT细胞的增殖和活化,提升DNT细胞的杀瘤作用和特异性。
附图说明
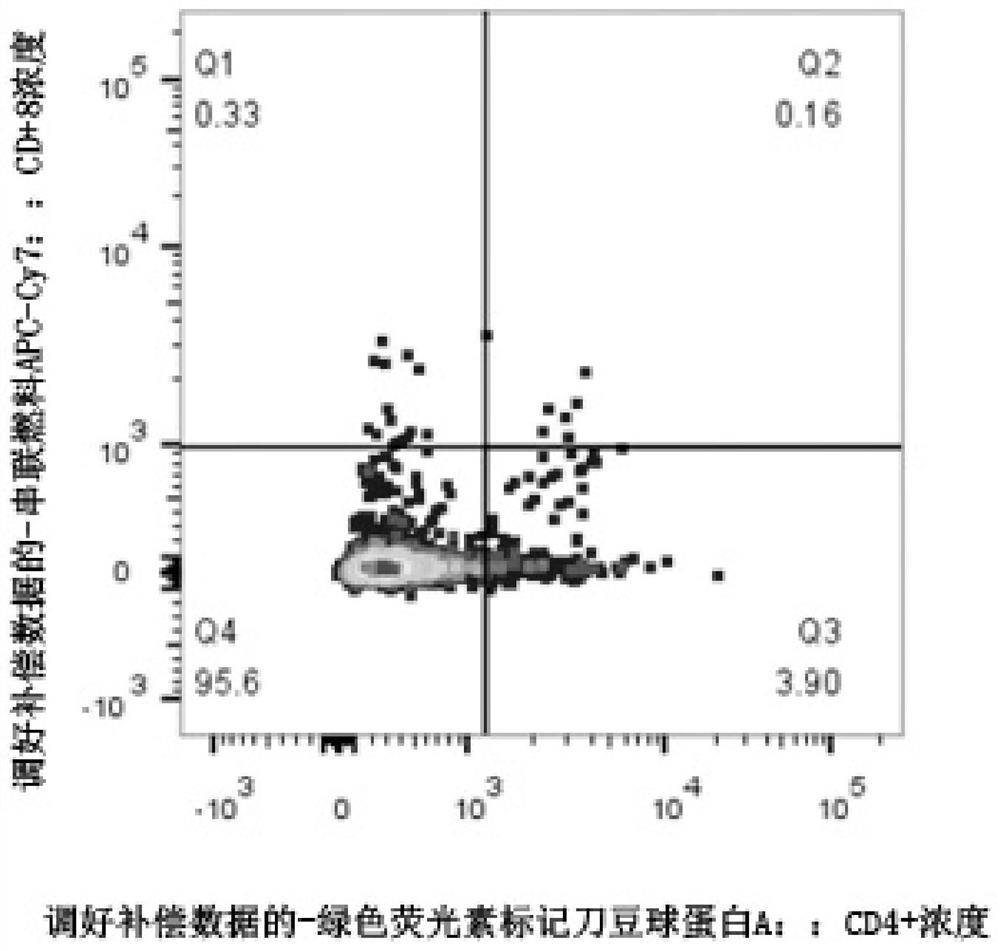
图1为DNT细胞的流式检测图。
图2a为肿瘤细胞膜抗原粗液共培养DC细胞的镜下图。
图2b为常规培养DC细胞的镜下图。
图3a为肿瘤细胞膜抗原负载DC细胞外囊泡共培养的DNT细胞镜下图。
图3b为常规培养的DNT细胞镜下图。
图4为DNT细胞培养液中炎性因子IL-2、IL-4和IFN-γ含量的变化特征图。
具体实施方式:
下面对本发明的具体实施方式详细说明。
具体实施例1
一种促进DNT细胞扩增与活化的方法,包括以下步骤:
(1)、制备肿瘤细胞膜抗原粗液;
(2)、肿瘤细胞膜抗原负载DC细胞培养;
(3)、肿瘤细胞膜抗原负载DC细胞外囊泡制备;
(4)、利用肿瘤细胞膜抗原负载DC细胞外囊泡促进DNT细胞扩增与活化。
进一步地,步骤(1)包括以下步骤:
(11)、对于来自外科手术或活检瘤组织,用生理盐水清洗2次后,在无菌条件下用灭菌的剪刀和镊子剔除脂肪、筋膜和大血管,称重后用手术剪刀将肿瘤组织切成1立方毫米的小块后,放入无菌的组织研磨器中,加入1倍肿瘤组织重量/体积的预冷细胞裂解液,将组织研磨器置于冰水浴中进行肿瘤组织的研磨和均质,得到组织均浆,其中:
肿瘤组织的重量以克计;
预冷细胞裂解液以毫升计;
(12)、将步骤(11)所得的组织匀浆经300目无菌细胞筛网过滤,滤液收集在无菌离心管中,滤渣置于研磨器中加入1倍肿瘤组织重量/体积的预冷细胞裂解液再次进行研磨,再经300目细胞筛网过滤,用1倍肿瘤组织重量/体积预冷细胞裂解液淋洗研磨器,并经筛网滤入离心管中得到肿瘤组织裂解液,其中:
肿瘤组织的重量以克计;
预冷细胞裂解液以毫升计;
(13)、将步骤(12)所得盛放有肿瘤组织裂解液的离心管连续冷冻融化2次,完成后将该离心管置于离心机中以500转/分钟离心10分钟,收集上清液,其中:
冷冻融化的条件为:将盛放有肿瘤组织裂解液的离心管置于-80℃条件下冷冻存储8小时后,转移到4℃条件下融解48小时;
(14)、在步骤(13)所得的上清液中,按重量/体积0.5%的比例加入脱氧胆酸钠离子去污剂,然后在1℃的条件下连续搅拌1小时后,40000转/分钟离心60分钟,吸去表层的油脂后,收集提取液,无菌密封后置-80℃冰箱中保存,得到肿瘤细胞膜抗原粗液。
更进一步的,步骤(11)中的外科手术或活检瘤组织取材时避免用退变组织。
更进一步地,步骤(11)中的细胞裂解液的制备包括以下步骤:
(111)配置含有0.05%苯甲基磺酰氯、0.1%氯化钠的水溶液;
(112)经115℃灭菌60分钟后,预冷至1℃存放即可。
进一步地,肿瘤细胞为卵巢癌细胞。
进一步地,步骤(2)包括以下步骤:
(21)、无菌抽取健康人的外周血30ml,肝纳素抗凝并充分混匀,避免凝血;
(22)、在室温条件下,将外周血600转/分钟的转速在10℃条件下离心10分钟,收集上层血浆于离心管中,置50℃水浴中加热60分钟后,在1℃条件下静置24小时,经1000转/分钟的转速离心30分钟,收集上层的灭活血浆于无菌密封容器中,置1℃条件下保存待用,然后向细胞沉淀中加入生理盐水至外周血等体积,缓缓重悬外周血细胞;
(23)、准备50毫升无菌离心管2支,无菌条件下在其中分别加入20毫升的淋巴细胞分离液,并在淋巴分离液的上面分别加入20毫升步骤(22)所得重悬外周血细胞,配平离心管后,600转/分钟的转速在10℃条件下离心10分钟,弃去上清,用灭菌毛细吸管收集淋巴细胞分离液表层细胞;
(24)、将步骤(23)所得的淋巴细胞分离液表层细胞移至50ml—次性无菌离心管中,用生理盐水反复洗涤并离心收集白色细胞层2次,即得到外周血单个核细胞,其中:收集白色细胞层包括以下步骤:
向所述—次性无菌离心管中加入3倍体积的预冷至1℃的生理盐水进行重悬和洗涤,600转/分钟的转速在1℃条件下离心10分钟,收集白色细胞层;
(25)、将步骤(24)所得外周血单个核细胞用3倍体积的RPMI1640培养基重悬后,置细胞培养瓶中于37℃、5%CO
(26)、在步骤(25)处理后的原培养瓶中加入1毫升生理盐水,润洗贴壁的DC细胞,吸出弃掉洗液后,在培养瓶中加入条件培养基于37℃、5%CO
所述条件培养基为含有5%胎牛血清的RPMI1640培养基,其中还添加有终浓度为500U/mL的GM-CSF、500U/mL的IL-4;
贴壁的DC细胞于37℃、5%CO
更进一步地,步骤(3)包括以下步骤:
(31)、在步骤(26)的贴壁DC细胞培养的第4天,在培养基中加入步骤S13得到的肿瘤细胞膜抗原粗液至体积比0.1:100,每天按质量体积浓度500U/mL分别补充GM-CSF和IL-4,同时分别加入TNF-α和自体灭活血浆至质量体积浓度20ng/mL和1%;
(32)、在贴壁DC细胞培养的第7天,显微镜下观察肿瘤细胞膜抗原负载DC细胞的数量、形态特征和分布情况后,将细胞培养瓶置于紫外线下照射30分钟,紫外线辐射能量为8mj/cm
(33)、用与上清液等体积的1℃PBS缓冲液重悬高速离心管中的沉淀物,以14000g转速离心120分钟,弃上清,收集沉淀并再次洗涤和离心后,称重计算所得沉淀重量,用PBS缓冲液分散备用,即得肿瘤细胞膜抗原负载DC细胞外囊泡悬液。
更进一步地,步骤(4)包括以下步骤:
(41)、取步骤(25)所得存放有非贴壁外周血单个核细胞细胞悬液的离心管,600转/分钟的转速在1℃条件下离心10分钟,取细胞沉淀,然后通过细胞负性分选法去除该细胞沉淀中的CD8+T细胞、CD4+T细胞、CD56+NK细胞,收集CD8-、CD4-和CD56-的单个核细胞悬液进行培养;
(42)、用商业化的磁珠分选缓冲液MACS重悬细胞沉淀,调节浓度为1×10
经600转/分钟的转速在1℃℃条件下离心10分钟,弃上清,用等量1℃预冷的MACS重悬并洗涤细胞1次,重悬细胞后按每10
经600转/分钟的转速在1℃条件下离心10分钟,弃上清,用等量1℃预冷的MACS重悬并洗涤细胞1次,弃上清;
用1℃预冷的MACS重悬并调整细胞浓度在1×10
(43)、将步骤(42)所得DNT细胞悬液经600转/分钟的转速在1℃条件下离心10分钟,弃上清,用DNT条件培养液重悬细胞,调整浓度为1×10
所述CD3抗体包被细胞培养瓶为提前1小时加入抗人CD3抗体的125ml培养瓶,每瓶加CD3抗体2ml,CD3抗体浓度为2ug/ml,放置于37℃培养箱静置孵育,取出时吸去瓶中液体;
所述DNT条件培养液采用x-vivo 15培养基,在其中添加灭活血浆1%,添加CD3抗体终浓度至500ng/ml,添加重组人白介素IL-2至20ng/ml;
在细胞培养的第2天和第3天,每天补充添加灭活血浆至1%,添加卡介苗至2ug/ml,添加重组人白介素IL-2至20ng/ml;
在细胞培养的第4天,添加一倍体积的DNT条件培养液,同时补充添加灭活血浆至1%,添加CD3抗体终浓度至500ng/ml,添加卡介苗至2ug/ml,添加重组人白介素IL-2至20ng/ml,添加重组人白介素IL-4至10ng/ml;
在细胞培养的第5~6天,每天添加CD28抗体至终浓度500ng/ml,补充添加灭活血浆至1%,添加CD3抗体终浓度至500ng/ml,添加重组人白介素IL-2至20ng/ml,添加重组人白介素IL-4至10ng/ml;
在细胞培养的第7天,对DNT细胞进行细胞计数,加入DNT条件培养基调整终浓度为1×10
CO
(44)从培养瓶中取出细胞悬液分装于50毫升无菌离心管中,600转/分钟的转速在1℃条件下离心10分钟,弃上清,用10ml生理盐水重悬、洗涤细胞后,600转/分钟的转速在1℃条件下离心10分钟,如此重悬、洗涤2次后,用10ml注射器抽取人血清白蛋白1~5ml加入细胞沉淀表面,同时加入生理盐水至10ml重悬细胞,即得到DNT细胞。
进一步地,在步骤(43)的连续培养过程中,每隔3天进行一次细胞计数,根据细胞数量添加DNT条件培养液,调整终浓度为1×10
进一步地,在步骤(43)的连续培养过程中,每天在显微镜下观察DNT细胞的形态学特征和生长情况;在培养结束时,用细胞计数仪进行计数,同时在培养结束时,在显微镜下观察DNT细胞的形态学特征,用细胞计数仪进行计数并计算细胞活率。
具体实施例2
一种促进DNT细胞扩增与活化的方法,包括以下步骤:
(1)、制备肿瘤细胞膜抗原粗液;
(2)、肿瘤细胞膜抗原负载DC细胞培养;
(3)、肿瘤细胞膜抗原负载DC细胞外囊泡制备;
(4)、利用肿瘤细胞膜抗原负载DC细胞外囊泡促进DNT细胞扩增与活化。
进一步地,步骤(1)包括以下步骤:
(11)、对于来自外科手术或活检瘤组织,用生理盐水清洗3次后,在无菌条件下用灭菌的剪刀和镊子剔除脂肪、筋膜和大血管,称重后用手术剪刀将肿瘤组织切成5立方毫米的小块后,放入无菌的组织研磨器中,加入5倍肿瘤组织重量/体积的预冷细胞裂解液,将组织研磨器置于冰水浴中进行肿瘤组织的研磨和均质,得到组织均浆,其中:
肿瘤组织的重量以克计;
预冷细胞裂解液以毫升计;
(12)、将步骤(11)所得的组织匀浆经500目无菌细胞筛网过滤,滤液收集在无菌离心管中,滤渣置于研磨器中加入3倍肿瘤组织重量/体积的预冷细胞裂解液再次进行研磨,再经500目细胞筛网过滤,用3倍肿瘤组织重量/体积预冷细胞裂解液淋洗研磨器,并经筛网滤入离心管中得到肿瘤组织裂解液,其中:
肿瘤组织的重量以克计;
预冷细胞裂解液以毫升计;
(13)、将步骤(12)所得盛放有肿瘤组织裂解液的离心管连续冷冻融化3次,完成后将该离心管置于离心机中以1000转/分钟离心15分钟,收集上清液,其中:
冷冻融化的条件为:将盛放有肿瘤组织裂解液的离心管置于-60℃条件下冷冻存储8小时后,转移到9℃条件下融解18小时;
(14)、在步骤(13)所得的上清液中,按重量/体积2%的比例加入脱氧胆酸钠离子去污剂,然后在8℃的条件下连续搅拌3小时后,100000转/分钟离心20分钟,吸去表层的油脂后,收集提取液,无菌密封后置-60℃冰箱中保存,得到肿瘤细胞膜抗原粗液。
更进一步的,步骤(11)中的外科手术或活检瘤组织取材时避免用退变组织。
更进一步地,步骤(11)中的细胞裂解液的制备包括以下步骤:
(111)配置含有0.2%苯甲基磺酰氯、0.6%氯化钠的水溶液;
(112)经125℃灭菌30分钟后,预冷至5℃存放即可。
进一步地,肿瘤细胞为黑色素瘤细胞。
进一步地,步骤(2)包括以下步骤:
(21)、无菌抽取健康人的外周血200ml,肝纳素抗凝并充分混匀,避免凝血;
(22)、在室温条件下,将外周血2000转/分钟的转速在1℃条件下离心20分钟,收集上层血浆于离心管中,置60℃水浴中加热20分钟后,在4℃条件下静置8小时,经2500转/分钟的转速离心10分钟,收集上层的灭活血浆于无菌密封容器中,置4℃条件下保存待用,然后向细胞沉淀中加入生理盐水至外周血等体积,缓缓重悬外周血细胞;
(23)、准备50毫升无菌离心管10支,无菌条件下在其中分别加入20毫升的淋巴细胞分离液,并在淋巴分离液的上面分别加入25毫升步骤(22)所得重悬外周血细胞,配平离心管后,2000转/分钟的转速在1℃条件下离心20分钟,弃去上清,用灭菌毛细吸管收集淋巴细胞分离液表层细胞;
(24)、将步骤(23)所得的淋巴细胞分离液表层细胞移至50ml—次性无菌离心管中,用生理盐水反复洗涤并离心收集白色细胞层4次,即得到外周血单个核细胞,其中:收集白色细胞层包括以下步骤:
向所述—次性无菌离心管中加入10倍体积的预冷至10℃的生理盐水进行重悬和洗涤,2000转/分钟的转速在1℃条件下离心20分钟,收集白色细胞层;
(25)、将步骤(24)所得外周血单个核细胞用8倍体积的RPMI1640培养基重悬后,置细胞培养瓶中于37℃、5%CO
(26)、在步骤(25)处理后的原培养瓶中加入5毫升生理盐水,润洗贴壁的DC细胞,吸出弃掉洗液后,在培养瓶中加入条件培养基于37℃、5%CO
所述条件培养基为含有20%胎牛血清的RPMI1640培养基,其中还添加有终浓度为2500U/mL的GM-CSF、2500U/mL的IL-4;
贴壁的DC细胞于37℃、5%CO
更进一步地,步骤(3)包括以下步骤:
(31)、在步骤(26)的贴壁DC细胞培养的第第6天,在培养基中加入步骤S13得到的肿瘤细胞膜抗原粗液至体积比2.0:100,每天按质量体积浓度2500U/mL分别补充GM-CSF和IL-4,同时分别加入TNF-α和自体灭活血浆至质量体积浓度200ng/mL和5%;
(32)、在贴壁DC细胞培养的第7天,显微镜下观察肿瘤细胞膜抗原负载DC细胞的数量、形态特征和分布情况后,将细胞培养瓶置于紫外线下照射120分钟,紫外线辐射能量为16mj/cm
(33)、用与上清液等体积的4℃PBS缓冲液重悬高速离心管中的沉淀物,以100000g转速离心50分钟,弃上清,收集沉淀并再次洗涤和离心后,称重计算所得沉淀重量,用PBS缓冲液分散备用,即得肿瘤细胞膜抗原负载DC细胞外囊泡悬液。
更进一步地,步骤(4)包括以下步骤:
(41)、取步骤(25)所得存放有非贴壁外周血单个核细胞细胞悬液的离心管,2000转/分钟的转速在1℃条件下离心20分钟,取细胞沉淀,然后通过细胞负性分选法去除该细胞沉淀中的CD8+T细胞、CD4+T细胞、CD56+NK细胞,收集CD8-、CD4-和CD56-的单个核细胞悬液进行培养;
(42)、用商业化的磁珠分选缓冲液MACS重悬细胞沉淀,调节浓度为2×10
经2000转/分钟的转速在1℃条件下离心20分钟,弃上清,用等量4℃预冷的MACS重悬并洗涤细胞3次,重悬细胞后按每10
经2000转/分钟的转速在1℃条件下离心20分钟,弃上清,用等量4℃预冷的MACS重悬并洗涤细胞3次,弃上清;
用14℃预冷的MACS重悬并调整细胞浓度在2×10
(43)、将步骤(42)所得DNT细胞悬液经2000转/分钟的转速在1℃条件下离心20分钟,弃上清,用DNT条件培养液重悬细胞,调整浓度为2×10
所述CD3抗体包被细胞培养瓶为提前3小时加入抗人CD3抗体的125ml培养瓶,每瓶加CD3抗体5ml,CD3抗体浓度为10ug/ml,放置于37℃培养箱静置孵育,取出时吸去瓶中液体;
所述DNT条件培养液采用x-vivo 15培养基,在其中添加灭活血浆5%,添加CD3抗体终浓度至5000ng/ml,添加重组人白介素IL-2至200ng/ml;
在细胞培养的第2天和第3天,每天补充添加灭活血浆至5%,添加卡介苗至10ug/ml,添加重组人白介素IL-2至200ng/ml;
在细胞培养的第4天,添加一倍体积的DNT条件培养液,同时补充添加灭活血浆至5%,添加CD3抗体终浓度至5000ng/ml,添加卡介苗至10ug/ml,添加重组人白介素IL-2至200ng/ml,添加重组人白介素IL-4至50ng/ml;
在细胞培养的第6天,每天添加CD28抗体至终浓度5000ng/ml,补充添加灭活血浆至5%,添加CD3抗体终浓度至5000ng/ml,添加重组人白介素IL-2至200ng/ml,添加重组人白介素IL-4至50ng/ml;
在细胞培养的第7天,对DNT细胞进行细胞计数,加入DNT条件培养基调整终浓度为2×10
(44)从培养瓶中取出细胞悬液分装于50毫升无菌离心管中,2000转/分钟的转速在1℃条件下离心20分钟,弃上清,用20ml生理盐水重悬、洗涤细胞后,2000转/分钟的转速在1℃条件下离心20分钟,如此重悬、洗涤3次后,用10ml注射器抽取人血清白蛋白5ml加入细胞沉淀表面,同时加入生理盐水至50ml重悬细胞,即得到DNT细胞。
进一步地,在步骤(43)的连续培养过程中,每隔3天进行一次细胞计数,根据细胞数量添加DNT条件培养液,调整终浓度为2×10
进一步地,在步骤(43)的连续培养过程中,每天在显微镜下观察DNT细胞的形态学特征和生长情况;在培养结束时,用细胞计数仪进行计数,同时在培养结束时,在显微镜下观察DNT细胞的形态学特征,用细胞计数仪进行计数并计算细胞活率。
具体实施例3
一种促进DNT细胞扩增与活化的方法,包括以下步骤:
(1)、制备肿瘤细胞膜抗原粗液;
(2)、肿瘤细胞膜抗原负载DC细胞培养;
(3)、肿瘤细胞膜抗原负载DC细胞外囊泡制备;
(4)、利用肿瘤细胞膜抗原负载DC细胞外囊泡促进DNT细胞扩增与活化。
进一步地,步骤(1)包括以下步骤:
(11)、对于来自外科手术或活检瘤组织,用生理盐水清洗3次后,在无菌条件下用灭菌的剪刀和镊子剔除脂肪、筋膜和大血管,称重后用手术剪刀将肿瘤组织切成3立方毫米的小块后,放入无菌的组织研磨器中,加入3倍肿瘤组织重量/体积的预冷细胞裂解液,将组织研磨器置于冰水浴中进行肿瘤组织的研磨和均质,得到组织均浆,其中:
肿瘤组织的重量以克计;
预冷细胞裂解液以毫升计;
(12)、将步骤(11)所得的组织匀浆经400目无菌细胞筛网过滤,滤液收集在无菌离心管中,滤渣置于研磨器中加入2倍肿瘤组织重量/体积的预冷细胞裂解液再次进行研磨,再经400目细胞筛网过滤,用2倍肿瘤组织重量/体积预冷细胞裂解液淋洗研磨器,并经筛网滤入离心管中得到肿瘤组织裂解液,其中:
肿瘤组织的重量以克计;
预冷细胞裂解液以毫升计;
(13)、将步骤(12)所得盛放有肿瘤组织裂解液的离心管连续冷冻融化2次,完成后将该离心管置于离心机中以800转/分钟离心12分钟,收集上清液,其中:
冷冻融化的条件为:将盛放有肿瘤组织裂解液的离心管置于-70℃条件下冷冻存储16小时后,转移到5℃条件下融解24小时;
(14)、在步骤(13)所得的上清液中,按重量/体积1%的比例加入脱氧胆酸钠离子去污剂,然后在4℃的条件下连续搅拌2小时后,70000转/分钟离心40分钟,吸去表层的油脂后,收集提取液,无菌密封后置-70℃冰箱中保存,得到肿瘤细胞膜抗原粗液。
更进一步的,步骤(11)中的外科手术或活检瘤组织取材时避免用退变组织。
更进一步地,步骤(11)中的细胞裂解液的制备包括以下步骤:
(111)配置含有0.1%苯甲基磺酰氯、0.4%氯化钠的水溶液;
(112)经120℃灭菌45分钟后,预冷至3℃存放即可。
进一步地,肿瘤细胞包括卵巢癌细胞、黑色素瘤细胞。
进一步地,步骤(2)包括以下步骤:
(21)、无菌抽取健康人的外周血100ml,肝纳素抗凝并充分混匀,避免凝血;
(22)、在室温条件下,将外周血1000转/分钟的转速在5℃条件下离心15分钟,收集上层血浆于离心管中,置55℃水浴中加热40分钟后,在3℃条件下静置16小时,经1500转/分钟的转速离心20分钟,收集上层的灭活血浆于无菌密封容器中,置3℃条件下保存待用,然后向细胞沉淀中加入生理盐水至外周血等体积,缓缓重悬外周血细胞;
(23)、准备50毫升无菌离心管5支,无菌条件下在其中分别加入20毫升的淋巴细胞分离液,并在淋巴分离液的上面分别加入22毫升步骤(22)所得重悬外周血细胞,配平离心管后,1000转/分钟的转速在5℃条件下离心15分钟,弃去上清,用灭菌毛细吸管收集淋巴细胞分离液表层细胞;
(24)、将步骤(23)所得的淋巴细胞分离液表层细胞移至50ml—次性无菌离心管中,用生理盐水反复洗涤并离心收集白色细胞层3次,即得到外周血单个核细胞,其中:收集白色细胞层包括以下步骤:
向所述—次性无菌离心管中加入5倍体积的预冷至5℃的生理盐水进行重悬和洗涤1000转/分钟的转速在5℃条件下离心15分钟,收集白色细胞层;
(25)、将步骤(24)所得外周血单个核细胞用6倍体积的RPMI1640培养基重悬后,置细胞培养瓶中于37℃、5%CO
(26)、在步骤(25)处理后的原培养瓶中加入3毫升生理盐水,润洗贴壁的DC细胞,吸出弃掉洗液后,在培养瓶中加入条件培养基于37℃、5%CO
所述条件培养基为含有15%胎牛血清的RPMI1640培养基,其中还添加有终浓度为1500U/mL的GM-CSF、1000U/mL的IL-4;
贴壁的DC细胞于37℃、5%CO
更进一步地,步骤(3)包括以下步骤:
(31)、在步骤(26)的贴壁DC细胞培养的第5天,在培养基中加入步骤S13得到的肿瘤细胞膜抗原粗液至体积比1:100,每天按质量体积浓度1500U/mL分别补充GM-CSF和IL-4,同时分别加入TNF-α和自体灭活血浆至质量体积浓度100ng/mL和2%;
(32)、在贴壁DC细胞培养的第7天,显微镜下观察肿瘤细胞膜抗原负载DC细胞的数量、形态特征和分布情况后,将细胞培养瓶置于紫外线下照射60分钟,紫外线辐射能量为10mj/cm
(33)、用与上清液等体积的3℃PBS缓冲液重悬高速离心管中的沉淀物,以50000g转速离心80分钟,弃上清,收集沉淀并再次洗涤和离心后,称重计算所得沉淀重量,用PBS缓冲液分散备用,即得肿瘤细胞膜抗原负载DC细胞外囊泡悬液。
更进一步地,步骤(4)包括以下步骤:
(41)、取步骤(25)所得存放有非贴壁外周血单个核细胞细胞悬液的离心管,1000转/分钟的转速在5℃条件下离心15分钟,取细胞沉淀,然后通过细胞负性分选法去除该细胞沉淀中的CD8+T细胞、CD4+T细胞、CD56+NK细胞,收集CD8-、CD4-和CD56-的单个核细胞悬液进行培养;
(42)、用商业化的磁珠分选缓冲液MACS重悬细胞沉淀,调节浓度为1.5×10
经600~2000转/分钟的转速在5℃条件下离心15分钟,弃上清,用等量2℃预冷的MACS重悬并洗涤细胞2次,重悬细胞后按每10
经600~2000转/分钟的转速在4℃条件下离心15分钟,弃上清,用等量3℃预冷的MACS重悬并洗涤细胞2次,弃上清;
用2℃预冷的MACS重悬并调整细胞浓度在1.5×10
(43)、将步骤(42)所得DNT细胞悬液经1000转/分钟的转速在5℃条件下离心15分钟,弃上清,用DNT条件培养液重悬细胞,调整浓度为1.5×10
所述CD3抗体包被细胞培养瓶为提前2小时加入抗人CD3抗体的125ml培养瓶,每瓶加CD3抗体3ml,CD3抗体浓度为5ug/ml,放置于37℃培养箱静置孵育,取出时吸去瓶中液体;
所述DNT条件培养液采用x-vivo 15培养基,在其中添加灭活血浆3%,添加CD3抗体终浓度至1000ng/ml,添加重组人白介素IL-2至100ng/ml;
在细胞培养的第2天和第3天,每天补充添加灭活血浆至13%,添加卡介苗至6ug/ml,添加重组人白介素IL-2至100ng/ml;
在细胞培养的第4天,添加一倍体积的DNT条件培养液,同时补充添加灭活血浆至3%,添加CD3抗体终浓度至1000ng/ml,添加卡介苗至8ug/ml,添加重组人白介素IL-2至100ng/ml,添加重组人白介素IL-4至30ng/ml;
在细胞培养的第5天,每天添加CD28抗体至终浓度1000ng/ml,补充添加灭活血浆至1~5%,添加CD3抗体终浓度至1000ng/ml,添加重组人白介素IL-2至100ng/ml,添加重组人白介素IL-4至30ng/ml;
在细胞培养的第7天,对DNT细胞进行细胞计数,加入DNT条件培养基调整终浓度为1.4×10
(44)从培养瓶中取出细胞悬液分装于50毫升无菌离心管中,1000转/分钟的转速在5℃条件下离心15分钟,弃上清,用15ml生理盐水重悬、洗涤细胞后,1000转/分钟的转速在5℃条件下离心15分钟,如此重悬、洗涤2次后,用10ml注射器抽取人血清白蛋白3ml加入细胞沉淀表面,同时加入生理盐水至20ml重悬细胞,即得到DNT细胞。
进一步地,在步骤(43)的连续培养过程中,每隔3天进行一次细胞计数,根据细胞数量添加DNT条件培养液,调整终浓度为1.5×10
进一步地,在步骤(43)的连续培养过程中,每天在显微镜下观察DNT细胞的形态学特征和生长情况;在培养结束时,用细胞计数仪进行计数,同时在培养结束时,在显微镜下观察DNT细胞的形态学特征,用细胞计数仪进行计数并计算细胞活率。
具体实施例4
与具体实施例1大致相同,区别仅仅在于步骤(1)的制备步骤不同:
步骤(1)包括以下步骤:
S11、将采集的胸腹水经200目无菌细胞筛网过滤,分装在称过重量的刻度离心管中,用2500转/分钟的转速离心30分钟,弃上清并称重计算沉淀物重量后,在沉淀物中加入3倍重量/体积的预冷细胞裂解液,用吸管吹打混合均匀,其中:
胸腹水的沉淀物以克计;
预冷细胞裂解液以毫升计;
S12、将步骤S11的离心管密封后置冰水浴中孵育10分钟,用组织匀浆器以2500转/分钟的转速上下匀浆粉碎8次后,然后反复冻融三次使滤液中的细胞完全裂解得到细胞冻融液,其中:冻融包括以下步骤:
将离心管放入-80℃冰箱中冻存8小时,取出后置4℃水浴中融解48小时;
S13、将步骤S12所得的细胞冻融液分装在高速离心管中,在1℃以500转/分钟的转速离心15分钟,吸取上层液体分装在已确定重量的高速离心管中,按重量/体积0.5%的比例加入脱氧胆酸钠离子去污剂,在1℃的条件下连续搅拌1小时后,以20000转/分钟的转速离心60分钟,吸去表层的油脂和上清液,收集沉淀物,无菌密封后置-80℃冰箱中保存,得到肿瘤细胞膜抗原粗液。
更进一步地,步骤S11中的细胞裂解液的制备包括以下步骤:
(111)配置含有0.05%苯甲基磺酰氯、0.1%氯化钠的水溶液;
(112)经115℃灭菌60分钟后,预冷至1℃存放即可。
具体实施例5
与具体实施例1大致相同,区别仅仅在于步骤(1)的制备步骤不同:
步骤(1)包括以下步骤:
S11、将采集的胸腹水经400目无菌细胞筛网过滤,分装在称过重量的刻度离心管中,用3500转/分钟的转速离心10分钟,弃上清并称重计算沉淀物重量后,在沉淀物中加入10倍重量/体积的预冷细胞裂解液,用吸管吹打混合均匀,其中:
胸腹水的沉淀物以克计;
预冷细胞裂解液以毫升计;
S12、将步骤S11的离心管密封后置冰水浴中孵育30分钟,用组织匀浆器以3500转/分钟的转速上下匀浆粉碎4次后,然后反复冻融三次使滤液中的细胞完全裂解得到细胞冻融液,其中:冻融包括以下步骤:
将离心管放入-60℃冰箱中冻存24小时,取出后置9℃水浴中融解18小时;
S13、将步骤S12所得的细胞冻融液分装在高速离心管中,在5℃以1000转/分钟的转速离心10分钟,吸取上层液体分装在已确定重量的高速离心管中,按重量/体积2%的比例加入脱氧胆酸钠离子去污剂,在8℃的条件下连续搅拌3小时后,以50000转/分钟的转速离心20分钟,吸去表层的油脂和上清液,收集沉淀物,无菌密封后置-60℃冰箱中保存,得到肿瘤细胞膜抗原粗液。
更进一步地,步骤S11中的细胞裂解液的制备包括以下步骤:
(111)配置含有0.2%苯甲基磺酰氯、0.6%氯化钠的水溶液;
(112)经125℃灭菌30分钟后,预冷至5℃存放即可。
具体实施例6
与具体实施例1大致相同,区别仅仅在于步骤(1)的制备步骤不同:
步骤(1)包括以下步骤:
S11、将采集的胸腹水经300目无菌细胞筛网过滤,分装在称过重量的刻度离心管中,用3000转/分钟的转速离心20分钟,弃上清并称重计算沉淀物重量后,在沉淀物中加入6倍重量/体积的预冷细胞裂解液,用吸管吹打混合均匀,其中:
胸腹水的沉淀物以克计;
预冷细胞裂解液以毫升计;
S12、将步骤S11的离心管密封后置冰水浴中孵育20分钟,用组织匀浆器以3000转/分钟的转速上下匀浆粉碎6次后,然后反复冻融三次使滤液中的细胞完全裂解得到细胞冻融液,其中:冻融包括以下步骤:
将离心管放入-70℃冰箱中冻存16小时,取出后置6℃水浴中融解24小时;
S13、将步骤S12所得的细胞冻融液分装在高速离心管中,在3℃以800转/分钟的转速离心12分钟,吸取上层液体分装在已确定重量的高速离心管中,按重量/体积1%的比例加入脱氧胆酸钠离子去污剂,在6℃的条件下连续搅拌2小时后,以30000转/分钟的转速离心40分钟,吸去表层的油脂和上清液,收集沉淀物,无菌密封后置-70℃冰箱中保存,得到肿瘤细胞膜抗原粗液。
更进一步地,步骤S11中的细胞裂解液的制备包括以下步骤:
(111)配置含有0.1%苯甲基磺酰氯、0.3%氯化钠的水溶液;
(112)经120℃灭菌45分钟后,预冷至4℃存放即可。
具体实施例7-16
与具体实施例1大致相同,区别仅仅在于肿瘤细胞种类不同:
实验验证:
本发明方法可在体外高效扩增DNT细胞。
从50ml成人外周血中可获得2~9×10
外周血单个核细胞分别接种在A和B两组培养瓶中进行DC细胞培养。在DC细胞培养的第4天~第6天,在A组培养瓶加入肿瘤细胞膜抗原粗液至终浓度1mg/mL,在B组培养瓶中加入等体积的PBS缓冲液,之后在A和B两组培养瓶中每天按质量体积浓度1000U/mL分别补充GM-CSF和IL-4,同时加入TNF-α和自体灭活血浆至质量体积浓度100ng/mL和2%。在贴壁DC细胞培养的第7天,显微镜下观察A和B两组培养瓶中DC细胞的数量、形态特征和分布情况后,结果发现:在培养液中加入肿瘤细胞膜抗原粗液可促进DC细胞的生长,A组培养瓶中DC细胞的数量、胞体体积及多突起结构明显多于B组培养瓶。见图2a和图2b。
在DNT细胞培养的第7天,对DNT细胞进行细胞计数后,加入DNT条件培养基调整细胞终浓度为1×10
在DNT细胞培养的第7天,对DNT细胞进行细胞计数后,加入DNT条件培养基调整细胞终浓度为1×10
DNT细胞与乳腺癌细胞系共培养时,光镜下观察到DNT细胞呈小而圆形且密集分布,在肿瘤细胞周围分布更为密集,提示DNT细胞可能具有肿瘤细趋化作用。与DNT细胞共培养的肿瘤细胞较单肿瘤细胞组长势较慢,生长状态差,肿瘤细胞密度小,且背景中存在细胞碎片。通过将体外扩增的DNT细胞与三株乳腺癌细胞SK-BR-3、MDA-MB-231、MCF-7共培养,乳腺癌细胞株的凋亡率均随着共培养DNT细胞比例的增加而上升,当DNT细胞:肿瘤细胞的比例为8:1时DNT细胞促凋亡作用最强,三株细胞凋亡率高达70.6%,84.5%,88.9%。实验初步证明DNT细胞具有显著的促乳腺癌细胞凋亡作用。
上面对本发明的实施方式做了详细说明。但是本发明并不限于上述实施方式,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下做出各种变化。
- 一种促进DNT细胞扩增与活化的方法
- 一种将体外富集的PBMC扩增活化CD8+T细胞群的方法
