基于微滴数字PCR技术检测猪链球菌的引物和探针及试剂盒和方法
文献发布时间:2023-06-19 11:59:12
技术领域
本发明属于核酸检测技术领域,具体涉及基于微滴数字PCR技术检测猪链球菌的引物和探针及试剂盒和方法。
背景技术
猪链球菌(Streptococcus suis,SS)属球菌科、链球菌属,是一种革兰阳性细菌,有荚膜,无芽孢,多数呈短链或球状排列,需氧或兼性厌氧。猪链球菌在自然界中广泛存在,是一种重要的人畜共患病病原体,能致猪发病和死亡,临床症状主要表现为败血症、脑膜炎和关节炎等;也可感染人,引起脑膜炎、感染性休克,严重时可致人死亡。
根据细菌荚膜抗原的差异,猪链球菌最早被分为35个血清型(1-34型和1/2型)。后来由于32型和34型与其它型差异较大,被划为鼠口腔链球菌。自此,猪链球菌被认为有33个血清型(1-31、33、1/2)。但是,近年来多种细菌分类方法均已证实,血清型20、22、26、33与猪链球菌属于不同的分类,被称为“猪链球菌样菌株”,应当从猪链球菌现有的33个血清型中剔除。猪链球菌病OIE国际参考实验室将在《兽医微生物学》(第6版)和相关国标、行标等中对猪链球菌的血清型进行更正,将“33个血清型”修正为“29个传统血清型”。
快速准确地检测猪链球菌对于感染的早期诊断和治疗非常重要。目前,猪链球菌的检测方法主要有三种类型,微生物学方法、分子生物学检测和免疫学分析。鉴于灵敏性和可靠性的优势,当前鉴定猪链球菌最常应用的是分子生物学检测方法,通常是根据已知的猪链球菌特异性靶基因序列设计引物来鉴定猪链球菌的PCR方法。其中,以猪链球菌看家基因谷氨酸脱氢酶(glutamate dehydrogenase,gdh)为靶基因的PCR方法应用最为普遍。然而,近年来猪链球菌PCR检测暴露出如下问题:(1)gdh为靶基因的PCR不能区分猪链球菌和链球菌属某些其它成员;(2)在当前公认的33个血清型中,血清型20、22、26、33被认为是不同于猪链球菌的“猪链球菌样菌株”,但以gdh为靶基因的PCR不能对猪链球菌和“猪链球菌样菌株”进行鉴别区分;(3)普通PCR和荧光定量PCR只能进行定性和相对定量检测,无法做到对细菌数的绝对定量。目前用得最多的细菌计数方法是平板计数法,但该法操作繁琐且耗时长。因此,针对当前猪链球菌PCR检测的现状,急需建立能够特异性检测猪链球菌的绝对定量PCR方法。
发明内容
本发明旨在至少解决现有技术中存在的技术问题之一,提供了基于微滴数字PCR(droplet digital PCR,ddPCR)技术检测猪链球菌的引物和探针及试剂盒和方法,用于猪链球菌的检测,特异性好、灵敏度高,可以鉴定猪链球菌的29个传统血清型(1/2型、1-19型、21型、23-25型、27-31型)以及对细菌数的绝对定量。
因此,本发明的目的之一在于提供一种组合物。
本发明的另一目的在于提供一种上述组合物在制备猪链球菌的检测试剂中的应用。
本发明的另一目的在于提供一种试剂盒。
本发明的另一目的在于提供一种上述试剂盒的使用方法。
本发明的另一目的在于提供一种基于微滴数字PCR技术检测猪链球菌的方法。
本发明所采用的技术方案如下文所述。
一种组合物,包括引物对和探针,所述引物对的核苷酸序列如SEQ ID NO:1~2所示,所述探针的核苷酸序列如SEQ ID NO:3所示。
在本发明的一些实施方式中,所述探针带有可检测的标记。
在本发明的一些实施方式中,所述探针为自身淬灭探针。
在本发明的一些实施方式中,所述探针的5’端标记有荧光发射基团,3’端标记有荧光淬灭基团。
在本发明的一些实施方式中,所述荧光发射基团选自FAM、CY5、VIC、JOE和HEX;所述荧光淬灭基团选自BHQ1、BHQ2、TAMRA和MGB。优选地,所述荧光发射基团为FAM,荧光淬灭基团为BHQ1。
在本发明的一些实施方式中,所述引物对和所述探针的摩尔比为10~15:1;优选为12~14:1。
在本发明的一些实施方式中,所述引物对和探针可以由本领域常规技术手段合成。
本发明的另一方面提供了上述组合物在制备猪链球菌的检测试剂中的应用。
本发明的另一方面提供了一种试剂盒,包括如上所述的组合物。
根据本发明的一些实施方式,所述试剂盒还包括ddPCR预混液、无核酸酶水、阴性对照品和阳性对照品。
根据本发明的一些实施方式,所述阳性对照品为猪链球菌2型标准菌株基因组DNA。
根据本发明的一些实施方式,所述阴性对照品为无核酸酶水。
本发明另一方面还提供了上述试剂盒在猪链球菌检测中的应用。
本发明另一方面还提供了上述试剂盒的使用方法,包括:
取待测样品的DNA、阳性对照品和阴性对照品分别与ddPCR反应液混合,形成ddPCR反应体系;其中,所述ddPCR反应液包括核苷酸序列如SEQ ID NO:1~2所示的引物对,核苷酸序列如SEQ ID NO:3所示的探针、ddPCR预混液、无核酸酶水;
对所述ddPCR反应体系进行PCR扩增;
PCR扩增结束后,通过微滴读取仪直接读出反应体系中样本拷贝数。
本发明另一方面还提供了基于微滴数字PCR技术检测猪链球菌的方法,包括使用如上所述的组合物,或使用如上所述的试剂盒对待测样品进行检测。
根据本发明的一些实施方式,所述方法基于微滴数字PCR。
根据本发明的一些实施方式,所述基于微滴数字PCR技术检测猪链球菌的方法,包括:
取待测样品的DNA、阳性对照品和阴性对照品分别与ddPCR反应液混合,形成ddPCR反应体系;其中,所述ddPCR反应液包括核苷酸序列如SEQ ID NO:1~2所示的引物对,核苷酸序列如SEQ ID NO:3所示的探针、ddPCR预混液、无核酸酶水;
对所述ddPCR反应体系进行PCR扩增;
PCR扩增结束后,通过微滴读取仪直接读出反应体系中样本拷贝数。
根据本发明的一些实施方式,所述PCR扩增的反应程序为:92~98℃9~11min;91~97℃25~35s,55~61℃55~65s,38~42个循环;96~99℃9.5~10.5min;优选为:95℃10min;94℃30s,58℃1min,40个循环;98℃10min。
根据本发明的一些实施方式,所述反应程序中的升降温速率1~3℃/s;优选为1.5~2.5℃/s;更优选为2℃/s。
本发明的有益效果为:
本发明人首次尝试针对recN基因设计了引物和探针,其特异性好、扩增效率高。能够实现对猪链球菌29个传统血清型(1/2型、1-19型、21型、23-25型、27-31型)的检测以及对细菌数的绝对定量。并且可以特异性区分猪链球菌和链球菌属其它成员(包括“猪链球菌样菌株”)。
本发明的组合物用于检测猪链球菌,灵敏度高、特异性好,能实现细菌数的绝对定量。
本发明的试剂盒可以用于猪链球菌29个传统血清型(1/2型、1-19型、21型、23-25型、27-31型)的检测,检测结果准确可靠。
本发明基于微滴数字PCR技术,建立了猪链球菌微滴数字PCR定量检测方法,特异性好,灵敏度高,稳定性好,能对细菌数进行准确定量检测,灵活性与可扩展性兼备,操作简单,能有效满足猪链球菌快速检测、准确定量等核心问题的方法学研究趋势与现实需求。
附图说明
图1为质粒pUC57-RecN的PCR鉴定图;
图2为质粒pUC57-RecN的双酶切鉴定图;
图3为质粒pUC57-RecN的测序结果图;
图4为不同引物浓度的的微滴散点图;
图5为不同探针浓度的的微滴散点图;
图6为不同退火温度的的微滴散点图;
图7为最低检测限试验的微滴散点图;
图8为特异性试验的微滴散点图;
图9为重复性试验的微滴散点图。
具体实施方式
PCR是在核酸聚合酶作用下体外扩增DNA或RNA的实验技术,是现代生命科学研究中最常规的实验方法之一,其发展经历了3个主要阶段:(1)普通PCR作为“第一代PCR”只适用于定性研究,操作烦琐,PCR结束后需通过琼脂糖凝胶电泳判定结果,配胶使用的核酸染料对人体有一定危害,并且PCR产物可能造成样品间和环境污染。(2)荧光定量PCR作为“第二代PCR”灵敏度和准确性高、重复性好、操作便捷,是目前应用最广泛的PCR技术。然而,该技术需要用已知浓度的标准物质去构建标准曲线,通过Ct值和标准曲线对起始模板只能达到相对定量分析,同时Ct值易受PCR扩增效率影响,造成测量结果的偏差。(3)基于以上两种PCR技术的缺陷和限制,数字PCR技术应运而生,该技术通过有限稀释法和根据泊松分布原理来准确计算核酸浓度,被称为“第三代PCR”。该方法不再依赖标准曲线和Ct值而直接给出核酸靶分子的起始拷贝数,且下限可低至单拷贝,实现了真正意义上的绝对定量。荧光定量PCR在检测靶标核酸丰度低及抑制成分高的样品时,灵敏度和准确度会大打折扣,而微滴式数字PCR将反应体系极大程度分散,并通过PCR终点判断阴阳性微滴个数来定量样品,受PCR效率和抑制物影响非常小,因此该技术特别适合诸如:以粪便、血液为样品的微生物及标记物检测;以土壤、污水、淤泥、酒泥等为样品的环境生物学研究和微生物监测;经复杂工艺制作的含大量抑制物的食品材料中转基因成分、动植物成分鉴定和含量分析及致病微生物的检测。
微滴数字PCR(droplet digital PCR,ddPCR)技术结合了液滴微流控芯片与数字PCR技术,是一种新型的核酸扩增及检测技术,具有高度灵敏、绝对定量及高效方便等特点。近年来,随着微滴式数字PCR仪的问世,相关研究手段和检测方法实现了巨大的跨越,ddPCR技术在微生物检测、转基因检测、疾病检测以及质检领域中已凸显优势,但在动物疫病检测方面的研究和应用还较少。
本发明针对recN基因设计引物探针,并建立了ddPCR定量检测方法,用以鉴定猪链球菌以及对细菌数绝对定量。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明做各种改动或修改,这些等价形式同样落于本发明所附权利要求书所限定的范围。
材料及试剂说明
QX 200数字PCR仪购自美国伯乐公司。
磁珠法通用型基因组DNA提取试剂盒购自天根生化科技有限公司;质粒提取试剂盒购自生工生物工程股份有限公司;ddPCR预混液、ddPCR空白对照、微滴生成用油、微滴读取用油购自美国伯乐公司;限制性内切酶、premix Taq、无核酸酶水购自宝生物工程有限公司。
DG8微滴生成卡、卡托、胶垫、96孔PCR板、铝箔购自美国伯乐公司。
实施例1引物设计
根据GenBank公布的猪链球菌recN基因序列(AKG40892.1),设计引物和TaqMan荧光探针,用于ddPCR。
上游引物序列recN-F:5’-TCTGGAGATGATTTGGAAGTTCAG-3’(SEQ ID NO:1);
下游引物序列recN-R:5’-CTTCTAAAACAACAGCCAATTCATG-3’(SEQ ID NO:2);
探针recN-Probe:5’-AACGAGCAGGTCAGCTCAGCCAATCA-3’(SEQ ID NO:3),探针的5'端标记FAM荧光报告基团,3'端标记BHQ1荧光淬灭基团。
设计普通PCR引物,用于质粒的鉴定。
上游引物序列recN-JF:5’-CTACAAACAGCTCTCTTCT-3’(SEQ ID NO:4);
下游引物序列recN-JR:5’-ACAACAGCCAATTCATGGCGTGATT-3’(SEQ ID NO:5)。
引物、探针送生工生物工程股份有限公司合成。
实施例2质粒合成和鉴定
根据GenBank公布的猪链球菌recN基因序列(AKG40892.1),人工全基因合成含有recN基因全序列(1674bp)的质粒pUC57-RecN,合成工作由生工生物工程股份有限公司完成。
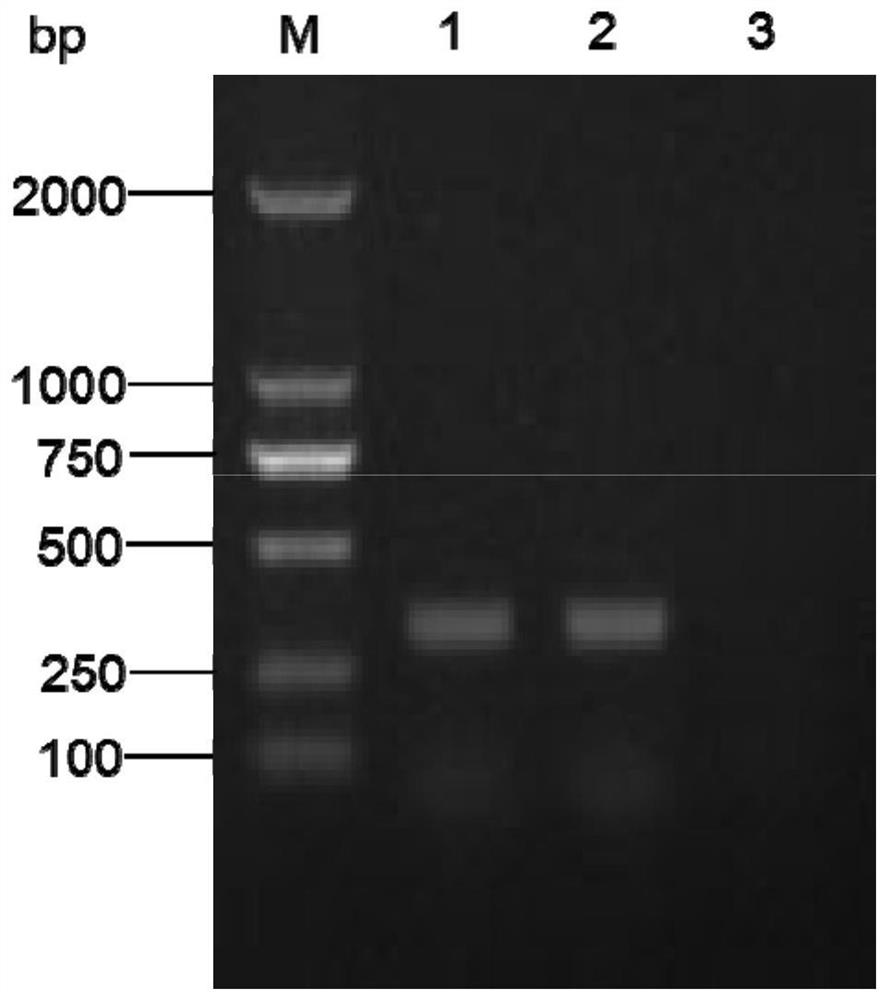
用引物recN-JF、recN-JR对质粒pUC57-RecN进行普通PCR扩增,扩增程序:94℃2min;94℃30s,60℃10s,68℃30s,30次循环;68℃5min。扩增后进行琼脂糖凝胶电泳,结果如图1所示,其中,泳道M为DL2000 DNA marker,泳道1为质粒pUC57-RecN,泳道2为阳性对照,泳道3为阴性对照,电泳得到大小约336bp的条带,与预期相符。
将质粒pUC57-RecN用EcoRI/BamHI双酶切后进行琼脂糖凝胶电泳,结果如图2所示,其中,泳道M为DL10000 DNA marker,泳道1为质粒pUC57-RecN,电泳得到大小约1674bp和2671bp的2个条带,与预期相符。
将质粒pUC57-RecN进行全基因测序,测序结果如图3所示,显示碱基正确率为100%。
上述PCR鉴定、双酶切鉴定和全基因测序结果均表明合成的质粒pUC57-RecN基因序列正确,可用于后续实验。
将质粒pUC57-RecN用EcoRI单酶切成线性,-20℃备用。
实施例3 ddPCR定量检测方法的构建及优化
1、ddPCR操作步骤
(1)反应体系配制:
设待检样品、阳性对照(猪链球菌2型标准菌株基因组DNA)和阴性对照(无核酸酶水)样品数总和为N,配制N+1份ddPCR反应体系,ddPCR反应体系如表1所示。
表1 ddPCR反应体系
(2)微滴生成:
将一个新的DG8微滴生成卡放入卡托中。
将20μL反应体系加入到DG8微滴生成卡中间一排的8个孔内。不足8个样品时用20μL 1×ddPCR空白对照补足,加样时枪头接近孔一侧底部,与侧壁呈现大约15°角,缓慢打出液体,避免引入气泡。
在DG8微滴生成卡最底排8个孔中各加入70μL微滴生成用油。
盖上胶垫。
将以上卡托轻轻地平稳放置于微滴生成仪中,开始生成微滴。
使用8通道排枪小心缓慢吸取40μL顶端孔中生成的微滴打入96孔PCR板对应的位置孔中。吸取时枪头以与孔壁呈30~45°角放入,轻触孔底,约5秒吸取,再同样缓慢地打入96孔PCR板相应位置孔内,约5秒打入。
转移微滴后立即用铝箔(红线朝上)密封96孔PCR板避免蒸发。将封板温度设为180℃,5s。
(3)PCR扩增:
封好膜之后应该在30分钟内进行PCR反应,或者放于4℃冰箱4小时之内进行PCR。扩增程序见表2:
表2扩增程序
(4)微滴读取:
启动QX200微滴读取仪,预热30min。检查微滴读取仪前面的指示灯,指示灯绿色提示可以正常运行,指示灯黄色提示废液已满或应更换微滴读取用油。
按带有绿键的按钮打开微滴读取仪,将96孔PCR板放入板架中并且再次按带有绿键的按钮将其关闭。
打开QuantaSoft软件,对96孔PCR板中样品信息进行设置,每次实验之前做一次设备冲洗(Flush System),若一周以上未使用先做一次首次冲洗(prime)再做设备冲洗,完成后即可进行微滴读数。
微滴读数完成后,取出板架,移出96孔PCR板并丢弃。
2、引物浓度的优化
以质粒pUC57-RecN为模板进行引物浓度优化实验,设定上下游引物终浓度分别为600nM、700nM、800nM、900nM、1000nM时进行ddPCR扩增,反应体系见表3。扩增程序:95℃10min;94℃30s,60℃1min,40次循环;98℃10min;4℃60min。升降温速率2℃/s。微滴散点图如图4所示,当上下游引物浓度均为900nM时,质粒拷贝数最大,荧光强度值最高。
表3引物浓度优化实验的反应体系
3、探针浓度的优化
以质粒pUC57-RecN为模板进行探针浓度优化实验,设定探针终浓度分别为150nM、200nM、250nM、300nM、350nM时进行ddPCR扩增,反应体系见表4。扩增程序:95℃10min;94℃30s,60℃1min,40次循环;98℃10min;4℃60min。升降温速率2℃/s。微滴散点图如图5所示,当探针浓度为350nM时,质粒拷贝数相对较大,荧光强度值最高。
表4探针浓度优化实验的反应体系
4、退火温度的优化
以质粒pUC57-RecN为模板进行退火温度优化实验,设定退火温度梯度在50℃-60℃之间,分别进行ddPCR扩增。反应体系:ddPCR预混液10μL,上下游引物各1.8μL(900nM),探针0.7μL(350nM),无核酸酶水3.7μL,模板2μL。扩增程序:95℃10min;94℃30s,50℃-60℃1min,40次循环;98℃10min;4℃60min。升降温速率2℃/s。微滴散点图如图6所示,当退火温度为58.0℃时,质粒拷贝数相对较大,荧光强度值相对较高。
综上,优化后的反应体系为:ddPCR预混液10μL,上下游引物各1.8μL(900nM),探针0.7μL(350nM),无核酸酶水3.7μL,模板2μL。优化后的反应程序为:95℃10min;94℃30s,58℃1min,40个循环;98℃10min。升降温速率2℃/s。
实施例4试剂盒的组装
1、本发明检测猪链球菌的试剂盒包括如下组分:
(1)核苷酸序列如SEQ ID NO:1~2所示的引物对,核苷酸序列如SEQ ID NO:3所示的探针;
(2)ddPCR预混液、微滴生成用油、ddPCR空白对照、无核酸酶水;
(3)阳性对照(猪链球菌2型标准菌株基因组DNA)、阴性对照(无核酸酶水)。
2、上述试剂盒的使用方法
(1)反应体系配制:
设待检样品、阴性对照和阳性对照样品数总和为N,配制N+1份20μL ddPCR反应体系,ddPCR的反应体系如表5所示:
表5优化后的反应体系
(2)微滴生成:
将一个新的DG8微滴生成卡放入卡托中。
将20μL反应体系加入到DG8微滴生成卡中间一排的8个孔内。不足8个样品时用20μL 1×ddPCR空白对照补足,加样时枪头接近孔一侧底部,与侧壁呈现大约15°角,缓慢打出液体,避免引入气泡。
在DG8微滴生成卡最底排8个孔中各加入70μL微滴生成用油。
盖上胶垫。
将以上卡托轻轻地平稳放置于微滴生成仪中,开始生成微滴。
使用8通道排枪小心缓慢吸取40μL顶端孔中生成的微滴打入96孔PCR板对应的列中。吸取时枪头以与孔壁呈30~45°角放入,轻触孔底,约5秒吸取,再同样缓慢地打入96孔PCR板相应位置孔内,约5秒打入。
转移微滴后立即用铝箔(红线朝上)密封PCR板避免蒸发。将封板温度设为180℃,5s。
(3)PCR扩增:
封好膜之后应该在30分钟内进行PCR反应,或者放于4℃冰箱4小时之内进行PCR。扩增程序见表6:
表6优化后的扩增程序
(4)微滴读取:
启动QX200微滴读取仪,预热30min。检查微滴读取仪前面的指示灯。
按带有绿键的按钮打开微滴读取仪,将96孔PCR板放入板架中并且再次按带有绿键的按钮将其关闭。
打开QuantaSoft软件,对96孔板中样品信息进行设置,每次实验之前做一次设备冲洗,若一周以上未使用先做一次首次冲洗再做设备冲洗,完成后即可进行微滴读数。
微滴读数完成后,取出板架,移出96孔PCR板并丢弃。
(5)结果判定:
阳性对照:1415±5个拷贝,阴性对照:无读数,实验结果成立。
待检测样品结果有读数时为猪链球菌阳性。读数“conc(copies/μL)”表示每微升反应体系中细菌拷贝数,读数“copies/20μL Well”表示20μL反应体系中细菌拷贝数。通常所指的“细菌拷贝数”指的是每微升样品中细菌拷贝数,由于20μL反应体系中加入了2μL模板,相当于模板被稀释了10倍,因此,将上述读数“conc(copies/μL)”乘以10即可得到每微升样品中细菌拷贝数。
待检测样品结果无读数时为猪链球菌阴性。
实施例5.试剂盒的性能
1、最低检测限
为评估该试剂盒的灵敏性,将质粒pUC57-RecN进行10倍比稀释至约1×10
微滴散点图见图7所示,浓度1到浓度5的ddPCR测定浓度依次为11500copies/μL、1098copies/μL、109copies/μL、11.3copies/μL、0.9copies/μL,因此,所建立的ddPCR的最低检测限为0.9copies/μL。
2、特异性试验
猪链球菌29个传统血清型标准菌株、“猪链球菌样菌株”(原猪链球菌20、22、26、33型)、无乳链球菌、溶血性链球菌、溶血性葡萄球菌、大肠杆菌、沙门菌、胸膜肺炎放线杆菌、副猪嗜血杆菌由中国动物卫生与流行病学中心惠赠。分别提取上述菌株的基因组DNA,提取方法按照磁珠法通用型基因组DNA提取试剂盒说明书进行。将提取的各菌株基因组DNA作为模板,用已建立的ddPCR方法分别进行检测,评估该方法的特异性。
结果如图8所示,ddPCR扩增的微滴生成数均在12000以上,微滴生成正常,结果成立。图8(a)中菌株从左到右依次是29个猪链球菌传统血清型标准菌株(1/2型、1-19型、21型、23-25型、27-31型)、4个“猪链球菌样菌株”(原猪链球菌20、22、26、33型)、阳性对照、阴性对照;结果显示对照成立,该方法能对猪链球菌29个传统血清型标准菌株进行特异性检测并定量,细菌拷贝数为3.34×10
本实验表明该方法特异性良好,可以特异性区分猪链球菌29个传统血清型菌株和其它种属菌株(包括“猪链球菌样菌株”)。
3、重复性试验
提取猪链球菌2型标准菌株的基因组,提取方法按照磁珠法通用型基因组DNA提取试剂盒说明书进行。将提取的基因组稀释成不同浓度数量级(10
结果表明,该方法的变异系数小于10%,重复性良好。五个浓度梯度的微滴散点图如图9所示,(a)-(e)图的浓度平均值分别为16843.33copies/μL、4326.67copies/μL、106copies/μL、17copies/μL、8.23copies/μL,对应的变异系数分别为0.36%、0.93%、4.11%、5.8824%、8.27%。从图中可以看出,模板浓度越高,微滴散点越集中,变异系数越小;相反,模板浓度越低,微滴散点越分散,变异系数越大。
实施例6临床应用案例
用本发明的ddPCR方法对100株临床分离的猪链球菌菌株进行检测,以验证该方法的临床应用效果。待测菌株涵盖了猪链球菌的29个传统血清型(1/2、1-19、21、23-25、27-31),并且均已通过国际公认的血清凝集试验鉴定。
将临床分离菌株进行纯化培养,取细菌纯培养液提取基因组核酸,提取方法按照磁珠法通用型基因组DNA提取试剂盒说明书进行。将提取的各分离菌株基因组作为模板,用已建立的ddPCR方法分别进行检测。试验结果证实,本发明的ddPCR方法鉴定结果与血清凝集试验的符合率为100%,说明本发明用于猪链球菌的检测具有特异、准确、绝对定量等优点。菌株血清型分布及细菌核酸拷贝数见下表。
表7检测结果
本领域技术人员应该理解的是,本发明的使用不受限于上述特定应用。就本文描述或描绘的特定元素和/或特征而言,本发明也不局限于其优选实施方案。应当理解的是,本发明不限于所公开的实施方案例或各个实施方案,且在不脱离由以下权利要求所阐述和限定的本发明的范围的情况下能够进行许多重新布置、修改和替换。
SEQUENCE LISTING
<110> 四川省动物疫病预防控制中心
广东海大畜牧兽医研究院有限公司
<120> 基于微滴数字PCR技术检测猪链球菌的引物和探针及试剂盒和方法
<130> 111
<160> 5
<170> PatentIn version 3.5
<210> 1
<211> 24
<212> DNA
<213> 人工序列(Artificial sequence)
<400> 1
tctggagatg atttggaagt tcag 24
<210> 2
<211> 25
<212> DNA
<213> 人工序列(Artificial sequence)
<400> 2
cttctaaaac aacagccaat tcatg 25
<210> 3
<211> 26
<212> DNA
<213> 人工序列(Artificial sequence)
<400> 3
aacgagcagg tcagctcagc caatca 26
<210> 4
<211> 19
<212> DNA
<213> 人工序列(Artificial sequence)
<400> 4
ctacaaacag ctctcttct 19
<210> 5
<211> 25
<212> DNA
<213> CTACAAACAGCTCTCTTCT
<400> 5
acaacagcca attcatggcg tgatt 25
- 基于微滴数字PCR技术检测猪链球菌的引物和探针及试剂盒和方法
- 一种基于微滴式数字PCR的牛、猪源性成分定量检测方法、引物和探针及试剂盒
