一种线虫提取物及其应用
文献发布时间:2023-06-19 18:37:28
本申请是中国发明专利申请的分案申请,原申请日为2021年6月11日,申请号:202110652064X,发明创造名称:一种线虫提取物及其应用,公开号:CN 113796390A;由于原申请存在多个技术问题,申请人提出分案申请。
技术领域
本发明属于农药领域,具体涉及一种线虫提取物及其在作为杀线虫制剂中的应用。
背景技术
线虫,属线虫门,在淡水、海水、陆地上随处可见,是多样性仅次于昆虫的一个动物类群,目前有超过28,000个已被记录的物种,包括256科2271属,尚有大量种尚未命名。1743年,英国科学家Needham首次在小麦病粒中发现了小麦粒线虫后,世界各个地区相继出现对各类线虫不同的报道。1993年Yeates等学者按照线虫的取食特征、食道的结构和捕食方法等,将线虫的营养类群分成8个类群,其中植物寄生线虫(Plant-parasitic nematodes,PPN)、食真菌线虫(Fungivores,Fu)、食细菌线虫(Bacterivores,Ba)和杂食性线虫(Omnivore-predators,Op)为土壤生态系统中的重要营养类群。如植物寄生线虫松材线虫(Bursaphelenchus xylophilus)、南方根结线虫(Meloidogyne incognita)、大豆孢囊线虫(Heterodera glycines Ichinohe);杂食性线虫原始毛刺线虫(Trichodorusprimitivus)、全齿复活线虫(Panagrellus redivivus)。上述各线虫的分类地位、形态特征、繁殖方式等存在非常大差异,主要差异见下表1。
表1各类线虫差异
松材线虫(Bursaphelenchus xylophilus),是一种常见的松树寄生线虫,通过松墨天牛等媒介昆虫传播,进而引发松材线虫病。寄主主要包括黑松、赤松、马尾松等松属植物。被松材线虫感染的松树,针叶呈黄褐色或红褐色,整株干枯死亡。松材线虫病在墨西哥、美国、加拿大、日本、韩国等国均有发生。我国于1982年在南京中山陵首次发现该病,随后相继在山东、安徽、广东、浙江等地形成几个发病中心,并向四周扩散,使这些省的局部地区发生并流行成灾,导致大批松树枯死,至今松材线虫病已扩散蔓延至全国18个省18个省666个县(市区),2019年发生1671.9万亩,致死松树1946.7万株,已直接威胁到我国9亿亩松科森林的存亡,给我国林业生产和生态安全带来极大的破坏。截至全国因松材线虫病损失的松树累计仍达数十亿株,造成的直接经济损失和生态服务价值损失上千亿元。
根结线虫(Meloidogyne spp.)是一种高度专化型的杂食性植物病原线虫。1855年Berkeley首先在黄瓜根际肿瘤中发现了根结线虫的存在,根结线虫是危害设施蔬菜的病原生物之一,广泛分布于世界各地。到目前为止,世界各地已报道的根结线虫种类超过了80种,在我国报道的有29种,其主范围十分广泛,调查发现大约超过3000种作物被其寄生,包括蔬菜、粮食作物、经济作物、果树、观赏植物及杂草等。胞囊线虫是一类在世界许多国家发生并具有经济重要性的植物寄生线虫。它们引起许多重要作物的产量损失,这些作物包括禾谷作物、水稻、马铃薯和大豆等。其中危害最严重的属大豆胞囊线虫,大豆胞囊线虫(Heterodera glycines,SCN),是大豆专性寄生线虫,是全球大豆的破坏性害虫。主要分布在我国东北地区,内蒙古,河南,河北,江苏等地。据估计中国每年由于大豆胞囊线虫造成的经济损失高达12亿美元。
原始毛刺线虫(Trichodorus primitivus)是一种传毒土壤线虫,大部分发现在沙和沙质土壤中,偶尔也在粘土中发现。通过取食直接对根部造成危害。该线虫是TRV(烟草脆裂病毒)的传播介体,而TRV则会引起西红柿维管束畸形,此外它还能传播PEBV(豌豆早褐病毒),PEBV会使豌豆作物受损并能影响到紫花苜蓿、黄瓜、烟草、甜菜,导致甜菜根畸形。也可通过球茎类的花卉、苗木进行远距离传播。主要分布在温带区。大部分的有关报道来自于欧洲。
目前对线虫的防治主要是采用化学防治法,即采用高效的化学杀虫剂。有效成分主要包括阿维菌素、噻唑磷、甲基异柳磷、灭线磷、溴甲烷、涕灭威、氨基寡糖素、棉隆、杀螟丹、威百亩、克百威、丁硫克百威等,大部分产品为有机磷类产品,毒性很高,多数药剂对寄生在松科等木本植物中的松材线虫抑制效果一般,如阿维菌素在推荐使用浓度下对松材线虫的致死率不足30%。此外,线虫还容易对这些广谱性合成药物产生抗药性,并且这些杀虫剂多是高毒、剧毒或是高残留的农药,对人类、环境、微生物、水资源等都造成很严重的污染,所以化学杀虫剂的应用受到了很大的限制。现在随着人类环保意识的提高,从自然界中寻找安全、高效、低毒、环境友好的新型生物杀虫剂已经成为研究热点。现有研究表明,艾叶、鸡屎藤、苦豆子、牛心朴子草、细辛和紫茎的乙醇提取物对香蕉根结线虫有较强的毒杀活性,薄荷、苦楝、水蓼、商陆、小飞蓬、青蒿、卷丹等药用植物甲醇提取液对大豆孢囊线虫的毒杀活性较好,但这些提取物仅对特定种线虫有毒杀活性,且起作用的杀线虫活性物质的成分及其作用机理以及实际应用还有待进一步研究。
同时,基于松材线虫与其他线虫(如根结、原始毛刺和全齿复合线虫)在分类、主要形态、繁殖方式、最主要的是在农药或化合物耐受性上存在的显著差异,在相当程度上可以证明同种类别的农药和/或化合物对于不同线虫的抗线作用是不具有可类比性的。胡俊杰(2017,华东理工大学)以具有线虫杀灭活性的5-HT3受体拮抗剂MDL-72222为先导,通过改变氮杂双桥桥链位置,及引入农药活性基团噻二唑或噻唑基,设计合成了61个未见报道的3-氮杂双环[3.2.1]辛烷类芳基噻二唑/噻唑类化合物,并分别对其中42个化合物进行了南方根结线虫和松材线虫活性实验(线虫离体测试),结果表明:所测试的化合物中共有6种化合物对松材线虫有一定的抑制活性;而不同浓度下,对于根结线虫具有抑制活性的14种化合物均与对松材线虫具有抑制活性的化合物不同;即同种类别甚至同样的化合物对于不同线虫的抗线活性是不具有可类比性的。
因此应用线虫提取物等具有可操作性的生物防治方法控制线虫是国内外学者的共识,研究、开发、应用新型高效生物合理杀线虫剂是线虫防治发展的趋势。
发明内容
本发明的目的是针对现有技术中存在的问题,提供一种线虫提取物及其在作为杀线虫制剂中的应用。
为实现上述目的,本发明采用技术方案为:
一种线虫提取物,所述线虫提取物为由线虫自身为原料提取获得的提取物。
所述线虫为线虫动物门所有线虫。
所述线虫为尾感器纲双胃亚纲线虫。
所述线虫为尾感器纲双胃亚纲滑刃目滑刃总科滑刃科线虫。
所述线虫为松材线虫(Bursaphelenchus xylophilus)、拟松材线虫(B.mucronatus)、前孔隐滑刃线虫(Cryptaohelenchoides propora)、松柱型垫刃线虫(Cylindrotylenchus pini)、伞滑刃线虫(B.nanjaci)、小松伞滑刃线虫(B.pinasteri)、来氏伞滑刃线虫(B.leoni)以及树伞滑刃线虫(B.silvestris)。
所述线虫优选为松材线虫(Bursaphelenchus xylophilus)。
本发明所述的“提取物”是以线虫为原料,根据对提取的最终物质的杀线虫用途的需要,经过物理化学提取分离过程,定向获取和/或浓集原料中的某一种或多种目标成分(即具有杀线虫作用的成分)而形成的物质。包括通过本领域已知的提取方法及本领域已知的提取方法的组合获得的;提取方法包括但不限于溶剂处理(水、乙酸乙酯、醇、丙酮、油等)、固相提取、超临界CO
本发明所述“粗提取物”和“粗提物”均是指通过溶剂(乙醇、异丙醇等醇类,水,乙酸乙酯等)或生物酶解对原料进行提取分离后,获得的较低浓度目标成分和较高浓度非目标成分的混合物。
本发明所述“活性组分”是指针对粗提取物进行进一步处理,如萃取、层析、蒸馏、升华、结晶和沉淀、离子交换、色谱分离、离心分离、电渗析、电解分离、电磁分离、吸附分离、磁力分离等,获得的含有较高浓度目标成分的提取物(相对于粗提取物)。
本发明所述的“活性单体”是指“活性组分”中某一种目标化合物(即具有杀线虫作用的活性化合物)。
本发明所述的“活性物质”是指从提取物中获得的某一种或几种活性单体(即具有杀线虫作用的活性化合物)。
本发明所述的“类似物”是指以提取物中获得的某一种或几种活性单体(即具有杀线虫作用的活性化合物)作为母体化合物,(1)与母体化合物在化学结构上具有相似性的化合物;(2)具有母体化合物核心结构特征的化合物;(3)保留母体化合物的基本结构,以类似原子或基团代替母体化合物结构中的碳原子或其他原子而成的新化合物。
所述线虫提取物是以线虫自身为原料,通过有机溶剂提取获得。
所述提取的方法可为压榨发、浸提法、超临界萃取法、水提、溶剂提取法中的一种或几种。
所述提取方法是是将线虫加入有机溶剂中,浸提12-36h,超声,然后经抽滤、减压蒸馏,得浸膏;浸膏加入甲醇离心,上清液过滤,即得。
所述有机溶剂为醇类;优选为无水乙醇。
一种线虫提取物在作为杀线虫剂的应用。
所述杀线虫剂含由线虫自身为原料提取获得的提取物、其提取物中的活性物质、其提取物中的活性物质的类似物中的一种或几种。
所述杀线虫剂在作为保护植物抵抗线虫侵染或危害中的应用;特别是作为保护植物抵抗松材线虫侵染或危害中的杀线虫剂中的应用。
所述杀虫剂作为保护植物或植物繁殖材料抵抗由线虫导致的损害、运输造成的再传播或再危害的杀线虫剂的应用;特别是作为保护植物或植物繁殖材料抵抗由松材线虫导致的损害、运输造成的再传播或再危害的杀线虫剂的应用。
所述提取物中的活性物质含脂肪酸类化合物、苯类化合物、含氮化合物、多元醇类化合物或氨基酸类化合物及前述所述化合物(前述化合物为脂肪酸类化合物、苯类化合物、含氮化合物、多元醇类化合物或氨基酸类化合物)的盐或酯中的一种或几种。
本发明所述“脂肪酸类化合物”是指由碳、氢、氧三种元素组成的、碳链上带有羧基、且碳链上可带有羟基的一类化合物;其中碳链可为饱和的或不饱和的。
本发明所述“前述物质的盐”或“通式化合物的盐”,为活性化合物中羟基或羧基中的氢被金属离子取代从而形成相应的盐。进一步的说,活性化合物中羟基或羧基中的氢被Na、K等金属离子取代从而形成相应的盐。
本发明所述“前述物质的酯”或“通式化合物的酯”,为活性化合物中羧基与醇发生酯化反应从而形成相应产物。
进一步的,所述脂肪酸类化合物为脂肪酸、羟基脂肪酸或二元酸;其中,脂肪酸类中含油酸、硬脂酸、亚油酸、花生四烯酸、肉豆蔻酸乙酯、顺式-8,11,14-二十烷三烯酸、顺式-11,14-二十烷二烯酸、14-二十碳烯酸、α-桐油酸、神经酸、花生酸、芥酸、木蜡酸、正壬酸、正癸酸、顺13,16,19-二十二碳三烯酸或前述各物质的盐或酯中的一种或几种;优选为油酸、亚油酸、肉豆蔻酸乙酯、正壬酸或前述各物质的盐或酯中的一种或几种;更优选为油酸、肉豆蔻酸乙酯、正壬酸或前述各物质的盐或酯中的一种或几种。
所述羟基脂肪酸中含6-羟基己酸、(15Z)-9,12,13-Trihydroxy-15-octadecenoicacid、2-羟基戊酸、(9Z)-12,13-二羟基-十八碳烯-9-酸、3-羟基肉豆蔻酸、20-羟基二十碳-5Z,8Z,11Z,14Z-四烯酸、Corchorifatty acid F、16-羟基棕榈酸、2-羟基肉豆蔻酸、10-羟基-2-癸烯酸或前述各物质的盐或酯中的一种或几种;优选为2-羟基戊酸、3-羟基肉豆蔻酸、16-羟基棕榈酸、2-羟基肉豆蔻酸、10-羟基-2-癸烯酸或前述各物质的盐或酯中的一种或几种;更优选为2-羟基戊酸、3-羟基肉豆蔻酸、16-羟基棕榈酸、2-羟基肉豆蔻酸或前述各物质的盐或酯中的一种或几种。
所述二元酸中含甲基丙二酸、壬二酸、2-异丙基苹果酸、柠康酸或前述各物质的盐或酯中的一种或几种;优选为甲基丙二酸、壬二酸或前述各物质的盐或酯中的一种或几种;更优选为壬二酸及其盐或酯中的一种或几种,如壬二酸单甲酯、壬二酸二甲酯、壬二酸单乙酯和/或壬二酸二乙酯。
所述苯类化合物中含2-甲基苯甲酸、水杨酸、邻甲基水杨酸、阿魏酸、香草酸、龙胆酸、苯甲酸、邻苯二甲酸一丁酯、苯乳酸、尿黑酸、4-羟苯基丙酮酸、苯并二氢呋喃-2-羧酸、2,5-二叔丁基对苯二酚、双酚B或前述各物质的盐或酯中的一种或几种;优选为2-甲基苯甲酸、水杨酸、邻甲基水杨酸、阿魏酸、苯甲酸、邻苯二甲酸一丁酯、苯乳酸或前述各物质的盐或酯中的一种或几种;更优选为2-甲基苯甲酸、水杨酸、邻甲基水杨酸、苯甲酸、邻苯二甲酸一丁酯、尿黑酸或前述各物质的盐或酯中的一种或几种。
所述含氮化合物中含去甲猪毛菜碱、1,2,3,4-四氢异喹啉-3-羧酸、2-吡啶甲酸、5-羧基吲哚-3-乙酸、1-异丙烯基-2,3-二氢-1H-苯并[d]咪唑-2-酮、尿刊酸或脲基丙酸或前述各物质的盐或酯中的一种或几种;优选为去甲猪毛菜碱、1,2,3,4-四氢异喹啉-3-羧酸、2-吡啶甲酸、5-羧基吲哚-3-乙酸或前述各物质的盐或酯中的一种或几种。
所述多元醇类化合物中含赤藓糖醇、其盐或酯中的一种或几种。
所述氨基酸化合物中含谷氨酸、亮氨酸、苯丙氨酸、酪氨酸甲酯、L-酪氨酸、天门冬氨酸、色氨酸、D-泛酸/维生素B5、N-乙酰-DL-正缬氨酸或前述各物质的盐或酯中的一种或几种。
所述提取物中的活性物质的类似物为式Ⅰ所示化合物,
式中,
R
n
且,除当R
或,通式化合物的盐或酯。
进一步的,所述提取物中的活性物质的类似物为式Ⅰ所示化合物,所述化合物优选为油酸、油酸甲酯、油酸乙酯、亚油酸、亚油酸甲酯、亚油酸乙酯、壬二酸、壬二酸单甲酯、壬二酸二甲酯、壬二酸单乙酯、壬二酸二乙酯、正壬酸、壬酸甲酯、壬酸乙酯等中的一种或几种。
上述化合物还可为天然、市购或按现有技术制备获得。
一种杀线虫剂,杀线虫剂的活性成分中含由线虫自身为原料提取获得的提取物、其提取物中的活性物质、其提取物中的活性物质的类似物中的一种或几种。
所述杀线虫剂为活性成分与农业上可接受的溶剂的混合,其中活性成分占杀虫剂重量的0.00001-99.9%;所述溶剂为水或有机溶剂中的一种或几种。
所述活性成分占杀虫剂重量优选为0.00005-99%,进一步优选为0.0005-30%,更进一步优选为0.00005-15%。
进一步的,所述有机溶剂为极性溶剂或非极性溶剂中的一种或几种。
进一步的,所述极性溶剂包括苯甲醚、二甲基亚砜(DMSO)、酯、酰胺、酮、醇、二元醇及其衍生物、吡咯烷酮及其衍生物等。
进一步的,所述酯类为乙酸丁酯、乙酸仲丁酯、乙酸苄酯、苯甲酸苄酯、苯甲酸丁酯、2-乙氧基丙基乙酸酯、丙二醇乙酸酯、磷酸三丁酯等中的一种或几种。
进一步的,所述酰胺为N,N-二烷基烷基酰胺,优选脂肪酸二甲基酰胺,更优选为N,N-二甲基辛酰胺、N,N-二甲基癸酰胺、N-甲基-2-吡咯烷酮、N-乙基-2-吡咯烷酮(NEP)、N-辛基-2-吡咯烷酮(NOP)、N-甲基戊内酰胺中的一种或几种。
进一步的,所述酮为丁酮、2-庚酮、环己酮、苯乙酮等,苯乙酮衍生物如4-甲氧基苯乙酮等中的一种或几种。
进一步的,所述醇为丁醇、环己醇、苄醇等、双丙酮醇,如4-羟基-4-甲基-2-戊酮、正辛醇、2-乙基己醇等中的一种或几种。
进一步的,所述二元醇及其衍生物为聚乙二醇,甘油、丙二醇、丙二醇单甲醚乙酸酯、二丙二醇单甲醚、丙二醇单苯基醚等中的一种或几种。
进一步的,所述吡咯烷酮及其衍生物为N-辛基吡咯烷酮、N-乙基吡咯烷酮、N-十二烷基吡咯烷酮等中的一种或几种。
进一步的,所述极性溶剂优选为DMSO、N-乙基-2-吡咯烷酮、N-辛基-2-吡咯烷酮、苯乙酮、2-庚酮、环己酮、苄醇、2-乙基己醇、脂肪酸二甲基酰胺或N,N-二甲基辛酰胺和N,N-二甲基癸酰胺中的一种或几种。
进一步的,所述非极性溶剂为芳族石油衍生物(芳族烃)或植物油中的一种或几种;所述植物油为椰子油、棕榈仁油、棕榈油、大豆油、菜籽油、玉米油和上述油的甲酯或乙酯。
所述溶剂优选为水。
所述杀线虫剂为活性成分与农业上可接受的溶剂的混合,还可包括农业上可接受的辅料;其中,活性成分占杀线虫剂重量的0.00001-99.9%。
所述活性成分占杀线虫剂重量优选为0.00005-99%,进一步优选为0.0005-30%,更进一步优选为0.00005-15%。
进一步的,所述辅料包括农业上可接受的助剂和/或载体。
进一步的,所述助剂包括湿润剂、分散剂、增稠剂、防冻剂、消泡剂、成膜剂、防腐剂和/或乳化剂。
所述提取物中的活性物质含脂肪酸类化合物、苯类化合物、含氮化合物、多元醇类化合物或氨基酸类化合物及其前述所述化合物的盐或酯中的一种或几种。
所述脂肪酸类化合物为脂肪酸、羟基脂肪酸或二元酸;其中,脂肪酸类中含油酸、硬脂酸、亚油酸、花生四烯酸、肉豆蔻酸乙酯、顺式-8,11,14-二十烷三烯酸、顺式-11,14-二十烷二烯酸、14-二十碳烯酸、α-桐油酸、神经酸、花生酸、芥酸、木蜡酸、正壬酸、正癸酸、顺13,16,19-二十二碳三烯酸或前述各物质的盐或酯中的一种或几种;优选为油酸、亚油酸、肉豆蔻酸乙酯、正壬酸或前述各物质的盐或酯中的一种或几种;更优选为油酸、肉豆蔻酸乙酯、正壬酸或前述各物质的盐或酯中的一种或几种。
所述羟基脂肪酸中含6-羟基己酸、(15Z)-9,12,13-Trihydroxy-15-octadecenoicacid、2-羟基戊酸、(9Z)-12,13-二羟基-十八碳烯-9-酸、3-羟基肉豆蔻酸、20-羟基二十碳-5Z,8Z,11Z,14Z-四烯酸、Corchorifatty acid F、16-羟基棕榈酸、2-羟基肉豆蔻酸、10-羟基-2-癸烯酸或前述各物质的盐或酯中的一种或几种;优选为2-羟基戊酸、3-羟基肉豆蔻酸、16-羟基棕榈酸、2-羟基肉豆蔻酸、10-羟基-2-癸烯酸或前述各物质的盐或酯中的一种或几种;更优选为2-羟基戊酸、3-羟基肉豆蔻酸、16-羟基棕榈酸、2-羟基肉豆蔻酸或前述各物质的盐或酯中的一种或几种。
所述二元酸中含甲基丙二酸、壬二酸、2-异丙基苹果酸、柠康酸或前述各物质的盐或酯中的一种或几种;优选为甲基丙二酸、壬二酸或前述各物质的盐或酯中的一种或几种;更优选为壬二酸及其盐或酯中的一种或几种,如壬二酸单甲酯、壬二酸二甲酯、壬二酸单乙酯或壬二酸二乙酯。
所述苯类化合物中含2-甲基苯甲酸、水杨酸、邻甲基水杨酸、阿魏酸、香草酸、龙胆酸、苯甲酸、邻苯二甲酸一丁酯、苯乳酸、尿黑酸、4-羟苯基丙酮酸、苯并二氢呋喃-2-羧酸、2,5-二叔丁基对苯二酚、双酚B或前述各物质的盐或酯中的一种或几种;优选为2-甲基苯甲酸、水杨酸、邻甲基水杨酸、阿魏酸、苯甲酸、邻苯二甲酸一丁酯、苯乳酸或前述各物质的盐或酯中的一种或几种;更优选为2-甲基苯甲酸、水杨酸、邻甲基水杨酸、苯甲酸、邻苯二甲酸一丁酯、尿黑酸或前述各物质的盐或酯中的一种或几种。
所述含氮化合物中含去甲猪毛菜碱、1,2,3,4-四氢异喹啉-3-羧酸、2-吡啶甲酸、5-羧基吲哚-3-乙酸、1-异丙烯基-2,3-二氢-1H-苯并[d]咪唑-2-酮、尿刊酸或脲基丙酸或前述各物质的盐或酯中的一种或几种;优选为去甲猪毛菜碱、1,2,3,4-四氢异喹啉-3-羧酸、2-吡啶甲酸、5-羧基吲哚-3-乙酸或前述各物质的盐或酯中的一种或几种。
所述多元醇类化合物中含赤藓糖醇、其盐或酯中的一种或几种。
所述氨基酸化合物中含谷氨酸、亮氨酸、苯丙氨酸、酪氨酸甲酯、L-酪氨酸、天门冬氨酸、色氨酸、D-泛酸/维生素B5、N-乙酰-DL-正缬氨酸或前述各物质的盐或酯中的一种或几种。
所述提取物中的活性物质的类似物为式Ⅰ所示化合物,
式中,
R
n
且,除当R
进一步的,所述提取物中的活性物质的类似物为式Ⅰ所示化合物,所述化合物优选为油酸、油酸甲酯、油酸乙酯、亚油酸、亚油酸甲酯、亚油酸乙酯、壬二酸、壬二酸单甲酯、壬二酸二甲酯、壬二酸单乙酯、壬二酸二乙酯、正壬酸、壬酸甲酯、壬酸乙酯等中的一种或几种。
上述化合物可为天然、市购或按现有技术制备获得。
进一步的,所述提取物中的活性物质的类似物为式Ⅰ中除表1所记载的脂肪酸、羟基脂肪酸和二元酸中的其他脂肪酸类化合物。如:亚麻酸、十二碳酸异丙酯、4,4-二甲基-1,7-庚二酸单甲酯、2,3-烯壬二酸、2-羟基-4-乙基戊酸;上述化合物可为天然的,也可通过人工合成。
一种杀线虫组合物制剂,组合物为活性组分A和活性组分B,其中,活性组分A与活性组分B按重量份数比为1:100-100:1混合;所述活性组分A为由线虫自身为原料提取获得的提取物、其提取物中的活性物质、其提取物中的活性物质的类似物中的一种或几种;活性组分B为其他杀线虫剂、杀虫剂、杀螨剂、杀菌剂中的一种或几种。
所述制剂可为注射剂、喷洒剂、熏蒸剂、包衣剂或纳米化制剂等。其中,纳米化制剂可采用湿法介质研磨法制备化合物纳米化制剂,所述纳米化粒径为50-500nm,优选300-500nm。
一种化合物在制备杀线虫制剂中的应用,所述化合物为式Ⅰ所示化合物、2-羟基戊酸、3-羟基肉豆蔻酸中的一种或几种;
式中,
R
n
且,除当R
或,通式化合物的盐或酯。
进一步的,所述化合物优选为油酸、油酸甲酯、油酸乙酯、亚油酸、亚油酸甲酯、亚油酸乙酯、壬二酸、壬二酸单甲酯、壬二酸二甲酯、壬二酸单乙酯、壬二酸二乙酯、正壬酸、壬酸甲酯、壬酸乙酯中的一种或几种。
一种保护植物或其繁殖材抵抗由线虫导致的损害的方法,所述方法包括将由线虫自身为原料提取获得的提取物、其提取物中的活性物质、其提取物中的活性物质的类似物中的一种或几种或所述的制剂施用于植物或其场所。
所述方法包括将由线虫自身为原料提取获得的提取物、其提取物中的活性物质、其提取物中的活性物质的类似物中的一种或几种或所述的制剂施用于线虫侵染后的植物材料四周。
上述作为杀线虫剂中,线虫为线虫动物门所有线虫。
所述线虫为尾感器纲双胃亚纲线虫。
所述线虫为尾感器纲双胃亚纲滑刃目滑刃总科滑刃科线虫。
所述线虫为松材线虫(Bursaphelenchus xylophilus)、拟松材线虫(B.mucronatus)、前孔隐滑刃线虫(Cryptaohelenchoides propora)、松柱型垫刃线虫(Cylindrotylenchus pini)、伞滑刃线虫(B.nanjaci)、小松伞滑刃线虫(B.pinasteri)、来氏伞滑刃线虫(B.leoni)以及树伞滑刃线虫(B.silvestris)。
所述线虫优选为松材线虫(Bursaphelenchus xylophilus)。
本发明的有益效果在于:
(1)本发明的线虫提取物、其提取物中的活性物质是对线虫自身提取所得,进而用于该线虫的自身消杀处理;不含任何外加添加剂或外源化合物,不但高效,且更加安全、无毒。
(2)本发明所提取获得的线虫提取物、其提取物中的活性物质可经喷雾、浸泡、涂刷等方法用于线虫侵染后的植物材料周围。
(3)本发明化合物作为杀线虫剂,不仅能够有效控制线虫、特别是松材线虫危害,而且化合物可通过线虫本身进行提取,易于获取;同时,本发明化合物还可与其他具有杀虫作用的化合物、杀线虫剂、杀虫剂、杀螨剂、杀菌剂等组合使用,如阿维菌素、苦参碱、噻唑膦、氨基寡糖素,可显著提高活性;本发明制剂利于后续市场化推广与应用。
附图说明
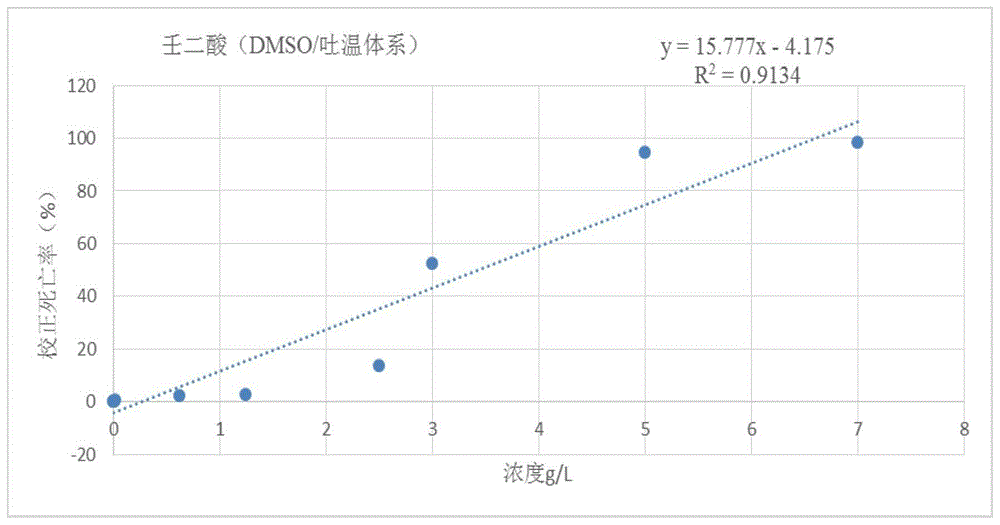
图1为本发明实施例3提供的壬二酸(DMSO/吐温的水体系)24h对松材线虫室内毒杀LC50效果图。
图2为本发明实施例3提供的壬二酸(水体系)24h对松材线虫室内毒杀LC50效果图。
图3为本发明实施例4提供的壬二酸二乙酯(水体系)24h对松材线虫室内毒杀LC50效果图。
图4为本发明实施例4提供的壬二酸二甲酯(水体系)24h对松材线虫室内毒杀LC50效果图。
具体实施例
下面将对本发明实施例中的技术方案进行清楚、完整地描述,所描述的实施例仅仅是本发明的一部分,而不是发明的全部。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
实施例1、松材线虫粗提取物的制备及其化学成分分析
1供试松材线虫来源与松材线虫的扩大培养
称取形态完整的干玉米粒300g常温下用清水浸泡2天后分装进10只容量为250mL的锥形瓶中,分装好后用透气封口膜封口,放入湿热高压灭菌锅120℃灭菌30分钟。灭菌完成后待其自然冷却至室温后在无菌条件下接种适量的灰葡萄孢菌Botrytis cinerea,25℃、70%RH人工气候箱内避光培养5-7天后向每个锥形瓶中接种松材线虫3000-5000头,25℃、70%RH人工气候箱内避光继续培养8-15天后可收获大量松材线虫。
2松材线虫粗提取物的制备
用200mL蒸馏水将线虫从每个锥形瓶壁上冲出后,将洗脱液收集到250mL塑料离心杯中,室温2000r/min离心10min,弃去上清液,收集沉淀物。将贝尔曼漏斗法分离得到线虫转移至500mL锥形瓶中,加入无水乙醇至醇浓度为85%,浸泡24h后,50℃超声30min,抽滤并60℃下减压蒸发除去乙醇。浸膏加入甲醇,室温下2000r/min离心2min,收集上清液,即为粗提取物,将其于0.45μm针式过滤器过滤后,4℃保存备用。
3松材线虫粗提取物化学成分LC/MS/MS分析
将松材线虫粗提取物用LC/MS/MS进行成分分析,即获得提取物中的活性成分。分析条件如下:
仪器:Thermo Scientific Vanquish超高效液相色谱系统系统包括二元高压梯度泵、自动进样器、柱温箱、真空脱气机,并与用于质谱分析的thermo scientific QExactive Orbitrap质谱仪耦合,Q-Exactive主机系统包括H-ESI II源,自动注射泵及切换阀。数据由Thermo Scientific Compound Discoverer软件进行分析。色谱柱为WaterAtlantis T3柱(2.1m m×150mm,3μm)。
LC/MS/MS分析:色谱流动相为乙腈、0.1%(v/v)甲酸水溶液。乙腈与酸水梯度洗脱,流速0.3ml/min,洗脱时间40min,柱温25℃,进样量3μL,双电喷雾电离源在正负离子模式下工作,获得50-1200m/z的全扫描质谱,扫描速率为1.0谱/秒,源气温度设定为350℃,附加源参数设定为鞘层和辅助气体流量分别为40和15,扫气流量为0;喷雾电压为3.0kV;毛细管温度为325℃;S透镜射频电平为60V。数据由Masshanter Data Acquisition V B.04采集,并由Thermo Scientific Compound Discoverer软件进行分析,分析结果见下表。
结果:从下表中看出,松材线虫中主要包括长链脂肪酸、带羟基和双键的脂肪酸、二元碳酸、苯甲酸及其类似物和含氮化合物。
表2松材线虫提取物LC/MS/MS分析
实施例2、松材线虫粗提物对松材线虫的活性实验
药剂配置:将实施例1中制备的线虫粗提物用DMSO测试体系(4%DMSO+15%吐温80)配置成10g/L的水溶液,DMSO测试体系(4%DMSO+15%吐温80)为空白对照组。
线虫悬浮液的制备:用适量的灭菌水将位于玉米粒培养基上的松材线虫悬浮于水相,后经贝尔曼漏斗法分离得到活的松材线虫悬浮液,将线虫悬浮液2000r/min离心2min,去上清留沉淀并加适量灭菌水后镜检观察线虫龄期、活性状况并统计线虫数量,最后用灭菌水将线虫悬浮液定量至1000头线虫/mL,绝大多数线虫处于J3期,有少数为J2期及J4期,4℃备用。
药剂处理:取0.5mL上述制备的线虫悬浮液,在2000r/min离心2min,去除上清液,向沉淀中分别加入0.5mL上述不同的供试药剂,用移液枪打吹均匀,将离心管盖盖后置于25℃、相对湿度60%、无光的人工气候箱内培养,24h后在40倍奥林巴斯CX33光学显微镜下镜检观察并记录线虫总虫数和死亡虫数。
表3松材线虫粗提物对松材线虫的毒杀作用
由上表可知,松材线虫粗提物对松材线虫有一定的杀虫活性(24h,线虫校正死亡率达94.51%),在杀线虫剂产品开发上拥有一定的开发前景。
实施例3、松材线虫提取物中含有的活性成分单体对松材线虫的活性实验
实验一、壬二酸对松材线虫的活性及LC50测定
(一)壬二酸(DMSO/吐温的水体系)对松材线虫的活性实验
药剂配制:
下述实验组药剂的配制为:将壬二酸(市购)经含DMSO和吐温80的水溶液进行配制不同浓度的壬二酸水溶液;其中,水溶液中DMSO含量为4%,吐温80含量为15%。
实验组:
1)浓度为7g/L的壬二酸水溶液10mL;
2)浓度为5g/L的壬二酸水溶液10mL;
3)浓度为3g/L的壬二酸水溶液10mL;
4)浓度为2.5g/L的壬二酸水溶液10mL;
5)浓度为1.25g/L的壬二酸水溶液10mL;
6)浓度为0.625g/L的壬二酸水溶液10mL;
7)浓度为0.025g/L的壬二酸水溶液10mL;
8)浓度为0.0125g/L的壬二酸水溶液10mL;
9)浓度为0.00625g/L的壬二酸水溶液10mL;
10)浓度为0.00375g/L的壬二酸水溶液10mL;
对照组:以实验组溶剂作为空白对照。
线虫悬浮液的制备:用适量的灭菌水将位于玉米粒培养基上的松材线虫悬浮于水相,后经贝尔曼漏斗法分离得到活的松材线虫悬浮液,将线虫悬浮液2000r/min离心2min,去上清留沉淀并加适量灭菌水后镜检观察线虫龄期、活性状况并统计线虫数量,最后用灭菌水将线虫悬浮液定量至1000头线虫/mL,绝大多数线虫处于J3期,有少数为J2期及J4期,4℃备用。
药剂处理:取0.5mL上述制备的线虫悬浮液,在2000r/min离心2min,去除上清液,向沉淀中分别加入0.5mL上述不同的供试药剂,用移液枪打吹均匀,将离心管盖盖后置于25℃、相对湿度60%、无光的人工气候箱内培养,24h后在40倍奥林巴斯CX33光学显微镜下镜检观察并记录线虫总虫数和死亡虫数。
表4壬二酸(含DMSO/吐温的水体系)在不同工作浓度下对松材线虫的毒杀作用
对壬二酸(含DMSO/吐温的水体系)24h的不同浓度下对松材线虫的毒杀活性拟合方程,得图1;由图1可知,壬二酸(含DMSO/吐温80的水体系)对松材线虫具有一定的毒杀活性,其室内24h对松材线虫的LC50为3.43g/L。
(二)壬二酸靶标特异性实验
选用市面上常见的杀线虫剂阿维菌素、甲氨基阿维菌素苯甲酸盐作为阳性对照药剂,壬二酸作为处理药剂,清水作为空白对照。
选用室内饲养的发育阶段一致且个头相近的鞘翅目叶甲科柳蓝叶甲作为非靶标昆虫60头,均分为6组,每个处理两个重复,分别向供试昆虫喷洒1%壬二酸(含DMSO/吐温80的水体系)、1%阿维菌素、1%甲氨基阿维菌素苯甲酸盐(甲维盐)溶解体系。2h后统计各组死虫率。
实验结果:
表5不同处理剂对柳蓝叶甲的处理结果表
实验结论:与市售常规杀线虫剂产品相比,壬二酸有更强的靶标特异性,对非靶标昆虫(柳蓝叶甲)安全性更高。
(三)壬二酸(水体系)对松材线虫的活性实验
药剂配制:
下述实验组药剂的配制为将壬二酸(市购)经蒸馏水进行配制不同浓度的壬二酸水溶液,壬二酸水溶液浓度分别为1g/L、0.9g/L、0.8g/L、0.7g/L、0.6g/L、0.5g/L。蒸馏水作为空白对照组。
线虫悬浮液的制备:用适量的灭菌水将位于玉米粒培养基上的松材线虫悬浮于水相,后经贝尔曼漏斗法分离得到活的松材线虫悬浮液,将线虫悬浮液2000r/min离心2min,去上清留沉淀并加适量灭菌水后镜检观察线虫龄期、活性状况并统计线虫数量,最后用灭菌水将线虫悬浮液定量至1000头线虫/mL,绝大多数线虫处于J3期,有少数为J2期及J4期,4℃备用。
药剂处理:取0.5mL上述制备的线虫悬浮液,在2000r/min离心2min,去除上清液,向沉淀中分别加入0.5mL上述不同的供试药剂,用移液枪打吹均匀,将离心管盖盖后置于25℃、相对湿度60%、无光的人工气候箱内培养,24h后在40倍奥林巴斯CX33光学显微镜下镜检观察并记录线虫总虫数和死亡虫数。
实验结果:
表6壬二酸(水体系)对松材线虫的毒杀作用
对壬二酸(水体系)24h的不同浓度下对松材线虫的毒杀活性拟合方程,得图2;由图2可知,壬二酸(水体系)对松材线虫具有较好的毒杀活性,其室内24h对松材线虫的LC50为0.55g/L。
实验二、2-羟基戊酸、3-羟基肉豆蔻酸不同药剂对松材线虫的活性实验
将2-羟基戊酸用灭菌水配置成10g/L的溶液,3-羟基肉豆蔻酸用DMSO测试体系(含4%DMSO+15%吐温80的水)配置成10g/L的溶液,以实验组溶剂作为空白对照(DMSO测试体系、灭菌水)。线虫悬浮液的制备及药剂处理方法与实验一相同,24h后在40倍奥林巴斯CX33光学显微镜下镜检观察并记录线虫总虫数和死亡虫数,结果如下。
表7不同药剂对松材线虫的毒杀作用
由上表可知,2-羟基戊酸和3-羟基肉豆蔻酸在10g/L时对松材线虫均具有一定的毒杀活性。
实验三、6-羟基己酸、甲基丙二酸、苹果酸或柠康酸不同药剂对松材线虫的活性实验
将6-羟基己酸用DMSO测试体系(含4%DMSO+15%吐温80的水)配置成10g/L的溶液,甲基丙二酸、苹果酸、柠康酸用灭菌水配置成10g/L的溶液,以实验组溶剂作为空白对照(DMSO测试体系、灭菌水)。线虫悬浮液的制备及药剂处理方法与实验一相同,24h后在40倍奥林巴斯CX33光学显微镜下镜检观察并记录线虫总虫数和死亡虫数,结果如下。
表8不同药剂对松材线虫的毒杀作用
由上表可知,6-羟基己酸在10g/L时对松材线虫几乎不存在毒杀活性,甲基丙二酸、苹果酸、柠康酸在10g/L时对松材线虫存在微弱的毒杀活性。
实施例4、壬二酸酯类/壬二酸钾盐对松材线虫的活性实验
实验一、壬二酸二乙酯对松材线虫的活性实验
1.壬二酸二乙酯/DMSO体系对松材线虫的活性实验
药剂配置:将壬二酸二乙酯(市购)用DMSO测试体系(含4%DMSO+15%吐温80的水)配置成10g/L的溶液,DMSO测试体系(含4%DMSO+15%吐温80的水)为空白对照组。
线虫悬浮液的制备:用适量的灭菌水将位于玉米粒培养基上的松材线虫悬浮于水相,后经贝尔曼漏斗法分离得到活的松材线虫悬浮液,将线虫悬浮液2000r/min离心2min,去上清留沉淀并加适量灭菌水后镜检观察线虫龄期、活性状况并统计线虫数量,最后用灭菌水将线虫悬浮液定量至1000头线虫/mL,绝大多数线虫处于J3期,有少数为J2期及J4期,4℃备用。
药剂处理:取0.5mL上述制备的线虫悬浮液,在2000r/min离心2min,去除上清液,向沉淀中分别加入0.5mL上述不同的供试药剂,用移液枪打吹均匀,将离心管盖盖后置于25℃、相对湿度60%、无光的人工气候箱内培养,24h后在40倍奥林巴斯CX33光学显微镜下镜检观察并记录线虫总虫数和死亡虫数。
表9壬二酸二乙酯/DMSO对松材线虫的毒杀作用
由上表可知,壬二酸二乙酯(DMSO/吐温体系)对松材线虫有一定的杀虫活性(24h,杀虫活性达91.1%)。
2.壬二酸二乙酯/水体系对松材线虫的活性实验
药剂配置:将壬二酸二乙酯(市购)用水分别配置成1g/L、0.7g/L、0.5g/L、0.3g/L、0.1g/L、0.07g/L、0.05g/L、0.03g/L及0.01g/L的壬二酸二乙酯水溶液,水作为空白对照组。
线虫悬浮液的制备:用适量的灭菌水将位于玉米粒培养基上的松材线虫悬浮于水相,后经贝尔曼漏斗法分离得到活的松材线虫悬浮液,将线虫悬浮液2000r/min离心2min,去上清留沉淀并加适量灭菌水后镜检观察线虫龄期、活性状况并统计线虫数量,最后用灭菌水将线虫悬浮液定量至1000头线虫/mL,绝大多数线虫处于J3期,有少数为J2期及J4期,4℃备用。
药剂处理:取0.5mL上述制备的线虫悬浮液,在2000r/min离心2min,去除上清液,向沉淀中分别加入0.5mL上述不同的供试药剂,用移液枪打吹均匀,将离心管盖盖后置于25℃、相对湿度60%、无光的人工气候箱内培养,24h后在40倍奥林巴斯CX33光学显微镜下镜检观察并记录线虫总虫数和死亡虫数。
表10壬二酸二乙酯/水对松材线虫的毒杀作用
对壬二酸二乙酯(水体系)24h的不同浓度下对松材线虫的毒杀活性拟合方程,得图3;由图3可知,壬二酸二乙酯(水体系)24h对松材线虫的LC50=0.222g/L,说明壬二酸二乙酯对松材线虫存在较好的杀线活性。
实验二、壬二酸二甲酯对松材线虫的活性实验
药剂配置:将壬二酸二甲酯(市购)用水分别配置成0.01g/L、0.03g/L、0.05g/L、0.07g/L、0.1g/L、0.2g/L壬二酸二甲酯水溶液,水作为空白对照组。
线虫悬浮液的制备:用适量的灭菌水将位于玉米粒培养基上的松材线虫悬浮于水相,后经贝尔曼漏斗法分离得到活的松材线虫悬浮液,将线虫悬浮液2000r/min离心2min,去上清留沉淀并加适量灭菌水后镜检观察线虫龄期、活性状况并统计线虫数量,最后用灭菌水将线虫悬浮液定量至1000头线虫/mL,绝大多数线虫处于J3期,有少数为J2期及J4期,4℃备用。
药剂处理:取0.5mL上述制备的线虫悬浮液,在2000r/min离心2min,去除上清液,向沉淀中分别加入0.5mL上述不同的供试药剂,用移液枪打吹均匀,将离心管盖盖后置于25℃、相对湿度60%、无光的人工气候箱内培养,24h后在40倍奥林巴斯CX33光学显微镜下镜检观察并记录线虫总虫数和死亡虫数。
表11壬二酸二甲酯/水对松材线虫的毒杀作用
对壬二酸二甲酯(水体系)24h的不同浓度下对松材线虫的毒杀活性拟合方程,得图4;由图4可知,壬二酸二甲酯(水体系)对松材线虫具有较好的毒杀活性,其室内24h对松材线虫的LC50为0.0656g/L。
实验三、壬二酸二钾盐对松材线虫的活性实验
药剂配置:将壬二酸二钾盐用DMSO测试体系(含4%DMSO+15%吐温80的水)配置成10g/L的溶液,DMSO测试体系(含4%DMSO+15%吐温80的水)为空白对照组。
线虫悬浮液的制备:用适量的灭菌水将位于玉米粒培养基上的松材线虫悬浮于水相,后经贝尔曼漏斗法分离得到活的松材线虫悬浮液,将线虫悬浮液2000r/min离心2min,去上清留沉淀并加适量灭菌水后镜检观察线虫龄期、活性状况并统计线虫数量,最后用灭菌水将线虫悬浮液定量至1000头线虫/mL,绝大多数线虫处于J3期,有少数为J2期及J4期,4℃备用。
药剂处理:取0.5mL上述制备的线虫悬浮液,在2000r/min离心2min,去除上清液,向沉淀中分别加入0.5mL上述不同的供试药剂,用移液枪打吹均匀,将离心管盖盖后置于25℃、相对湿度60%、无光的人工气候箱内培养,24h后在40倍奥林巴斯CX33光学显微镜下镜检观察并记录线虫总虫数和死亡虫数。
表12壬二酸二钾盐对松材线虫的毒杀作用
由上表可知,壬二酸二钾盐对松材线虫有一定的杀虫活性(24h,杀虫活性达82.2%),说明松材线虫杀线物的成盐形式可能对线虫也存在一定的的杀线活性。
实施例5、壬二酸复配农药对松材线虫毒杀活性的增效作用
药剂配制:
组别1.壬二酸用DMSO测试体系(含4%DMSO+15%吐温80的水)配制为3g/L的水溶液;
组别2.苦参碱经灭菌水配制为0.6mg/L的水溶液;
组别3.阿维菌素经灭菌水配制为18mg/L的水溶液;
组别4.复配药剂1为灭菌水中添加壬二酸和苦参碱,其中壬二酸终浓度为3g/L,苦参碱终浓度为0.6mg/L;
组别5.复配药剂2为灭菌水中添加壬二酸和阿维菌素,其中壬二酸终浓度为3g/L,阿维菌素终浓度为0.6mg/L;
组别6.DMSO测试体系(含4%DMSO+15%吐温80的水)为空白对照组;
线虫悬浮液的制备:用适量的灭菌水将位于玉米粒培养基上的松材线虫悬浮于水相,后经贝尔曼漏斗法分离得到活的松材线虫悬浮液,将线虫悬浮液2000r/min离心2min,去上清留沉淀并加适量灭菌水后镜检观察线虫龄期、活性状况并统计线虫数量,最后用灭菌水将线虫悬浮液定量至1000头线虫/mL,绝大多数线虫处于J3期,有少数为J2期及J4期,4℃备用。
药剂处理:取0.5mL上述制备的线虫悬浮液,在2000r/min离心2min,去除上清液,向沉淀中分别加入0.5mL上述不同的供试药剂,用移液枪打吹均匀,将离心管盖盖后置于25℃、相对湿度60%、无光的人工气候箱内培养,24h后在40倍奥林巴斯CX33光学显微镜下镜检观察并记录线虫总虫数和死亡虫数。
表13壬二酸复配农药对松材线虫毒杀活性的增效
表14壬二酸复配农药对松材线虫毒杀活性的增效
结论:由上表可知,壬二酸与阿维菌素、苦参碱存在明显的协同增效作用。
实施例6、壬二酸纳米制剂制备方法及其对松材线虫的活性实验
1)壬二酸纳米化制剂制备方法:
分别取0.1g-0.5g吐温80及PVP K30加入100ml去离子水中,在500r/min磁力搅拌器中溶解,形成水相。称取0.3g壬二酸加入上述溶液中,混匀后转移至WG-0.3L介质研磨机中,选用直径0.2mm的氧化锆珠为研磨介质,介质填充量为研磨机腔体的80%,2500r/min研磨30min,研磨好的纳米混悬液等分为4份,分别于52℃下放置0.5h、2d、6d、12d后测量并统计纳米混悬液的粒径大小、多分散性、壬二酸分解率,详细数据见表。
表15纳米混悬剂各指标表
壬二酸经上述湿法介质研磨后于25℃存放12d内其平均粒径均小于500nm,且其多分散性PDI均小于0.25,表明溶液颗粒不仅达到纳米化级别且壬二酸在纳米化混悬液中分布窄,体系均一性较好。湿法介质研磨过程中由于研磨介质的反复碰撞有效成分会存在一定的分解比率,经高效液相色谱定量分析得出壬二酸在纳米混悬液中的分解率均小于5%,GB/T 19136-2003《农药热储稳定性测定方法》规定,农药经过热储化学稳定性试验,药物有效成分分解率低于5%即为合格。综上,基于介质研磨法制备的壬二酸纳米混悬剂有效成分平均粒径、有效成分在体系内的分散性、有效成分稳定性等均符合要求,因此可以使用上述方法制备合格的壬二酸纳米化制剂。
2)利用上述获得壬二酸纳米化制剂对松材线虫的毒杀活性测定:
药剂配制:取制备好的有效成分浓度为3g/L的壬二酸纳米混悬液、配制浓度为3g/L的无纳米化处理的壬二酸溶液、配制0.3%吐温80+PVP K30水溶液为对照药剂。
线虫悬浮液的制备:用适量的灭菌水将位于玉米粒培养基上的松材线虫悬浮于水相,后经贝尔曼漏斗法分离得到活的松材线虫悬浮液,将线虫悬浮液2000r/min离心2min,去上清留沉淀并加适量灭菌水后镜检观察线虫龄期、活性状况并统计线虫数量,最后用灭菌水将线虫悬浮液定量至1000头线虫/mL,绝大多数线虫处于J3期,有少数为J2期及J4期,4℃备用。
药剂处理:取0.5mL上述制备的线虫悬浮液,在2000r/min离心2min,去除上清液,向沉淀中分别加入0.5mL上述不同的供试药剂,用移液枪打吹均匀,将离心管盖盖后置于25℃、相对湿度60%、无光的人工气候箱内培养,24h后在40倍奥林巴斯CX33光学显微镜下镜检观察并记录线虫总虫数和死亡虫数。
表16壬二酸纳米化前后杀线虫活性
结论:壬二酸经纳米化处理后其对松材线虫的杀虫活性大幅提升,提升幅度为62.12%。实施例7、2-羟基戊酸复配农药对松材线虫毒杀活性的增效作用
药剂配制:
组别1.2-羟基戊酸用水配制为10g/L的水溶液;
组别2.苦参碱经灭菌水配制为0.6mg/L的水溶液;
组别3.阿维菌素经灭菌水配制为18mg/L的水溶液;
组别4.复配药剂1为灭菌水中添加2-羟基戊酸和苦参碱,其中2-羟基戊酸终浓度为10g/L,苦参碱终浓度为0.6mg/L;
组别5.复配药剂2为灭菌水中添加2-羟基戊酸和阿维菌素,其中2-羟基戊酸终浓度为10g/L,阿维菌素终浓度为0.6mg/L;
组别6.水为对照组;
线虫悬浮液的制备:用适量的灭菌水将位于玉米粒培养基上的松材线虫悬浮于水相,后经贝尔曼漏斗法分离得到活的松材线虫悬浮液,将线虫悬浮液2000r/min离心2min,去上清留沉淀并加适量灭菌水后镜检观察线虫龄期、活性状况并统计线虫数量,最后用灭菌水将线虫悬浮液定量至1000头线虫/mL,绝大多数线虫处于J3期,有少数为J2期及J4期,4℃备用。
药剂处理:取0.5mL上述制备的线虫悬浮液,在2000r/min离心2min,去除上清液,向沉淀中分别加入0.5mL上述不同的供试药剂,用移液枪打吹均匀,将离心管盖盖后置于25℃、相对湿度60%、无光的人工气候箱内培养,24h后在40倍奥林巴斯CX33光学显微镜下镜检观察并记录线虫总虫数和死亡虫数。
表17 2-羟基戊酸复配农药对松材线虫毒杀活性的增效
表18 2-羟基戊酸复配农药对松材线虫毒杀活性的增效
结论:由表可知,2-羟基戊酸与阿维菌素、苦参碱存在明显的协同增效作用。实施例8、2-羟基戊酸纳米制剂制备方法及其对松材线虫的活性实验
1)2-羟基戊酸纳米化制剂制备方法:
分别取0.1g-0.5g吐温80及PVP K30加入100ml去离子水中,在500r/min磁力搅拌器中溶解,形成水相。称取1g 2-羟基戊酸加入上述溶液中,混匀后转移至WG-0.3L介质研磨机中,选用直径0.2mm的氧化锆珠为研磨介质,介质填充量为研磨机腔体的80%,2500r/min研磨30min,研磨好的纳米混悬液等分为4份,分别于52℃下放置0.5h、2d、6d、12d后测量并统计纳米混悬液的粒径大小、多分散性、2-羟基戊酸分解率,详细数据见下表。
表19纳米混悬剂各指标表
2-羟基戊酸经上述湿法介质研磨后于25℃存放12d内其平均粒径均小于500nm,且其多分散性PDI均小于0.25,表明溶液颗粒不仅达到纳米化级别且2-羟基戊酸在纳米化混悬液中分布窄,体系均一性较好。湿法介质研磨过程中由于研磨介质的反复碰撞有效成分会存在一定的分解比率,经高效液相色谱定量分析得出2-羟基戊酸在纳米混悬液中的分解率均小于5%,GB/T 19136-2003《农药热储稳定性测定方法》规定,农药经过热储化学稳定性试验,药物有效成分分解率低于5%即为合格。综上,基于介质研磨法制备的2-羟基戊酸纳米混悬剂有效成分平均粒径、有效成分在体系内的分散性、有效成分稳定性等均符合要求,因此可以使用上述方法制备合格的2-羟基戊酸纳米化制剂。
2)利用上述获得2-羟基戊酸纳米化制剂对松材线虫的毒杀活性测定:
药剂配制:取制备好的有效成分浓度为10g/L的2-羟基戊酸纳米混悬液、配制浓度为10g/L的无纳米化处理的2-羟基戊酸溶液、配制0.3%吐温80+PVP K30水溶液为对照药剂。
线虫悬浮液的制备:用适量的灭菌水将位于玉米粒培养基上的松材线虫悬浮于水相,后经贝尔曼漏斗法分离得到活的松材线虫悬浮液,将线虫悬浮液2000r/min离心2min,去上清留沉淀并加适量灭菌水后镜检观察线虫龄期、活性状况并统计线虫数量,最后用灭菌水将线虫悬浮液定量至1000头线虫/mL,绝大多数线虫处于J3期,有少数为J2期及J4期,4℃备用。
药剂处理:取0.5mL上述制备的线虫悬浮液,在2000r/min离心2min,去除上清液,向沉淀中分别加入0.5mL上述不同的供试药剂,用移液枪打吹均匀,将离心管盖盖后置于25℃、相对湿度60%、无光的人工气候箱内培养,24h后在40倍奥林巴斯CX33光学显微镜下镜检观察并记录线虫总虫数和死亡虫数。
表20 2-羟基戊酸纳米化前后杀线虫活性
结论:2-羟基戊酸经纳米化处理后其对松材线虫的杀虫活性大幅提升,提升幅度为39.6%。
实施例9、3-羟基肉豆蔻酸复配农药对松材线虫毒杀活性的增效作用
药剂配制:
组别1.3-羟基肉豆蔻酸用DMSO测试体系(4%DMSO+15%吐温80)配置成10g/L的溶液;
组别2.苦参碱经灭菌水配制为0.6mg/L的水溶液;
组别3.阿维菌素经灭菌水配制为18mg/L的水溶液;
组别4.复配药剂1为DMSO测试体系(4%DMSO+15%吐温80)中添加3-羟基肉豆蔻酸和苦参碱,其中3-羟基肉豆蔻酸终浓度为10g/L,苦参碱终浓度为0.6mg/L;
组别5.复配药剂2为DMSO测试体系(4%DMSO+15%吐温80)中添加3-羟基肉豆蔻酸和阿维菌素,其中3-羟基肉豆蔻酸终浓度为10g/L,阿维菌素终浓度为0.6mg/L;
组别6.DMSO测试体系(4%DMSO+15%吐温80)为对照组;
线虫悬浮液的制备:用适量的灭菌水将位于玉米粒培养基上的松材线虫悬浮于水相,后经贝尔曼漏斗法分离得到活的松材线虫悬浮液,将线虫悬浮液2000r/min离心2min,去上清留沉淀并加适量灭菌水后镜检观察线虫龄期、活性状况并统计线虫数量,最后用灭菌水将线虫悬浮液定量至1000头线虫/mL,绝大多数线虫处于J3期,有少数为J2期及J4期,4℃备用。
药剂处理:取0.5mL上述制备的线虫悬浮液,在2000r/min离心2min,去除上清液,向沉淀中分别加入0.5mL上述不同的供试药剂,用移液枪打吹均匀,将离心管盖盖后置于25℃、相对湿度60%、无光的人工气候箱内培养,24h后在40倍奥林巴斯CX33光学显微镜下镜检观察并记录线虫总虫数和死亡虫数。
表21 3-羟基肉豆蔻酸复配农药对松材线虫毒杀活性的增效
表22 3-羟基肉豆蔻酸复配农药对松材线虫毒杀活性的增效
结论:由表可知,3-羟基肉豆蔻酸与阿维菌素、苦参碱存在明显的协同增效作用。
实施例10、3-羟基肉豆蔻酸纳米制剂制备方法及其对松材线虫的活性实验
1)3-羟基肉豆蔻酸纳米化制剂制备方法:
分别取0.1g-0.5g吐温80及PVP K30加入100ml去离子水中,在500r/min磁力搅拌器中溶解,形成水相。称取1g 3-羟基肉豆蔻酸加入上述溶液中,混匀后转移至WG-0.3L介质研磨机中,选用直径0.2mm的氧化锆珠为研磨介质,介质填充量为研磨机腔体的80%,2500r/min研磨30min,研磨好的纳米混悬液等分为4份,分别于52℃下放置0.5h、2d、6d、12d后测量并统计纳米混悬液的粒径大小、多分散性、3-羟基肉豆蔻酸分解率,详细数据见下表。
表23纳米混悬剂各指标表
3-羟基肉豆蔻酸经上述湿法介质研磨后于25℃存放12d内其平均粒径均小于500nm,且其多分散性PDI均小于0.25,表明溶液颗粒不仅达到纳米化级别且3-羟基肉豆蔻酸在纳米化混悬液中分布窄,体系均一性较好。湿法介质研磨过程中由于研磨介质的反复碰撞有效成分会存在一定的分解比率,经高效液相色谱定量分析得出3-羟基肉豆蔻酸在纳米混悬液中的分解率均小于5%,GB/T 19136-2003《农药热储稳定性测定方法》规定,农药经过热储化学稳定性试验,药物有效成分分解率低于5%即为合格。综上,基于介质研磨法制备的3-羟基肉豆蔻酸纳米混悬剂有效成分平均粒径、有效成分在体系内的分散性、有效成分稳定性等均符合要求,因此可以使用上述方法制备合格的3-羟基肉豆蔻酸纳米化制剂。
2)利用上述获得3-羟基肉豆蔻酸纳米化制剂对松材线虫的毒杀活性测定:
药剂配制:取制备好的有效成分浓度为10g/L的3-羟基肉豆蔻酸纳米混悬液、配制浓度为5g/L的无纳米化处理的3-羟基肉豆蔻酸溶液、配制0.3%吐温80+PVP K30水溶液为对照药剂。
线虫悬浮液的制备:用适量的灭菌水将位于玉米粒培养基上的松材线虫悬浮于水相,后经贝尔曼漏斗法分离得到活的松材线虫悬浮液,将线虫悬浮液2000r/min离心2min,去上清留沉淀并加适量灭菌水后镜检观察线虫龄期、活性状况并统计线虫数量,最后用灭菌水将线虫悬浮液定量至1000头线虫/mL,绝大多数线虫处于J3期,有少数为J2期及J4期,4℃备用。
药剂处理:取0.5mL上述制备的线虫悬浮液,在2000r/min离心2min,去除上清液,向沉淀中分别加入0.5mL上述不同的供试药剂,用移液枪打吹均匀,将离心管盖盖后置于25℃、相对湿度60%、无光的人工气候箱内培养,24h后在40倍奥林巴斯CX33光学显微镜下镜检观察并记录线虫总虫数和死亡虫数。
表24 3-羟基肉豆蔻酸纳米化前后杀线虫活性
结论:3-羟基肉豆蔻酸经纳米化处理后其对松材线虫的杀虫活性得到提升,提升幅度为26.6%。
