组合的神经调节技术
文献发布时间:2024-04-18 19:52:40
背景技术
本文公开的主题涉及神经调节,并且更具体地涉及使用组合的神经调节治疗的技术,该组合的神经调节治疗包括从能量源施加的能量和/或与药物治疗结合使用的神经调节。
神经调节已被用于治疗多种临床病症。例如,在沿着脊髓的不同位置处的电刺激已经用于治疗慢性背痛。这种治疗可以通过可植入设备来进行,该可植入设备周期性地产生电能,该电能被施加到组织以激活某些神经纤维,这又可以导致疼痛感觉的降低。在脊髓刺激的情况下,刺激电极通常定位在硬膜外腔中,尽管脉冲发生器可以定位成稍微远离电极,例如在腹部或臀部区中,但是经由导线连接到电极。定位在某些靶标神经处或附近的电极通过触发神经纤维中的动作电位来介导神经调节,这又导致神经突触处的神经递质释放以及与下一神经的突触通信。这种传播可导致比期望的相对更大或更扩散的生理效应,因为植入电极的当前实施同时刺激许多神经或轴突。因为神经途径是复杂和相互连接的,所以更靶向的调节效应可能在临床上更有用。
附图说明
当参考附图阅读以下详细描述时,将更好地理解本发明的这些和其他特征、方面和优点,附图中相同的符号在整个附图中表示相同的部分,其中:
图1是根据本公开的实施方案的下丘脑代谢控制中心及其在整合关于葡萄糖和营养可用性的激素/内分泌和神经元/传入感觉信息中的作用的示意图;
图2是根据本公开的实施方案的下丘脑中葡萄糖激发和葡萄糖抑制的神经元群体的示意图;
图3A是根据本公开的实施方案的从肠-肝脏-大脑轴到下丘脑的自主输入的示意图;
图3B是根据本公开的实施方案的从肠-肝脏-大脑轴到下丘脑的自主输入的示意图;
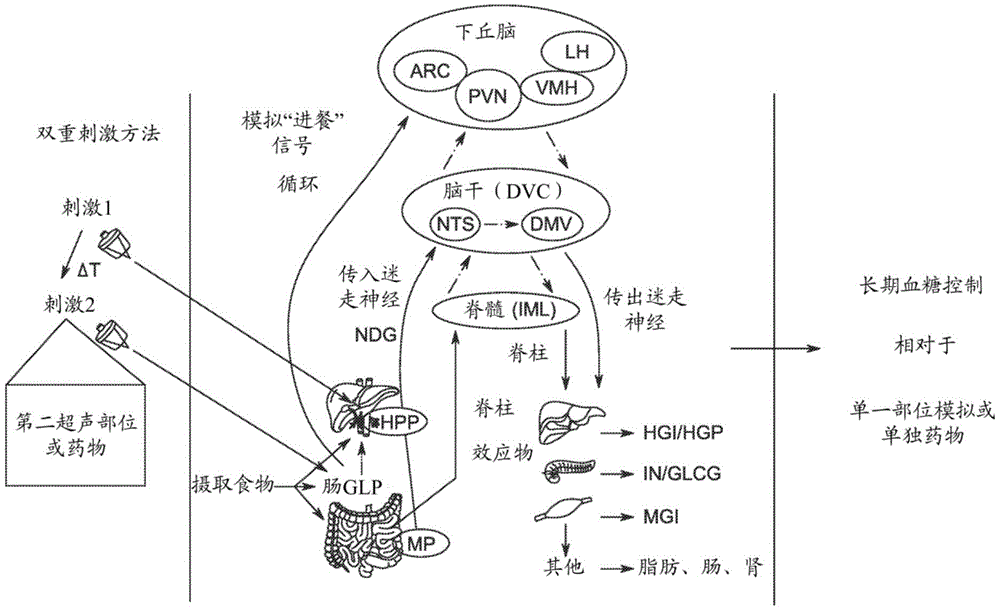
图4是根据本公开的实施方案的组合的神经调节技术的示意图,该组合的神经调节技术使用与额外的刺激组合的肝门传感器的非侵入性超声神经调节,以模拟进食状态信号传导并触发葡萄糖处置;
图5A显示了在每日肝门丛(单一部位)刺激期间动物模型中的葡萄糖控制;
图5B显示了在单一部位治疗后超声停止后三天图5A的效应持续时间的停止;
图6显示了双重部位刺激(即肝门丛和肠系膜上丛)后动物模型中的长期缓解,以及当使用低剂量GLP激动剂利拉鲁肽(liraglutide)的双重部位刺激时甚至更长时间的缓解;
图7比较了单独药物相对于单一部位刺激与药物治疗组合的组合的神经调节的动物模型中的缓解期;
图8A显示了在晚期ZDF(Zucker糖尿病肥胖大鼠)动物中作为双重部位刺激的组合的神经调节的结果对循环葡萄糖的效应;
图8B显示了在晚期ZDF动物中作为双重部位刺激的组合的神经调节的结果对循环葡萄糖的效应;
图9显示了在动物模型中用二甲双胍(metformin)治疗期间的双重部位相对于单一部位刺激;
图10A显示了对于组合的神经调节疗法、单一部位刺激和对照的动物模型中的非禁食血糖浓度;
图10B显示了对于单独的不同单一部位刺激部位/靶标的动物模型中的血浆GLP-1浓度;
图10C显示了对于单独的不同单一部位刺激部位/靶标的动物模型中的循环胰岛素浓度;
图10D显示了对于单独的不同单一部位刺激部位/靶标的动物模型中的GABA浓度;
图10E显示了对于单独的不同单一部位刺激部位/靶标的动物模型中的循环胰高血糖素浓度;
图11显示了对于组合的神经调节疗法、单一部位刺激和对照的动物模型中的急性口服葡萄糖耐量测试中的循环葡萄糖浓度;
图12显示了在不同起始和停止时间点的对于组合的神经调节疗法和对照的动物模型中的非禁食循环葡萄糖浓度;
图13A显示了对于用营养辅料的单一部位刺激和对照的动物模型中的急性口服葡萄糖耐量测试中的循环葡萄糖浓度;
图13B显示了对于用营养辅料的单一部位刺激和对照的动物模型中的急性口服葡萄糖耐量测试中的循环葡萄糖浓度;
图14是根据本公开的实施方案的使用脉冲发生器的神经调节系统的示意图示;并且
图15是根据本公开的实施方案的神经调节系统的框图。
具体实施方式
在下面将描述一个或多个具体的实施方案。为了提供这些实施方案的简明描述,并非实际具体实施的所有特征都要在说明书中进行描述。应当理解,在任何此类实际具体实施的开发中,如在任何工程或设计项目中,必须做出许多特定于具体实施的决策以实现开发者的具体目标,诸如遵守可能因具体实施而不同的系统相关和业务相关约束。此外,应当理解,此类开发努力可能是复杂且耗时的,但对于受益于本公开的普通技术人员来说仍然是设计、制作和制造的常规任务。
本文中给出的任何示例或例证不应以任何方式被视为对其所利用的任何一个或多个术语的约束、限制或明确定义。相反,这些示例或例证应被视为关于各种特定实施方案描述而且仅为例示性的。本领域普通技术人员将理解,这些示例或例证所使用的任何一个或多个术语将涵盖可能或可能不与其一起给出或在本说明书中的其他地方给出的其他实施方案,并且所有这样的实施方案旨在被包括在该一个或多个术语的范围内。指定此类非限制性示例和例证的语言包括但不限于:“例如(for example)”、“比如”、“诸如”、“例如(e.g.)”、“包括”、“在某些实施方案中”、“在一些实施方案中”和“在一个实施方案中”。
本文提供了包括施加神经调节能量的组合的神经调节技术。组合的神经调节技术引起作为组合的神经调节技术的结果的靶向生理结果(例如,治疗、预防、治愈或引起生理状况的缓解)。例如,如本文所提供的组合的神经调节技术可用于加强或增加药物或其它神经调节治疗的效应和/或使先前对治疗有抗性或响应较小的患者变得有响应。在一个实施方案中,组合的神经调节技术包括在两个或更多个不同的感兴趣区处的神经调节治疗,以靶向生理控制途径的不同部分。在一个实施方案中,组合的神经调节技术包括靶向至少一个感兴趣区的神经调节治疗和至少一种药物治疗。
在组合的技术的实施方案中,在第一部位处的神经调节(例如,组合的神经调节技术的第一部分)可用于增强药物治疗和/或增强在患者的第二部位或一或多个不同部位处的神经调节。因此,增强可允许修改药物治疗或组合的神经调节剂量以调整标准或推荐剂量。在一个示例中,相对于在不存在神经调节的情况下施用的标准剂量,较少的药物治疗组合物被施用于患者以实现相同的临床效应。因此,治疗可以更便宜,因为施用更少的治疗组合物。此外,患者暴露于较低剂量的药物治疗,这又可降低副作用的风险并允许某些药物方案在较长时间段内施用。在另一个示例中,可以基于组合治疗的增强来调整(例如,降低)在一个或多个靶标部位处的神经调节能量,使得向感兴趣区内的特定治疗靶标施加更少的神经调节能量以实现期望的生理结果。
增强可以是双向的,使得组合的神经调节技术的第一部分增强组合的神经调节技术的第二部分的临床效应,或者反之亦然。在一个实施方案中,将神经调节提供给也经历药物治疗的患者,以增强药物治疗的临床效应或神经调节的效应中的一者或两者。例如,药物治疗的施用可以激活或改变患者中与成功的神经调节(例如,将神经调节能量成功地施加到患者的感兴趣区以引起生理效应)相关的分子或细胞的存在或水平。因此,药物治疗可用于增强神经调节或改善患者对神经调节的响应。类似地,在双重部位治疗方针的一个或两个部位处的神经调节可用于增强在另一部位处的临床效应。
超声可以刺激器官内和周围的外周神经场(传出和传入神经场),包括脾(激活调节免疫细胞和免疫系统功能的神经)和肝脏(激活调节葡萄糖/营养传感和代谢系统功能的神经)。在一个实施方案中,本文提供了改善超声治疗的抗糖尿病效应的技术,该技术导致甚至在遗传性肥胖糖尿病Zucker(ZDF)啮齿动物模型中提供长期缓解II型糖尿病的意外结果。在一个实施方案中,该技术包括使用来自胃肠道的感觉场的超声神经调节(即,上升葡萄糖传感器传入途径的肝/肝门丛神经调节)和神经内分泌场的超声神经调节(即,胰高血糖素样肽(GLP)分泌和相关激素和传入途径的刺激)两者的下丘脑代谢控制中心的双重刺激治疗。在一个实施方案中,组合的神经调节技术包括感觉场的超声神经调节(即,上升的葡萄糖传感器传入途径的肝/肝门丛神经调节)和内分泌靶标的药物激活(即,利拉鲁肽;GLP激动剂)。在一个实施方案中,组合的神经调节技术包括靶向肠系膜上丛、肠系膜下丛和/或胃底作为神经调节能量的靶标。
组合的神经调节技术的公开的部分可以同时施用或者可以涉及组合的不同部分的时间分开施用。在一个实施方案中,组合的不同部分可在彼此的30分钟内或彼此的60分钟内施用。在一个实施方案中,组合的不同部分可以至少五分钟间隔施用。本文提供双重部位刺激之间的特定时间点,其提供肝脏相对于GI道的时间分开的神经调节,这使得能够实现协同的双重部位效应;所公开的定时被设计成匹配在进食期间将发生的传入信号传导以获得所示的独特结果(即,长期糖尿病缓解)。因此,如本文所提供的,组合的神经调节治疗可与由组合的神经调节的第一能量施加所引起的葡萄糖动力学一致。在一个实施方案中,在前40分钟-60分钟的较高葡萄糖时期内施加或施用第二或随后的治疗。在一个实施方案中,在降低的葡萄糖时期内和在前40分钟-60分钟之后施加或施用第二或随后的治疗。组合的神经调节的不同部分可以是在单次患者就诊时一起施用的治疗的一部分。
应当理解,组合的神经调节技术可以是患者的治疗方案的一部分,包括在不同天、周或月施用的多种组合的神经调节。可基于患者进展或临床状况,在治疗方案的过程中修改或调整如本文所公开的组合的神经调节。调整可以包括调整能量施加参数和/或药物剂量。
组合的神经调节技术的意想不到的效应包括使用上述两种双重调节技术在糖尿病动物模型中的长期缓解。此外,使用比先前展现的更低的超声功率展现了肝部位(即肝门神经丛)的超声激活。这种低功率激活是通过在比先前描述的高功率激活/神经调节更长的持续时间/刺激时间内刺激肝部位来实现的。
所公开的组合的神经调节技术的实施方案包括药物治疗和神经调节技术,以治疗患有代谢病状的患者。在血糖调控的背景下讨论了本公开的某些实施方案。图1是下丘脑代谢控制中心及其在整合关于葡萄糖和营养可用性的激素/内分泌和神经元/传入感觉信息中的作用的示意图。下丘脑内的特定核在维持葡萄糖稳态中发挥作用,并且可以与外周中的效应组织(例如肝脏、肠、肌肉、胰腺)结合工作以基于感觉信息介导全身葡萄糖“设定点”(即,靶标血糖浓度)。此外,该大脑区域在整合来自激素/内分泌和神经/自主输入两者的感觉信息中的重要性得到该区中细胞/神经群体的存在的支持,该细胞/神经群体包含激素和神经递质受体两者,并且经由与循环血液整合(在下丘脑和脑室器官的正中隆起处)以及与传入外周感觉神经的直接和间接连接来监视激素和自主环境两者。
图2是下丘脑中葡萄糖激发和葡萄糖抑制的神经元群体的示意图。基于当前葡萄糖浓度增加或降低发射率(firing rate)的感觉神经元群体是葡萄糖调控系统的组分。下丘脑的弓状核(ARC)(即,位于正中隆起(接近血液)附近的部位)内的细胞群体具有进入/传入感觉神经元神经支配(直接和间接来自其它核),并且具有向主要代谢控制中心(诸如室旁核(PVN))传出的输出。两个主要的细胞群体对这些区域中的代谢具有相反的效应;POMC(促阿片-黑素细胞皮质素原)/CART(可卡因(cocaine)和安非他明(amphetamine)调控的转录物)神经元,其与全身食欲减退结果(和食欲抑制/饱腹感)相关;以及NPY(神经肽Y)/AgRP(刺鼠相关肽)神经元,其与开胃结果(和食欲刺激)相关。如图2中所示,该神经元群体具有葡萄糖处置相对于葡萄糖摄取的急性效应。此外,这些神经元还与抑制性GABA(γ-氨基丁酸)神经元相关,其作为NPY/AgRP侧的抑制性输入。
图3A至图3B显示了从肠-肝脏-大脑轴到下丘脑的自主输入。图3A是肠/肝脏肝门-肠系膜营养传感的示意图。肝门丛含有一组与下丘脑通信的传入神经元。这些神经元与门静脉和肝动脉相关联,并且基于门静脉相对于肝脏的外周血供应之间的血糖梯度而改变发射率(例如,进餐将与来自肠的血液的葡萄糖增加相关,或者门静脉中相对于肝动脉更高的血糖浓度相关)。在该部位处的刺激和这些神经元的激活对糖尿病患者的动物模型具有深远的效应,例如在每日刺激条件下。
然而,如图3B所示,该肝门丛的功能不仅仅依赖于门静脉内“食物”(即葡萄糖)的直接检测。一种相互作用是与肠降血糖素和自主传感系统的相互作用。除了改变肝葡萄糖传感器的发射率之外,食物的摄取和营养在胃肠道内的存在导致肠降血糖素(和其它激素)从内衬胃肠壁的细胞中分泌。这些激素执行多种功能:1)改变胃动力和排空(其可改变门静脉葡萄糖传感器发射的动力学/持续时间),2)调节胃肠道内的肠激素依赖性感觉神经元(这些也受营养受体调节并且已知投射到下丘脑)的发射率/信号传导,以及3)溢出到循环中并且经由血液而不是直接神经元途径通过正中隆起/脑室器官改变下丘脑功能。
图4是包括肝门传感器的超声神经调节和额外的刺激(其可以是在不同靶标处的另一超声神经调节或药物治疗)的组合神经调节技术的示意图。双重部位或双重刺激神经调节即使在停止刺激后也产生糖尿病“缓解”或长期血糖控制,这是本公开的实施方案的意想不到的结果。有多种途径在进食时被激活,其触发代谢系统改变(并且是健康的葡萄糖调控所需要的)。作为非侵入性技术,作为组合的神经调节的一部分的超声神经调节技术可用于刺激或触发多个途径。这可以通过用超声刺激两个或更多个途径(即,如上所示刺激肝门和胃肠部位两者)或通过用超声刺激(即,神经治疗)结合药物(即,激素或受体途径)刺激一个途径来完成。另外,因此,“双重刺激”可被定时或间隔开以便模拟进食状态或进餐期间的“天然”信号传导。
实施例
以下部分提供了本文提供的实施例的方面的实验参数和实验结果。
材料和方法
1.1-MHz单一元件聚焦超声系统
1.1MHz单一元件聚焦超声系统包括信号5发生器(型号33120A,加利福尼亚圣克拉拉市的安捷伦公司(Agilent Technologies Inc.,Santa Clara,CA))、RF功率放大器(型号350L,纽约罗切斯特市億恩埃科技有限公司(Electronics&Innovation Ltd.,Rochester,NY))和1.1MHz聚焦单一元件超声换能器(型号H102,美国华盛顿博塞尔市索尼克概念公司(Sonic Concepts Inc.,Bothell,WA))。使用匹配网络(型号H102,美国华盛顿博塞尔市索尼克概念公司)将换能器连接到功率放大器的输出。换能器元件直径为64mm并且具有63.2mm 10的曲率半径,在中心具有20mm直径的孔,小的成像换能器可以插入到该孔中以用于图像引导。换能器通过填充有脱气水的6-cm高的塑料支座锥体与动物声学地耦合。
波形的标称设置在下面列出:
载波频率-1.1MHz
135mV pk至pk信号发生器幅度
150微秒脉冲长度
5Hz脉冲重复频率
最大负压=0.78MPa
刺激时间=3分钟总持续时间(每个解剖部位)
脉冲平均强度(Isppa)=23W/cm^2
时间平均强度(Ispta)=6,263mW/cm^2
MI=0.6
TI=0.7
系统的声学性能在ISO/IEC 17025:2017认可的实验室(科罗拉多州朗蒙特市阿科他拉声学实验室(Acertara Acoustic Labs,Longmont,CO))进行表征。在上述设置下,表征了三个单独的20个系统,产生1.79平均值(+/-0.10stdev)的机械指数MI、1.87(+/-0.11)Mpa的降低的峰值负压pr.3、125.7(+/-15.0)W/cm2的降低的空间峰值脉冲平均强度Isppa.3和94.3(+/-11.2)mW/cm2的降低的空间峰值时间平均强度Ispta.3。在从100mV pk至pk到200mV pk至pk的幅度范围内观察到MI的良好线性(0.9947R2),因此声输出25可以合理地线性外推至其它幅度、脉冲持续时间和脉冲重复频率。使用场II120,121,模拟的压力分布具有横向1.8mm和深度方向6mm的全宽半最大幅度。在认可的实验室处,测得峰值处的-6dB直径在X扫描轴上为1.45(+/-0.02)mm,在Y扫描轴上为1.46(+/-0.02)mm。
在神经调节开始之前,使用Vivid E9超声系统(通用电气医疗保健(GEHealthcare))或11L探针(通用电气医疗保健)进行超声扫描。探针的成像束与超声刺激束对准。因此,可以使用靶向器官/淋巴结的图像(在Vivid E9上可视化)确认超声束靶向感兴趣区。
以下参数涉及用于低功率(例如,涓流)神经调节实验的替代手持式超声系统。
GE V-扫描手持式超声系统(通用电气医疗保健)。设置#117-腹部/深度探针预设;设定为彩色模式的单元(MI:1.0和Tis:1.2)
该设置的聚焦深度估计为4.1cm。
与上述原型刺激相比,这些设置提供较低的功率刺激:
载波频率-1.8MHz
PRF=68Hz
占空比=0.0048%
Isppa(峰值声强度)=200W/cm
Ispta(平均声强度)=10mW/cm
刺激时间-20分钟持续时间(每个解剖部位)
以下涉及所使用的糖尿病动物模型和超声神经调节的方法。
2型糖尿病的动物模型
Zucker糖尿病肥胖(ZDF)大鼠模型
成年雄性ZDF大鼠(美国纽约州金斯敦查尔斯河(Charles River,Kingston,NYUSA))在8周龄前预定到达。所有动物均以高热量啮齿动物食物(Purina 5008)维持,提供水,随意提供。所有大鼠均在25℃下以12小时光/暗循环圈养并适应环境最少1周,进行处理,然后进行实验以最小化由于应激响应引起的潜在混杂葡萄糖测量。所有规程均根据美国国立卫生研究院(National Institutes of Health(NIH))指南在由通用电气全球研究中心(GE Global Research)的中国医学科学院医学实验动物研究所实验动物使用与管理委员会(Institutional Animal Care and Use Committee))(IACUC)批准的方针下进行。通过每日处理使ZDF动物适应环境以防止循环葡萄糖中应激诱导的变化。8周后,ZDF啮齿动物开始表现出糖尿病表型的快速发展,然后分成用于急性或慢性超声刺激的假手术-CTRL(对照)或pFUS(外周聚焦超声)处理组。
所有大鼠均在1%-4%异氟烷以1L/min O
单一部位刺激条件:
在定位肝/肝门、胃底、肠系膜神经上丛或下丛区的靶标后,使用pFUS原型设备或手持式超声设备递送任一者的指定的超声治疗
然后原型pFUS设备递送3分钟的刺激(1.1MHz,150突发周期,500μs突发时段)。
使用较低功率设置的手持式超声设备递送20分钟的刺激(1.8MHz,68Hz脉冲重复频率,占空比0.0048%)。
对于慢性研究,每日监测大鼠的血糖水平,对于急性和OGTT研究,以5分钟间隔监测。在慢性研究中,每周收集额外的血液样品用于循环标记物的分析。在安乐死时收集最终的终末血液样品并用于评价循环胰岛素水平。
双重部位刺激条件:在单一部位刺激研究后,在单个时期期间组合测试在单一部位刺激研究中识别的先导靶标区(例如肝门区、肠系膜神经上丛)的组合。
对于原型pFUS设备,将刺激(1.1MHz,每脉冲200mV,150突发周期,500μs突发时期)施加到每个区,每个靶标3分钟。例如,最初将pFUS施加于肝门区3分钟。在pFUS刺激肝门部后,立即将探针移至肠系膜神经上区,并施加第二次pFUS施加。每日改变pFUS对肝和肠系膜上区的施加,交替改变刺激的初始部位(例如,第1天:肝pFUS->肠系膜上pFUS,第2天:肠系膜上pFUS->肝pFUS等)。在第一解剖靶标部位和第二解剖靶标部位、或第二解剖靶标部位和第三解剖靶标部位的刺激之间有约5分钟的延迟期。
对于手持式超声设备,将使用手持式设备的上述低功率刺激施加于每个区,每个靶标20分钟。与原型pFUS设备一样,最初将手持式超声设备施加于一个靶标,接着施加于第二个靶标,每日发生靶标交替(例如,第1天:肝pFUS->肠系膜上pFUS,第2天:肠系膜上pFUS->肝pFUS等)。然而,在手持设备的情况下,在靶标刺激之间允许20分钟的休息期,以限制手持设备的一定程度的加热,这可能会混淆结果。
使用自由精简版血糖仪(Freestyle Freedom Lite)(美国加州雅培糖尿病护理公司(Abbott Diabetes Inc.,Alameda,CA,US)),将从尾静脉获得的血液样品用于评估每日葡萄糖(用于慢性研究)和5分钟葡萄糖间隔(用于急性研究)。Freestyle Freedom光度计使用小的血液15体积(0.3uL),并且因此不需要额外的流体来恢复血液取样后的总体积。
在麻醉和放置尾静脉导管20以及收集基线血液样品之前,将大鼠禁食过夜(12小时-16小时)。在收集基线样品后,立即施加单一轮pFUS刺激,使动物从麻醉中恢复。恢复后,通过口服注射器进食给予动物2g/kg葡萄糖溶液的单一口服剂量。葡萄糖施用后,每5分钟通过导管收集从尾静脉收集血液样品。所有规程均按照通用电气全球研究中心的中国医学科学院医学实验动物研究所实验动物使用与管理委员会(IACUC)进行。对于AUC-OGTT(口服葡萄糖耐量测试)的计算,考虑由基线和葡萄糖过载后120分钟的葡萄糖水平确定的曲线下面积(AUC)。
所公开的神经调节技术包括向患者施用药物治疗。药物治疗可以是当与神经调节技术组合时具有期望的治疗或临床效应的任何化合物、药剂、药物、治疗或其它治疗剂量、方案或方针。药物治疗可以包括例如口服、肠胃外、静脉内、局部、吸入或粘膜施用的药物中的一种或多种。
测试药物干预和pFUS疗法的组合以确定双重疗法对治疗窗以及功效持续时间的效应。使用二甲双胍和利拉鲁肽的可获得的人剂量-响应关系以选择最低有效剂量(≤影响的有效剂量(ED20))。该剂量(ED20)代表在服用它的20%群体中产生定量效应(全部效应或无效应)的剂量,代表典型的低剂量选项。
将二甲双胍(33mg-100mg)配制在无菌水中以避免味觉厌恶,并通过口服注射器进食每日给予两次,以12小时的间隔,以说明6.2小时的血浆半衰期。该给药方案(定时)与在人类中使用的给药方案相同,在早晨和傍晚进餐时间之前进行给药。
将利拉鲁肽(20μg-50μg)配制在1.42mg二水合磷酸氢二钠、14mg丙二醇、5.5mg苯酚、和水中用于胃肠外注射,并通过皮下注射每天注射一次。该给药方案说明利拉鲁肽的延长的血浆半衰期为大约15小时,并且在所有情况下均在早晨施用。
图5A显示了在每日肝门丛(单一部位)刺激期间动物模型中的葡萄糖控制;图5B显示了在超声停止后三天图5A的效应持续时间的停止。每日刺激足以预防或逆转ZDF模型中的高血糖症,如图5A所示。然而,当停止超声治疗时,如图5B所示,高血糖症在仅三天内即恢复。还显示在与幼稚/非糖尿病队列的刺激和假手术对照(即,超声探针放置,但没有刺激/超声能量递送)的结果相关的数据中,并且表示在没有治疗的ZDF模型中血糖的预期渐进增加(即,糖尿病进展)。因此,图5A所展现的循环葡萄糖的超声介导的控制在停止超声刺激剂量后回复到不受控制的状态,如图5B中所示,而利用聚焦超声的另一组展现循环葡萄糖降低。
图6显示了在双重部位刺激(即肝门丛和肠系膜上丛,结果显示在数据100中)后的动物模型中的更长期的缓解,以及当另外使用低剂量GLP激动剂利拉鲁肽的双重部位刺激时甚至更长时间的缓解,结果显示在数据102中。结果展现,双重部位刺激(即肝门丛和肠系膜上丛两者的刺激)导致血糖的进一步降低(在每日刺激7天后)。另外,在治疗7天后,对于实验的剩余部分停止超声刺激(在第8天),并且在超声停止(没有任何额外的处理)后平均血糖仍然保持在200mg/dL或以下达36天。这代表在ZDF模型中报道的最长缓解期中的一个缓解期。
此外,当除了用GLP激动剂利拉鲁肽进行低剂量治疗(即靶向与肠系膜上丛刺激位置相关的效应组织的药物;102)之外还进行双重部位刺激时,甚至进一步延长ZDF动物保持低于200mg/dL的时段(再次,在第8天停止超声后;在超声后56天血糖保持低于200mg/dL)。
图7比较了单独药物相对于单一部位刺激与药物治疗组合的组合的神经调节的动物模型中的缓解期。与图6中所示的双重治疗结果相反,图7显示了用单独药物的单一治疗(即低剂量利拉鲁肽;数据显示在200中)或药物治疗加上单一肝门丛刺激治疗(即仅在肝门部位超声7天,然后在第8天之后仅药物,数据显示在202中)不导致相同的长期缓解。即使继续用利拉鲁肽治疗(数据200),血糖在13天内(超声后时期)也上升到200mg/dL以上。单一部位刺激(即单独的肝门丛刺激7天)将保持在200mg/dL以下的时间长度改善至21天,但没有导致长期缓解(即在ZDF模型中可以是大于四周的缓解)。应当理解,在一个实施方案中,所公开的治疗效应可以经由施用两种或更多种药物来实现。
图8A至图8B显示了在晚期ZDF动物中作为双重部位刺激的组合的神经调节的结果对循环葡萄糖的效应。在另一个实验中,在晚期ZDF队列(其中平均血糖已经达到>400mg/dL)中进行双重部位超声刺激治疗(即肝门丛和肠系膜上丛刺激)。先前在ZDF模型中显示长期缓解(即在FGF1注射到脑室内(icv)空间或弓状核下面的心室后4周缓解)的几种治疗在疾病进展已经很严重(即>300mg/dL平均葡萄糖)的ZDF动物中未能起作用。然而,在用超声刺激治疗的11只动物中,如图8A所示,在每日超声刺激5天后(然后在第6天停止超声治疗),它们中的7只有响应,30天的缓解(低于200mg/dL葡萄糖水平)。有趣的是,如图8B所示,该晚期队列中的4只动物在停止超声治疗后约8天显示出升高的血糖水平,并且在第17天、第27天和第34天经历额外的一天“推注”双重部位刺激,但是继续向高血糖症进展(即使每种刺激导致血糖的短暂下降)。该数据表明使用组合的神经调节治疗的长期缓解可能与完整的胰岛素信号相关。
图9显示了在动物模型中用二甲双胍治疗期间的双重部位相对于单一部位刺激。在额外的实验队列中,在施用和不施用低剂量的抗糖尿病药物二甲双胍(即,替代的非GLP途径糖尿病药物)的情况下进行单一部位和双重部位刺激治疗(再次,用超声刺激7天,并且然后在剩余的实验中停止)。双重部位刺激的数据,数据300,再次显示在双重超声刺激(无药物)队列中在超声停止后实现长期缓解(即>4周)。双重部位刺激是肝脏(肝门丛)和胃肠(肠系膜上丛刺激)刺激。然而,向该队列中添加低剂量的二甲双胍没有导致延长的缓解(如图6中使用GLP激动剂所示;数据302)。数据304中显示的单独的二甲双胍队列确实显示低于200mg/dL的暂时下降,但不如单独的利拉鲁肽队列有效(就血糖的绝对减少或低于200mg/dL所花费的时间长度而言);同样,如图6所示,就血糖降低持续时间而言,二甲双胍加单一部位(肝门静脉丛)刺激组(数据306)不如单一部位加利拉鲁肽队列有效。
图10A至图10E显示了来自双重部位、多部位或单一部位超声刺激的数据。在图10A中,监测用上述双重部位治疗(即肝门丛刺激和肠系膜上丛刺激;显示为数据400)、多个单一部位(即单独的肝门丛/肝脏(显示为数据402)或单独的肠系膜上丛/GI(显示为数据404))或三重刺激(即肝门丛/肝脏、肠系膜上丛/GI加胰腺的直接刺激)连续刺激14天的血糖。在以前的报道中,我们已经显示胰腺的直接刺激导致胰岛素分泌增加(对胰高血糖素没有效应)。
肝脏和GI部位的刺激导致ZDF模型队列中的血糖快速降低至低于200mg/dL的值(显示为数据404);添加第三部位(胰腺;显示为数据406)没有导致任何额外的益处或血糖值的降低。两种单一部位刺激治疗(即肝脏或GI刺激;402、404)导致较慢的血糖降低,其在第14天没有达到相同的葡萄糖降低(与双重刺激治疗相比)。没有超声的接受假手术对照/探针放置的ZDF没有展现葡萄糖水平的任何降低。图10B显示了对于单独单一部位刺激的动物模型中的血浆GLP-1浓度。图10C显示了对于单独单一部位刺激的动物模型中的循环胰岛素浓度。图10D显示了对于单独单一部位刺激的动物模型中的GABA浓度。图10E显示了对于单独单一部位刺激的动物模型中的循环胰高血糖素浓度。如图10B至图10E所示,胰腺刺激导致血液中胰岛素水平增加(图10C),而GI刺激导致GLP水平增加(图10B)和GABA水平增加(图10D)。
图11显示了对于组合的神经调节疗法、单一部位刺激和对照的动物模型中的急性口服葡萄糖耐量测试中的循环葡萄糖浓度。在ZDF模型中,与假手术对照(显示在数据502中)相比,单独的肝脏刺激(显示在数据500中;肝门区刺激)导致改善的葡萄糖调控。即,在口服葡萄糖耐量测试期间40分钟后葡萄糖值降低。令人惊讶地,在这些短期/急性OGTT测试期间,没有胃肠道(GI)部位显示出改善,并且每个不同的GI部位显示出对OGTT葡萄糖曲线的不同效应。即,与假手术对照相比,肠系膜神经上丛、肠系膜神经下丛(显示于数据503中)或胃底的单一部位刺激导致在OGTT的前40分钟中血糖水平升高。此外,在整个测试过程中(直至200分钟),两个肠系膜部位具有更高的葡萄糖水平。有趣的是,肠系膜上丛和肝门部位的双重刺激导致OGTT曲线动力学,其显示在前40分钟期间类似于单一GI部位的曲线,但在40分钟-200分钟期间动力学类似于单一肝脏部位。并且,虽然在上图中双重部位刺激的长期益处是明显的和深远的(即,在ZDF模型中的长期缓解),但是GI刺激的进一步益处在急性OGTT测试中不容易明显。另一个令人惊讶的结果是双重部位刺激(显示于数据504中)和胃底刺激(显示于数据506中)之间有类似动力学,表明单一自主刺激部位可以产生与“混合”或双重部位刺激治疗类似的结果。应当理解,在实施方案中,所公开的缓解结果可以用单一部位刺激实现。在一个实施方案中,胃肠组织的单一部位刺激可诱导代谢病状的缓解。在一个实施方案中,单一部位刺激可以持续总时间,该总时间是如本文公开的双重部位刺激的组合时间。
图12显示了在不同起始和停止时间点的对于组合的神经调节疗法和对照的动物模型中的非禁食循环葡萄糖浓度。图5至图11中的数据是使用相对高功率水平(即,6,263mW/cm^2)的原型超声系统产生的;尽管这仍然比与空化和/或组织损害相关的水平低得多。图12显示了使用手持式/电池供电超声系统(即,上述GE Vscan,约10mW/cm^2)在低得多的功率下的超声刺激也能够产生神经调节结果。然而,在该队列(具有较低的功率刺激)中,将每个解剖位置处理/刺激20分钟(即,对于双重部位,每个部位40分钟或20分钟,并且对于三重部位,每个部位60分钟或20分钟)。在所有先前的高功率刺激测试中,每个部位的刺激持续时间仅为3分钟。此外,在该队列中,在第0天开始单一部位刺激,在第11天添加GI部位用于双重刺激治疗,并且在第25天添加胰腺。如上所示,与单独的单一部位刺激相比,额外的多个部位刺激导致葡萄糖的进一步降低。在第32天停止所有超声治疗。对于该队列,起始血液浓度非常高(甚至高于图8),并且在超声治疗停止后缓解持续大约15天。
图13A显示了对于用营养支持的单一部位刺激和对照的动物模型中的急性口服葡萄糖耐量测试中的循环葡萄糖浓度;图13B显示了对于用营养支持的单一部位刺激和对照的动物模型中的急性口服葡萄糖耐量测试中的循环葡萄糖浓度;如图13A中所示,与假手术对照(显示在数据602中)相比,单独的肝脏刺激(显示在数据600中;肝门区刺激)导致改善的葡萄糖调控。即,在口服葡萄糖耐量测试期间40分钟后葡萄糖值降低。而当单独给予时,在这些短期/急性OGTT期间没有胃肠道(GI)部位显示改善,GI刺激与单一口服剂量的ω-3-脂肪溶液的组合在前40分钟期间产生类似于单一GI部位的OGTT曲线动力学,但在40分钟-200分钟期间产生类似于单一肝脏部位的动力学。此外,ω-3-脂肪溶液与单一部位GI刺激的组合产生了与双重部位刺激(肝脏和GI)相同的OGTT曲线(图13B),表明该单一自主刺激部位与营养支持的组合可以产生与“混合”或双重部位刺激治疗类似的结果。
组合的神经调节技术中的神经调节
如本文所提供的一个或多个感兴趣区(例如,单一部位或多个部位)的神经调节允许仅向一个或多个靶向的感兴趣区(例如,向一个或多个刺激部位)局部且非消融性地施加能量,而不在一个或多个感兴趣区外部施加能量。能量施加可以触发靶向的感兴趣区之外的下游效应,例如在含有感兴趣区的相同器官、组织或结构中,或在不含靶向的感兴趣区的其它器官和结构中。在一些实施方案中,例如,可以在下丘脑区域中诱导下游效应。能量施加还可以沿着能量施加部位上游的靶向神经诱导效应。在一些实施方案中,可以实现一个或多个靶向的感兴趣区之外的效应,而未将能量直接施加到感兴趣区之外的诱导下游效应或上游效应的区域。因此,局部能量施加可用于达成或实现全身效应,该全身效应可包括局部效应、下游效应和/或上游效应。一个或多个靶向的感兴趣区可以是身体中具有与非神经元细胞或流体形成突触的轴突末端的任何组织或结构。在一个示例中,感兴趣区可以是器官或结构的子区,诸如脾、肝脏、胰腺或胃肠组织。在另一个示例中,感兴趣区可以在淋巴系统组织中。
对靶向的感兴趣区的神经调节可施加生理过程的变化,以中断、减少或增加受试者中的一个或多个生理途径,从而产生期望的生理结果。此外,因为局部能量施加可以导致全身变化,所以不同的生理途径可以以不同的方式并且在身体中的不同位置处改变,以引起由针对特定受试者的靶向神经调节引起的受试者中的生理变化的总体特征性谱以及针对特定受试者的靶向神经调节的特性。虽然这些变化是复杂的,但是本神经调节技术提供了一种或多种可测量的靶向生理结果,对于所治疗的受试者而言,这些可测量的靶向生理结果是神经调节的结果并且在没有将能量施加到一个或多个靶向的感兴趣区或没有其它干预的情况下可能是不可实现的。此外,其它类型的干预(例如,作为组合的神经调节的一部分的药物治疗)可以加强或增强由神经调节引起的生理变化。
本文讨论的组合的神经调节技术可用于引起感兴趣分子的浓度变化(例如,增加、减少)和/或感兴趣分子的特性变化的生理结果。即,一个或多个感兴趣分子(例如,第一感兴趣分子、第二感兴趣分子等)的选择性调节可以指由于向一种或多种组织(例如,第一组织、第二组织等)中的一个或多个感兴趣区(例如,第一感兴趣区、第二感兴趣区等)施加能量而调节或影响分子的浓度(循环、组织)或特性(共价修饰)。感兴趣分子的调节可包括分子特性的变化,诸如蛋白质的表达、分泌、易位和基于离子通道效应的直接活性变化,该离子通道效应来源于能量施加本身或作为分子直接影响离子通道的结果。感兴趣分子的调节还可以指维持该分子的期望浓度,使得预期的浓度变化或波动作为神经调节的结果而发生。调节感兴趣分子可以指引起分子特性的变化,诸如酶介导的共价修饰(磷酸化、乙酰化、核糖基化等的变化)。即,应当理解,感兴趣分子的选择性调节可以指分子浓度和/或分子特性。感兴趣分子可以是生物分子,诸如碳水化合物(单糖、多糖)、脂质、核酸(DNA、RNA)或蛋白质中的一种或多种。在某些实施方案中,感兴趣分子可以是信号传导分子,诸如激素(胺激素、肽激素或类固醇激素)。
本文所述的某些实施方案提供组合的神经调节技术,该组合的神经调节技术导致用于治疗葡萄糖代谢和相关病状的靶向生理结果。葡萄糖调控是复杂的并且涉及不同的局部和全身代谢途径。将能量施加到靶向的感兴趣区导致这些代谢途径的特征性变化,以改善葡萄糖调控。在一些实施方案中,在一个或多个感兴趣区处的调节可用于治疗病状,包括但不限于糖尿病(即1型或2型糖尿病)、高血糖症、败血症、创伤、感染、生理应激、糖尿病相关的痴呆、肥胖症或其它进食或代谢病状。在一些实施方案中,神经调节可用于促进体重减轻、控制食欲、治疗恶病质或增加食欲。在一个示例中,生理应激可以在医学上被定义为包括多种急性医学状况(感染、严重损伤/创伤、心脏病发作、旁路手术)以及呈现高血糖症的外科手术情况。例如,直接胰腺刺激可导致食欲增加,而直接肝脏刺激可引起NPY降低,这又促进饱腹感的信号。靶向生理结果可以包括将受试者中的循环(即血液)葡萄糖浓度调整到与正常葡萄糖水平相关的期望浓度范围内并且避免高血糖症或低血糖症。以这种方式,可以实现感兴趣分子的选择性调节。该调整可以是经由靶向神经调节诱导血液或组织中的葡萄糖调控激素的变化以引起期望的葡萄糖浓度(即,期望的葡萄糖终点)的结果。此外,葡萄糖调控对于没有疾病诊断但为糖尿病前期或希望维持健康体重的健康患者可能是有益的。
为此,所公开的神经调节技术可以与神经调节系统结合使用。图14是用于神经调节以实现响应于能量的施加的神经递质释放和/或激活突触的组分(例如,突触前细胞、突触后细胞)的系统1000的示意图示。所描绘的系统包括耦合到能量施加设备1012(例如,超声换能器)的脉冲发生器1014。能量施加设备1012被配置为例如经由引线或无线连接接收能量脉冲,该能量脉冲在使用中被引导到受试者的内部组织或器官的感兴趣区,这又导致靶向生理结果。在某些实施方案中,脉冲发生器1014和/或能量施加设备1012可以被植入在生物相容性部位(例如,腹部),并且一个或多个引线在内部耦合能量施加设备1012和脉冲发生器1014。例如,能量施加设备1012可以是MEMS换能器,诸如电容微机械超声换能器。
在某些实施方案中,能量施加设备1012和/或脉冲发生器1014可例如与控制器1016无线地通信,该控制器又可向脉冲发生器1014提供指令。在其它实施方案中,脉冲发生器1014可以是体外设备,例如,可操作以从受试者身体外部的位置经皮地或以非侵入方式施加能量,并且在某些实施方案中,可在控制器1016内集成。在脉冲发生器1014是体外设备的实施方案中,能量施加设备1012可由护理者操作,并且定位在受试者皮肤上或上方的某一点,使得能量脉冲被经皮地递送到期望的内部组织。一旦定位成将能量脉冲施加到期望的部位,系统10就可起始神经调节以实现靶向生理结果或临床效应。
在某些实施方案中,系统10可包括评估设备1020,该评估设备耦合到控制器1016并评估指示是否已实现调节的靶向生理结果的特性。在一个实施方案中,靶向生理结果可以是局部的。例如,调节可导致局部组织或功能变化,诸如组织结构变化、某些分子浓度的局部变化、组织移位、增加的流体移动等。
调节可导致全身或非局部变化,并且靶向生理结果可与循环分子浓度的变化或不包括能量直接施加到的感兴趣区的组织的特性的变化相关。在一个示例中,移位可以是期望调节的代理测量,并且低于预期移位值的移位测量可以导致调节参数的修改,直到诱导预期移位值为止。因此,在一些实施方案中,评估设备1020可以被配置为评估浓度变化。在一些实施方案中,评估设备1020可以是被配置为评估器官大小和/或位置的变化的成像设备。虽然系统10的所描绘的元件是分开显示的,但是应当理解,该元件中的一些或全部可以彼此组合。此外,该元件中的一些或全部元件可以以有线或无线方式彼此通信。
基于该评估,可以改变控制器1016的调节参数。例如,如果期望的调节与在限定的时间窗口(例如,在能量施加规程开始后5分钟、30分钟)内或相对于规程开始时的基线的浓度(一个或多个分子的循环浓度或组织浓度)的变化相关,则诸如脉冲频率或其它参数的调节参数的变化可能是期望的,这又可以由操作者或经由自动反馈回路提供给控制器1016,用于限定或调整脉冲发生器1014的能量施加参数或调节参数。
本文提供的系统1000可根据各种调节参数提供能量脉冲。例如,调节参数可包括范围从连续到间歇的各种刺激时间模式。在间歇刺激的情况下,在信号接通时间期间以特定频率递送能量一段时间。信号接通时间之后是没有能量输送的一段时间,称为信号断开时间。调节参数还可包括刺激施加频率和持续时间。施加频率可以是连续的或在不同的时间段递送,例如在一天或一周内。治疗持续时间可持续不同的时间段,包括但不限于从几分钟到几小时。在某些实施方案中,具有指定刺激模式的治疗持续时间可持续一小时,以例如72小时间隔重复。在某些实施方案中,治疗可以较高的频率(比如每三小时)递送,持续较短的持续时间,例如30分钟。根据调节参数,诸如治疗持续时间和频率,能量的施加可被可调整地控制以实现期望的结果。
图15是系统1000的某些部件的框图。如本文所提供的,用于神经调节的系统1000可以包括脉冲发生器1014,该脉冲发生器适于产生多个能量脉冲以施加到受试者的组织。脉冲发生器1014可以是单独的或者可以被集成到外部设备(诸如控制器1016)中。控制器1016包括用于控制该设备的处理器1030。软件代码或指令存储在控制器1016的存储器1032中,用于由处理器1030执行以控制设备的各种部件。控制器1016和/或脉冲发生器1014可以经由一个或多个引线1033或无线地连接到能量施加设备1012。
控制器1016还包括具有输入/输出电路1034和显示器1036的用户界面,该用户界面适于允许临床医生向调节程序提供选择输入或调节参数。每个调节程序可以包括一组或多组调节参数,包括脉冲幅度、脉冲宽度、脉冲频率等。脉冲发生器1014响应于来自控制器设备1016的控制信号修改其内部参数,以改变通过引线1033传输到能量施加设备1012所施加到的受试者的能量脉冲的刺激特性。可以采用任何合适类型的脉冲发生电路,包括但不限于恒定电流、恒定电压、多个独立的电流源或电压源等。所施加的能量是电流幅度和脉冲宽度持续时间的函数。控制器1016允许通过改变调节参数和/或在某些时间起始能量施加或在某些时间取消/抑制能量施加来可调整地控制能量。在一个实施方案中,能量施加设备的可调整控制基于关于受试者中的一个或多个分子(例如,循环分子)的浓度的信息。如果信息来自评估设备1020,则反馈回路可驱动可调整的控制。例如,如果由评估设备1020测量的循环葡萄糖浓度高于预定阈值或范围,则控制器1016可以起始对感兴趣区(例如,肝脏)的能量施加,并且具有与循环葡萄糖的降低相关的调节参数。能量施加的起始可由漂移高于预定(例如,期望)阈值或在预定义范围之外的葡萄糖浓度触发。在另一个实施方案中,当最初施加的能量在预定时间范围(例如,1小时、2小时、4小时、1天)内没有导致靶向生理结果(例如,感兴趣分子的浓度)的预期变化时,可调整的控制可以是改变调节参数的形式。
在一个实施方案中,存储器1032存储可由操作者选择的不同操作模式。例如,所存储的操作模式可以包括用于执行与特定治疗部位(诸如肝脏、胰腺、胃肠道、脾中的感兴趣区)相关的一组调节参数的指令。不同的部位可以具有不同的相关调节参数。控制器1016可以被配置为基于选择来执行适当的指令,而不是让操作者手动输入模式。在另一个实施方案中,存储器1032存储用于不同类型治疗的操作模式。例如,激活可以与相对于与抑制或阻断组织功能相关的那些刺激压力或频率范围不同的刺激压力或频率范围相关。在特定示例中,当能量施加设备是超声换能器时,时间平均功率(时间平均强度)和峰值正压在1mW/cm
在另一实施方案中,存储器1032存储允许调整或修改调节参数以实现期望结果的校准或设置模式。在一个示例中,刺激以较低能量参数开始并且自动地或在接收到操作者输入时递增地增加。以这种方式,当调节参数被改变时,操作者可以实现对诱导效应的调整。
系统1000还可以包括便于聚焦能量施加设备1012的成像设备。在一个实施方案中,成像设备可以与能量施加设备1012集成或可以是与该能量施加设备相同的设备,使得不同的超声参数(频率、孔径或能量)被施加用于选择(例如,空间地选择)感兴趣区并且用于将能量聚焦到所选感兴趣区以用于靶向和随后的神经调节。在另一实施方案中,存储器1032存储用于在器官或组织结构内空间地选择感兴趣区的一个或多个靶向或聚焦模式。空间选择可以包括选择器官的子区以识别对应于感兴趣区的器官的体积。空间选择可依赖于如本文所提供的图像数据。基于空间选择,能量施加设备1012可以聚焦在对应于感兴趣区的所选体积上。例如,能量施加设备1012可以被配置为首先以靶向模式操作以施加靶向模式能量,该靶向模式能量用于捕获图像数据以用于识别感兴趣区。靶向模式能量不处于适合优先激活的水平和/或不以适合优先激活的调节参数施加。然而,一旦识别出感兴趣区,则控制器1016可以根据与优先激活相关的调节参数以治疗模式操作。
控制器1016还可以被配置为接收与靶向生理结果相关的输入作为对调节参数的选择的输入。例如,当使用成像模态评估组织特性时,控制器1016可以被配置为接收特性的计算的指数或参数。基于指数或参数高于还是低于预定义阈值,可以修改调节参数。在一个实施方案中,参数可以是受影响组织的组织位移的量度或受影响组织的深度的量度。其它参数可以包括评估一个或多个感兴趣分子的浓度(例如,评估相对于阈值或基线/对照的浓度变化、变化速率、确定浓度是否在期望范围内中的一者或多者)。此外,能量施加设备1012(例如,超声换能器)可以在控制器1016的控制下操作以a)采集组织的图像数据,该图像数据可以用于在靶标组织内空间地选择感兴趣区,b)将调节能量施加到感兴趣区,并且c)采集图像以确定靶向生理结果已经发生(例如,经由位移测量)。在这样的实施方案中,成像设备、评估设备1020和能量施加设备1012可以是相同的设备。
在另一实施中,期望的调节参数组也可由控制器1016存储。以这种方式,可以确定受试者特异性参数。此外,可以随时间评估这些参数的有效性。如果一组特定的参数随时间不太有效,则受试者可能对激活的途径不敏感。如果系统10包括评估设备1020,则评估设备1020可以向控制器1016提供反馈。在某些实施方案中,可以从用户或评估设备1020接收指示靶标生理结果的特性的反馈。控制器1016可以被配置为使得能量施加设备根据调节参数施加能量并且基于反馈动态地调整调节参数。例如,基于反馈,处理器1016可以实时地并且响应于来自评估设备1020的反馈自动地改变调节参数(例如,超声束或机械振动的频率、幅度或脉冲宽度)。
在一个示例中,本技术可用于治疗患有代谢病状的受试者。本技术还可用于调控葡萄糖调控紊乱的受试者的血糖水平。因此,本技术可用于促进感兴趣分子的稳态或促进一个或多个感兴趣分子(例如,葡萄糖、胰岛素、胰高血糖素或其组合)的期望循环浓度或浓度范围。在一个实施方案中,本技术可用于控制循环(即血液)葡萄糖水平。在一个实施方案中,以下阈值可用于将血糖水平维持在正常范围内的动态平衡中:
禁食:
小于50mg/dL(2.8mmol/L):胰岛素休克
50mg/dL-70mg/dL(2.8mmol/L-3.9mmol/L):低血糖/低血糖症
70mg/dL-110mg/dL(3.9mmol/L-6.1mmol/L):正常
110mg/dL-125mg/dL(6.1mmol/L-6.9mmol/L):升高/受损(糖尿病前期)
125(7mmol/L):糖尿病
非禁食(进餐后餐后大约2小时):
70mg/dL-140mg/dL:正常
140mg/dL-199mg/dL(8mmol/L-11mmol/L):升高或“边界线”/糖尿病前期
超过200mg/dL:(11mmol/L):糖尿病
例如,该技术可用于将循环葡萄糖浓度维持低于约200mg/dL和/或高于约70mg/dL。该技术可用于将葡萄糖维持在约4mmol/L-8mmol/L或约70mg/dL-150mg/dL之间的范围内。该技术可以用于维持受试者(例如,患者)的正常血糖范围,其中该正常血糖范围可以是基于患者的个体因素(诸如体重、年龄、临床病史)的个体化范围。因此,对一个或多个感兴趣区的能量施加可以基于感兴趣分子的期望的最终浓度来实时调整,并且可以基于来自评估设备1020的输入在反馈回路中调整。例如,如果评估设备1020是循环葡萄糖监测器或血糖监测器,则实时葡萄糖测量结果可用作对控制器16的输入。
能量施加设备1012可以包括超声换能器(例如,非侵入式或手持式超声换能器),其能够将能量施加到作为非限制性示例显示为肝脏的靶标。能量施加设备1012可以包括用于控制超声换能器的控制电路。处理器1030的控制电路可以集成到能量施加设备1012(例如,经由集成控制器1016)或者可以是单独的部件。超声换能器还可以被配置为采集图像数据以辅助空间地选择期望的或靶向的感兴趣区并且基于所采集的图像数据将所施加的能量聚焦在靶标组织或结构的感兴趣区上。
感兴趣区内的期望的靶标可以是包括轴突末端和非神经元细胞的突触的内部组织或器官。突触可以通过将能量直接施加到聚焦在靶标的感兴趣区上的超声换能器的聚焦场内的轴突末端以引起分子释放到突触空间中来刺激。例如,轴突末端与肝脏细胞形成突触,神经递质的释放和/或离子通道活性的变化进而引起下游效应,诸如葡萄糖代谢的活化。在一个实施方案中,肝脏刺激或调节可以指调节肝门处或附近的感兴趣区。
能量可以聚焦或基本上集中在感兴趣区上以及内部组织或器官的仅一部分(例如小于组织总体积的约50%、25%、10%或5%)上。在一个实施方案中,可将能量施加到靶标组织中的两个或更多个感兴趣区,并且两个或更多个感兴趣区的总体积可小于组织总体积的约90%、50%、25%、10%或5%。在一个实施方案中,将能量施加到组织总体积的仅约1%-50%、组织总体积的仅约1%-25%、组织总体积的仅约1%-10%或组织总体积的仅约1%-5%。在某些实施方案中,仅靶标组织的感兴趣区中的轴突末端将直接接收施加的能量并释放神经递质,而感兴趣区外的未受刺激的轴突末端不接收大量能量,并且因此不以相同方式被激活/刺激。在一些实施方案中,直接接收能量的组织部分中的轴突末端将诱导改变的神经递质释放。以这种方式,可以以颗粒方式靶向组织子区用于神经调节,例如,可以选择一个或多个子区。在一些实施方案中,可选择能量施加参数以诱导直接接收能量的组织内的神经或非神经元组分的优先激活,以诱导期望的组合生理效应。在某些实施方案中,能量可聚焦或集中在小于约25mm
如本文所提供的,能量可以基本上仅施加到一个或多个感兴趣区以优先地以靶向方式激活突触以实现靶向生理结果,并且基本上不以一般或非特异性方式跨整个组织施加。
所公开的实施方案的技术效应包括使用所公开的组合的神经调节技术来引起超声刺激治疗的改善。在一个实施方案中,对已经进行药物治疗的糖尿病患者进行的超声刺激可以:1)允许减少他们所服用的当前药物的剂量(以及随后的副作用),2)将患者从多种药物方案转移到单一药物方案(具有潜在的金钱节约),或3)通过使用多部位超声刺激代替药物治疗来消除所有药物治疗。此外,为了防止糖尿病进展,除了饮食和运动指导之外,还可以对糖尿病前期(例如,胰岛素抵抗的受试者)开始多部位超声。这可以通过不频繁(即每月或每季度)的超声给药再次进行,以提供对他们的饮食/锻炼计划的加强。
另外,单一刺激超声治疗可以与单一药物治疗结合进行,使得两种治疗作用于重叠和/或协同的分子和/或神经途径。与如本文所公开的双重部位超声治疗相比,肝脏超声和GLP激动剂的治疗是示例性情况。
该书面描述使用示例作为本公开的部分,并且还使本领域的任何技术人员能够实践所公开的实施方案,包括制造和使用任何设备或系统以及进行任何并入的方法。本专利范围由权利要求书限定,并且可以包括本领域的技术人员想到的其它示例。如果此类其他示例具有与权利要求书的字面语言没有区别的结构元素,或者如果它们包括与权利要求书的字面语言具有微小差别的等效结构元素,则此类其他示例旨在落入权利要求书的范围内。
