抗菌肽AP138在制备抗菌药物中的应用
文献发布时间:2024-04-18 19:52:40
技术领域
本发明涉及生物技术领域,具体地说,涉及抗菌肽AP138在制备抗菌药物中的应用。
背景技术
抗菌肽(AMPs)是多细胞生物为保护宿主免受病原微生物侵害而产生的内源性多肽,由于它们在构成先天性免疫系统中起着至关重要的作用,因此抗菌肽(AMPs)也被定义为宿主防御肽。通常具有阳离子、两亲性、氨基酸序列短等特点,能够对细菌、真菌、病毒,原生动物起到抑制和杀伤作用(Zasloff等,2002);低耐药和多种杀菌靶位点,杀菌机制与现有抗生素不同以及作为免疫调节剂的广泛活性,因此AMPs被认为是未来抗菌药物最有力的候选物之一(Ali Adem Bahar等,2013)。但是天然抗菌肽存在抗菌活性较低、合成困难且成本较高、产量低、不易纯化等缺点。因此如何降低成本和获取较高纯度和产量抗菌肽药物是开发难点和希望所在。所以,通过发酵表达和纯化流程相结合解决产量低和纯度低的问题。
Plectasin是Mygid等人在2005年从北欧松林地表腐生子囊菌中分离得到,对革兰氏阳性菌具有较好的活性。其包括前体肽和成熟肽,前体肽一般不具活性,成熟多肽由40个氨基酸组成,含有6个Cys残基和5个Lys残基,一个区别的四肽(DEDD)模式,分子量为4407.99Da,净电荷在+1到+3之间变化,主要取决于它的两个组氨酸的离子状态。其6个Cys在分子内形3对二硫键(Cys4-Cys30,Cys15-Cys37,Cys19-Cys39),二级结构由3对二硫键稳定的一个N端α-螺旋和C端的两个反向平行的β-折叠结构以及螺旋和折叠结构之间的Loop区组成。Mygind等研究了Plectasin对130余株不同来源肺炎链球菌的抑制作用,发现对于青霉素敏感或抗性菌株,最小杀菌浓度(MIC)均在0.1-8μg/mL之间,MIC
发明内容
本发明的目的是提供抗菌肽AP138在制备抗菌药物中的应用。
为了实现本发明目的,第一方面,本发明提供抗菌肽AP138在制备抗菌药物中的应用,所述抗菌肽AP138包含如下氨基酸序列或由其组成:
i)如SEQ ID NO:1所示的氨基酸序列;或
ii)在i)的N端和/或C端连接标签得到的氨基酸序列;或
iii)i)或ii)的氨基酸序列经取代、缺失和/或增加一个或多个氨基酸得到的具有相同功能的多肽。
本发明中,所述菌为革兰氏阳性菌,包括但不限于金黄色葡萄球菌(Staphylococcus aureus)、表皮葡萄球菌(Staphylococcus epidermidis)、停乳链球菌(Streptococcus dysgalactiae)、无乳链球菌(Streptococcus agalactiae)。
本发明还提供抗菌肽AP138的以下任一应用:
1)用于食品保鲜;
2)用于制备食品添加剂或饲料添加剂;
3)用于化妆品领域;
4)用于制备消毒剂或防腐剂。
第二方面,本发明提供抗菌肽AP138的制备方法,包括以下步骤:
(1)基因表达框的设计:对编码抗菌肽AP138的DNA序列按照毕赤酵母所偏爱的密码子进行优化,在优化后的基因序列(SEQ ID NO:2)的5’端添加XhoI酶切位点和Kex2切割位点,在3’端添加TAA和TAG终止子序列以及XbaI酶切位点,具有如SEQ ID NO:3所示的核苷酸序列。
(2)重组酵母表达载体的构建:将SEQ ID NO:3所示的DNA序列和载体pPICZαA经XhoI和XbaI双酶切后连接,构建重组酵母表达载体。
(3)基因工程菌制备:将重组酵母表达载体线性化后转化毕赤酵母X-33,筛选出高水平表达抗菌肽AP138的重组酵母菌。
(4)抗菌肽AP138的制备:对步骤(3)获取的重组酵母菌进行发酵培养,通过补加50%葡萄糖和甲醇进行诱导,获取发酵液,收集上清,纯化,脱盐后得到抗菌肽AP138。
步骤(4)具体如下:
①种子液的制备:挑取筛选后的高表达酵母转化子单菌落于10mL YPD培养基含100μg/mL zeocin(博来霉素),30℃,250rpm,摇床培养18-24h,以0.5%-1%接种于200mLYPD液体培养基中,30℃,250rpm,摇床培养16-18h,至OD
②发酵培养初始阶段:将200mL种子液以10%的比例全部接种于2L基础盐培养基(45g葡萄糖、50g NH
③补糖生长阶段:观测溶氧值开始缓慢下降后突然上升,转速上调至1000rpm,溶氧升至70%以上,开始补加含12‰PMT1(FeSO
本发明还提供上述毕赤酵母X-33基因工程菌分泌的重组蛋白的纯化方法,其包括对发酵液进行离子交换层析、脱盐、冷冻真空干燥、复溶等步骤。
借由上述技术方案,本发明至少具有下列优点及有益效果:
本发明利用基因工程技术,通过对编码抗菌肽AP138的基因进行密码子优化,使其在毕赤酵母中重组表达。本发明首次实现抗菌肽AP138在毕赤酵母基因工程菌高产表达,发酵液上清蛋白浓度达2.98g/L,发酵液经离子交换柱纯化获得高纯度样品,对革兰氏阳性菌金黄色葡萄球菌ATCC25923、ATCC43300、CVCC546、临床分离株E48,链球菌ATCC13813、ATCC3399、CAU-FRI2、CAU-FRI2,表皮葡萄球菌ATCC35984、ATCC12228具有较好的抗菌活性,MIC在4-16μg/mL(0.9-3.6μM);同时抗菌肽AP138具有低细胞毒性和低溶血性的特点,可应用于抗菌药物、食品保鲜剂、食品添加剂、化妆品、饲料添加剂开发等领域,具有广阔的应用前景。
附图说明
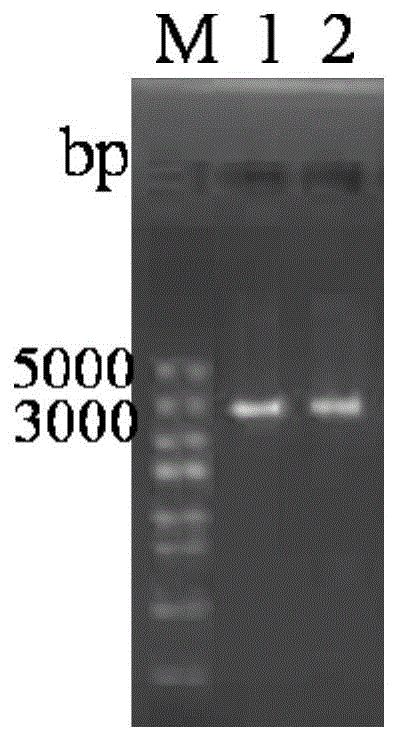
图1为本发明较佳实施例中pPICZαA-AP138重组质粒的琼脂糖凝胶电泳图;其中,M:DNA Marker I;1-2:pPICZαA-AP138。
图2为本发明较佳实施例中重组pPICZαA-AP138载体线性化电泳结果;其中,M:Trans5K DNA Marker;1-2:线性化的重组载体pPICZαA-AP138。
图3为本发明较佳实施例中48孔板AP138重组酵母菌株诱导发酵96后不同诱导时间的发酵上清抑菌活性检测结果。
图4为本发明较佳实施例中AP138重组酵母菌株不同转化子摇瓶水平诱导发酵上清Tricine-SDS-PAGE电泳检测结果;其中,M:超低分子量蛋白Marker;1-4:分别表示诱导AP138-8、AP138-28、AP138-68、AP138-94发酵液上清电泳条带。
图5为本发明较佳实施例中抗菌肽A-8、A-28、A-68、A-94(AP138-8、AP138-28、AP138-68、AP138-94)重组酵母菌株摇瓶水平诱导发酵上清抑菌活性检测结果。
图6为本发明较佳实施例中A-94重组酵母菌株诱导发酵0h、24h、48h、72h、96h、120h后不同诱导时间的发酵上清抑菌活性检测结果。
图7为本发明较佳实施例中A-94重组酵母菌株诱导发酵120h后不同诱导时间的发酵上清Tricine-SDS-PAGE电泳检测结果;其中,M:超低分子量蛋白Marker;1-6:分别表示诱导0h、24h、48h、72h、96h、120h发酵液上清电泳条带。
图8为本发明较佳实施例中A-94重组酵母菌株高密度发酵过程中分别表示诱导0h、24h、48h、72h、96h、120h过程中菌体湿重和总蛋白时间变化曲线。
图9为本发明较佳实施例中抗菌肽AP138纯化后Tricine-SDS-PAGE电泳检测结果;其中,M:超低分子量蛋白Marker;1-6:分别表示穿透峰,45.5%B液洗脱峰,70%B液洗脱峰,100%B液洗脱峰。
图10为本发明较佳实施例中抗菌肽纯化后质谱鉴定结果。
图11为本发明较佳实施例中抗菌肽AP138溶血性实验结果。
图12为本发明较佳实施例中抗菌肽AP138细胞毒性实验结果。
具体实施方式
本发明提供一种新型的抗菌肽AP138,其包含如下的氨基酸序列或由其组成:
i)如SEQ ID NO:1所示的氨基酸序列;或
ii)在i)的N端和/或C端连接标签得到的氨基酸序列;或
iii)i)或ii)的氨基酸序列经取代、缺失和/或增加一个或多个氨基酸得到的具有相同功能的多肽。
本发明还提供抗菌肽AP138的以下任一应用:
A、用于制备抗菌药物;
B、用于制备消毒剂;
C、用于制备防腐剂;
所述菌为革兰氏阳性菌。
所述革兰氏阳性菌包括金黄色葡萄球菌(Staphylococcus aureus)、表皮葡萄球菌(Staphylococcus epidermidis)和停乳链球菌(Streptococcus dysgalactiae)、无乳链球菌(Streptococcus agalactiae)。
本发明还提供一种重组表达载体,所述重组表达载体携带如下基因表达框:诱导型启动子-编码α因子信号肽的DNA序列-Kex2切割位点-SEQ ID NO:2所示的编码抗菌肽AP138的DNA序列-终止密码子。
进一步地,所述编码抗菌肽AP138的DNA序列的5’端连接有XhoI酶切位点,3’端连接有XbaI酶切位点。
本发明还提供含有所述重组表达载体的宿主细胞,优选毕赤酵母细胞X-33。
本发明还提供一种基因工程菌,将所述重组载体线性化导入所述毕赤酵母细胞内,筛选高表达转化子。
本发明还提供所述基因工程菌的培养方法,对原有发酵工艺进行优化,主要体现在温度由29℃提高至30℃,前期发酵阶段由800rpm持续16-18小时,改为先以600rpm持续8小时,再以800rpm持续8-10小时,以及甲醇流加速度进行优化。具体实施包括以下步骤:
1)种子液的制备:从YPD平板挑取酵母转化子单菌落,接种于含100μg/ml zeocin的10mL YPD液体培养基中,30℃,250rpm,摇床培养18-24h,以1%(v/v)接种量接种于200mLYPD液体培养基中,30℃,250rpm,摇床培养16-18h,至OD
2)发酵培养:25℃~29℃下,按10%(v/v)的接种量将上述种子液加入2L基础盐培养基中,调pH值至5.0,加入9.6ml PMT1,通气量维持在8vvm,转速为600rpm,溶氧维持在20%以上;
3)饲喂碳源:观测溶氧值开始缓慢下降后突然上升至80%以上,开始流加含12‰PMT1的50%葡萄糖溶液,流加速度为12~24mL/L/min,连续流加6~8h,转速上调至1000rpm;
4)甲醇诱导:流加葡萄糖后,饥饿半小时,开始补加100%甲醇,由第一小时的流速1mL/L/min逐渐增加到第六小时的6mL/L/min,转速上调至1100rpm,pH上调至5.5,控制溶氧在20%以上,至发酵结束。
其中,步骤2)中使用的基础盐培养基配方为:45g葡萄糖、50g NH
本发明还提供一种在重组毕赤酵母中表达抗菌肽AP138的方法,上述获得的重组毕赤酵母经过发酵培养,分泌产生抗菌肽AP138。
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例均按照常规实验条件,如Sambrook等分子克隆实验手册(Sambrook J&Russell DW,Molecular Cloning:a Laboratory Manual,2001),或按照制造厂商说明书建议的条件。
以下实施例中涉及的培养基和缓冲液配方:
LB培养基:胰蛋白胨10g/L,酵母浸提取物5g/L,NaCl 10g/L;固体LB培养基加入2%的琼脂糖。
低盐LB培养基:胰蛋白胨10g/L,酵母浸提取物5g/L,NaCl 5g/L;固体低盐LB培养基加入2%的琼脂粉。
MHB培养基:酪蛋白水解物17.5g/L,牛肉浸粉5g/L,淀粉1.5g/L。
MHA培养基:固体MHB培养基加入2%的琼脂粉。
YPD培养基:蛋白胨20g/L,酵母浸提取物10g/L,葡萄糖20g/L;固体YPD培养基加入2%琼脂粉。
YPDS培养基:蛋白胨20g/L,酵母浸提取物10g/L,山梨醇182.2g/L,葡萄糖20g/L,琼脂粉20g/L。
BMGY培养基(每L):酵母浸提取物10g,蛋白胨20g,甘油10mL,13.4%无氨基酸酵母氮源(YNB)100mL,0.02%生物素2mL,1mol/L磷酸缓冲液,pH6.0,100mL。
有关LB培养基、低盐LB、MHB、MHA、YPD、YPDS等培养基的使用参照Invitrogen毕赤酵母操作手册。
50mM磷酸盐缓冲液(A液):7.786g Na
1M NaCl 50mM磷酸盐缓冲液(B液):70786g Na
以下实施例中涉及的基因扩增及转化子鉴定方法为PCR法及DNA测序法。
以下实施例中涉及的蛋白检测方法为Tricine-SDS-PAGE,参照(
以下实施例中涉及的蛋白质浓度测定方法为考马斯亮蓝法。
以下实施例中涉及的蛋白分子量的确定方法为MALDI-TOF MS法。
以下实施例中涉及的蛋白纯化的方法为基于离子层析法。
以下实施例中涉及的发酵方法为高密度发酵法。
抗菌肽NZ2114的序列为:GFGCNGPWNEDDLRCHNHCKSIKGYKGGYCAKGG FVCKCY。
抗菌肽MP1102的序列为:GFGCNGPWQEDDVKCHNHCKSIKGYKGGYCAKGG FVCKCY。
抗菌肽MP1106的序列为:GFGCNGPWSEKDMHCHNHCKSIKGYKGGYCAKGG FICKCY。
以下实施例中涉及的菌种和质粒见表1:
表1供试菌种和质粒
/>
实施例1抗菌肽AP138基因序列获取
根据抗菌肽数据库DBAASP(https://www.dbaasp.org/home),筛选获取plectasin衍生肽AP138氨基酸序列GFGANGPWSEDDLRAHRHAKSIKGYRGGYCAKGGFVA KCY(SEQ ID NO:1),对其理化性质进行预测和分析,发现AP138比活性较好的Plectasin衍生肽NZ2114具有更高的正电荷、两亲性、抗菌肽可能性,选取AP138序列,并根据毕赤酵母密码子偏爱性,设计抗菌肽AP138的编码基因,通过密码子优化获取DNA序列:ggttttggttgtaacggtccatggtctgaagatgatttgagatgtcatagacattgtaagtctattaagggttacaga ggtggtta ctgtgctaagggtggttttgtttgtaagtgttactaataa(SEQ ID NO:2)。
为了有效终止rAP138翻译表达,在编码AP138基因序列3’端添加两个终止密码子TAA、TGA。为了能实现rAP138在毕赤酵母中实现天然分泌表达,信号肽切割位点Kex2位点插入rAP138的5’端。为实现重组表达载体pPICZaA-AP138构建,在AP138基因两端设计XhoI、XbaI核酸内切酶位点。表达框基因序列如下:
以上序列由上海生工生物工程股份有限公司完成。其中,斜体为两个终止密码子,下划线处为酶切位点,加粗为kex2基因表达产物切割识别序列,粗体为两个终止密码子。
抗菌肽AP138及其它衍生肽理化性质预测分析如下:
抗菌肽AP138及其它衍生肽二级结构预测及抗菌肽指标分析如下:
/>
实施例2酵母重组表达载体的构建
1、将实施例1获得的AP138基因片段经XhoI和XbaI核酸内切酶双酶切后回收纯化片段。同时,用XhoI和XbaI双酶切pPICZαA载体(购自Invitrogen)。
双酶切体系如下:
以上酶切体系加样完毕后置于37℃水浴锅反应4h,2%琼脂糖凝胶电泳检测,电泳条件:120V,30min。酶切产物用DNA产物回收试剂盒回收。AP138基因和pPICZαA载体经过XbaI和XhoI双酶切消化后,用T4DNA连接酶将AP138基因与线性化的pPICZαA载体进行连接。连接体系如下:
连接条件:以上连接体系加样完毕后于PCR仪16℃过夜连接。
2、将获得的重组载体转化到大肠杆菌DH5α中,转化步骤如下:
1)10μL连接产物于50μL E.coli DH5α感受态细胞,冰浴30min;
2)42℃热激45s,立即冰浴2~3min;
3)加入450μL 37℃预热的LB低盐培养基,37℃100rpm恢复培养1h;
4)重悬菌体后取100μL涂布含有25μg/mL Zeocin的LB低盐固体培养基;
5)37℃倒置培养12-16h。
3、大肠杆菌DH5α阳性转化子鉴定
挑取在低盐LB平板上长出的单菌落接种于10mL LB液体培养基中(含25μg/mlzeocin),37℃,250rpm过夜培养,通过菌落PCR鉴定阳性转化子。挑取经特异引物验证的阳性转化子接种于10mL低盐LB液体培养基中(含25μg/mL zeocin),37℃250rpm过夜培养,取500μL测序验证。
挑取阳性转化子,进行菌液PCR验证转化子正确性,PCR体系、条件如下:
PCR体系:
引物F:5`-GGCAAATGGCATTCTGACAT-3`
引物R:5`-GACTGGTTCCAATTGACAAGC-3`
PCR条件:94℃5min;94℃30s,58℃30s,72℃40s,28个循环;72℃10min。
提取重组表达载体的E.coli质粒,进行1%琼脂糖凝胶电泳鉴定(图1),为线性化电转毕赤酵母(P.pastoris)准备。
实施例3含AP138基因重组酵母的构建
1、重组载体pPICZαA-AP138的线性化
利用内切酶PmeI对组成型重组表达载体pPICZαA-AP138进行酶切,酶切体系和反应条件如下:
/>
以上酶切体系加样完毕后置于37℃水浴锅反应4h,1%琼脂糖凝胶电泳检测,电泳条件:155V,30min。电泳结果显示,pPICZαA-AP138重组载体完全线性化(图2)。
2、线性化质粒浓缩
将线性化质粒放入真空冻干机内,待样品为粉状即可,取出备用。
3、毕赤酵母X-33感受态的制备
1)挑取YPD平板上的X-33单菌落,接种至10mL YPD液体培养基,30℃,250rpm,过夜培养;
2)取毕赤酵母X-33过夜培养液以1%接种量,接种至200mL YPD液体培养基,30℃,250rpm振荡培养至OD
3)分装至50mL无菌离心管内,4℃4000rpm离心5min后,弃去上清,加入50mL无菌ddH
4)之后,4℃4000rpm离心5min后,去上清,加入50mL无菌水重悬;
5)之后,4℃4000rpm离心5min后,去上清,加入2mL 1M预冷山梨醇重悬;
6)最后,4℃4000rpm离心5min后,去上清,加入100μL 1M预冷山梨醇重悬后即为毕赤酵母X-33感受态细胞。
4、电转化
取100μL酵母感受态细胞加入线性化重组质粒冻干粉,轻轻混匀,转至冰预冷的无菌电转杯中,冰上放置5min,电转,参数为1200V,25μF,400Ω。电转后立即加入1ml冰预冷的1M山梨醇溶液,混匀转入2mL离心管中,29-30℃,复苏2h,取100μL和150μL复苏后的菌液涂布在含有100μg/mL zeocin抗生素的YPDS平板上,29-30℃倒置培养,直至长出单菌落。
5、48孔板诱导筛选阳性转化子
在48孔板中每孔加入500μL YPD培养基,挑取步骤4中长出的半个单菌落接种于48孔板中,30℃,250rpm振荡培养24h后;以1%比例接种于含500μL BMGY培养基中,30℃,250rpm振荡培养24h后;每孔加入2.5μL甲醇(甲醇终浓度为0.5%),记为诱导0h,每隔24h加一次甲醇,分别记为0h、24h、48h、72h,诱导72h后,分别收集48孔板中的发酵液于1.5mL离心管中,离心取上清,进行抗菌活性检测。48孔板诱导上清,抑菌圈试验结果见图3。
实施例4摇瓶水平高效表达AP138重组酵母菌株的筛选
1、阳性转化子摇瓶水平诱导表达
挑取实施例3中筛选得到的阳性转化子(记为Pichia pastorisX-33AP138,接种至10mL YPD液体培养基,30℃,250rpm振荡培养16-18h;1%接种量转接至200mL BMGY液体培养基,30℃,250rpm振荡培养24h后,每个摇瓶加1mL甲醇诱导(甲醇终浓度为0.5%),以4层灭菌纱布替换封口膜包裹摇瓶口,记为诱导0h,30℃,250rpm振荡培养,每隔24h补加1mL甲醇,直到诱导96h结束。
2、重组酵母发酵液抗菌活性检测抑菌圈实验分析
挑取S.aureus ATCC43300单菌落接种于10mL MHB培养基中,37℃,250rpm过夜培养,之后以1%接种量转接至新鲜10mL MHB培养基,之后转移至50mL MHB固体培养基中使细菌数为1×10
3、重组酵母分泌蛋白水平Tricine-SDS-PAGE检测
对获得的高活性重组酵母菌株进一步采用Tricine-SDS-PAGE分析重组突变体表达水平,电泳方法参照
本发明成功优化了编码抗菌肽AP138基因,并构建了pPICZαA-AP38重组表达载体,经PmeI线性化后成功转化到毕赤酵母X-33中获得A-8、A-28、A-68、A-94四株表达水平较高的重组酵母菌株,抗菌肽AP138在毕赤酵母X-33中实现了高水平的分泌表达。A-8、A-28、A-68、A-94重组酵母菌株摇瓶水平发酵上清抑菌试验结果见图4,A-8、A-28、A-68、A-94重组酵母菌株120h诱导摇瓶水平发酵上清Tricine-SDS-PAG电泳检测结果见图5。
实施例5重组酵母菌株A-33的高密度发酵
根据挑选阳性转化子,A-94摇瓶水平蛋白表达量最高,因此,选取A-94重组酵母菌株用于后续高密度发酵。从YPD平板挑取转化子单菌落,接种至10ml YPD液体培养基(含100μg/ml zeocin)的50mL摇瓶中,30℃,250rpm振荡培养16-18h,以0.5-1%接种量接种于装液量为200ml YPD种子液培养基的1L摇瓶中,30℃,250rpm振荡培养16-18h,OD
采用5L发酵罐进行高密度发酵,发酵过程分为三个阶段:(1)菌体生长阶段:加入2L基础盐培养基,121℃灭菌20min,冷却至29℃,调节pH到5.0,加入9.6mL PMT1,接入200mL菌液(1:10,v/v),通气量维持在8vvm,转速先600rpm维持6h左右,之后调至800rpm,溶氧维持在20%以上;(2)流加葡萄糖生长阶段:观测溶氧值开始缓慢下降后突然上升,转速上调至1000rpm,使溶氧达70%左右,溶氧达到平衡状态,开始流加50%葡萄糖溶液(12‰PMT1),流加速度为24mL/L/min,连续流加6h;(3)甲醇过渡诱导阶段:发酵条件变化,流加葡萄糖6h后,饥饿半小时,开始补加100%甲醇,由第一小时的流速1mL/L/min逐渐增加到第六小时的6mL/L/min,转速上调至1100rpm,pH上调为5.5,控制溶氧在20%以上,其它发酵条件不变,直至发酵结束。
从过渡诱导开始,每隔24h取样,用于蛋白表达情况分析及抗菌活性分析。图6为重组酵母菌株高密度发酵上清抑菌效果,图7为发酵上清蛋白电泳图,图8为发酵过程菌体湿重和总蛋白时间变化曲线。其表达产量高于其它plectasin衍生肽NZ2114、MP1102、MP1106。各Plectasin衍生肽高密度发酵总蛋白产量见表2:
表2各Plectasin衍生肽高密度发酵总蛋白产量
实施例6抗菌肽AP138的纯化
1、阳离子交换层析纯化
对抗菌肽AP138纯化进行条件进行摸索和优化,首先选用20mM,pH6.7磷酸盐洗脱缓冲液(A液)和0.6M NaCl的20mM,pH7的磷酸盐洗脱缓冲液(B液),后分别调整磷酸盐洗脱缓冲液浓度由20mM至50mM和pH值由6.7至7;之后设置不同的A液和B液进行洗脱杂带和洗脱目的带,具体步骤如下:
将HiPrep SP FF阳离子交换柱(长度16mm,内径10mm,GE Healthcare)利用A液平衡3-5个柱体积后上样。进样完毕后,先用含有50mM,pH7的磷酸盐洗脱缓冲液(A液)进行洗脱杂带,待穿透峰洗脱完后,用含有0.6M NaCl的50mM,pH7的磷酸盐洗脱缓冲液(B液)进行洗脱,收集洗脱峰,根据UV 280nm监测洗脱情况。纯化AP138Tricine-SDS-PAGE胶图见图9,纯化AP138质谱检测结果见图10。
2、切向流过滤除盐
将收集到的洗脱峰样品经0.22μm过滤,备用。先用ddH
3、样品冻干
将收集样品放入真空冻干机,经冷冻-抽真空-冻干将样品冻干,获得抗菌肽AP138冻干粉产品。
实施例7抗菌肽AP138抗菌活性检测
根据实施例6中获得抗菌肽AP138冻干粉,用灭菌生理水配制浓度为128μg/mL的抗菌肽AP138和万古霉素溶液,2倍倍比稀释至终浓度1.25μg/mL,将不同浓度的抗菌肽AP138溶液和万古霉素(Van)溶液分别加到无菌96孔细胞培养板中,10mL/孔,每个样品三个平行,相同量(10μL)无菌生理盐水作为阴性对照,制备MIC板。菌株采用MHB液体培养基培养,37℃振荡培养至OD
表3AP138对革兰氏阳性菌的抗菌活性
实施例8抗菌肽AP138溶血性实验
根据实施例6中获得的抗菌肽AP138冻干粉,将抗菌肽AP38溶解于无菌生理盐水中,配置成浓度为512μg/mL的母液,2倍倍比稀释终浓度为2μg/mL。取6-8周龄SPF级的ICR小鼠,眼球取血,收集至肝素钠抗凝管。采集的血液于4℃,1500rpm,离心10min,用10mM PBS(pH7.3)重复洗涤红细胞3~5次,至上清无色透明制成8%的红细胞悬浮液。将红细胞悬浮液和抗菌肽AP138以1:1(v/v)各取100μL,加入96孔板,37℃孵育1h,收集液体,1500rpm离心5min,吸取上清至ELISA酶标板检测540nm下紫外吸光值。同时生理盐水和0.1%Triton X-100分别为0%和100%溶血对照实验。溶血程度计算公式如下(参考Jung,Park等,2007),结果如图11所示。
溶血度(%)=[(Abs
实施例9抗菌肽AP138的细胞毒性实验
37℃,5%CO
存活率(%)=处理组OD值/对照组OD值×100%
实施例10抗菌肽AP138的稳定性实验
首先进行盐离子稳定测定,将抗菌肽AP138在50mM、100mM、150mM、200mM、300mMNaCl溶液中37℃孵育2h后,进行MIC实验测定,具体步骤同实施例7。
之后进行热稳定性实验,将抗菌肽AP138在20℃、40℃、60℃、80℃、100℃孵育1h后,进行MIC实验测定,具体步骤同实施例7。结果显示抗菌肽AP138在300mM NaCl高盐浓度保持活性(表4),且在80℃保持较好的抗菌活性(表5)。具有较好的耐高盐离子稳定性和较高的耐热稳定性。
表4盐离子稳定性
表5热稳定性
本发明成功优化了编码抗菌肽AP138基因,并构建了pPICZαA-AP138重组表达载体,经PmeI线性化后成功转化到毕赤酵母X-33中获得重组酵母菌株。对纯化后的抗菌肽AP138进行了抗菌活性检测,结果显示,AP138抗革兰氏阳性菌有较好的抗菌活性(0.95-1.91μM),活性优于plectasin,AP138的溶血性实验结果表明,浓度在1-256μg/mL范围内几乎不对红细胞产生溶血。AP138的细胞毒性实验结果表明,AP138在浓度256μg/mL时细胞的存活率较高达66%,毒性较小。抗菌肽AP138具有抗菌活性好,毒性低的特点,在生产实践中的良好的应用前景。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
参考文献:
1.Seo MD,Won HS,Kim JH,et al.Antimicrobial peptides for therapeuticapplications:A review[J].Molecules,2012,17(12):12276-12286.
2.Jenssen,Hamill P,Hancock R E W.Peptide antimicrobial agents[J].Clinical Microbiology Reviews,2006,19(3):491-511.
3.Zasloff,Michael.Antimicrobial peptides of multicellular organisms[J].Nature,2002,415(6870):389-395.[0147].
4.Bahar A,Ren D.Antimicrobial Peptides[J].Pharmaceuticals,2013,6(12):1543-1575.
5.Mygind P H,Fischer R L,Schnorr K M,et al.Plectasin is a peptideantibiotic with therapeutic potential from a saprophytic fungus[J].Nature(London),2005,437(7061):975-980.[0149].
6.Tenland E,Krishnan N,Anna,et al.A novel derivative of the fungalantimicrobial peptide plectasin is active against Mycobacterium tuberculosis[J].Tuberculosis,2018,113:231-238.
7.
8.Tian Z G,Dong T T,Yang Y L,et al.Expression of antimicrobialpeptide LH multimers in Escherichia coli C43(DE3)[J].Applied Microbiology andBiotechnology,2009,83(1):143-149.
9.Jung H J,Park Y,Sung W S,et al.Fungicidal effect of pleurocidin bymembrane-active mechanism and design of enantiomeric analogue for proteolyticresistance[J].Biochimica et Biophysica Acta,2007,1768(6):0-1405.
10.Wu LZ,Huang ML,Qi CL,Shen LJ,Zou Y,Yang R,Sheng JF,ChenSM.Overexpression of Notch2 enhances radiosensitivity via inhibition of theAKT/mTOR signaling pathway in nasopharyngeal carcinoma.Bioengineered.2021Dec;12(1):3398-3409.
11.Zhang,Y.,Teng,D.,Mao,R.et al.High expression of a plectasin-derived peptide NZ2114 in Pichia pastoris and its pharmacodynamics,postantibiotic and synergy against Staphylococcus aureus.Appl MicrobiolBiotechnol 98,681–694(2014).https://doi.org/10.1007/s00253-013-4881-2.
12 J.Jiao,R.Mao,X.Wang,Y.Zhang,D.Teng,X.Feng,J.Wang,GAP-initiatedconstitutive expression of a novel plectasin-derived peptide MP1106by Pichiapastoris and its activity against Streptococcus suis,Process Biochem.50(2015)253–261.
