一种筛选获得区分脑积水和蛛网膜囊肿分子标记物的系统
文献发布时间:2024-04-18 19:52:40
技术领域
本发明属于生物信息学技术领域,尤其涉及一种筛选获得区分脑积水和蛛网膜囊肿分子标记物的系统。
背景技术
脑积水是脑脊液中一种常见且复杂的神经系统疾病,会导致脑室的异常扩张。脑积水的发病机制复杂,越来越多的证据表明,大约40%的脑积水的发病机制中伴随着遗传分子的改变,并且相关研究表明有100多个基因在综合性脑积水病例中发生了突变。但是环境和获得性因素也是脑积水发病机制中的重要危险因素。尽管在过去的几十年中科研工作者对脑积水有了更加深入的了解,但是仍有很多局限性。目前研究已证实脑积水和蛛网膜囊肿可通过神经内窥镜和手术干预等方法进行治疗。但是对于脑积水的治疗和临床定义还处于单一的脑积水患者亚群中,这种现象限制了人们对脑积水患者的了解,降低了治疗效率。因此深入了解脑积水的遗传分子特点和危险因素对于研究脑积水的发病机制和提高脑积水的治疗策略是至关重要的。
识别脑积水的遗传分析的改变,对于实现精准的病因学诊断和找到有效治疗脑积水的最佳治疗策略有重要意义。差异表达分析已被广泛应用于多种癌症的比较分析中,包括鉴定癌症样本和正常样本之间的差异表达基因,识别这些差异表达基因能够作为对样本进行分型的特征基因。功能富集分析能够描述重要基因的功能影响,促进了进一步从功能方面了解这些基因的特点。然而,目前对于脑积水和蛛网膜囊肿,其差异表达基因和功能通路方面尚未得到系统的描述。此外,目前的研究大多基于对脑积水具体病例的评估。虽然有部分研究已经指出了获得性脑积水的发病机制和治疗靶点,为脑积水疾病的治疗提供了最新的见解,但是仅识别少数潜在的靶点。而且,脑积水是一个常见的疾病,该疾病具有个体异质性且发病机制复杂,极易与蛛网膜囊肿疾病混淆。目前针对脑积水的治疗还局限在神经内窥镜和手术干预治疗等治疗策略上,并没有基于网络分析系统地识别脑积水和蛛网膜囊肿的分子标记和潜在治疗靶点的方法。
发明内容
有鉴于此,本发明的目的在于提供一种基于蛋白质组学和网络分析筛选获得区分脑积水和蛛网膜囊肿分子标记物的系统,以及提供一种筛选脑积水或蛛网膜囊肿潜在治疗靶点和潜在治疗药物的系统。
为了实现上述发明目的,本发明提供了以下技术方案:
本发明提供了一种筛选获得区分脑积水和蛛网膜囊肿分子标记物的系统,所述系统包括:
数据获取模块1,用于获得脑积水和蛛网膜囊肿的蛋白质组学数据;
差异表达蛋白处理模块,采用t检验方法筛选数据获取模块1中脑积水和蛛网膜囊肿中p<0.05的差异表达蛋白,按照下式计算每个蛋白的差异倍数FC:
其中
结果输出模块1,设置FC>1.5且p<0.05的蛋白为上调蛋白,输出为脑积水的分子标记物;FC<1/1.5且p<0.05的蛋白为下调蛋白,输出为蛛网膜囊肿的分子标记物。
本发明还提供了一种筛选脑积水潜在治疗靶点和潜在治疗药物的系统,在上述系统的基础上,还包括:
数据获取模块2,用于获得脑积水药物-药靶相互作用数据;
蛋白比对模块1,将脑积水药物-药靶相互作用数据与上述上调蛋白进行比对,得到重叠蛋白;
结果输出模块2,输出所述重叠蛋白作为脑积水潜在治疗靶点,根据脑积水药物-药靶相互作用数据确定靶向重叠蛋白的药物,输出为脑积水潜在治疗药物。
本发明还提供了一种筛选蛛网膜囊肿潜在治疗靶点和潜在治疗药物的系统,在上述系统的基础上,还包括:
数据获取模块3,用于获得蛛网膜囊肿药物-药靶相互作用数据;
蛋白比对模块2,将蛛网膜囊肿药物-药靶相互作用数据与上述下调蛋白进行比对,得到重叠蛋白;
结果输出模块3;输出所述重叠蛋白作为蛛网膜囊肿潜在治疗靶点,根据蛛网膜囊肿药物-药靶相互作用数据确定靶向重叠蛋白的药物,输出为蛛网膜囊肿潜在治疗药物。
本发明还提供了一种区分脑积水和蛛网膜囊肿的分子标记物的筛选方法,包括如下步骤:获得脑积水患者和蛛网膜囊肿患者的蛋白质组学数据;利用差异表达分析获得脑积水患者和蛛网膜囊肿患者的差异表达蛋白,所述差异表达分析为采用t检验两种疾病之间每个蛋白的差异显著性p值,采用权利要求1的公式计算差异倍数FC,设置FC>1.5且p<0.05的蛋白为上调蛋白,FC<1/1.5且p<0.05的蛋白为下调蛋白;上调蛋白判定为脑积水的分子标记物,下调蛋白判定为蛛网膜囊肿的分子标记物。
优选的,基于质谱分析方法获得脑积水患者和蛛网膜囊肿患者的蛋白质组学数据。
优选的,在差异表达分析前,删除所有样品中表达NA值的蛋白,然后使用R语言impute包中的impute.knn()函数来补充NA值。
本发明还提供了一种筛选脑积水潜在治疗靶点和潜在治疗药物的方法,包括如下步骤:将已批准药物的药物-药靶相互作用数据与上述上调蛋白进行比对,重叠蛋白为脑积水潜在治疗靶点;根据药物-药靶相互作用数据确定靶向重叠蛋白的药物,为脑积水潜在治疗药物。
本发明还提供了一种筛选蛛网膜囊肿潜在治疗靶点和潜在治疗药物的方法,包括如下步骤:将已批准药物的药物-药靶相互作用数据与上述下调蛋白进行比对,重叠蛋白为蛛网膜囊肿潜在治疗靶点;根据药物-药靶相互作用数据确定靶向重叠蛋白的药物,为蛛网膜囊肿潜在治疗药物。
优选的,从DrugBank数据库下载已批准药物的药物-药靶相互作用数据。
本发明的有益效果:
本发明首次提供了一种基于蛋白质组学和网络分析的方法来筛选获得区分脑积水和蛛网膜囊肿分子标记物,以及筛选获得脑积水或蛛网膜囊肿潜在治疗靶点和潜在治疗药物,进一步促进了医疗工作者对多样化脑积水患者的了解,对于提高临床脑积水和蛛网膜囊肿治疗有重要意义。
本发明系统基于差异表达分析识别鉴定了脑积水的149个上调蛋白和82个下调蛋白,这些蛋白能够用于对患者进行分层。另外,本发明系统基于网络分析方法确定的74种药物和49种药物靶点能够改善脑积水目前已有的治疗策略。
附图说明
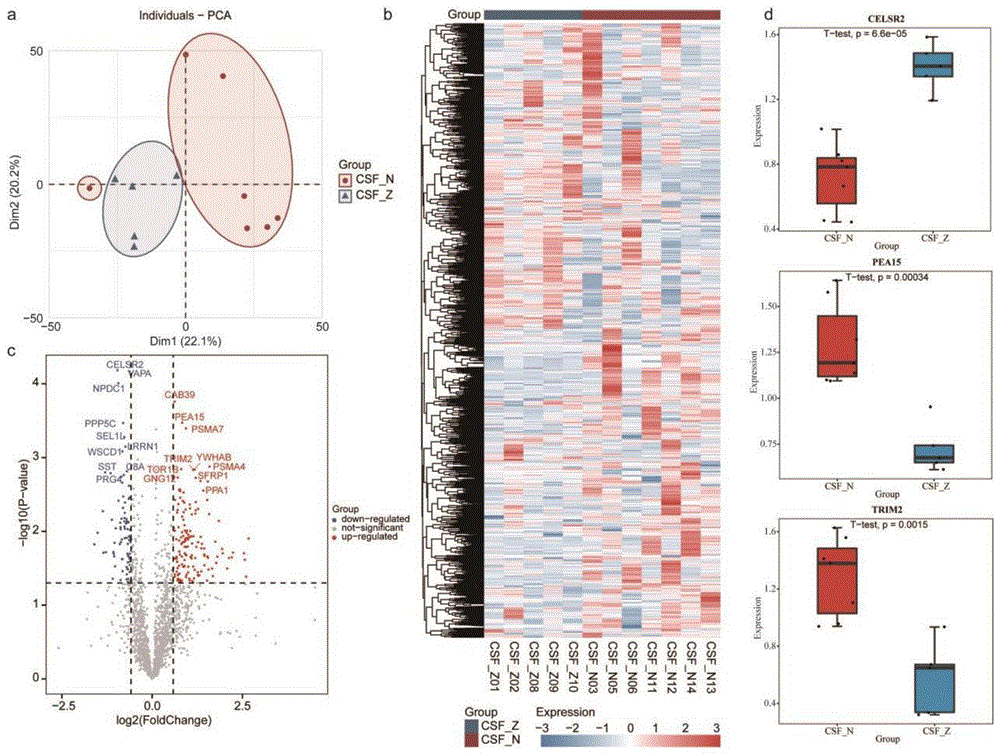
图1为脑积水和蛛网膜囊肿的差异表达分析,其中a为脑积水和蛛网膜囊肿患者的蛋白质组学数据的主成分分析(PCA)图,b为脑积水和蛛网膜囊肿患者的蛋白质表达热图,c为差异表达蛋白(DEPs)火山图,红色为上调蛋白,蓝色为下调蛋白,灰色为不显著差异表达的蛋白,d为表示显著差异表达的DEPs表达的箱线图;
图2为差异表达蛋白功能富集分析,其中a为上调蛋白和下调蛋白GO富集分析,b为上调蛋白GSEA富集分析,每条线代表一条功能,c为下调蛋白GSEA富集分析,每条线代表一条功能;
图3为癌症相关的Hallmark通路和免疫相关通路的富集分析,a为热图显示上调蛋白富集于癌症相关的Hallmark通路和免疫相关通路中的ssGSEA得分平均值,b为热图显示下调蛋白富集于癌症相关的Hallmark通路和免疫相关通路中的ssGSEA得分平均值,c为Circos图展示了富集于癌症相关的Hallmark通路和免疫相关通路中的差异表达蛋白;
图4为潜在治疗靶点预测模式图;
图5为潜在治疗靶点和药物,其中a为药物与潜在药物靶点的网络可视化,b为不同药物类型的潜在药物数量,c为药物潜在靶向的药物靶点数量。
具体实施方式
本发明提供了一种筛选获得区分脑积水和蛛网膜囊肿分子标记物的系统,所述系统包括:
数据获取模块1,用于获得脑积水和蛛网膜囊肿的蛋白质组学数据;
差异表达蛋白处理模块,采用t检验方法筛选数据获取模块1中脑积水和蛛网膜囊肿中p<0.05的差异表达蛋白,按照下式计算每个蛋白的差异倍数FC:
其中
结果输出模块1,设置FC>1.5且p<0.05的蛋白为上调蛋白,输出为脑积水的分子标记物;FC<1/1.5且p<0.05的蛋白为下调蛋白,输出为蛛网膜囊肿的分子标记物。
在本发明中,所述数据获取模块1优选的通过质谱分析方法获得脑积水和蛛网膜囊肿患者的蛋白质表达数据,然后采用差异表达分析方法对脑积水和蛛网膜囊肿患者的蛋白进行比较,获得了识别脑积水和蛛网膜囊两种疾病之间的差异表达蛋白(上调/下调蛋白)。更优选的,本发明通过富集分析系统预测差异表达蛋白影响的功能通路,并比较两种疾病癌症相关Hallmark通路和免疫相关通路的差异。
本发明还提供了一种筛选脑积水潜在治疗靶点和潜在治疗药物的系统,在上述系统的基础上,还包括:
数据获取模块2,用于获得脑积水药物-药靶相互作用数据;
蛋白比对模块1,将脑积水药物-药靶相互作用数据与上述上调蛋白进行比对,得到重叠蛋白;
结果输出模块2,输出所述重叠蛋白作为脑积水潜在治疗靶点,根据脑积水药物-药靶相互作用数据确定靶向重叠蛋白的药物,输出为脑积水潜在治疗药物。
本发明还提供了一种筛选蛛网膜囊肿潜在治疗靶点和潜在治疗药物的系统,在上述系统的基础上,还包括:
数据获取模块3,用于获得蛛网膜囊肿药物-药靶相互作用数据;
蛋白比对模块2,将蛛网膜囊肿药物-药靶相互作用数据与上述下调蛋白进行比对,得到重叠蛋白;
结果输出模块3;输出所述重叠蛋白作为蛛网膜囊肿潜在治疗靶点,根据蛛网膜囊肿药物-药靶相互作用数据确定靶向重叠蛋白的药物,输出为蛛网膜囊肿潜在治疗药物。
本发明通过药物-靶点相互作用网络分析,确定了脑积水和蛛网膜囊肿的潜在治疗药物和靶点。
本发明还提供了一种区分脑积水和蛛网膜囊肿的分子标记物的筛选方法,包括如下步骤:获得脑积水患者和蛛网膜囊肿患者的蛋白质组学数据;利用差异表达分析获得脑积水患者和蛛网膜囊肿患者的差异表达蛋白,所述差异表达分析为采用t检验两种疾病之间每个蛋白的差异显著性p值;采用权利要求1的公式计算差异倍数FC,设置FC>1.5且p<0.05的蛋白为上调蛋白,FC<1/1.5且p<0.05的蛋白为下调蛋白;上调蛋白判定为脑积水的分子标记物,下调蛋白判定为蛛网膜囊肿的分子标记物。
在本发明中,优选的采用质谱分析方法获得脑积水患者和蛛网膜囊肿患者的蛋白质组学数据。在差异表达分析前,优选的需删除所有样品中表达NA值的蛋白,然后使用R语言impute包中的impute.knn()函数来补充NA值,其中NA值代表缺失值。
本发明还提供了一种筛选脑积水潜在治疗靶点和潜在治疗药物的方法,包括如下步骤:将已批准药物的药物-药靶相互作用数据与上述上调蛋白进行比对,重叠蛋白为脑积水潜在治疗靶点;根据药物-药靶相互作用数据确定靶向重叠蛋白的药物,为脑积水潜在治疗药物。
本发明还提供了一种筛选蛛网膜囊肿潜在治疗靶点和潜在治疗药物的方法,包括如下步骤:将已批准药物的药物-药靶相互作用数据与上述下调蛋白进行比对,重叠蛋白为蛛网膜囊肿潜在治疗靶点;根据药物-药靶相互作用数据确定靶向重叠蛋白的药物,为蛛网膜囊肿潜在治疗药物。
在本发明中,优选的从DrugBank数据库下载已批准药物的药物-药靶相互作用数据。
下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
下述实施例中,如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1
1)脑积水和蛛网膜囊肿的蛋白质组学数据的获取
脑脊液(CSF)样品在-80℃取出,加入1%蛋白酶抑制剂、1%磷酸酶抑制剂、50μMPR-619、3μM TSA和50mM NAM(3μM TSA和50mM NAM为乙酰化,1%磷酸酶抑制剂为磷酸化,50μM PR-619为泛素化)。利用BCA试剂盒进行蛋白浓度测定。酶解时,以胰酶与蛋白质质量比1:50的比例加入胰蛋白酶,第一次酶解过夜,用5mM二硫苏糖醇在37℃下还原60分钟,用11mM碘乙酰胺在室温黑暗条件下烷基化45分钟,然后胰酶与蛋白质质量比1:100的比例进行第二次酶解4小时。最后用Strata X固相萃取柱对肽进行脱盐。
将胰蛋白酶多肽溶解于溶剂A(0.1%甲酸,2%乙腈/水)中,直接装入自制的反相分析柱上(长度25cm,id 100μm)。多肽在68分钟内用4%到20%的溶剂B(0.1%甲酸在90%乙腈中)梯度分离,在14分钟内20%到32%,在4分钟内攀升到80%,然后在最后4分钟保持在80%,所有这些都在500nL/min的恒定流速下使用易-nlc 1200UPLC系统(赛默飞世尔科学公司)。分离的肽在Exploris
采用上述质谱分析方法获得了7例脑积水患者和5例蛛网膜囊肿患者的蛋白质组学数据。
2)脑积水的分子标记的识别:
为了鉴定脑积水和蛛网膜囊肿之间的差异表达蛋白,使用t检验来分析脑积水和蛛网膜囊肿之间的差异。在差异表达分析前,删除所有样品中表达NA值的蛋白,然后使用R语言impute包中的impute.knn()函数来补充NA值。根据处理后的表达谱进行后续分析。基于脑积水/蛛网膜囊肿,计算差异倍数(FC)。首先计算脑积水和蛛网膜囊肿患者每个蛋白质的平均表达值,然后使用每个蛋白脑积水的平均表达值除以蛛网膜囊肿的平均表达值得到差异倍数。具体计算方法如下:
其中FC是指差异倍数,CSF_N表示脑积水患者,CSF_Z表示蛛网膜囊肿患者。
使用t检验两种疾病之间每个基因的差异显著性p值,并使用FDR方法进行校正。设置FC>1.5且p<0.05的蛋白为上调蛋白,FC<1/1.5且p<0.05的蛋白为下调蛋白,其中上调蛋白是指在脑积水中上调而在蛛网膜囊肿中下调的蛋白,下调蛋白是指在脑积水中下调而在蛛网膜囊肿中上调的蛋白。结果如图1和表1所示。
表1脑积水和蛛网膜囊肿患者的差异表达蛋白
/>
/>
/>
/>
/>
/>
/>
/>
/>
可以看出,通过差异表达分析,一共得到了脑积水和蛛网膜囊肿的149上调蛋白和82个下调蛋白。可以依据蛋白质的表达情况,鉴定患者是脑积水还是蛛网膜囊肿患者,从而有针对性地进行治疗。
3)所识别的分子标记的功能鉴定
将差异分析中得到的上调和下调的蛋白进行GO富集分析。在分析的过程中,仅考虑基因数量最小15,最大500的GO功能,设置p<0.01且p.adjust<0.05为显著富集的GO功能。发现上调蛋白主要富集在一些免疫和细胞周期相关的生物过程。
差异分析后,根据差异分析得到的p值和FC值,将所有蛋白按照得分S进行排秩:
S(i)=-log10(p-value)*sign(log(FC))
其中p-value是差异表达分析中得到的p值。
根据得分S对所有蛋白进行排秩。然后使用R语言clusterProfiler包中的gseGO()函数对上调/下调蛋白进行了GO功能的GSEA富集分析,结果如图2所示。
为了分析脑积水与蛛网膜囊肿的差异表达蛋白在癌症相关的Hallmark通路和免疫相关通路中的差异,使用单样本基因集富集分析(ssGSEA)计算每个样本中癌症相关的Hallmark通路和免疫相关通路的ssGSEA富集得分。该富集得分是基于R语言中的“clusterProfiler”包实现的,计算过程中使用该包中的gsva()函数进行分析,并设置参数method=“ssgsea”。然后分别计算7个脑积水患者和5个蛛网膜囊肿患者的ssGSEA得分的平均值,将平均值作为比较脑积水和蛛网膜囊肿在癌症相关的Hallmark通路和免疫相关通路中是否存在差异。然后,使用超几何检验对上调和下调蛋白的癌症相关的Hallmark通路和免疫相关通路进行富集分析,考虑p<0.05的通路为显著富集的通路。具体计算方式如下:
其中,N表示人类总基因数目,K表示某通路的基因数目,M表示上调或下调的蛋白数量,r代表上调或下调的蛋白与通路基因重叠的数目。对于计算得到的p值,使用FDR方法校正,结果如图3所示,识别出了富集的信号通路。
实施例2
潜在治疗靶点的识别:
为了识别脑积水潜在的治疗药物和药靶,从DrugBank数据库下载了已批准脑积水药物的药物-药靶相互作用数据,包含2227种药物和2868个靶点。然后基于实施例1所得的上调蛋白与药物靶点的重叠预测潜在的治疗靶点,模式图如图4所示。
根据药物靶向的人类蛋白质,确定了靶向显著差异表达蛋白的药物,并建议这些药物可以作为脑积水的潜在治疗药物,这些差异表达蛋白可以作为脑积水潜在的治疗靶点,结果如图5所示。
基于药物-药靶互作数据,本发明确定了用于脑积水的74种潜在药物和49种药物靶点,可以改善脑积水的临床治疗策略。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
