一种体外培养筛选代谢乙醇菌株的方法
文献发布时间:2024-04-18 19:58:30
技术领域
本发明涉及一种体外培养筛选代谢乙醇菌株的方法。属于微生物分离培养检测技术领域。
背景技术
人体微生物组是指定植于人体内所有微生物群落及其基因组,其基因组总量甚至比宿主本身基因组还要大,因此被称为人体第二大基因组。肠道菌群是人类微生物组的重要组成部分,主要集中在结肠中,由多种不同菌群组成。肠道微生物在人体营养代谢中发挥了关键作用,共生细菌可在人体肠道中处理营养物质和代谢物质,产生多种代谢产物。
当前,酒精饮用过度和酗酒在全球范围内引起了严重的人体健康危机,过度饮酒导致的肝病现已成为死亡率增加的重要原因之一。饮酒引起的生理反应以及肠道微生物群体的变化已经引起了研究人员的关注,乙醇的摄入将破坏肠道微生物群落组成。在正常情况下,人体肠道微生物可以代谢乙醇产生乙醛,同时肠道微生物也可能产生内源性乙醇,促进相关疾病恶化。乙醇及其代谢产物不仅对人体有直接损伤,它还通过影响肠道菌群的生态系统进一步影响人类健康水平。
目前,已有通过补充益生菌和粪菌移植等方式改善人体肠道菌群状况进而缓解乙醇摄入带来的健康损伤。然而,粪菌移植手段存在对人体的安全性和实际作用效率不明等问题,同时补充益生菌制剂作为解酒手段的实际作用存疑。因此采用更加专业的培养方案,从人体肠道微生物样本汇总分离鉴定更多具有一定乙醇代谢能力的细菌是一个良好的策略,可以从微生物多样性丰富的肠道微生物群落中获得具有乙醇代谢能力的菌株,并为之后细菌缓解乙醇健康损害提供更多的参考。
发明内容
本发明的目的是为克服上述现有技术的不足,提供一种体外培养筛选代谢乙醇菌株的方法。
为实现上述目的,本发明采用下述技术方案:
一种体外培养筛选代谢乙醇菌株的方法,具体步骤如下:
(1)收集人体粪便样本作为实验材料,利用乙醇单一碳源的培养基一共进行八代传代培养,在每次传代前收集培养样本,对原始粪便样本和培养样本进行测序,分析确定优势菌门、菌属,以及乙醇代谢相关基因丰度变化以及与优势菌群之间的关系;
(2)将步骤(1)第八次传代培养结束后所得培养样本进行单菌分离培养实验,获得乙醇代谢优势菌株,测序并筛选16S rRNA基因,比对得到分离菌株16S rRNA基因最相近种属,构建系统发育树。
作为优选的技术方案之一,所述方法还包括步骤(3),具体方法如下:将步骤(2)所得菌株进行扩大培养,得到菌悬液;将菌悬液混入含乙醇的培养基,在0h以及24h时取菌液与三氯乙酸溶液混合后离心取上清,将该上清与重铬酸钾-浓硫酸工作液混合,避光反应,检测吸光度值,代入乙醇浓度随吸光度值变化的标准曲线计算菌液中乙醇浓度。
作为进一步优选的技术方案之一,所述标准曲线是通过以下方法获得的:0.25mol/L重铬酸钾与浓硫酸以4:1的体积比混合制备工作液,配制梯度浓度乙醇溶液;吸取200μL工作液与50μL待测液在96孔板中混合,避光反应15min,OD
作为优选的技术方案之一,步骤(1)中,所述培养基为含乙醇的NMS1液体培养基,是通过以下方法配制得到的:分别量取50mLNMS溶液,100μL Trace element溶液,2.5mL20×PBS以及200μL无水乙醇混匀,量取50mL混合液灌入已高温灭菌后的250mL锥形瓶中备用。
作为进一步优选的技术方案之一,所述NMS母液是通过以下方法配制得到的:称取0.2g七水硫酸镁,0.105g无水氯化钙以及1g硝酸钾溶解于1L双蒸水中,121℃,20分钟高温高压蒸汽灭菌,常温(25℃)储存备用;所述Trace element溶液是通过以下方法配制得到的:称取1g乙二胺四乙酸二钠、2g七水硫酸亚铁、0.8g七水硫酸锌、0.03g四水氯化锰、0.03g硼酸、0.2g六水氯化钴、0.6g二水合氯化铜、0.6g六水合氯化镍和0.05g钼酸钠二水溶解于1L双蒸水中,121℃,20分钟高温高压蒸汽灭菌,储存于4℃冰箱备用。所述20×PBS是通过一下方法配制得到:称取5.44g磷酸二氢钾和10.73g磷酸氢二钠溶解于1L ddH
作为优选的技术方案之一,步骤(1)中,传代培养的具体方法为:将人体粪便样本利用20×PBS缓冲溶液分散溶解,得到粪便溶液,将粪便溶液加入培养基中,在37℃和200rpm条件下进行传代培养,培养时间为24小时;其中,人体粪便样本与20×PBS缓冲溶液的比例为1g:2mL,粪便溶液与培养基的体积比为1:49。
作为优选的技术方案之一,步骤(1)中,所述优势菌门为变形菌门,优势菌属包含克雷伯氏菌属(Klebsiella sp.)、肠杆菌属(Enterobacter sp.)、不动杆菌属(Actinetobacter sp.)。
作为优选的技术方案之一,步骤(2)中,第三代传代培养所使用的培养基为NBS1固体培养基,是通过以下方法配制得到的:50mL未灭菌的NMS溶液加0.75g琼脂粉,121℃20分钟高温高压蒸汽灭菌,待温度降至40℃,依次加入100μLTrace element溶液,2.5mL20×PBS以及200μL无水乙醇溶液混匀,在无菌操作台中分装倾倒于无菌平板中,冷却凝固备用,4℃保存。
作为优选的技术方案之一,步骤(2)中,单菌株分离培养的条件为:37℃培养12小时。
作为进一步优选的技术方案之一,挑取稳定生长的细菌单菌落接种于5mL LB液体培养基中,扩大培养,重复离心收集菌体,存储于-80℃;接着采用三区划线法进行平板涂布,培养出单菌落;挑取平板上细菌单菌落接种于LB液体培养基中过夜扩大培养;多次离心收集菌体,使用20×PBS缓冲溶液吹打重悬菌体制作菌悬液;菌悬液按照1:1000的体积比混入新配制的含乙醇的NMS1液体培养基中培养(3个平行样本),每间隔6h测定菌液OD
作为优选的技术方案之一,步骤(2)中,构建系统发育树的具体方法为:采用NCBI数据库Blastn工具比对得到分离菌株16S rRNA基因最相近种属,根据种属信息在NCBI界面下载基准基因组,使用UBCG工具对所有分离菌株基因组和基准基因组筛选所有细菌保守单拷贝基因序列,并基于最大似然算法对每个基因序列和串联序列分别构建系统发育树。
作为进一步优选的技术方案之一,根据注释信息,获得细菌乙醇代谢相关功能基因差异。
本发明的有益效果:
本发明构建了一种对收集样本的全面精准具有特定代谢能力的细菌培养筛选方案,对收集到人体粪便样本进行乙醇为单一碳源的胁迫传代培养,结合多种高通量测序手段以及化学分析手段获得具有乙醇代谢能力的菌株。通过持续不断的对粪便样品进行培养驯化,进而筛选得到能代谢特定底物的优势细菌,通过扩增子测序手段进一步得到该优势细菌物种的组成信息。接着在培养前后,宏基因组的结果表明样品整体与乙醇代谢相关的基因也发生巨变。经过培养后,与乙醇代谢相关的基因存在不同程度的富集。对培养之后的样本进一步的分离纯化培养,分离得到了6株优势细菌,分别属于克雷伯氏菌属(Klebsiella sp.)和不动杆菌属(Actinetobacter sp.)。本发明具有较强的实操性和专一性,能广泛应用在分离研究具有特定底物代谢能力的细菌。
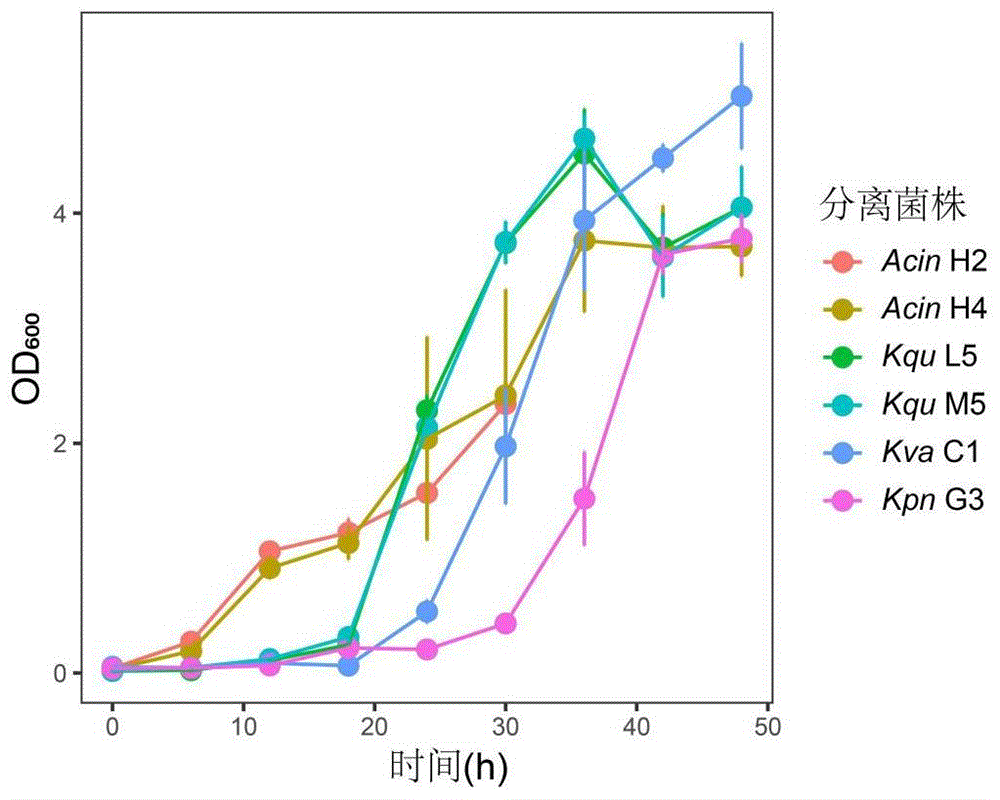
对分离菌株进行全基因组测序和系统发育分析,分离得到的菌株分别为(Klebsiella variicola,Kva)Kva C1、(Klebsiella quasivariicola,Kqu)Kqu M5、KquL5、(Klebsiella pneumoniae,Kpn)Kpn G3、(Acinetobacter,Acin)Acin H2、Acin H4。这6株分离细菌进一步在乙醇单一碳源的培养基中测定生长曲线,结果表明所有菌株均能够在35-40h左右达到生长平台期。而后检测24小时之内细菌对乙醇的消耗效率发现最低能达到0.1225mM/h。针对所有分离细菌的全基因组测序表明菌株均具有乙醇代谢的相关基因,所有菌株中都检测到了编码醋酸激酶、乙酰辅酶A合成酶、乙醛还原酶和3-氧代丙酸脱氢酶的基因,而Kqu M5和Kqu L5菌株拥有乙醇代谢关键酶的所有功能基因,因此进一步证明了细菌的乙醇代谢能力。
综上所述,本发明在针对分离具有特定底物代谢能力的细菌具有一定的优势,通过结合多组学测序方案能够更加精确的分离得到需要的细菌并完成鉴定分析工作。
附图说明
图1为传代前后细菌门水平组成变化。
图2为传代前后细菌属水平丰度与组成变化:字母“G”表示培养世代。
图3为乙醇代谢相关基因丰度热图:字母“G”表示培养世代。
图4为优势细菌与乙醇代谢相关基因网络关联。
图5为分离细菌在乙醇单一碳源培养基上的生长曲线。
图6为基于4株待测细菌以及参比基准菌株保守单拷贝基因序列构建的最大似然系统发育推断分析。分支上的数字表示树中分类群的置信度。
图7为基于2株待测细菌以及参比基准菌株保守单拷贝基因序列构建的最大似然系统发育推断分析。分支上的数字表示树中分类群的置信度。
图8为重铬酸钾比色法标准曲线。
图9为6株分离菌株乙醇代谢途径相关基因比较。根据与产醇代谢途径有关基因,对6个分离的菌株进行比较。蓝色区块表示该菌株存在右侧所列的基因,而空白区块表示该菌株缺少相关基因。
具体实施方式
下面结合附图和实施例对本发明进行进一步的阐述,应该说明的是,下述说明仅是为了解释本发明,并不对其内容进行限定。
实施例1:
本实施例提供了一种环境或人体粪便样本传代培养筛选具有底物代谢优势细菌群落方案,该方法包括如下步骤:
1.培养基配制:
(1)NMS母液配制:称取0.2g七水硫酸镁,0.105g无水氯化钙以及1g硝酸钾溶解于1L ddH
(2)20×PBS配制:称取5.44g磷酸二氢钾和10.73g磷酸氢二钠溶解于1L ddH
(3)Trace element溶液配制:称取1g乙二胺四乙酸二钠、2g七水硫酸亚铁、0.8g七水硫酸锌、0.03g四水氯化锰、0.03g硼酸、0.2g六水氯化钴、0.6g二水合氯化铜、0.6g六水合氯化镍和0.05g钼酸钠二水溶解于1L ddH
(4)含乙醇的NMS1液体培养基:分别量取50mLNMS溶液,100μLTrace element溶液,2.5mL 20×PBS以及200μL无水乙醇混匀,量取50mL混合液灌入经过121℃,20分钟高温高压灭菌后的250mL锥形瓶中备用。
2.微生物群落动态变化以及优势物种
称取5g粪便样本溶解于10mL的20×PBS中,吸取1mL的该溶液加入到49mL含乙醇的NMS1培养基中,37℃,200rpm培养。第一代以及第二代均培养至24h后,吸取5毫升原培养液至45毫升的新鲜培养基中,于37℃,200rpm培养至菌液浓度OD
3.乙醇代谢相关基因丰度变化及其与优势物种之间的关联
(1)接着选用原本粪便样本以及上一步中收集的第一代与第三代培养后样品,使用
由R包pheatmap制作热图。对于优势属与乙醇代谢或生产相关基因的网络图,仅使用前10的优势菌属进行分析,以减少数据集中的噪声。经过一代的胁迫培养,样品中与乙醇代谢相关功能基因丰度分布发生了改变,乙醇脱氢酶adhP、adhT、ahr,醛还原酶aldB和bauC基因富集。在第三代富集培养样品中,乙醇脱氢酶yahk和adhE基因丰度较高,而第三代时的乙醇脱氢酶adh和乙酰辅酶A合成酶acs基因丰度低于第一代(图3)。
psych包用于检验优势属与基因丰度两两之间的Spearman秩相关系数(r)。只有当(Spearman's|r|≥0.6)和具有统计学显著性(p-value<0.05)才会纳入网络分析,Gephi(V0.9.2)用于网络分析的可视化。网络关联分析通过对网络中节点之间的关系进行分析,揭示节点之间的相互作用和关联规律。为了说明胁迫培养后的优势菌群与传代培养期间参与乙醇代谢和乙醇产生相关基因之间的关联,本节采用了网络关联分析(图4)。具体而言,在网络图中,几乎一半的ADH基因与优势菌属表现出负相关,ALDH基因主要与优势菌属表现为正相关,ydfG基因与优势菌属负相关(图4)。此外,克雷伯氏菌属(Klebsiella sp.)与adhP和butA基因正相关,而与乙酸酯CoA-转移酶、磷酸酯乙酰转移酶相应基因负相关(图4)。接着,不动杆菌属(Acinetobacter sp.)与乙酰辅酶A合成acs和乙酸-CoA-转移酶cat1基因正相关,但与乙酰辅酶A合成酶adhE基因显示为负相关(图4)。从中还能观察到肠杆菌属(Enterobacter sp.)与乙酸-CoA-转移酶cat1基因负相关。另外,所有乙醇代谢相关基因与优势菌属之间的关联更加偏向正向关联(图4)。
实施例2:
本实施例提供了一种具有乙醇代谢优势菌株分离培养方案,该方案包含如下步骤:
1.培养基的配制
(1)含乙醇的NMS1固体培养基:50mL未灭菌的NMS溶液加0.75g琼脂粉,121℃20min高温高压灭菌。待温度降至40℃,依次加入100μLTrace element溶液,2.5mL 20×PBS以及200μL无水乙醇混匀。混匀后的液相固体培养基在无菌操作台中分装倾倒于无菌平板中,冷却凝固备用,4℃保存。
(2)LB液体培养基:称取2.5g LB Broth,Miller粉末溶解于100mL dd H
(3)LB固体培养基:称取2.5g LB Broth,Miller粉末和1.5g琼脂粉溶解于100mLdd H
2.单菌落分离培养
(1)从第8代培养样本的菌悬液中吸取100μL菌液涂布于含有乙醇的NMS1固体培养基平板,37℃培养12h。
(2)在平板上逐一挑取单菌落传代到新的含有乙醇NMS1固体培养基,37℃培养12h,直到菌株稳定生长到第三代。
(3)挑取稳定生长的细菌单菌落接种于5mL LB培养基中,37℃200rpm过夜扩大培养。
(4)吸取扩大培养后的1mL菌液于1.5mL EP管中,12000rpm,1min离心,弃上清,重复上述步骤三次。另吸取500μLDMSO和500μL LB培养基重悬菌体,存储于-80℃。
3.分离菌株生长曲线
从-80℃冰箱取出保藏的菌株,待溶解后,使用无菌接种环在无菌操作台中蘸取菌液,采用三区划线法进行平板涂布,以便分离培养出单菌落。涂布后的平板经封口膜密封,在恒温培养箱中37℃培养12h。挑取平板上细菌单菌落接种于5mL LB液体培养基中,37℃,200rpm过夜扩大培养。吸取1mL扩大培养后的菌液于1.5mL EP管中,12000rpm,1min离心弃上清,重复该步骤三次,吸取1200μL 20×PBS吹打重悬菌体制作菌悬液。配制好的菌悬液按照1:1000的体积比混入新配制的含乙醇的NMS1液体培养基(3个平行样本),37℃,200rpm培养,每间隔6h测定菌液OD
实施例3:
本实施例提供了一种全基因组测序分析鉴定方案以及细菌乙醇代谢效率测定方案,该方案包含如下步骤:
1.肠源性菌株的全基因组概况及系统发育分析
(1)全基因组测序、组装和注释:6个细菌菌株的基因组DNA提取采用Cetyltrimethyl Ammonium Bromide(CTAB)提取方法。Qubit Flurometer(Invitrogen,USA)和NanoDrop Spectrophotometer(Thermo Scientific,USA)用于DNA质量和完整性测定。标准Illumina TruSeqNano DNALT文库用于构建所需的基因组上机文库。采用IlluminaMiseq测序平台进行测序(中国上海派森诺生物公司)。下机数据以双端FASTQ格式保存,FastQC进行质控。通过fastp对所有样品的原始数据进行修剪,去除adaptor、N碱基和低质量序列。采用SPAdes对6株细菌进行基因组组装,Prokka用于分离菌株蛋白质编码基因预测和注释。细菌全基因组原始数据储存于国家基因组学数据中心基因序列档案,编号为CRA009237(https://ngdc.cncb.ac.cn/gsa)。
(2)系统发育分析:根据注释结果筛选16S rRNA基因,采用NCBI数据库Blastn工具比对得到分离菌株16S rRNA基因最相近种属。根据种属信息在NCBI界面下载基准基因组(表1)。使用UBCG工具对所有分离菌株基因组和基准基因组筛选所有细菌保守单拷贝基因序列,并基于最大似然算法对每个基因序列和串联序列分别构建系统发育树。MEGA-X用于绘制和美化系统发育树。根据分离菌株的系统发育树,对6株分离菌株重新命名,分别为(Klebsiella variicola,Kva)Kva C1、(Klebsiella quasivariicola,Kqu)Kqu M5、KquL5、(Klebsiellapneumoniae,Kpn)Kpn G3、(Acinetobacter,Acin)Acin H2、Acin H4(图6,图7),分别属于克雷伯氏菌属(Klebsiella sp.)或不动杆菌属(Actinetobacter sp.)。
表1.基准细菌NCBI序列号
2.分离菌株乙醇代谢效率测定
0.25mol/L重铬酸钾溶液与浓硫酸以4:1的体积比混合制备工作液并冷却,4℃保存。采用无水乙醇和ddH
表2.分离菌株24h乙醇代谢效率
3.细菌乙醇代谢相关功能基因差异
分离细菌全基因组中与乙醇代谢相关的功能基因热图结果显示,所有菌株中都检测到了编码醋酸激酶、乙酰辅酶A合成酶、乙醛还原酶和3-氧代丙酸脱氢酶的基因,而KquM5和Kqu L5菌株拥有乙醇代谢关键酶的所有功能基因(图9)。
上述虽然结合附图对本发明的具体实施方式进行了描述,但并非对本发明保护范围的限制,在本发明的技术方案的基础上,本领域技术人员不需要付出创造性劳动即可做出的各种修改或变形仍在本发明的保护范围以内。
- 一株耐受低pH的乙醇生产运动发酵单胞菌菌株及其分离筛选方法和应用
- 通过代谢工程化的酵母菌株调节由玉米生产乙醇期间的氮代谢的方法
- 一种耐热激黑木耳菌株的筛选培养基及室内筛选耐热激黑木耳菌株的方法
