IL-2激动剂的2-Thr-二氢异喹啉-3S-甲酰-AA、及其制备和抗肿瘤的应用
文献发布时间:2024-04-18 20:00:50
技术领域
本发明涉及四种3S-2-Thr-四氢异喹啉-3S-甲酰-AA化合物,涉及它们的制备方法以及在制备IL-2激动剂中的应用。实验证明,本发明的IL-2激动剂有良好的抗肿瘤作用。本发明属于生物医药领域。
背景技术
根据世界卫生组织(WHO)公布的数据,全球每年新增1500万恶性肿瘤患者。在适龄劳动人口伤残和死亡的病因上,恶性肿瘤无疑是最主要的疾病之一。从临床治疗的措施看,化学治疗仍然是恶性肿瘤的首选策略。寻找毒副作用低疗效好的化学治疗剂,是药物化学的重要目标之一。
IL-2,IL-8,IL-10以及TNF-ɑ与恶性肿瘤发病的关系有明确的描述。例如,恶性肿瘤患者的IL-2水平低于健康人,IL-2可以单独用以治疗恶性肿瘤的重要生物制剂;在多种恶性肿瘤组织分泌IL-8及表达IL-8的mRNA,而相应的正常组织不表达或低表达IL-8;此外,在膀胱癌的动物模型上抗IL-8抗体可抑制肿瘤生长;IL10对恶性肿瘤生长有抑制作用;此外,IL-10基因缺失增大恶性肿瘤的发病风险;TNF-ɑ能够直接杀伤恶性肿瘤细胞,对正常细胞无明显毒性,是迄今为止所发现的抗肿瘤作用最强的生物活性因子之一。这些知识表明,寻找毒副作用低疗效好的化学治疗剂可转化为寻找IL-2,IL-8,IL-10以及TNF-ɑ激动剂。
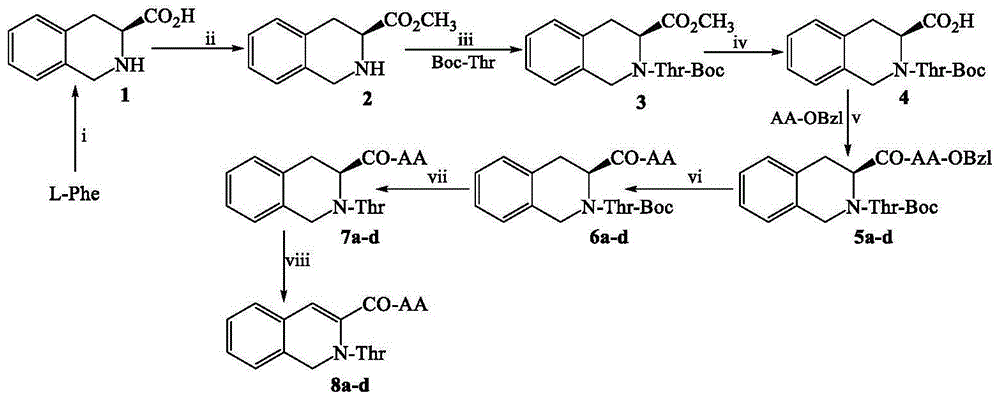
在研究3S-2-Thr-四氢异喹啉-3S-甲酰-AA的代谢产物时,发明人发现了四种3S-2-Thr-二氢异喹啉-3S-甲酰-AA化合物(AA代表为L-Gln残基,L-Asn残基,L-Leu残基及L-Ala残基)。发明人设想,3S-2-Thr-二氢异喹啉-3S-甲酰-AA可能是IL-2,IL-8,IL-10以及TNF-ɑ激动剂。于是,发明人将该四种化合物与IL-2,IL-8,IL-10以及TNF-ɑ的活性部位对接。分子对接表明,3S-2-Thr-二氢异喹啉-3S-甲酰-AA与IL-10的对接自由能最低。活性评价表明,3S-2-Thr-二氢异喹啉-3S-甲酰-AA有效上调血液IL-2浓度。活性评价还表明,这四种3S-2-Thr-二氢异喹啉-3S-甲酰-AA化合物有良好的抗肿瘤作用。根据这些发现,申请人提出了本发明。
发明内容
本发明要解决的技术问题是提供四种2-Thr-二氢异喹啉-3-甲酰-AA化合物(AA为L-Gln残基,L-Asn残基,L-Leu残基及L-Ala残基),,确认这四种化合物在制备IL-2激动剂的抗肿瘤作用。为了达到所述目的,本发明采用了以下技术手段。
首先,本发明提出了具有下式结构的2-Thr-二氢异喹啉-3-甲酰-AA化合物,
AA为L-Gln残基,L-Asn残基,L-Leu残基及L-Ala残基。
其次,是将四种2-Thr-二氢异喹啉-3-甲酰-AA化合物与IL-2,IL-8,IL-10以及TNF-ɑ的活性部位对接,筛选出IL-2的激动剂。
第三个技术手段是提出2-Thr-二氢异喹啉-3-甲酰-AA的制备方法,该方法包含以下步骤:
1)制备3S-四氢异喹啉-3-羧酸;
2)制备3S-四氢异喹啉-3-羧酸甲酯;
3)制备3S-2-(Boc-Thr)-四氢异喹啉-3-羧酸甲酯;
4)制备3S-2-(Boc-Thr)-四氢异喹啉-3-羧酸;
5)制备3S-2-(Boc-Thr)-四氢异喹啉-3-甲酰-AA-OBzl;
6)制备3S-2-(Boc-Thr)-四氢异喹啉-3-甲酰-AA;
7)制备3S-2-Thr-四氢异喹啉-3-甲酰-AA;
8)制备3S-2-Thr-二氢异喹啉-3-甲酰-AA。
第四个技术手段是确认上述结构的2-Thr-二氢异喹啉-3-甲酰-AA化合物能有效上调血液IL-2浓度,是优秀的IL-2激动剂。
第五个技术手段是确认上述结构的2-Thr-二氢异喹啉-3-甲酰-AA化合物是在制备抗肿瘤剂中的应用。
实验证明,本发明所述结构的四种2-Thr-二氢异喹啉-3-甲酰-AA化合物与IL-10的对接自由能最低,能有效上调血液IL-2浓度,并具有良好的抗肿瘤作用。因而本发明的提出为抗肿瘤药物提供了有效的技术手段。
附图说明
图1为3S-2-Thr-二氢异喹啉-3S-甲酰-AA的合成路线图:i)CH
具体实施方式
为了进一步阐述本发明,下面给出一系列实施例。这些实施例完全是例证性的,它们仅用来对本发明进行具体描述,不应当理解为对本发明的限制。
实施例1制备3S-四氢异喹啉-3-羧酸(1)
将L-Phe(4.0g,24.2mmol)依次与21.6mL甲醛及36mL浓盐酸(35%)充分搅拌,使均匀混合。将得到的混悬液80℃搅拌,2小时后L-Phe完全溶解,2.5小时后开始有无色沉淀,7小时后薄层层析(CHCl
实施例2制备3S-四氢异喹啉-3-羧酸甲酯(2)
将50mL甲醇冷却至0℃,往冷却的甲醇中缓缓滴加10mLSOCl
实施例3制备3S-2-(Boc-Thr)-四氢异喹啉-3-羧酸甲酯(3)
0℃下往3S-四氢异喹啉-3-羧酸甲酯(4.30g,22.5mmol)与Boc-Thr(4.31g,22.5mmol)和150mL无水四氢呋喃的溶液中加N-羟基苯并三唑(HOBt,3.04g,22.5mmol)及二环己基羰二亚胺(DCC,4.71g,22.5mmol)。反应混合物0℃搅拌30分钟。然后用N-甲基吗啉(NMM)调pH8。反应混合物0℃搅拌6小时,薄层层析(乙酸乙酯/甲醇,20/1)显示3S-四氢-β-咔啉-3-羧酸消失,终止反应。反应混合物过滤,滤液减压浓缩至干,残留物用200mL乙酸乙酯溶解。得到的溶液依次用5%碳酸氢钠水溶液洗(30mL×3),饱和氯化钠水溶液洗(30mL×3),5%盐酸水溶液洗(30mL×3),饱和氯化钠水溶液洗(30mL×3)。分离乙酸乙酯层,用无水硫酸钠干燥12小时,过滤,滤液减压浓缩至干,得到8.21g(93%)标题化合,为无色粉末。ESI-MS(m/e):393[M+H]
实施例4制备3S-2-(Boc-Thr)-四氢异喹啉-3-羧酸(4)
0℃下将3S-2-(Boc-Thr)-四氢异喹啉-3-羧酸甲酯(7.45g,19mmol)和50mL甲醇的溶液与5mLNaOH水溶液(3N)混合。反应混合物0℃搅拌6小时,薄层层析(乙酸乙酯/甲醇,20/1)监测到3S-2-(Boc-Thr)-四氢异喹啉-3-羧酸甲酯消失,终止反应。反应混合物用稀盐酸调pH至2,滤液减压浓缩至干,残留物用200mL乙酸乙酯溶解。得到的溶液依次用5%碳酸氢钠水溶液洗(30mL×3),饱和氯化钠水溶液洗(30mL×3),5%盐酸水溶液洗(30mL×3),饱和氯化钠水溶液洗(30mL×3)。分离乙酸乙酯层,用无水硫酸钠干燥12小时,过滤,滤液减压浓缩至干,得到6.68g(93%)标题化合,为无色粉末。ESI-MS(m/e):377[M-H]
实施例5制备3S-2-(Boc-Thr)-四氢异喹啉-3-甲酰-Gln-OBzl(5a)
采用实施例3的方法从3S-2-(Boc-Thr)-四氢异喹啉-3-羧酸(3.78g,10mmol)和Gln-OBzl(2.36g,10mmol)得到4.95g(83%)标题化合,为无色粉末。ESI-MS(m/z):597[M+H]
实施例6制备3S-2-(Boc-Thr)-四氢异喹啉-3-甲酰-Gln(6a)
将3S-2-(Boc-Thr)-四氢异喹啉-3-甲酰-Gln-OBzl(4.77g,8mmol)溶于50mL甲醇,加入240mgPd/C,通入氢气,氢解48小时。滤除Pd/C,减压浓缩除去甲醇,残留物用石油醚磨洗(30mL×3)得到3.85g(95%)标题化合,为无色粉末。ESI-MS(m/z):507[M+H]
实施例7制备3S-2-Thr-四氢异喹啉-3-甲酰-Gln(7a)
将3S-2-(Boc-Thr)-四氢异喹啉-3-甲酰-Gln(3.54g,7mmol)溶于100mL浓度为4N的氯化氢的无水乙酸乙酯溶液,0℃搅拌50分钟。向反应混合物加入无水乙醚,减压浓缩,直至氯化氢气完全抽净。得2.71g(95%)标题化合,为无色粉末。FT-ICR-MS(m/e):407.1931[M+H]
实施例8制备3S-2-Thr-二氢异喹啉-3-甲酰-Gln(8a)
0℃下将3S-2-Thr-四氢异喹啉-3-甲酰-Gln(2.03g,5mmol)缓慢与KMnO
实施例9制备3S-2-(Boc-Thr)-四氢异喹啉-3-甲酰-Asn-OBzl(5b)
采用实施例3的方法从3S-2-(Boc-Thr)-四氢异喹啉-3-羧酸(3.78g,10mmol)和Asn-OBzl(2.22g,10mmol)得到4.84g(83%)标题化合,为无色粉末。ESI-MS(m/z):583[M+H]
实施例10制备3S-2-(Boc-Thr)-四氢异喹啉-3-甲酰-Asn(6b)
采用实施例6的方法从3S-2-(Boc-Thr)-四氢异喹啉-3-甲酰-Asn-OBzl(4.31g,8mmol)得到4.42g(95%)标题化合,为无色粉末。ESI-MS(m/z):493[M+H]
实施例11制备3S-2-Thr-四氢异喹啉-3-甲酰-Asn(7b)
采用实施例7的方法从3S-2-(Boc-Thr)-四氢异喹啉-3-甲酰-Asn(3.13g,7mmol)得到2.31g(95%)标题化合,为无色粉末。FT-ICR-MS(m/e):393.1774[M+H]
实施例12制备3S-2-Thr-二氢异喹啉-3-甲酰-Asn(8b)
采用实施例8的方法从3S-2-Thr-四氢异喹啉-3-甲酰-Asn(1.96g,5mmol)得到1.86g(95%)标题化合,为黄色粉末。FT-ICR-MS(m/e):391.1618[M+H]
实施例13制备3S-2-(Boc-Thr)-四氢异喹啉-3-甲酰-Leu-OBzl(5c)
采用实施例3的方法从3S-2-(Boc-Thr)-四氢异喹啉-3-羧酸(3.78g,10mmol)和Leu-OBzl(2.22g,10mmol)得到4.99g(86%)标题化合,为无色粉末。ESI-MS(m/z):582[M+H]
实施例14制备3S-2-(Boc-Thr)-四氢异喹啉-3-甲酰-Leu(6c)
采用实施例6的方法从3S-2-(Boc-Thr)-四氢异喹啉-3-甲酰-Leu-OBzl(4.65g,8mmol)得到3.73g(95%)标题化合,为无色粉末。ESI-MS(m/z):492[M+H]
实施例15制备3S-2-Thr-四氢异喹啉-3-甲酰-Leu(7c)
采用实施例7的方法从3S-2-(Boc-Thr)-四氢异喹啉-3-甲酰-Leu(3.44g,7mmol)得到2.61g(95%)标题化合,为无色粉末。FT-ICR-MS(m/e):392.2185[M+H]
实施例16制备3S-2-Thr-二氢异喹啉-3-甲酰-Leu(8c)
采用实施例8的方法从3S-2-Thr-四氢异喹啉-3-甲酰-Leu(1.96g,5mmol)得到1.85g(95%)标题化合,为黄色粉末。FT-ICR-MS(m/e):390.2029[M+H]
实施例17制备3S-2-(Boc-Thr)-四氢异喹啉-3-甲酰-Ala-OBzl(5d)
采用实施例3的方法从3S-2-(Boc-Thr)-四氢异喹啉-3-羧酸(3.78g,10mmol)和Ala-OBzl(1.79g,10mmol)得到4.64g(86%)标题化合,为无色粉末。ESI-MS(m/z):540[M+H]
实施例18制备3S-2-(Boc-Thr)-四氢异喹啉-3-甲酰-Ala(6d)
采用实施例6的方法从3S-2-(Boc-Thr)-四氢异喹啉-3-甲酰-Ala-OBzl(4.31g,8mmol)得到3.41g(95%)标题化合,为无色粉末。ESI-MS(m/z):450[M+H]
实施例19制备3S-2-Thr-四氢异喹啉-3-甲酰-Ala(7d)
采用实施例7的方法从3S-2-(Boc-Thr)-四氢异喹啉-3-甲酰-Ala(3.14g,7mmol)得到2.32g(95%)标题化合,为无色粉末。FT-ICR-MS(m/e):350.1716[M+H]
实施例20制备3S-2-Thr-二氢异喹啉-3-甲酰-Ala(8d)
采用实施例8的方法从3S-2-Thr-四氢异喹啉-3-甲酰-Ala(1.75g,5mmol)得到2.03g(95%)标题化合,为黄色粉末。FT-ICR-MS(m/e):348.1559[M+H]
实施例21 3S-2-Thr-二氢异喹啉-3-甲酰-AA的分子对接
为了预测3S-2-Thr-二氢异喹啉-3-甲酰-Gln(8a),3S-2-Thr-二氢异喹啉-3-甲酰-Asn(8b),3S-2-Thr-二氢异喹啉-3-甲酰-Leu(8c)及3S-2-Thr-二氢异喹啉-3-甲酰-Ala(8d)对肿瘤小鼠血液细胞因子的影响本申请完成了8a-d和IL-2,IL-8,IL-10及TNF-ɑ的活性部位的分子对接。IL-2,IL-8,IL-10及TNF-ɑ均来自欧洲蛋白质库。对接时采用DiscoveryStudio的LigandFit将8a-d对接到IL-2,IL-8,IL-10及TNF-ɑ的活性部位。对接时经历了四个步骤。第一步,用flood-filling算法选择腔体,以便选择和确定作为对接的区域的IL-2,IL-8,IL-10及TNF-ɑ的活性位点。第二步,为8a-d选择位点时先通过随机抽样选择可变扭转角的柔性值搜索8a-d的构象,再用三维规则网格检测位点的检测并估算对接IL-2,IL-8,IL-10及TNF-ɑ的活性位点所需能量。第三步,比较IL-2,IL-8,IL-10及TNF-ɑ和8a-d的库仑力,范德华力,结合能,原子间距,氢键能,空间相互作用,亲脂相互作用,溶剂化效应和熵效应的分数,以便得到综合评价结果。第四步,计算8a-d的对接自由能。表1的数据表明,向IL-2,IL-8,IL-10以及TNF-ɑ的活性部位对接时8a-d与IL-2的结合自由能显著性低于与IL-8,IL-10及TNF-ɑ的结合自由能。可见,IL-2是8a-d的潜在的分子靶点。
表1 8a-d与IL-2,IL-8,IL-10以及TNF-ɑ的活性部位的结合能
实施例22评价3S-2-Thr-二氢异喹啉-3-甲酰-AA的抗肿瘤活性
ICR雄性小鼠(体重20±2g)在温度为25℃的环境静息2天,自由饮水和进食。之后,小鼠接种S180腹水瘤。小鼠的前右腋皮下接种S180腹水瘤的操作是:无菌条件下提取生长旺盛的S180腹水瘤的含肿瘤细胞的液体,得到的含肿瘤细胞的液体用两倍体积的生理盐水稀释之后,充分混合使成为肿瘤细胞悬浮液。瘤细胞悬浮液与台盼蓝染色液(台盼蓝染色液按标准操作配制,浓度为0.2%)混匀,然后按白细胞计数方法计数,染蓝色者为死细胞,不染色者为活细胞。按公式计算肿瘤细胞浓度和存活率:肿瘤细胞浓度=4个方格内的活细胞数/4×10
小鼠接种S180瘤细胞悬液6天后随机分组。小鼠或口服生理盐水(剂量为0.2mL/只小鼠/天,1天1次,连续11天,12只小鼠)或腹腔注射阿霉素(剂量为2μmol/kg/天,1天1次,连续11天,12只小鼠)或口服3S-2-Thr-二氢异喹啉-3-甲酰-AA(8a-d,剂量为10nmol/kg/天,1天1次,连续11天,各12只小鼠)。末次治疗的次日称小鼠体重,乙醚麻醉,取血,脱颈椎处死。用镊子固定小鼠前右腋肿瘤生长部位,剪开皮肤,暴露肿瘤,钝性剥离,称重。用肿瘤重量表示3S-2-Thr-二氢异喹啉-3-甲酰-AA(8a-d)的抗肿瘤活性。
表2的数据表明,在10nmol/kg/天口服剂量下8a-d有效地抑制肿瘤生长(与生理盐水比p<0.01)。表2的数据还表明,在10nmol/kg/天口服剂量下8a-d抑制肿瘤生长的活性和在2μmol/kg/天腹腔注射剂量下阿霉素抑制肿瘤生长的活性无显著性差异(与阿霉素比p>0.05)。可见,8a-d代表的四种3S-2-Thr-二氢异喹啉-3-甲酰-AA化合物对抑制肿瘤生长具有突出的技术效果。
表2 3S-2-Thr-二氢异喹啉-3-甲酰-AA的抗肿瘤活性
a)与生理盐水比p<0.01,与阿霉素比p>0.05;n=12.
实施例23评价3S-2-Thr-二氢异喹啉-3-甲酰-AA对细胞因子的影响
将肿瘤小鼠的血于4℃加入浓度为3.8%(g/100mL)枸橼酸钠的生理盐水溶液(v/v=9:1),3000g离心15分钟,然后吸取上清液作为IL-2,IL-8,IL-10以及TNF-ɑ酶联免疫测定样本。
ELISA法定量测定血浆样本中IL-2,IL-8,IL-10以及TNF-ɑ时,用纯化的IL-2,IL-8,IL-10以及TNF-ɑ抗体包被微孔板。按照ELISA试剂盒的方法实施操作,即向包被单抗的微孔中依次加入标准品或生理盐水治疗的肿瘤小鼠的血浆样本及8a-d治疗的肿瘤小鼠的血浆样本,加生物素化的IL-2,IL-8,IL-10以及TNF-ɑ抗体,以及辣根过氧化物酶标记的亲和素。然后,彻底洗涤微孔板并加底物TMB显色。显色时,先看到过氧化物酶作用诱发的蓝色,后看到在酸作用下蓝色转为黄色。黄色的深度与样本中IL-2,IL-8,IL-10以及TNF-ɑ的浓度正相关。在450nm的波长下用酶标仪测定标准品的吸光度(OD),绘制标准曲线。在450nm的波长下用酶标仪测定生理盐水治疗的肿瘤小鼠及8a-d治疗的肿瘤小鼠的血浆样本的吸光度(OD),通过标准曲线计算生理盐水治疗的肿瘤小鼠及8a-d治疗的肿瘤小鼠的血浆样本的IL-2,IL-8,IL-10以及TNF-ɑ的浓度。每个样本重复6次。表3的数据表明,8a-d显著性升高肿瘤小鼠的血浆IL-2的浓度(与生理盐水比p<0.01)。表3的数据还表明,8a-d对肿瘤小鼠的血浆IL-8,IL-10以及TNF-ɑ的浓度无显著影响(与生理盐水比p>0.05)。可见,小鼠血浆的IL-2的确是8a-d抑制肿瘤生长的分子靶点。
表3 8a-d对血浆IL-2,IL-8,IL-10以及TNF-ɑ的影响
a)8a-d与生理盐水比p<0.01;b)8a-d与生理盐水比p>0.05;c)8a-d与生理盐水比p>0.05;d)8a-d与生理盐水比p>0.05;n=10。
- 一种基于Qt资源文件的Excel文档生成方法及系统
- 一种接口文档的自动生成方法及终端设备
- 一种QT环境下基于模板的文档自动生成方法
- 基于QT5软件的需求规格说明文档自动生成方法及生成装置
