基于CRISPR/Cas9的人源化ATXN3基因敲入小鼠模型的构建方法及应用
文献发布时间:2024-04-18 20:01:23
技术领域
本发明涉及生物技术领域,特别涉及一种基于CRISPR/Cas9的人源化ATXN3基因敲入小鼠模型的构建方法及应用。
背景技术
遗传性脊髓小脑性共济失调(spinocerebellar ataxias,SCAs)是一类临床和遗传异质性较高的遗传性神经退行性疾病,其患病率约为0-5.6/10万。目前已报道了49种SCA亚型,其中以脊髓小脑性共济失调3型(又称马查多-约瑟夫病)(spinocerebellar ataxiatype 3/Machado-Joseph disease,SCA3/MJD,以下简称SCA3)最为常见,约占中国所有SCAs的60-70%。
SCA3由位于14q32区域的ATXN3基因10号外显子内CAG三核苷酸重复序列异常扩增所致。正常人群中CAG重复序列拷贝数为12-44次,而在SCA3患者中为52-86次,因此导致编码的ataxin-3蛋白内多聚谷氨酰胺肽链(polyglutamine,polyQ)异常扩展。异常扩展的polyQ蛋白将在小脑、脑干、脊髓等部位的神经元细胞核内选择性聚集,并形成神经元核内包涵体(neuronal intranuclear inclusions,NIIs),引起神经元变性及死亡,最终导致上述部位萎缩。该类由异常扩展的polyQ突变蛋白引起的疾病称为polyQ病,包括SCA1、2、3、6、7、17,脊髓延髓肌肉萎缩症(spinal and bulbar muscular atrophy,SBMA),齿状核红核苍白球路易体萎缩症(dentatorubral-pallidoluysian atrophy,DRPLA),亨廷顿病(Huntington’s disease,HD)。
SCA3是9种polyQ病中最具有代表性的一种,其临床表型复杂,核心症状为小脑性共济失调。步态异常是最常见的首发症状,主要表现为醉酒样步态,同时可伴构音障碍、眼球震颤、吞咽困难、饮水呛咳以及自主神经功能障碍、睡眠障碍、认知障碍等神经系统表现。影像学主要表现为小脑和脑干萎缩,可伴有第四脑室扩大。该病发病机制尚未被完全阐明,可能的机制包括毒性蛋白片段假说、细胞内蛋白稳态失衡假说、线粒体功能障碍假说、基因转录和表达失调假说、囊泡及轴突传递障碍假说、神经信号传导异常假说等,导致目前尚无特效治疗。构建理想的疾病动物模型对于SCA3的发病机制探索、治疗靶点发现和药物疗效评估至关重要。由于与人源基因相似度高、价格低、繁殖力强、存活能力强、遗传操作便利等优点,小鼠模型是该病最重要的模式生物之一。
既往SCA3小鼠模型的构建主要基于转基因技术和胚胎干细胞(embryonicstemcell,ES)打靶技术。转基因小鼠模型的构建一般是指通过原核显微注射的方法,将外源性目的基因注射到小鼠受精卵使之整合到小鼠基因组中,并在外源性启动子作用下过表达目的基因,其主要优势是可插入大片段目的基因。2002年Cemal等利用酵母人工染色体(Yeast artificial chromosomes,YAC)作为转基因载体,向小鼠受精卵中转入了含CAG重复序列拷贝数为84次的人源ATXN3基因cDNA全长片段,构建了MJD84.2转基因小鼠模型,但该模型表型出现时间较晚,15月龄才出现平衡障碍及肢体协调功能受损,不能很好地模拟SCA3患者的疾病特征。另外,由于目的基因的插入位点不可控,所以基于原核注射的转基因技术会导致目的基因随机整合,造成基因组发生重排、易位、缺失等突变,影响小鼠其它内源性基因的表达。而且,转基因技术用来控制目的基因表达的启动子为外源性人工启动子,该启动子虽能使目的基因过表达,但可能缺乏组织和时间的特异性,对动物的生理功能造成影响,进而影响疾病表型的出现。
ES打靶小鼠模型的构建一般先在小鼠ES细胞中通过同源重组将外源性目的基因定点整合入ES细胞基因组中,并将整合后的ES细胞注射到囊胚腔中形成嵌合胚胎,将嵌合胚胎移植到假孕鼠体内发育成嵌合体小鼠,嵌合鼠再与野生型小鼠杂交将ES细胞中的基因编辑信息传递给子代小鼠。基于同源重组的ES打靶技术极大降低了脱靶率。2015年Ramani等基于ES打靶技术构建了Atxn3Q82/Q6基因敲入(Knock-in,KI)SCA3小鼠模型,该小鼠模型的Atxn3基因座中定点插入了82次CAG重复序列,虽然能有效模拟SCA3患者的病理改变,但未能出现SCA3相关行为学表型,因此该模型仅可用于SCA3神经元损伤和症状前期分子机制研究。同期,Switonski等通过用含91次CAG重复序列的人源化ATXN3基因取代小鼠内源性Atxn3基因构建了SCA3-Ki91小鼠。与Atxn3Q82/Q6小鼠模型不同的是,SCA3-Ki91小鼠模型存在浦肯野细胞丢失和共济失调表型,但表型出现时间较晚,疾病表型轻微,且由于该模型只置换了Atxn3基因的7-11号外显子,因此不能完全模拟SCA3患者的遗传背景。此外,ES打靶技术存在操作复杂、打靶效率低下及成本高等缺点。鉴于以上问题,探究新的SCA3疾病模型构建技术至关重要。
发明内容
本发明为了解决上述技术问题,提供了一种基于CRISPR/Cas9的人源化ATXN3基因敲入小鼠模型的构建方法及应用。
本发明是通过以下技术方案得以实现的。
一种基于CRISPR/Cas9的人源化ATXN3基因敲入小鼠模型的构建方法,包括以下步骤:
目的基因序列及重组质粒的合成:构建含96次CAG三核苷酸重复的目的ATXN3-96Q-CDS序列,ATXN3-96Q-CDS序列如SEQ ID NO.1所示;将合成的目的基因序列导入质粒载体,构建重组质粒,将验证正确的重组质粒作为donor载体;
设计5’端和3’端的两条gRNA序列:5’端gRNA序列如SEQ ID NO.2所示,3’端gRNA序列如SEQ ID NO.2或SEQ ID NO.3所示;
Cas9/gRNA/donor的显微注射:将Cas9、gRNA以及含有目的基因序列的donor载体显微注射到小鼠受精卵中,再将受精卵移植到假孕母鼠,构建得到F0代首建鼠(KI-96Q小鼠模型)。
一种上述构建方法得到的CRISPR/Cas9的人源化ATXN3基因敲入小鼠模型在研究遗传性脊髓小脑性共济失调发病机制中的应用。
一种上述构建方法得到的CRISPR/Cas9的人源化ATXN3基因敲入小鼠模型在发现遗传性脊髓小脑性共济失调治疗靶点中的应用。
一种上述构建方法得到的CRISPR/Cas9的人源化ATXN3基因敲入小鼠模型在评估治疗遗传性脊髓小脑性共济失调药物疗效中的应用。
本申请具有以下有益效果。
(1)本发明基于CRISPR/Cas9技术成功构建的KI-96Q小鼠模型是致病基因完全人源化的小鼠模型,可以更好地模拟人源性目的蛋白的功能;
(2)本发明构建的KI-96Q小鼠模型行为学表型出现早,表现出进行性加重的运动及平衡功能失调,目前表型稳定,能有效模拟临床上SCA3患者的遗传及临床特点;
(3)本发明构建的KI-96Q小鼠模型具有包涵体形成和浦肯野细胞受损等SCA3主要神经病理改变特征,能有效模拟临床上SCA3患者的病理特点;
(4)本发明构建的KI-96Q小鼠模型具有以小脑、脑桥体积减少为主,同时伴有第四脑室扩大的影像学改变,能有效模拟临床上SCA3患者的神经影像特征;
(5)本发明构建的KI-96Q小鼠模型将进一步动态观察,以绘制SCA3不同疾病阶段的表型图谱;
(6)本发明构建的KI-96Q小鼠模型为后续SCA3的发病机制及治疗研究提供了有效工具;
(7)本发明构建的KI-96Q小鼠模型将应用于探索神经元选择性死亡的发病机制,解析SCA3相关分子及环路调控机制,整合分析空间转录组学、蛋白质组学等多组学变化,筛选SCA3相关修饰基因及通路;
(8)本发明构建的KI-96Q小鼠模型将应用于SCA3的间充质干细胞移植、小分子化合物药物筛选、RNA干扰等治疗研究,为SCA3的精准治疗和新药开发提供有效工具和新靶点。
附图说明
图1是本发明主要技术路线图;
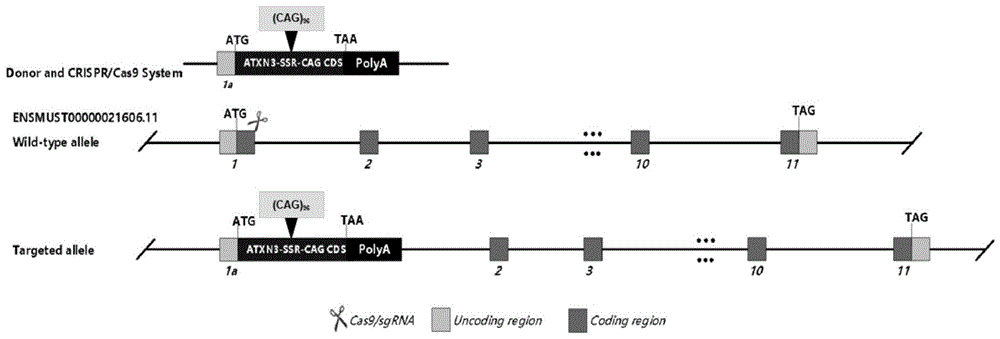
图2是本发明CRISPR/Cas9基因编辑示意图;应用CRISPR/Cas9在小鼠转录本(Atxn3-201,ENSMUST00000021606.11)的ATG翻译起始密码子位点处进行基因编辑,插入长度约为1.9kb的ATXN3-96Q-CDS序列和外源转录终止信号polyA尾;
图3是本发明目的序列合成及重组质粒表达鉴定结果图;其中,图3A为Sanger测序结果显示重组质粒含96次CAG三核苷酸重复;图3B为将重组质粒瞬时转染HEK293T细胞后,96Q质粒组可以表达突变型ataxin-3蛋白(70KD左右)和野生型ataxin-3蛋白(43KD左右),20Q对照质粒组可以表达45KD左右的ataxin-3蛋白,而空白对照组和空载质粒组仅能表达野生型ataxin-3蛋白;
图4是本发明小鼠PCR产物琼脂糖凝胶电泳结果图;其中5只阳性KI小鼠PCR产物均有500bp左右的阳性条带,而WT小鼠没有出现条带;
图5是本发明小鼠毛细管电泳结果图;其中毛细管电泳最高峰值代表KI-96Q小鼠CAG三核苷酸重复序列拷贝数为96次;
图6是本发明1月龄小鼠脑组织ataxin-3蛋白表达结果图;其中,6A:用抗ataxin-3抗体检测1月龄KI小鼠和WT小鼠脑组织中大脑、小脑、脑干ataxin-3蛋白表达情况,wt-ataxin-3蛋白为43KD左右,mut-ataxin-3蛋白为70KD左右;6B:用抗polyQ抗体检测1月龄KI小鼠和WT小鼠脑组织中大脑、小脑、脑干ataxin-3蛋白表达情况,同样wt-ataxin-3蛋白为43KD左右,mut-ataxin-3蛋白为70KD左右。内参GAPDH为36KD左右。图6A与6B中KI小鼠的小脑蛋白在75KD突变型条带下有一较浅条带,可能与ataxin-3蛋白修饰或降解有关;
图7是本发明不同月龄小鼠转棒实验结果图;其中,7A-7F:为不同月龄的KI小鼠和WT小鼠转棒停留时间的比较(转棒速度为40rpm);7G:转棒停留时间随小鼠月龄变化趋势图。n=8。*表示p<0.05,**表示p<0.01;
图8是本发明不同月龄小鼠平衡木实验结果图;其中,8A-8F为不同月龄的KI小鼠和WT小鼠在四种不同宽度平衡木上的行走时间的比较。n=8。*表示p<0.05;
图9是本发明小鼠在不同宽度平衡木实验结果趋势图;其中,9A-9D为KI小鼠和WT小鼠在四种不同宽度平衡木上的行走时间随小鼠月龄变化趋势图。n=8。*表示p<0.05,**表示p<0.01;
图10是本发明不同月龄小鼠抓力测试结果图;其中,10A-10C为不同月龄KI小鼠和WT小鼠最大抓力峰值的比较;10D为最大抓力峰值随小鼠月龄变化趋势图。n=8;
图11是本发明12月龄小鼠足迹实验图;其中,上下图分别为12月龄WT小鼠和KI小鼠足迹图。图中箭头代表小鼠运动方向为由左向右;
图12是本发明12月龄小鼠抱肢实验结果图;其中,12A:12月龄WT雄鼠抱肢实验表现为双侧后肢展开;12B:12月龄KI雄鼠抱肢实验表现为双侧后肢向腹部收缩;
图13是本发明小鼠旷场实验结果图;其中13A:12月龄KI小鼠旷场轨迹图;13B:12月龄WT小鼠旷场轨迹图;13C:12月龄KI小鼠与WT小鼠旷场总运动路程比较;13D:12月龄KI小鼠与WT小鼠旷场平均运动速度比较;
图14是本发明小鼠体重变化趋势图;
图15是本发明小鼠小脑组织calbindin 28K免疫荧光结果图;其中,15A-15B:相较于2月龄WT小鼠,2月龄KI小鼠小脑浦肯野细胞数目、形态及荧光信号强度无明显变化,树突长度及分支未见明显减少;15C-15D:相较于12月龄WT小鼠,12月龄KI小鼠小脑浦肯野细胞数目明显减少,大多数浦肯野细胞形态不完整,荧光信号强度减弱,树突长度及分支明显减少。n=3。荧光显微镜下图A-D放大倍数为200×;
图16是本发明小鼠小脑组织HE染色结果图;其中,16A:12月龄WT小鼠小脑浦肯野细胞层,浦肯野细胞形态完好,核膜、核仁清晰可见;16B:12月龄KI小鼠小脑浦肯野细胞层,浦肯野细胞细胞核出现核固缩,胞浆浓缩呈深染状态,部分细胞未见细胞核。n=3。箭头标注的为浦肯野细胞。光镜下放大倍数均为200×;
图17是本发明2月龄KI小鼠小脑及脑干ataxin-3免疫组化结果图;其中,17A为2月龄KI小鼠脑桥神经元;17B为2月龄KI小鼠小脑浦肯野细胞。箭头所指为核内ataxin-3蛋白点状聚集。n=3。光镜下放大倍数均为1000×;
图18是本发明12月龄KI小鼠脑组织ataxin-3免疫组化结果图;其中,18A-18B:相较于12月龄WT小鼠,12月龄KI小鼠大脑皮层有少量包涵体形成;18C-18D:相较于12月龄WT小鼠,12月龄KI小鼠小脑有大量包涵体形成;18E-18F:相较于12月龄WT小鼠,12月龄KI小鼠脑干有大量包涵体形成;18G-18H:相较于12月龄WT小鼠,12月龄KI小鼠大脑皮层有少量包涵体形成;18I-18J:12月龄WT小鼠和KI小鼠纹状体均未见明显包涵体形成。箭头所指为包涵体(为突出显示效果,实验未用苏木素染色细胞核)。n=3。光镜下放大倍数为400×;
图19是本发明不同月龄小鼠脑组织ataxin-3免疫荧光结果图;其中,19A:2月龄WT小鼠脑桥神经元细胞核内未发现明显聚集物形成;19B:2月龄KI小鼠脑桥神经元细胞核内有少量点状突变型ataxin-3蛋白聚集;19C:12月龄WT小鼠的ataxin-3蛋白主要在神经元细胞质中广泛表达,而细胞核内少有聚集物形成;19D:12月KI小鼠脑干神经元细胞核的核仁周围有明显的突变型ataxin-3蛋白呈现团状聚集,而细胞质中也发现有少量聚集物形成。箭头所指为核内包涵体。n=3。荧光显微镜下放大倍数均为630×;
图20是本发明12月龄小鼠7.0T动物磁共振影像结果图;其中,20A:12月龄WT小鼠矢状位扫描图;20B:12月龄KI小鼠矢状位扫描图;20C:12月龄WT小鼠冠状位扫描图;20D:12月KI小鼠冠状位扫描图。n=4;
图21是本发明12月龄KI小鼠各脑区体积对比结果图。其中,21A:12月龄KI小鼠各脑区矢状面、冠状面、横断面体积对比可视化图;21B:12月龄KI小鼠和WT小鼠不同脑区体积比较。n=4。*表示FDR校正后p<0.05。
具体实施方式
以下结合附图和实施例对本专利申请进行进一步的说明。
本申请主要技术路线如图1所示。
1.CRISPR/Cas9基因编辑
(1)CRISPR/Cas9基因编辑:本申请在小鼠Atxn3-201转录本(ENSMUST00000021606.11)的翻译起始密码子位点插入下述合成好ATXN3-96Q-CDS序列,并加上外源转录终止信号PolyA尾,因此小鼠基因转录本被破坏而表达敲入的人源基因(图2)。
(2)目的基因序列及重组质粒的合成:本申请在人源ATXN3基因的CDS中插入了96次CAG三核苷酸重复序列(划线部分),并在CDS序列两端加上了NotI酶切位点(斜体部分),合成的目的基因片段共1386bp,序列如下(SEQ ID NO.1):
GCGGCCGCATGGAGTCCATCTTCCACGAGAAACAAGAAGGCTCACTTTGTGCTCAACATTGCCTGAATAACTTATTGCAAGGAGAATATTTTAGCCCTGTGGAATTATCCTCAATTGCACATCAGCTGGATGAGGAGGAGAGGATGAGAATGGCAGAAGGAGGAGTTACTAGTGAAGATTATCGCACGTTTTTACAGCAGCCTTCTGGAAATATGGATGACAGTGGTTTTTTCTCTATTCAGGTTATAAGCAATGCCTTGAAAGTTTGGGGTTTAGAACTAATCCTGTTCAACAGTCCAGAGTATCAGAGGCTCAGGATCGATCCTATAAATGAAAGATCATTTATATGCAATTATAAGGAACACTGGTTTACAGTTAGAAAATTAGGAAAACAGTGGTTTAACTTGAATTCTCTCTTGACGGGTCCAGAATTAATATCAGATACATATCTTGCACTTTTCTTGGCTCAATTACAACAGGAAGGTTATTCTATATTTGTCGTTAAGGGTGATCTGCCAGATTGCGAAGCTGACCAACTCCTGCAGATGATTAGGGTCCAACAGATGCATCGACCAAAACTTATTGGAGAAGAATTAGCACAACTAAAAGAGCAAAGAGTCCATAAAACAGACCTGGAACGAGTGTTAGAAGCAAATGATGGCTCAGGAATGTTAGACGAAGATGAGGAGGATTTGCAGAGGGCTCTGGCACTAAGTCGCCAAGAAATTGACATGGAAGATGAGGAAGCAGATCTCCGCAGGGCTATTCAGCTAAGTATGCAAGGTAGTTCCAGAAACATATCTCAAGATATGACACAGACATCAGGTACAAATCTTACTTCAGAAGAGCTTCGGAAGAGACGAGAAGCCTACTTTGAAAAACAGCAGCAAAAGCAGCAA
AGCAGCAGCAGCAGCAGCAGCAGCAGCAGCAGCAGCAGCAGCAGCAGC
AGCAGCAGCAGCAGCAGCAGCAGCAGCAGCAGCAGCAGCAGCAGCAGC
AGCAGCAGCAG
GCCAGCCACCAGTTCAGGAGCACTTGGGAGTGATCTAGGTGATGCTATG
AGTGAAGAAGACATGCTTCAGGCAGCTGTGACCATGTCTTTAGAAACTG
TCAGAAATGATTTGAAAACAGAAGGAAAAAAATAACTGTAAGTCTGCAG
AAATTGGCGGCCGC
再将以上合成好的目的基因序列导入含氨苄抗性的pcDNA3.1(+)质粒载体,构建重组质粒;将重组质粒转化到感受态细胞中,通过氨苄抗性和目的片段测序挑选单克隆菌落,摇菌培养后提取并纯化该重组质粒。对重组质粒摇菌培养后提取质粒DNA进行Sanger测序和毛细管电泳,结果均显示该重组质粒含96次CAG重复序列(图3A)。将重组质粒瞬时转染HEK293T细胞,Western Blot结果显示重组质粒可以表达突变型ataxin-3蛋白(图3B)。体外验证后将该重组质粒将其作为donor载体。
(3)gRNA的设计及合成:针对目的基因ATXN3序列,本申请使用CRISPR Design在线设计工具(http://crispr.mit.edu/)设计一对长度为20bp的gRNA(江苏集萃药康生物科技股份有限公司),检测其活性并进行体外转录合成。
5’端和3’端的两条gRNA序列:
5’端的gRNA序列:ACTCACTTTCTCGTGGAAGA(SEQ ID NO.2)
3’端的gRNA序列:CGCCCACACTCACTTTCTCG(SEQ ID NO.3)
(4)Cas9/gRNA/donor的显微注射:针对以上基因编辑策略,本申请在体外细胞转染验证重组质粒序列可以表达目的蛋白后,本申请以该重组质粒构建CRISPR/Cas9的同源重组donor载体,通过测序验证了载体序列的正确性。将Cas9、gRNA及donor载体显微注射到小鼠受精卵中进行同源重组,并将受精卵移植到假孕雌鼠体内,待其怀孕产仔,等待F0代首建鼠出生。
2.F0代KI小鼠基因型鉴定
用苯酚氯仿沉淀法提取子代小鼠基因组DNA,进行聚合酶链式反应(PolymeraseChain Reaction,PCR)和测序鉴定。
根据目的基因敲入位置,针对CAG重复序列的两端和敲入序列全长设计了以下两种引物(表1)。对成功提取的鼠尾DNA进行PCR扩增,所有操作均在冰上完成,配制25μl反应体系,依次向各PCR管加入金牌Mix 22μL、引物F1和R1各1μL、小鼠DNA 1μL,吹打混匀,点离;将PCR管放于PCR仪中,根据表2设置PCR反应条件;待反应结束后将产物于4℃保存。扩增反应体系及循环条件如下(表2)。
表1KI小鼠鉴定引物序列
表2PCR反应条件
本申请获得了5只阳性F0代首建鼠。琼脂糖凝胶电泳显示5只KI小鼠的PCR产物均有500bp左右的条带,而WT小鼠无此条带(图4)。
本申请对PCR产物进行Sanger测序,由擎科公司协助完成,使用SnapGene软件分析测序结果,鼠尾DNA的Sanger测序结果与质粒DNA的Sanger测序结果一致,均显示CAG重复序列拷贝数为96次。本申请还通过毛细管电泳计算小鼠PCR扩增目的基因片段中ATXN3基因CAG重复次数,毛细管电泳由上海生工生物科技公司协助完成,用Gene Marker软件分析电泳结果计算CAG重复序列拷贝数。KI小鼠的毛细管电泳结果均显示CAG重复序列拷贝数为96次,证明在DNA鉴定层面该小鼠模型构建成功(图5)。
3.Western Blot检测KI小鼠鼠脑突变型atxin-3蛋白表达
取1月龄的KI小鼠与WT小鼠,分别提取其大脑、小脑、脑干的蛋白,分别用抗ataxin-3抗体(sigma公司,货号MAB5360)和抗polyQ抗体(sigma公司,货号MAB1574)检测ataxin-3蛋白的表达情况。Western Blot结果显示在1月龄的KI小鼠大脑、小脑、脑干中均能表达突变型ataxin-3蛋白,而WT小鼠仅表达野生型ataxin-3蛋白(图6),证明在目的致病蛋白表达层面该小鼠模型构建成功。
4.KI小鼠行为学改变
本申请中所有实验小鼠均为年龄匹配的雄鼠,分为KI-96Q小鼠和WT小鼠,每组各8只。同月龄批次的小鼠之间年龄差距不超过2周。分别在两组小鼠的2、4、6、8、10、12月龄六个年龄段分组进行连续的行为学实验。所有行为学实验均在中南大学实验动物学部的行为学实验室完成,实验全程严格遵守实验动物伦理学要求。
实验环境需要保证安静、干净整洁、温度适中。所有小鼠尽量在相似的时间段测试;实验训练及正式测试前,需要将实验小鼠提前适应实验环境1小时。每次实验间隔中间需要用酒精擦拭仪器以避免干扰小鼠测试。
使用Shapiro-Wilktest方法进行正态性检验,使用Levene’s test方法进行方差齐性检验。两组均值之间的比较采用独立样本t检验。多重比较采用FDR校正。采用SPSS22.0及GraphPad Prism 8软件进行分析,p<0.05认为具有统计学意义。
(1)小鼠转棒实验结果
本申请所用设备为小鼠转棒式疲劳仪(型号YLS-4C),转棒直径为30mm,通过检测小鼠在转棒上停留的时间,评估小鼠的运动平衡和协调能力。先对小鼠连续训练三天,中间不能间断,三天的训练转速分别为10rpm、20rpm、30rpm,训练时长为300s,中途若小鼠掉落,则需要将其重新放回转棒继续训练,保证每只小鼠训练时间满300s。每只小鼠训练每种转速3次,每次间隔30min。注意需要将小鼠背对实验人员放在转棒仪上,每次开始前先让小鼠在转棒静止的状态下适应20-30s,然后再启动转棒仪。第四天开始正式测试,测试转速为40rpm,记录每只小鼠在转棒上运动持续的时间,最长计时为300s,超过则停止转棒仪并记录时间为300s。每只小鼠训练或正式测试3次,每次间隔30min。取正式测试时的三次时长平均值记作该小鼠的最终转棒实验结果。
根据小鼠训练情况,本申请在40rpm转棒速度下对KI小鼠和WT小鼠进行转棒实验测试。发现不同的小鼠体重可能会影响转棒实验结果,因此将小鼠体重纳入为协变量进行统计分析。结果显示,2月龄和4月龄的KI小鼠转棒停留时间均少于WT小鼠,但差异没有统计学意义。而6月龄、8月龄、10月龄、12月龄的KI小鼠转棒停留时间均明显少于WT小鼠,并且均有统计学意义(p<0.05)(图7,A-F)。转棒实验结果表明,该小鼠模型从6月龄起出现明显的运动功能减退,并且随小鼠年龄增长表型有进展趋势(图7G)。
(2)小鼠平衡木实验结果
本测试实验装置由平衡木、支架和暗箱三部分组成,支架高度为50cm,平衡木长度为100cm,有4种宽度,分别为宽3cm、宽2cm、宽1cm、宽0.5cm。暗箱放于平衡木终端平台上,是一个黑色不透明箱体,在连接平衡木的一侧留了小门以便小鼠进入。
实验时先将小鼠轻轻放于平衡木的一端,小鼠会自发爬向暗箱一端,记录小鼠通过100cm平衡木的时间。正式测试前需要提前训练3天,使小鼠可以自发地、无间断地从平衡木一端稳定匀速爬向另一端的暗箱,每种宽度平衡木训练3次,每次休息间隔30min,第四天正式测试。每次训练或正式测试前,可将小鼠放置于暗箱适应10min。
正式测试时,轻轻提起小鼠尾巴将其稳定放置在平衡木一端并开始计时,小鼠头部越过暗箱小门时终止计时。每只小鼠均重复测试三次,每次测试间休息30min。取三次测试结果平均值作为该小鼠的最终平衡木实验结果。
本申请采用3cm、2cm、1cm、0.5cm等4种宽度的平衡木进行测试。不同的小鼠体重可能会影响平衡木实验结果,因此将小鼠体重纳入为协变量进行统计分析。本申请发现该小鼠模型最早的行为学改变是2月龄KI小鼠通过0.5cm宽度平衡木的时间显著大于WT小鼠(p<0.05)。6月龄、8月龄、10月龄、12月龄的KI小鼠通过0.5cm宽度平衡木的时间均显著大于年龄匹配的WT小鼠,均有统计学意义(p<0.05)。此外,12月龄KI小鼠通过1cm宽度平衡木的时间大于WT小鼠(p<0.05)(图8)。对比不同宽度平衡木实验结果,发现在3cm和2cm这两种宽度的平衡木测试中,随小鼠年龄增长,通过平衡木的时间有缩短的趋势;然而在1cm和0.5cm这两种宽度的平衡木测试中,随小鼠年龄增长,通过平衡木的时间有增长的趋势。经过训练后,应用1cm和0.5cm宽度的平衡木更能检测出KI小鼠平衡能力失调的表型(图9)。
(3)小鼠抓力实验结果
使用Ugo Basile抓力测量仪测试小鼠前肢抓力。将连有传感器的金属网格与抓力仪连接,让小鼠前肢抓住金属网格,缓慢加力往后水平拉动鼠尾,直至小鼠前肢被拉离网格,此时抓力仪将记录向后拉动小鼠过程中施加的最大力。测量10次,每次休息10min,取每只小鼠的最大抓力峰值做统计。
结果显示,2月龄、4月龄、6月龄的KI小鼠前肢最大抓力均小于WT小鼠,但均没有统计学意义(p>0.05)(图10)
(4)小鼠足迹实验结果
在足迹实验中,准备一个封闭的开放式跑道(100cm长,6cm宽,10cm高);把宣纸放在跑道上,调节纸的位置以适合跑道宽度。
取出小鼠,适应实验场所环境半小时以上;用墨水把小鼠前爪涂成红色、后爪涂成蓝色,使颜色覆盖脚掌垫,随后立即将小鼠放在跑道的纸张末端,让小鼠在纸上爬向另一侧;将小鼠放在干净的笼子里洗去墨水;从跑道上取下纸,晾干脚印图案。
测量以下数据:(1)前肢纵向步距;(2)后肢纵向步距;(3)前肢横向步距;(4)后肢横向步距;(5)左侧前后脚掌重叠步距;(6)前肢单步步距;(7)后肢单步步距。均连续测量6步,尽量选取跑道中间位置的足迹,排除开始及结束时的足迹。每种步距各取平均值进行统计分析。
与WT小鼠对比,12月龄KI小鼠足迹表现出显著改变,表现为后肢纵向步距缩短,两后肢之间的步基增宽,单侧前后脚掌重叠差距增大(p<0.05)(图11)。此外,KI小鼠最早在2月龄即已出现前后脚掌重叠差距增大(p<0.01)(表3)。
表3小鼠足迹实验数据表
p值代表两组间差异的显著性。n=8。*表示p<0.05,**表示p<0.01。
(5)小鼠抱肢实验结果
抱肢实验可以用于测试运动功能障碍。轻轻拉住每只小鼠的尾巴将其倒挂悬吊30s来观察有无抱肢反应。正常的小鼠将试图通过扭动身体和踢爪子来逃避控制实验者控制,不会表现出抱肢反应;而运动功能障碍的小鼠将出现肢体收缩,并抱向腹部。
轻轻拉住小鼠尾巴将其倒挂30s来观察有无抱肢反应。结果发现8月龄和10月龄的KI小鼠偶有出现单侧后肢收缩靠近躯干的情况,但持续时间均没有超过3s。悬挂WT小鼠时其双侧后肢仍旧呈展开状,呈正常逃跑反应(图12A)。而12月龄KI小鼠出现单侧后肢收缩靠近躯干的现象明显增加,并且出现了双侧后肢收缩抱向腹部(图12B),且持续时间大于3s。
(6)小鼠旷场实验结果
将小鼠放入40cm×40cm的旷场实验箱中自由活动5min,通过Smart系统记录并分析小鼠自发活动轨迹(图13A-B)。结果发现,12月龄KI小鼠总活动路程和平均运动速度均小于WT小鼠(图13C-D)。
(7)小鼠体重变化结果
从小鼠出生2周后开始连续每周测量小鼠体重,每次称重的时间都在同一时间段。连续观察WT小鼠和KI小鼠体重变化,发现10月龄之前的KI小鼠和WT小鼠体重没有明显差异,但从第10月开始,KI小鼠体重有下降趋势,但尚无统计学差异(p>0.05)(图14)。
5.KI小鼠神经病理改变
(1)免疫荧光显示小脑浦肯野细胞及分子层变化
Cabindin 28k抗体(abcam公司,货号C9848)是小脑浦肯野细胞的特异性标记抗体。本申请应用该抗体对2月龄和12月龄的WT及KI小鼠小脑组织切片进行免疫荧光染色,观察小脑浦肯野细胞和分子层厚度变化。结果发现,相较于2月龄WT小鼠,2月龄KI小鼠的浦肯野细胞数目、形态及荧光信号强度无明显变化,树突长度及分支未见明显减少(图15A-15B)。而相较于12月龄WT小鼠,12月龄KI小鼠的浦肯野细胞数目明显减少,大多数浦肯野细胞形态不完整,荧光信号强度减弱,树突长度及分支明显减少(图15C-15D)。
(2)HE染色显示小脑浦肯野细胞形态改变
本申请对12月龄WT小鼠及KI小鼠的小脑组织切片进行了苏木精-伊红染色(hematoxylin-eosin staining,HE)染色。结果显示,12月龄WT小鼠浦肯野细胞形态完好,核膜、核仁清晰可见(图16A);而12月龄KI小鼠的浦肯野细胞细胞核出现核固缩,胞浆浓缩呈深染状态,部分细胞未见细胞核(图16B)。
(3)免疫组化显示KI小鼠脑组织中包涵体形成
本申请用抗ataxin-3抗体(sigma公司,货号MAB5360)对2月龄和12月龄的WT小鼠及KI小鼠的脑组织石蜡切片进行免疫组化,观察小鼠脑组织不同部位(大脑皮层、小脑、脑干、海马、纹状体)是否有包涵体形成。结果显示,最早在2月龄KI小鼠的小脑和脑干切片中,可观察到小脑浦肯野细胞和脑桥神经元中包涵体的出现,表现为细胞核内出现了深染的ataxin-3蛋白点状聚集物,而同月龄的WT小鼠的小脑和脑干切片中并无包涵体形成(图17)。
本申请发现,随着KI小鼠月龄增加,包涵体数目增多且体积增大。在12月龄的KI小鼠中观察到脑组织各部位包涵体的广泛形成,尤其是小脑、脑干部位有大量包涵体形成,镜下表现为深染的ataxin-3蛋白在细胞核团状聚集。大脑皮层和海马区也观察到少量包涵体,纹状体区未观察到包涵体。而在12月龄的WT小鼠切片中未观察到明显包涵体形成(图18)。
(4)免疫荧光显示包涵体的胞内定位
本申请用抗ataxin-3抗体(sigma公司,货号MAB5360)对2月龄和12月龄WT及KI小鼠的脑干切片进行了免疫荧光染色,观察包涵体的细胞内定位。结果显示,在2月龄WT小鼠脑桥神经元胞质中ataxin-3蛋白有表达,但细胞核内未发现有聚集物形成(图19A);而2月龄KI小鼠脑桥神经元胞质中ataxin-3蛋白广泛表达,并且细胞核内有少量点状突变型ataxin-3蛋白聚集(图19B);在12月龄WT小鼠的ataxin-3蛋白主要在神经元细胞质中广泛表达,细胞核内少有聚集物形成(图19C);而在12月龄KI小鼠脑桥神经元胞质中ataxin-3蛋白广泛表达,并且细胞核内核仁周围有明显的突变型ataxin-3蛋白呈现团状聚集,而在细胞质中也发现有少量聚集物形成(图19D)。
6.KI小鼠影像学改变
本申请使用Bruker 7.0T动物磁共振(Bruker Biospec 70/30,Germany)分别对12月龄KI小鼠和WT小鼠的头部进行矢状位和冠状位的T
利用基于MATLAB的SPM12(Statistical Parametric Mapping)工具包进行基于体素的形态测量学分析(voxel-based morphometry,VBM),计算关键脑区的体积并进行可视化比较(图21A)。将全脑体积纳入为协变量,FDR校正后取p<0.05为差异有统计学意义。结果发现相较于WT小鼠,12月龄的KI小鼠全脑体积减少,并且大脑、小脑、脑干体积均有减少,其中小脑、脑桥体积减少有统计学差异(p<0.05,FDR校正),同时伴有第四脑室扩大(p<0.05,FDR校正)。除此之外,还有苍白球、下丘脑、杏仁核、梨状区等脑区体积减少(p<0.05,FDR校正)(图21B)。
- 上电复位电路和包括上电复位电路的集成电路
- 上电复位电路、上电复位方法及集成电路
