一种诱导多能干细胞定向分化制备胰岛β细胞的培养液
文献发布时间:2023-06-19 11:26:00
技术领域
本发明属于细胞工程技术领域,具体来说是一种诱导多能干细胞定向分化制备胰岛β细胞的培养液。
背景技术
糖尿病(DiabetesMellitus,DM)是一种以血糖增高为临床特征的代谢障碍性疾病,其主要发病机制为胰岛素的分泌减少及其利用障碍。目前,糖尿病已成为继肿瘤、心脑血管后的第三大威胁人类健康和影响人们生活质量的疾病。世界卫生组织(WHO)在2016年的最新报告显示,全球已有4.22亿人患有糖尿病,而中国糖尿病患者数量超过1亿人,居全球之首。
糖尿病有两种类型:一型糖尿病(T1D),占疾病数量的5~10%,是一种胰岛β细胞被选择性破坏而导致的自身免疫疾病;二型糖尿病(T2D),占疾病数量的90%以上,是由于外周器官包括肝脏、脂肪和肌肉对胰岛素抵抗而产生的疾病。糖尿病人表现为体内胰岛素产生细胞--胰岛β细胞的缺失或胰岛素的利用降低,目前治疗手段皆为外源注射胰岛素以控制体内血糖平衡。虽然这种方法可以有效地控制疾病发展,但长期注射胰岛素不能稳定的维持体内血糖生理平衡而导致一些高风险疾病和并发症的发生。如低血糖和高血糖等并发症引起的血管病变会引起一些心血管、肾脏或神经疾病。因此,需要一种可以减少甚至消除长期并发症的治疗策略用于糖尿病的治疗。
一种可行的方法为将人类胰岛移植入病人体内进行糖尿病的治疗。这种方法可以很好地控制人体内血糖平衡,免除长期胰岛素注射的依赖和痛苦,并进而提高整体生活质量。然而,受限于供体胰岛的缺乏、供体-受体间胰岛的免疫排斥以及胰岛准备等方面的可变性,使得胰岛移植治疗糖尿病的方案不能普遍适用。因此,目前研究集中在可以获得大量产生胰岛素分泌细胞的替代方案。
其中一种方法为使用胚胎干细胞(hESCs)直接分化为胰岛素分泌细胞。但由于受到伦理道德的限制,目前可应用的胚胎干细胞系有限,更不适于应用到未来的临床细胞治疗中。后来的研究主要集中在使用其它类型的多能干细胞分化为胰腺内分泌细胞,表现为联合使用信号分子及其相关抑制剂/激动剂来实现的,一般按照6-7个连续分化阶段进行分化,分别是:定型内胚层(DE)、原始胚肠管(PrimitiveGutTube)、后前肠(PosteriorForegut)、胰腺内胚层(PE)、内分泌前体细胞(EP)和β样早期细胞,并进一步分化为成熟胰岛β样细胞。但这样的分化方法产生的仍为不成熟的β细胞,其表达的激素有限且不稳定、类型多样而胰岛素含量有限,不能用于移植治疗糖尿病患者。
综上,由于胰岛素注射会导致多种并发症,胰岛移植来源受限以及原有的胰岛β细胞分化方案不成熟、数量少或不具有GSIS功能等限制,使得糖尿病治疗受到很大的限制,新的胰岛β细胞分化方法和新的糖尿病治疗策略急需解决。
发明内容
1.发明要解决的技术问题
本发明的目的在于解决现有的胰岛β细胞分化产生的胰岛β细胞数量少且功能不完善的问题。
2.技术方案
为达到上述目的,本发明提供的技术方案为:
本发明的一种诱导多能干细胞定向分化制备胰岛β细胞的培养液,培养液包括AdvancedDMEM/F12培养基、葡萄糖、碳酸氢钠、人血清白蛋白(HSA)、N2、B27、谷氨酰胺、维生素C、JNK抑制剂、hedgehog通路拮抗剂、EGF信号因子、FGF信号因子、TGF-β抑制剂、WNT信号通路激活剂、Notch信号通路抑制剂、小分子化合物和微量元素,所述培养液在细胞培养的不同阶段的配比不同。
优选的,所述JNK抑制剂为CC-930,hedgehog通路拮抗剂为N-乙酰半胱氨酸或环巴胺,EGF信号因子为EGF,FGF信号因子为FGF10,TGF-β超家族因子为ActivinA,TGF-β抑制剂为ALK5iII,WNT信号通路激活剂为BML-284或WNT3a,Notch信号通路抑制剂为FLI-06或DAPT。
优选的,所述小分子化合物包括角蛋白生长因子、蛋白激酶C激活剂、ROCK1抑制剂、Sirt1抑制剂、C-Met抑制剂、甲状腺激素和视黄酸(RetinoicAcid)。
优选的,所述角蛋白生长因子为KGF,蛋白激酶C激活剂为TPB,ROCK1抑制剂为Y27632,Sirt1抑制剂为Nicotinamide,C-Met抑制剂为BMS-777607,甲状腺激素为T3。
优选的,还包括ALK4/5/7抑制剂、CDK5抑制剂、L型钙离子通道(LTCC)激活剂和Hippo信号通路效应器抑制剂,所述ALK4/5/7抑制剂为A83-01、CDK5抑制剂为AT7519、L型钙离子通道(LTCC)激活剂为BayK8644、Hippo信号通路效应器抑制剂为Super-TDU1-31。
优选的,所述培养液在细胞培养的不同阶段的配比不同,具体可分为培养液A、培养液B、培养液C和培养液D,所述培养液A用于诱导多功能细胞球分化为定型内胚层细胞阶段,所述培养液B用于定型内胚层细胞分化为胰腺前体细胞阶段,所述培养液C用于胰腺前体细胞分化为胰腺内分泌祖细胞阶段,所述培养液D用于胰腺内分泌祖细胞分化为胰岛β细胞阶段。
优选的,所述培养液A包括AdvancedDMEM/F12培养基、葡萄糖、碳酸氢钠、人血清白蛋白(HSA)、N2、B27、谷氨酰胺、维生素C、TGF-β因子、WNT信号通路激活剂和JNK信号抑制剂,其中TGF-β因子的浓度为30-100ng/mL;WNT信号通路激活剂的浓度为1-5μM;JNK信号抑制剂浓度为0.5-5μM。
优选的,所述培养液B包括AdvancedDMEM/F12培养基、葡萄糖、碳酸氢钠、人血清白蛋白(HSA)、N2、B27、谷氨酰胺、维生素C、EGF信号因子、视黄酸、角蛋白生长因子、蛋白激酶C激活剂和Sirt1抑制剂,其中EGF信号因子的浓度为2-20ng/mL;视黄酸(RetinoicAcid)的浓度为1-5μM;角蛋白生长因子的浓度为20-40ng/mL;蛋白激酶C激活剂的浓度为100-300nM;Sirt1抑制剂的浓度为10-40μM。
优选的,所述培养液C包括AdvancedDMEM/F12培养基、葡萄糖、碳酸氢钠、人血清白蛋白(HSA)、N2、B27、谷氨酰胺、维生素C、TGF-β抑制剂、hedgehog信号通路抑制剂、Notch信号通路抑制剂、FGF信号因子和甲状腺激素;其中TGF-β抑制剂的浓度为5-20μM;hedgehog信号通路抑制剂的浓度为10-50ng/mL;Notch信号通路抑制剂的浓度为0.2-1μM;FGF信号因子浓度为5-50ng/ml;甲状腺激素的浓度为0.1-1μM。
优选的,所述培养液D包括AdvancedDMEM/F12培养基、葡萄糖、碳酸氢钠、人血清白蛋白(HSA)、N2、B27、谷氨酰胺、维生素C、TGF-β抑制剂、C-Met抑制剂和微量元素,其中TGF-β抑制剂的浓度为5-20μM;C-Met抑制剂的浓度为20-100nM。
上述培养液A~D中所述添加因子的浓度为可成功诱导分化为本阶段细胞类型的浓度范围,低于或高于本范围浓度的因子均不能成功或获得质量差的最终细胞(如诱导效率低、最终产物数量少及功能不齐全等)。
3.有益效果
采用本发明提供的技术方案,与现有技术相比,具有如下有益效果:
本发明的一种诱导多能干细胞定向分化制备胰岛β细胞的培养液,培养液包括AdvancedDMEM/F12培养基、葡萄糖、碳酸氢钠、人血清白蛋白(HSA)、N2、B27、谷氨酰胺、维生素C、JNK抑制剂、hedgehog通路拮抗剂、EGF信号因子、FGF信号因子、TGF-β抑制剂、WNT信号通路激活剂、Notch信号通路抑制剂、小分子化合物和微量元素,培养液在细胞培养的不同阶段的配比不同,各组分分阶段定向发挥作用,可以高效地诱导多能干细胞定向分化为胰岛β细胞。
附图说明
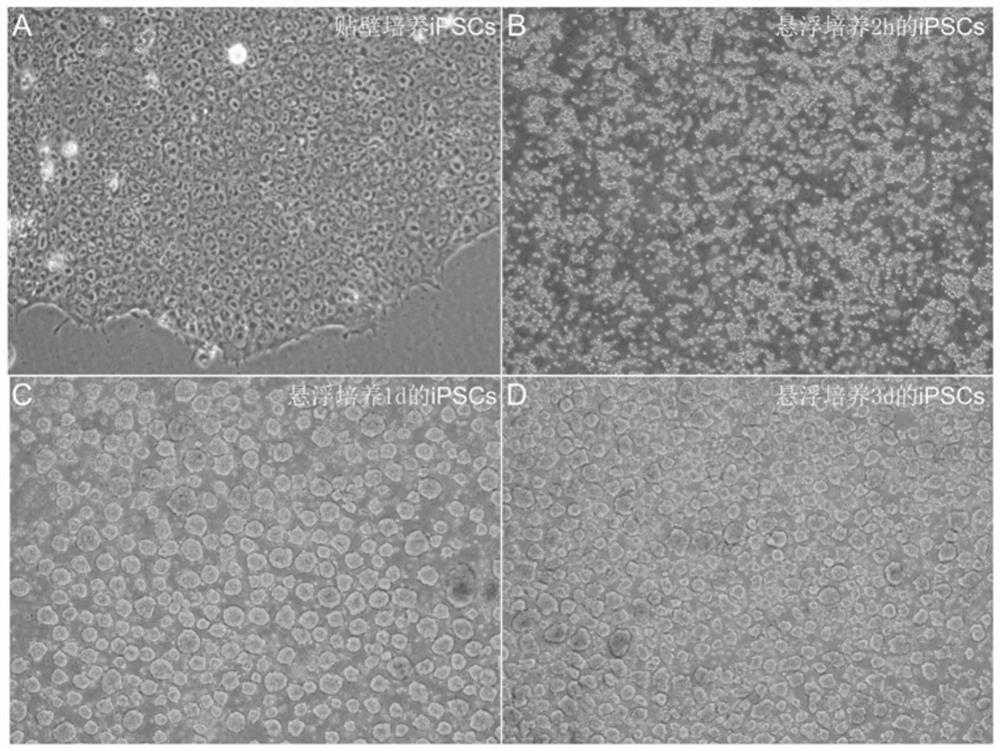
图1为诱导多功能干细胞(iPSCs)悬浮培养的显微镜照片;其中图1-A为正常iPSCs克隆(贴壁培养)图片,图1-B、C和D分别为悬浮培养2h、24h和72h后的细胞球形态(10×镜图片)。
图2为本发明培养得到的胰岛β细胞的显微镜照片;其中图2-A、B、C和D分别为使用实施例3中方法培养的四个阶段(DE阶段、PP阶段、EN阶段和胰岛β细胞阶段)的细胞球形态;而图2-A’~D’为使用实施例4中方法(添加*标记分子)培养的四个阶段的细胞球形态(4×镜图片)。
图3为本发明定向分化胰岛β细胞过程中关键阶段-DE细胞的特征性蛋白表达的鉴定,包括免疫荧光显微镜照片和流式细胞鉴定;其中图3-A~A”为DE阶段细胞球免疫荧光图片,包括DE标志性Marker-FOXA2和SOX17及合图;图3-B~B”为DE阶段单细胞免疫荧光图片;图3-C~C’为DE阶段细胞流式细胞术鉴定结果,包括FOXA2和SOX17两种Marker(以上免疫荧光图片均为20×镜拍摄)。
图4为本发明定向分化胰岛β细胞过程中关键阶段胰岛前体细胞(PP)的特征性蛋白表达的免疫荧光鉴定结果;其中图4-A~A”和图4-B~B”分别为PP阶段细胞球和单细胞的免疫荧光染色图片,包括PDX1、NKX6.1及合图(以上免疫荧光图片均为20×镜拍摄)。
图5为本发明定向分化的胰岛β细胞的特征性蛋白表达的鉴定及胰岛素释放功能检测;其中图5-A为胰岛β细胞标志性Marker(NKX6.1、C-peptide、insulin和MAFA)及胰岛α细胞Marker(Glucagon)的免疫荧光鉴定图片(20×镜拍摄);图5-B为胰岛β细胞的胰岛素含量(或分泌功能)Elisa检测结果(两次实验Exp-1和Exp-2);图5-C为胰岛β细胞对不同浓度葡萄糖刺激后的胰岛素分泌功能(GSIS)Elisa检测结果。
具体实施方式
为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述,附图中给出了本发明的若干实施例,但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例,相反地,提供这些实施例的目的是使对本发明的公开内容更加透彻全面。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同;本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在限制本发明;本文所使用的术语“及/或”包括一个或多个相关的所列项目的任意的和所有的组合。
实施例1
本实施例的一种诱导多能干细胞定向分化制备胰岛β细胞的培养液,培养液包括AdvancedDMEM/F12培养基、葡萄糖、碳酸氢钠、人血清白蛋白(HSA)、N2、B27、谷氨酰胺、维生素C、JNK抑制剂、hedgehog通路拮抗剂、EGF信号因子、FGF信号因子、TGF-β抑制剂、WNT信号通路激活剂、Notch信号通路抑制剂、小分子化合物和微量元素,所述培养液在细胞培养的不同阶段的配比不同。其中,AdvancedDMEM/F12培养基作为基础培养基,添加营养成分包括葡萄糖(0.4-1g/L)、碳酸氢钠(1.23g/L)、HSA(1~5g/L)、N2(1×)、B27(1×)、谷氨酰胺(1×)、维生素C(0.1~0.5mM)。
所述JNK抑制剂为CC-930,hedgehog通路拮抗剂为N-乙酰半胱氨酸或环巴胺,EGF信号因子为EGF,FGF信号因子为FGF10,TGF-β超家族因子为ActivinA,TGF-β抑制剂为ALK5iII,WNT信号通路激活剂为BML-284或WNT3a,Notch信号通路抑制剂为FLI-06或DAPT。
所述小分子化合物包括角蛋白生长因子、蛋白激酶C激活剂、ROCK1抑制剂、Sirt1抑制剂、C-Met抑制剂、甲状腺激素和视黄酸(RetinoicAcid)。
所述角蛋白生长因子为KGF,蛋白激酶C激活剂为TPB,ROCK1抑制剂为Y27632,Sirt1抑制剂为Nicotinamide,C-Met抑制剂为BMS-777607,甲状腺激素为T3。
还包括ALK4/5/7抑制剂、CDK5抑制剂、L型钙离子通道(LTCC)激活剂和Hippo信号通路效应器抑制剂,所述ALK4/5/7抑制剂为A83-01、CDK5抑制剂为AT7519、L型钙离子通道(LTCC)激活剂为BayK8644、Hippo信号通路效应器抑制剂为Super-TDU1-31。
所述培养液中的各组分可分阶段协同诱导iPSCs细胞定向分化为胰岛β细胞。其中,Advanced DMEM/F12培养基、葡萄糖、人血清白蛋白(HSA)、N2、B27和谷氨酰胺作为各分化阶段的必须成分,为细胞的长期存活、增殖提高丰富的营养。
所述TGF-β超家族因子为Activin A,WNT信号通路激活剂为BML-284或WNT3a,是内胚层谱系细胞特异性分化的关键因子;JNK信号通路抑制剂CC-930能增强Activin A和WNT3a的作用,可显著促进多能干细胞向内胚层的高效分化;视黄酸(RA)可以促进向PDX1
所述培养液在细胞培养的不同阶段的配比不同,具体可分为培养液A、培养液B、培养液C和培养液D,所述培养液A用于诱导多功能细胞球分化为定型内胚层细胞阶段,所述培养液B用于定型内胚层细胞分化为胰腺前体细胞阶段,所述培养液C用于胰腺前体细胞分化为胰腺内分泌祖细胞阶段,所述培养液D用于胰腺内分泌祖细胞分化为胰岛β细胞阶段。
所述培养液A包括AdvancedDMEM/F12培养基、葡萄糖、碳酸氢钠、人血清白蛋白(HSA)、N2、B27、谷氨酰胺、维生素C、TGF-β因子、WNT信号通路激活剂和JNK信号抑制剂,其中TGF-β因子的浓度为30-100ng/mL,优选50ng/mL;WNT信号通路激活剂的浓度为1-5μM,优选3μM;JNK信号抑制剂浓度为0.5-5μM,优选1μM。
所述培养液B包括AdvancedDMEM/F12培养基、葡萄糖、碳酸氢钠、人血清白蛋白(HSA)、N2、B27、谷氨酰胺、维生素C、EGF信号因子、视黄酸、角蛋白生长因子、蛋白激酶C激活剂和Sirt1抑制剂,其中EGF信号因子的浓度为2-20ng/mL,优选10ng/mL;视黄酸(RetinoicAcid)的浓度为1-5μM;角蛋白生长因子的浓度为20-40ng/mL,优选30ng/mL;蛋白激酶C激活剂的浓度为100-300nM,优选200nM;Sirt1抑制剂的浓度为10-40μM,优选20μM。
培养液B还包括ALK4/5/7抑制剂,ALK4/5/7抑制剂的浓度为10~50nM,优选20nM。所述ALK4/5/7抑制剂为A83-01,其可以选择性抑制TGF-β活化素受体ALK4、I型受体ALK5和节点受体ALK7,也可以抑制上皮细胞向间质细胞的转化,具有促进胰腺谱系细胞特异性分化和胰腺前体细胞扩增的功能。
所述培养液C包括AdvancedDMEM/F12培养基、葡萄糖、碳酸氢钠、人血清白蛋白(HSA)、N2、B27、谷氨酰胺、维生素C、TGF-β抑制剂、hedgehog信号通路抑制剂、Notch信号通路抑制剂、FGF信号因子和甲状腺激素;其中TGF-β抑制剂的浓度为5-20μM,优选10μM;hedgehog信号通路抑制剂的浓度为10-50ng/mL,优选30ng/mL;Notch信号通路抑制剂的浓度为0.2-1μM,优选0.5μM;FGF信号因子浓度为5-50ng/ml,优选10ng/ml;甲状腺激素的浓度为0.1-1μM,优选0.5μM。
培养液C还包括CDK5抑制剂,CDK5抑制剂的浓度为5~30nM,优选15nM。所述CDK5抑制剂为AT7519,其具有双重功效:首先,CDK5的激活因子P35和P39在胰脏细胞中有表达,对胰岛β细胞的成熟起调控作用,其次,AT7519还具有GSK3β抑制功能,可以激活WNT信号通路促进细胞分化,另外,CDK5抑制剂的作用在Notch信号抑制剂存在的前提下可以增强。
所述培养液D包括AdvancedDMEM/F12培养基、葡萄糖、碳酸氢钠、人血清白蛋白(HSA)、N2、B27、谷氨酰胺、维生素C、TGF-β抑制剂、C-Met抑制剂和微量元素,其中TGF-β抑制剂的浓度为5-20μM,优选10nM;C-Met抑制剂的浓度为20-100nM,优选50nM。
培养液D还包括L型钙离子通道(LTCC)激活剂和Hippo信号通路效应器抑制剂;其中,L型钙离子通道(LTCC)激活剂的浓度为10~30nM,优选20nM;Hippo信号通路效应器抑制剂的浓度为0.2~0.6μM,优选0.35μM。所述L型钙离子通道(LTCC)激活剂为BayK8644,其可以激活Ras信号,增强细胞周期,具有促进胰岛β细胞增殖的功能;所述Hippo信号通路效应器YAP抑制剂为Super-TDU1-31,它可以破坏YAP和TEADs转录因子之间相互作用,在促进内分泌细胞的分化和抑制增殖性前体细胞方面具有重要作用。
本实施例的培养液采用Advanced DMEM/F12培养基,并添加有一些维持细胞生长必须的关键成分如葡萄糖、碳酸氢钠、人血清白蛋白(HSA)、谷氨酰胺、维生素C等,以及包含JNK、hedgehog、EGF、FGF、TGF-β、WNT等信号通路的激动剂或拮抗剂,和一些必要的小分子化合物、微量元素等,各组分分阶段定向发挥作用,可以高效地诱导多能干细胞定向分化为胰岛β细胞。经所述方法,可在较短时间内将诱导多功能干细胞定向分化培养得到胰岛β细胞。首先,原材料数量不受限制,所述诱导多功能干细胞可以无限扩增,避免胚胎干细胞使用方面的道德争议;其次,培养胰岛β细胞的周期为三周左右,与现有的分化技术相比,大大提高了制备速度,降低了生产成本;第三,培养胰岛β细胞采用3D悬浮培养,与现有的贴壁(2D)培养技术相比,大大提高了分化后的细胞产量以及培养过程中由于试剂更换而造成的损耗;第四,培养胰岛β细胞过程中采用特定的信号通路抑制剂以及小分子化合物,可以大大提高胰岛β细胞的纯度和产量;第五,培养的胰岛β细胞选择性采用细胞分选或生物材料包裹技术,可以避免由于细胞纯度较低造成的治疗效果不佳,或者细胞移植后免疫排斥反应造成的安全隐患。
本实施例的诱导多能干细胞定向分化制备胰岛β细胞的培养液的使用方法如下:
S100、制备诱导多功能细胞球;
S200、一次分化,使用培养液A对诱导多功能细胞球进行定向分化培养获得定型内胚层细胞;
S300、二次分化,使用培养液B对定型内胚层细胞诱导分化获得胰腺前体细胞;
S400、三次分化,使用培养液C对胰腺前体细胞进行诱导分化获得胰腺内分泌祖细胞;
S500、四次分化,使用培养液D对胰腺内分泌祖细胞进行诱导分化获得所需胰岛β细胞。
步骤S100中制备诱导多功能细胞球具体为将贴壁培养的诱导多功能干细胞消化成细胞小块后,使用含ROCK1抑制剂的mTeSR-1完全培养基重悬,以0.2×10
步骤S200具体为将诱导多功能细胞球使用培养液A于37℃、5%CO
步骤S300具体为将定型内胚层细胞使用培养液B于37℃、5%CO
步骤S400具体为将胰腺前体细胞使用培养液C于37℃、5%CO
步骤S500具体为将胰腺内分泌祖细胞使用培养液D于37℃、5%CO
实施例2
本实施例的内容主要为胰岛β细胞分化培养液的配制,具体如下:
胰岛β细胞分化培养液分为四个阶段,阶段一(培养液A组成的DE诱导培养基)、阶段二(培养液B组成的PP诱导培养基)、阶段三(培养液C组成的EN诱导培养基)和阶段四(培养液D组成的胰岛β细胞诱导培养基),培养液成分均由基础培液组份(basal medium)和添加组份(supplement)构成,成分和比例如下表1~4:
表1 DE诱导培养基的成分及比例
表2 PP诱导培养基的成分及比例
备注:A83-01的添加可以显著提高细胞分化效率。
表3 EN诱导培养基的成分及比例
备注:AT7519的添加可以显著提高细胞分化效率。
表4胰岛β细胞诱导培养基的成分及比例
备注:BayK8644和Super-TDU1-31的添加可以显著提高细胞的分化效率。
实施例3
本实施例主要内容为利用3D悬浮培养方式培养诱导多功能干细胞,具体如下:
一、所需试剂
诱导多功能干细胞(iPSCs)培养所使用的培养液为mTeSR-1完全培养基,扩增传代所使用的的消化酶为EDTA,细胞润洗和平衡所使用的试剂为DPBS,促进细胞存活所使用的抑制剂为Y27632。
二、培养过程
将100mm-dish中贴壁培养的iPSCs弃去培养基并使用2mL DPBS润洗后,加4mLEDTA消化酶于37℃条件放置3~4min,待细胞间接触分离后弃掉消化酶,加12mL含终浓度为10μM Y7632的mTeSR-1完全培养基并将细胞吹打分离成细胞小块,每个细胞小块由10~30个细胞聚集。
分离的细胞小块平均转移至一块超低吸附的6孔板中,于37℃,5%氧气条件下培养24h至细胞成为规则的小球,然后转移至75或125mL spinner Flask中,以70~120rpm,优选100rpm转速进行3D悬浮培养。
三、细胞球形态观察
取100mm-dish置于无菌操作台,将培养1天或3天的悬浮细胞球使用10mL移液管转移至上述dish,轻轻摇晃dish使细胞球均匀分布,于EVOS显微镜下观察并拍照。
结果如图1所示:使用本方法可以获得数量庞大、形态均一的细胞球。
实施例4
本实施例的主要内容为利用诱导多功能干细胞定向分化培养胰岛β细胞,具体如下:
一、未分化细胞的培养
诱导多功能干细胞按照实施例2中方法获得3D悬浮细胞球,培养在125mL的spinner Flask中,每隔3-4天使用Accutase消化酶以单细胞形式传代,并使用含10μMY7632抑制剂的mTeSR-1完全培养基重悬,于37℃,5%CO
准备做胰岛β细胞分化时,将Accutase消化后的细胞以2~8×10
二、胰岛β细胞的定向分化培养
将培养3天的未分化iPSCs细胞球自然沉降3~5min,使用10mL移液管轻轻弃掉上层的mTeSR-1培养基和死亡细胞,并按照实施例1中各分化阶段诱导培养基(无*号标记的添加物)依次加入(30mL/Flask,培养基最好现用现配,若4℃保存则不超过7天,且使用前30分钟取出并平衡至室温),置于37℃,5%CO
三、胰岛β细胞球形态观察
取100mm-dish置于无菌操作台,将上述培养三周左右的胰岛β细胞球使用10mL移液管转移至dish中,轻轻摇晃dish使细胞球均匀分布,于EVOS显微镜下观察。
图2-A~D为使用实施例4中的分化方法培养的胰岛β细胞球(包括各阶段的细胞球形态),可知使用此方法可以获得形态较好的胰岛β细胞球。
实施例5
本实施例的主要内容为添加小分子化合物(提高分化效率)后的胰岛β细胞分化方法,具体如下:
使用实施例4中的胰岛β细胞分化方法,在分化的PP阶段、EN阶段和胰岛β细胞阶段的诱导培养基中,选择性添加小分子化合物A83-01、AT7519、BayK8644和Super-TDU1-31(*号标记),培养三周后对获得的胰岛β细胞的形态和数量进行比对。
结果如图2-A’~D’所示,添加小分子化合物后的诱导培养基可以获得数量更多的胰岛β细胞,且胰岛β细胞球的形态更加均一。
实施例6
本实施例的主要内容为通过免疫荧光法和流式细胞术对DE阶段细胞特征性蛋白表达的鉴定,具体如下:
使用实施例5中方法进行胰岛β细胞的定向分化,此过程中阶段一(DE细胞)的诱导是分化的起始和关键,DE细胞的鉴定采用如下免疫荧光法和流式细胞术进行。
a,免疫荧光法:
取培养至阶段一完成的细胞置于超低吸附24孔板,静置1min使细胞球沉入孔板底部;小心吸去上层培养液后,沿24孔板板壁缓缓加入1×PBS(pH7.4,下同,1mL/孔)洗2次;然后沿板壁缓慢加入37℃预温的4%PFA(多聚甲醛,0.5mL/孔),于室温放置18分钟固定细胞,轻柔地吸去PFA,加入1×PBS洗3次(1mL/孔/次)。
加入0.3%Triton×100(0.5mL/孔),于37℃孵育30分钟;然后加入5%的BSA(0.5mL/孔)封闭,于37℃孵育30分钟;接着直接向封闭液中加入一抗(SOX17和FOXA2),一抗加入量为10μL/孔,于37℃孵育1小时,加入1×PBS洗3次(1mL/孔/次)。
加入用1%BSA稀释(稀释比例1:1000)的二抗,二抗加入量为0.5mL/孔,37℃避光孵育60分钟后吸去二抗,加入1×PBS洗3次(1mL/孔/次),每次5分钟;然后加入用1×PBS配好的终浓度为1μg/mL的DAPI(0.5mL/孔),染色5分钟,吸去DAPI,加入1×PBS洗2次(1mL/孔/次);最后加入1×PBS(0.5mL/孔)重悬细胞球,显微镜下观察并拍照处理。
备注:除按上述方案进行细胞球免疫荧光染色外,还将细胞球使用Accutase消化为单细胞铺板在24孔板进行免疫荧光染色(更好地看清单细胞中各标志物的表达)。
b,流式细胞术:
取培养至阶段一完成的细胞球置于15mL离心管,自然沉降1~3min后弃去培液,并使用1mL DPBS润洗一次并弃掉;细胞球中加1~2mL Accutase或TrypLE消化液并置于37℃放置3~5分钟,将细胞球分离为单细胞;然后加2~3倍量DPBS稀释消化液,200~300g转速离心3分钟并弃掉消化液和DPBS。
细胞中加1mL 4%的多聚甲醛(PFA),于4℃固定30分钟后弃掉;然后加0.3%Triton×100(1mL)或其它staining buffer于4℃封闭和通透30分钟后弃掉;接着加入1mL封闭液配置的一抗(SOX17和FOXA2)4℃过夜。
第二天弃掉一抗,并加入1mL封闭液配置的二抗,置于4℃避光孵育2小时;最后进行流式细胞分析。
图3-A~B”和图3-C~C’分别为实施例5培养得到的DE细胞的免疫荧光和流式细胞鉴定结果,可知培养得到的DE细胞均具有很高的标志性分子表达。
实施例7
本实施例的主要内容为使用免疫荧光法对PP阶段细胞特征性蛋白表达的鉴定,具体如下:
将培养至阶段二的细胞(PP细胞)取出,按照实施例6中的免疫荧光法步骤,检测PP阶段细胞关键蛋白(PDX1和NKX6.1)的表达情况。
图4为实施例5培养得到的PP细胞的标志性Marker(PDX1和NKX6.1)免疫荧光鉴定结果,可知培养得到的PP细胞具有很高的标志性分子表达。
实施例8
本实施例的主要内容为使用免疫荧光法对胰岛β细胞特征性蛋白表达的鉴定,具体如下:
将培养至阶段四的细胞(胰岛β细胞)取出,按照实施例6中的免疫荧光法步骤,检测胰岛β细胞关键蛋白(NKX6.1、C-peptide、insulin)的表达情况。
图5-A为实施例5培养得到的胰岛β细胞的免疫荧光鉴定结果,可知培养得到的胰岛β细胞具有较高的标志性分子(NKX6.1、C-peptide、insulin和MAFA)表达。
实施例9
本实施例的主要内容为使用Elisa试剂盒对胰岛β细胞的胰岛素分泌功能进行检测,具体如下:
将阶段四培养7天的胰岛β细胞球(20~30个)使用5mL移液管收集于15mL离心管,细胞球自然沉降1~3分钟后弃掉上层培液。然后加入1mL含1.5%盐酸(HCL)的70%乙醇中,于-20℃放置24小时。24小时后轻轻震荡细胞球并再次放置24小时。
放置48小时后,将离心管置于离心机以2100rcf转速离心15分钟,收集1mL上层液体于新的15mL离心管中,并加1mL浓度为1M的TRIS(PH为7.5)中和。中和后的液体使用人胰岛素Elisa试剂盒检测胰岛素释放量。
图5-B为实施例5培养得到的胰岛β细胞的胰岛素释放检测结果,可知培养得到的胰岛β细胞具有较高的胰岛素释放量。
实施例10
本实施例的主要内容为使用Elisa试剂盒对胰岛β细胞的GSIS功能进行检测,具体如下:
试剂准备:Krb缓冲液由128mM NaCl、5mM KCl、2.7mM CaCl2、1.2mM MgCl2、1mMNa2HPO4、1.2mM KH2PO4、5mM NaHCO3、10mM HEPES和0.1%BSA利用去离子水配置;低浓度葡萄糖(2mM)和高浓度葡萄糖(20mM)由Krb缓冲液配置;30mM KCl由1M KCl水溶液和20mM的高浓度葡萄糖溶液配制;所有试剂配制完成后均经0.22μM滤膜过滤除菌。
GSIS功能验证:首先,将阶段四培养14天的胰岛β细胞球(20个)使用5mL移液管收集于15mL离心管,细胞球自然沉降1~3分钟后弃掉上层培液。然后,加入1mL Krb缓冲液润洗,并使用200μL低浓度(2mM)葡萄糖Krb溶液预孵育1小时用于移除残留的胰岛素。再次使用1mL Krb缓冲液润洗2次后,分别使用200μL低浓度(2mM)、高浓度(2mM)葡萄糖Krb溶液及KCl溶液孵育细胞球1小时(每次更换不同浓度的溶液时均使用Krb平衡液润洗,孵育结束时均收集上清液)。最后,收集200μL葡萄糖及KCl刺激后的上清液,使用胰岛素Elisa试剂盒检测胰岛β细胞对不同浓度葡萄糖刺激后的胰岛素释放(GSIS)含量。
图5-C为实施例5培养得到的胰岛β细胞的GSIS检测结果,可知培养得到的胰岛β细胞对不同浓度的葡萄糖刺激具有不同程度的胰岛素释放量,随葡萄糖含量升高刺激β细胞所释放的胰岛素含量也升高,并且在KCl刺激后含量达到最高。
从实施例4~10的鉴定结果可以看出,使用本发明的培养液和培养方法,由诱导多功能干细胞定向分化培养得到的细胞不仅具有胰岛β细胞特征性蛋白如PDX1、NKX6.1、C-Peptide和Insulin的表达,还具有很高的产量和纯度,并且具有葡萄糖刺激--胰岛素释放(GSIS)功能,表明其为成熟且有功能的胰岛β细胞。
本发明的培养液,使得经3D悬浮培养的诱导多功能干细胞定向分化为胰岛β细胞,与其它分化方法相比,具有以下优点:一,原料数量不受限,诱导多功能干细胞可以无限扩增;二,原料来源不受限,诱导多功能干细胞可以经健康人的成体细胞如外周血单核细胞重编程获得,而胚胎干细胞的使用具有伦理道德限制;三,分化效率高,使用悬浮培养以及特定的信号通路蛋白因子和小分子化合物,可以获得成熟且具有功能的胰岛β细胞;四,所获产量大,添加特定的小分子化合物,可以获得数量庞大、纯度更高的成熟胰岛β细胞;五,耗时短,培养周期为22~30天,且延长扩增时间可以获得更高细胞产量,降低成本损耗;六,安全可靠,使用细胞分选或生物材料包裹等方法,可以提高所获细胞的纯度或降低甚至没有细胞对宿主的免疫排斥反应。
另外,小分子化合物如ALK4/5/7抑制剂(A83-01)、CDK5抑制剂(AT7519)、LTCC激活剂(BayK8644)和Hippo信号通路效应器抑制剂(Super-TDU1-31)的使用促进了胰岛β细胞的定向分化,表现在分化过程中中间产物(胰腺前体细胞)的大量扩增,以及分化产物(胰岛β细胞)的成熟和高扩增效率。经本培养液和分化方法获得的胰岛β细胞数量多、成熟度高且功能完善,为未来糖尿病的治疗提供了新的方法。
以上所述实施例仅表达了本发明的某种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制;应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围;因此,本发明专利的保护范围应以所附权利要求为准。
- 一种诱导多能干细胞定向分化制备胰岛β细胞的培养液
- 一种诱导多能干细胞定向分化制备胰岛β细胞的添加剂
