一种负载苦参碱的聚乙二醇化二维硼烯纳米片及其制备方法与应用
文献发布时间:2023-06-19 18:37:28
技术领域
本发明涉及纳米药物载体领域,尤其涉及一种负载苦参碱的聚乙二醇化二维硼烯纳米片及其制备方法与应用。
背景技术
乏氧是肿瘤的常见标志,也是光动力疗法的致命弱点,严重影响Ⅱ型光动力疗法治疗效果。光动力治疗后乏氧的加剧产生的HIF-1α等因子与肿瘤的侵袭性、耐药性和不良预后密切相关。光动力疗法于19世纪90年代问世,是一种利用光激活的光敏剂外源性产生活性氧来杀灭癌细胞的非侵入性和精准的治疗方法。在光动力疗法中有三个关键作用:氧、光激发和光敏剂。根据产生活性氧的类型,光敏剂可分为Ⅰ型和Ⅱ型。然而,大多数光敏剂是通过氧气依赖的Ⅱ型光动力途径工作的,产生细胞毒性单线态氧。相反,Ⅰ型光敏剂可以与除了氧气之外的水或其他分子等对氧气依赖性较低的Ⅱ型光动力途径作用,产生羟基自由基、超氧自由基和其他相关自由基。光动力疗法临床应用面临的肿瘤乏氧的挑战需要相应的策略,开发理想的Ⅰ型光敏剂。
发明内容
本发明的首要目的在于克服上述现有技术的不足之处而提供一种负载苦参碱的聚乙二醇化二维硼烯纳米片。
本发明另一目的在于提供上述负载苦参碱的聚乙二醇化二维硼烯纳米片的制备方法。
本发明再一目的在于提供上述负载苦参碱的聚乙二醇化二维硼烯纳米片的应用。
为了解决上述技术问题,本发明采取的技术方案为:一种负载苦参碱的聚乙二醇化二维硼烯纳米片的制备方法,包括以下步骤:
S1、将硼粉与醇混合,通过液相剥离法制得二维硼烯纳米片;
S2、将聚乙二醇氨基与步骤S1所述的二维硼烯纳米片混合,去除多余的聚乙二醇氨基,得到聚乙二醇化二维硼烯纳米片;
S3、将苦参碱与步骤S2所述的聚乙二醇化二维硼烯纳米片混合,去除游离的苦参碱,得到负载苦参碱的聚乙二醇化二维硼烯纳米片。
作为优选方案,所述的二维硼烯纳米片的尺寸为50-300nm,厚度为1-10nm。
作为优选方案,步骤S1中所述的液相剥离法制得二维硼烯纳米片包括以下步骤:将硼粉与异丙醇混合制得的硼粉分散液,于10-20℃下水浴超声12-24h,离心,取上清液再次离心,收集沉淀,干燥,得到二维硼烯纳米片;作为更优选方案,所述的离心为3000-5000rpm离心20-30min;所述的再次离心为10000-18000rpm离心5-10min。
作为优选方案,步骤S1中所述醇为异丙醇。
作为优选方案,步骤S1中所述的硼粉与醇的比例为硼粉:醇=1-2mg:1mL。
作为优选方案,步骤S2中所述的聚乙二醇氨基与二维硼烯纳米片的质量比为3-8:1。
作为优选方案,步骤S2中所述的聚乙二醇氨基的聚乙二醇分子量为2000-8000。
作为优选方案,步骤S3中所述的苦参碱与聚乙二醇化二维硼烯纳米片的质量比为10-60:1。
作为优选方案,步骤S2中所述的混合为将聚乙二醇氨基与二维硼烯纳米片分别制采用去氧的去离子水制备为分散液后转速600rpm下混合12h。
作为优选方案,步骤S3中所述的混合为将苦参碱与聚乙二醇化二维硼烯纳米片分别采用去氧的去离子水分散后600rpm下混合24h。
作为优选方案,步骤S2中所述的去除多余的聚乙二醇氨基分别重复三次。
作为优选方案,步骤S3中所述的去除游离苦参碱分别重复三次。
作为优选方案,步骤S2、S3中所述的去除多余的聚乙二醇氨基、去除游离苦参碱采用离心的方式,10000-18000rpm离心10min。
作为优选方案,步骤S2、S3均在避光条件下进行。
所述负载苦参碱的聚乙二醇化二维硼烯纳米片需在除氧、避光条件下保存。
本发明还提供了通过上述制备方法制备得到的负载苦参碱的聚乙二醇化二维硼烯纳米片。
本发明还提供了上述负载苦参碱的聚乙二醇化二维硼烯纳米片在抑制肿瘤药物中的应用。
作为优选方案,所述负载苦参碱的聚乙二醇化二维硼烯纳米片作为Ⅰ型光敏剂。
本发明通过聚乙二醇改性二维硼烯纳米片,提高了其分散性、稳定性及生物相容性。
相比于现有技术,本发明实施例具有如下有益效果:
1、本发明的二维硼烯纳米片为Ⅰ型光敏材料,负载苦参碱,协同作用,在激光照射下能够协同提高细胞中的活性氧,降低谷胱甘肽的水平,降低Bcl-2、HIF-1α的水平,并且在小鼠体内协同提高抗肿瘤作用,达到光动力增敏的作用。本发明的产品结合光疗和化疗,能够克服肿瘤乏氧环境,杀伤肿瘤细胞,阻遏肿瘤侵袭和转移,同时具有多模态成像的能力,可以精准定位肿瘤,并且本身可降解,安全低毒性,有望在多方向生物医药领域,如乳腺肿瘤、肝肿瘤、肺肿瘤等恶性肿瘤疾病方向作为药物递送载体与治疗药物使用。
2、本发明基于二维硼烯纳米片负载苦参碱的Ⅰ型光敏剂的制备方法具有步骤简单、成本低等优点,可用于大规模工业化生产。
附图说明
图1为实施例1制备的二维硼烯纳米片的TEM表征图。
图2为实施例1制备的二维硼烯纳米片的AFM表征图。
图3为实施例1制备的二维硼烯纳米片的XPS表征图。
图4为实施例1制备的不同浓度的二维硼烯纳米片可见光吸收谱图。
图5为实施例1制备的负载苦参碱的聚乙二醇化二维硼烯纳米片的TEM表征图。
图6为实施例1制备的负载苦参碱的聚乙二醇化二维硼烯纳米片的AFM表征图。
图7为实施例1制备的负载苦参碱的聚乙二醇化二维硼烯纳米片的SEM元素Mapping表征图。
图8为实施例1制备的负载苦参碱的聚乙二醇化二维硼烯纳米片为实施例1制备的负载苦参碱的聚乙二醇化二维硼烯纳米片的紫外-可见光吸收谱图。
图9为实施例1制备的二维硼烯纳米片和聚乙二醇化二维硼烯纳米片放置7天后稳定性评价图。
图10为实施例1制备的二维硼烯纳米片和聚乙二醇化二维硼烯纳米片放置7天的可见光吸收谱图;其中,A为二维硼烯纳米片,B为聚乙二醇化二维硼烯纳米片。
图11为实施例1制备的二维硼烯纳米片的ESR测试图。
图12为实施例1制备的二维硼烯纳米片在常氧和乏氧条件下的ESR测试图。
图13为实施例1制备的负载苦参碱的聚乙二醇化二维硼烯纳米片在小鼠乳腺癌细胞的治疗效果图。
图14为实施例1制备的负载苦参碱的聚乙二醇化二维硼烯纳米片在常氧和乏氧状态下对小鼠乳腺癌细胞的治疗效果图。
图15为不同浓度苦参碱的活性氧探针测试荧光成像图。
图16为实施例1制备的负载苦参碱的聚乙二醇化二维硼烯纳米片在不同瓦数的660nm激光照射下的活性氧探针测试荧光成像图。
图17为不同治疗组在小鼠乳腺癌细胞上的Bcl-2和HIF-1α蛋白印迹图。
图18为不同治疗组在小鼠乳腺癌细胞上谷胱甘肽含量测定图。
图19为不同治疗组在小鼠体内抗肿瘤效果图。
图20为二维硼烯纳米片光声成像结果图。
图21为不同治疗组治疗结束后第2天小鼠血常规指标。
图22为不同治疗组治疗结束后第30天小鼠血常规指标。
图23为不同治疗组治疗结束后第2天小鼠肝肾功能指标。
图24为不同治疗组治疗结束后第30天小鼠肝肾功能指标。
图25为不同治疗组治疗结束后第2天小鼠体内炎症指标。
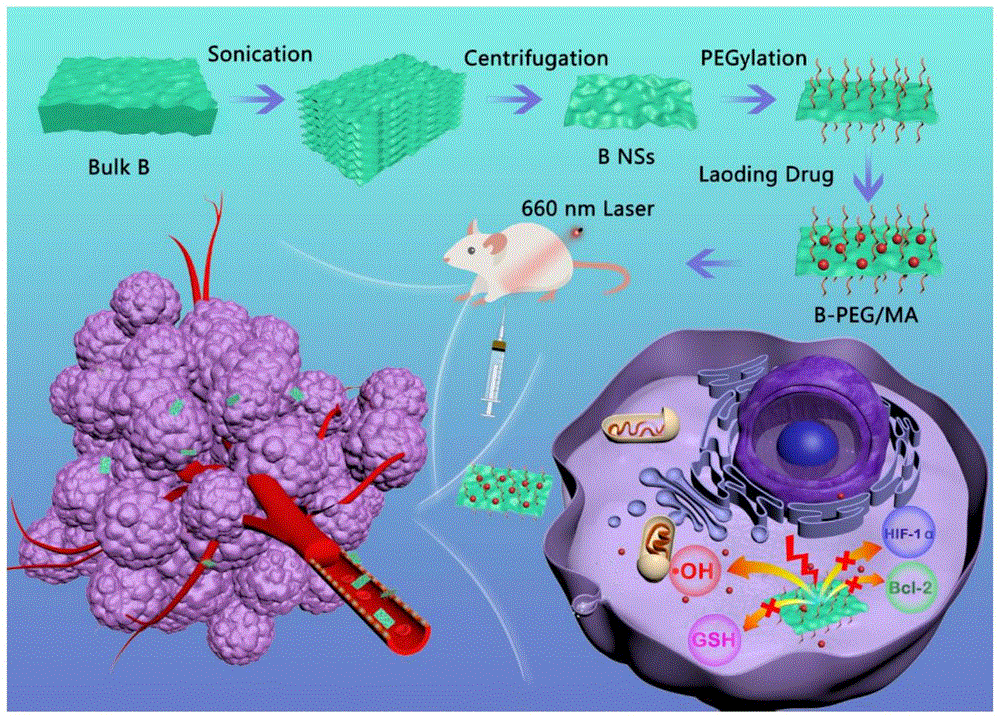
图26为本发明的负载苦参碱的聚乙二醇化二维硼烯纳米片制备流程及抗癌作用机理流程图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
下述实施例中的材料来源:
硼粉:购自上海麦克林生化科技有限公司;
聚乙二醇氨基(PEG-NH
苦参碱:购自南通生物医药公司,纯度≥99%;
胎牛血清:购自美国赛默飞世尔科技公司;
小鼠乳腺癌细胞株4T1:购自武汉普诺赛公司;
DMPO:购自北京百灵威科技有限公司;
DAPI:购自上海碧云天生物技术有限公司;
DCFH-DA:购自西格玛奥德里奇(上海)贸易有限公司;
谷胱甘肽含量测定试剂盒:购自上海碧云天生物技术有限公司;
一抗:购自艾博抗(上海)贸易有限公司;
Bcl-2抗体:购自艾博抗(上海)贸易有限公司;
HIF-1α抗体:购自艾博抗(上海)贸易有限公司;
Balb/c小鼠:购自北京维通利华实验动物有限公司;
青霉素、链霉素、MTT、水合氯醛:市售。
实施例1
实施例1提供了一种负载苦参碱的聚乙二醇化二维硼烯纳米片,制备方法包括以下步骤:
S1、将500mg硼粉与500mL异丙醇混合,得到1mg/mL的硼粉分散液,通过液相剥离法制得二维硼烯纳米片;液相剥离法具体为:将硼粉分散液在10℃水浴下超声12h,3000rpm转速下离心30min,取上清液,再15000rpm转速下离心8min,收集沉淀,冷冻干燥,得到二维硼烯纳米片(B NSs);
S2、将10mg聚乙二醇氨基(聚乙二醇分子量为2000)与2mL蒸馏水配制为聚乙二醇氨基分散液;步骤S1所得的二维硼烯纳米片在10000rpm转速下离心5min,去除上清液,重复3遍后取1mg沉淀加入1mL蒸馏水配制为二维硼烯纳米片分散液,将聚乙二醇氨基分散液与二维硼烯纳米片分散液按照体积比1:1混合,在室温、避光、600rpm下搅拌12h使分散液混合均匀,10000rpm离心10min去除上清液,重复3次离心以去除混合液中游离的聚乙二醇氨基,沉淀物重悬于1mL无氧蒸馏水中,得到聚乙二醇化二维硼烯纳米片(B-PEG NSs),于4℃保存;
S3、将苦参碱配制为3mg/mL的苦参碱溶液,步骤S2所得的聚乙二醇化二维硼烯纳米片配制为0.1mg/mL的分散液,将苦参碱溶液与聚乙二醇化二维硼烯纳米片分散液按照体积比1:1混合,在室温、避光、600rpm下搅拌24h,10000rpm离心10min去除上清液,重复3次离心以去除混合液中游离的苦参碱,沉淀物重悬于1mL无氧蒸馏水中,得到负载苦参碱的聚乙二醇化二维硼烯纳米片(B-PEG/MA),于4℃保存。
效果例1对B NSs及B-PEG/MA进行表征
对实施例1制备的二维硼烯纳米片(B NSs)通过透射电子显微镜(Transmissionelectron microscope,TEM)、X射线光电子能谱技术(X-ray photoelectronspectroscopy,XPS)、原子力显微镜(Atomic force microscope,AFM)以及可见光吸收光谱分析进行表征。
如图1所示,在TEM下观察发现B NSs呈片状,横向尺寸为50-300nm;如图2所示,在XPS检测中发现B NSs的元素为硼,表明实施例1成功制备出B NSs;如图3所示,在AFM下观察发现B NSs的厚度为4-6nm,横向尺寸为50-300nm,与TEM表征结果相符;如图4所示,不同浓度的B NSs在400-1000nm处无明显吸收峰,表明实施例1采用的液相剥离法能够成功制备BNSs。
对实施例1制备的负载苦参碱的聚乙二醇化二维硼烯纳米片(B-PEG/MA)、制备的负载苦参碱的二维硼烯纳米片(B/MA)通过TEM、AFM、Mapping分析以及紫外-可见光吸收光谱分析进行表征。
如图5所示,在TEM下观察发现B-PEG/MA呈片状,横向尺寸为234nm;如图6所示,在AFM下观察发现B-PEG/MA的厚度为5nm,横向尺寸为240nm,与TEM表征结果相符,B-PEG/MA的TEM和AFM表征结果与二维硼烯纳米片的相比厚度有所增加。如图7所示,通过Mapping分析发现B-PEG/MA中具有硼、氧、氮、碳4种元素,说明苦参碱较为均匀地分散附着在聚乙二醇化二维硼烯纳米片中;如图8所示,与二维硼烯纳米片相比,B-PEG/MA在200nm处具有明显的吸收峰,表明实施例1成功制备出B-PEG/MA。
效果例2稳定性评价
将实施例1制备得到的B NSs和B-PEG NSs分别用蒸馏水、磷酸缓冲液(PBS)和胎牛血清(FBS)重悬制备得到分散液,分别在室温条件下放置7天后测定可见光吸收光谱。采用的蒸馏水、PBS和FBS均经去氧处理。
如图9所示,B NSs和B-PEG NSs分别在不同溶剂中放置7天后肉眼观察无明显变化;如图10所示,B NSs和B-PEG NSs分别在不同溶剂中放置7天内每天通过可见光吸收光谱测定发现均无明显吸收峰,其中B-PEG NSs放置7天后的吸光度变化与第1天的无显著差异,表明B NSs和B-PEG NSs均具有较好的稳定性,B-PEG NSs的稳定性高于B NSs。
效果例3ESR分析
将实施例1所制备得到的B NSs进行ESR分析,采用DMPO作为自由基捕获剂,光照波长为660nm。
如图11所示,在660nm的光照下,B NSs可以产生强烈的羟基自由基;如图12所示,在乏氧和常氧状态下,B NSs的羟基自由基产生效率几乎一致,证明B NSs为Ⅰ型光敏剂。
效果例4体外疗效评价
利用小鼠乳腺癌细胞株(4T1)作为对象,对实施例1制备得到的B-PEG/MA进行疗效评价。
小鼠乳腺癌细胞在10%FBS,1%100μg/mL青霉素和1%100μg/mL链霉素的DEME培养基中培养,培养条件为37℃,5% CO
本实验共设置4个分组,分别为1个对照组(Mod):苦参碱组(Ma)、B-PEG NSs光照组(B-PEG+L)、B-PEG/MA组(B-MA)、B-PEG/MA光照组(B-MA+L)。每个分组各个浓度分别设置6个复孔。
B-MA+L组疗效评定:将小鼠乳腺癌细胞以5000个/孔接种于96孔细胞培养板中,培育24h。分别配制B-PEG/MA终浓度为5、10、15、20、25μg/mL的新鲜无血清培养基,替换原培养基,4h后采用660nm激光(150mW/cm
MTT染色法:向每孔中加入10mL MTT溶液,孵育4h,在490nm处测定吸光度,根据以下公式计算细胞存活率:
细胞存活率=OD
其中,OD
B-PEG+L组疗效评定方法与B-MA+L组相同,不同之处为新鲜无血清培养基加入的试剂为B-PEG NSs;B-MA组疗效评定方法与B-MA+L组基本相同,不同之处为660nm激光照射5min换为培养箱无光照培养5min;Ma组疗效评定方法与B-MA+L组基本相同,不同之处为新鲜无血清培养加入的试剂为苦参碱,660nm激光照射5min换为培养箱无光照培养5min,对照组疗效评定方法与B-MA+L组基本相同,不同之处为不添加试剂。
将B-MA+L组、B-PEG+L组、B-MA组、Ma组在常氧和乏氧环境下进行疗效评定,实验步骤与上述的相同,待测样品终浓度均为15μg/mL,采用三气箱培养细胞,气体浓度比例为5%CO
如图13、图14所示,不同浓度的B-MA+L组均能抑制小鼠乳腺癌细胞生长,并且在乏氧环境下,B-MA+L组仍能显著抑制细胞生长,表明B-PEG/MA在660nm的激光照射下,通过Ⅰ型光动途径发挥作用。
为了进一步探究苦参碱的光疗增敏能力,B-PEG NSs产生活性氧的能力和治疗机制,在小鼠乳腺癌细胞上进行给药,使用活性氧荧光探针DCFH-DA(Sigma-Aldrich 2044-85-1试剂盒)对MA组和B-PEG+L组进行荧光分析,结果见图15、16。对B-MA+L组、B-PEG+L组、B-MA组、Ma组的小鼠乳腺癌细胞Bcl-2、HIF-1α表达水平以及谷胱甘肽含量进行检测,Bcl-2、HIF-1α表达水平采用蛋白印迹法进行测定(Yuying Zhao,Ning Liu,Piaoxue Liu,Taojian Fan,Rui Ma,Huijie Hong,Xiaojia Chen,Zhongjian Xie,Han Zhang,Qi Wang,Tongkai Chen,Robust boron nanoplatform provokes potent tumoricidal activitiesvia inhibiting heat shock protein,Asian Journal of Pharmaceutical Sciences,Volume 17,Issue5,2022,Pages 728-740,ISSN 1818-0876;抗体来源Abcam)结果见图17,谷胱甘肽含量采用阿拉丁S0052谷胱甘肽试剂盒进行测定,结果见图18。
如图15所示,荧光成像图显示不同浓度的苦参碱均可以增加细胞中活性氧,并随着浓度升高活性氧的分泌增加;如图16所示,荧光成像图显示10μg/mL B-PEG NSs在660nm激光照射下生成活性氧,并随着激光瓦数增加活性氧的分泌增加;如图17所示,蛋白印迹图显示苦参碱可以降低小鼠乳腺癌细胞的Bcl-2、HIF-1α表达水平,B-PEG/MA可以显著降低小鼠乳腺癌细胞的Bcl-2、HIF-1α表达水平,并且B-PEG+L组的HIF-1α表达水平没有明显升高,与上述乏氧环境下B-MA+L组仍能显著抑制细胞生长的结果对应,进一步证明B NSs为Ⅰ型光敏剂。如图18所示,苦参碱和在660nm激光引发下的B-PEG/MA均可降低小鼠乳腺癌细胞内的谷胱甘肽含量,并且B-PEG/MA的谷胱甘肽抑制效果优于苦参碱。综上所述,苦参碱不仅可以作为化疗药物降低细胞的Bcl-2、HIF-1α表达水平,达到杀死肿瘤细胞的效果,还可以降低细胞的谷胱甘肽含量,提升活性氧的含量起到光疗增敏剂的作用,苦参碱和B NSs协同作用,大幅度提升B-PEG/MA的Ⅰ型光动力疗效。
效果例5体内疗效评价、光声成像检测、体内毒性评价
为了验证B-PEG/MA在体内的治疗效果,将小鼠乳腺癌细胞种植在Balb/c小鼠(北京维通利华实验有限公司许可证号SCXK京2021-0006)上,在每只小鼠乳腺组织皮下注射小鼠乳腺癌细胞(1×10
本实验共设置5个分组,分别为1个对照组(Mod),4个给药组,给药组分别为:苦参碱组(Ma),B-PEG NSs光照组(B-PEG+L),B-PEG/MA组(B-MA)和B-PEG/MA光照组(B-MA+L)。每个处理组7只小鼠。
将上述各组的样品配制分散液,根据荷瘤小鼠体重计算剂量,B-PEG+L组、B-MA组、B-MA+L组每只小鼠的硼烯剂量=1.23mg/kg,苦参碱组每只小鼠的苦参碱剂量=100mg/kg,对照组为PBS,各组注射量分别为50μL,注射部位为乳腺肿瘤。待注射结束后,针头在肿瘤内停留1min,然后再从肿瘤中拔出,以避免出现渗漏现象。每天注射一次,连续注射7天后处死小鼠,收集各组肿瘤。B-PEG+L组和B-MA+L组在每次注射后需经660nm激光(150mW/cm
将各组切除下的肿瘤组织进行对比,如图19所示,与对照组相比4个给药组均具有抗肿瘤的效果,其中经激光照射引发后的B-PEG/MA的抗肿瘤作用最为显著,表明B-PEG/MA作为Ⅰ型光敏剂通过光反应达到的治疗效果具有可行性。
将实施例1制备得到的B NSs进行光声成像分析,麻醉荷瘤小鼠后,每只小鼠给予0.2mL 4%的水合氯醛,肿瘤内注射100μL的B-PEG NSs(浓度为2mg/mL),于注射后2h、4h和6h分别在光声成像仪下观察荧光信号,结果见图20。
如图20所示,注射了B-PEG NSs后的6h内,荷瘤小鼠的肿瘤组织在光声成像仪下均检测到荧光信号,表明B NSs具有光声成像效果,即具有多模态成像的能力,可精准定位肿瘤。
对上述5个分组的小鼠进行2天和30天的毒性评价,取血采用摘眼球采血法,检测标准按临床生物化学检验常规项目分析质量指标WS/T 403-2012进行。
检测的指标有:血常规指标(血细胞数量、红细胞数量、血红蛋白、平均红细胞体积、平均红细胞血红蛋白量、红细胞平均血红蛋白浓度、血小板、红细胞比积),肝肾功能指标(谷丙转氨酶、谷草转氨酶、总蛋白、总胆红素、血浆中白蛋白、直接胆红素、肌酐、尿素),免疫因子(γ干扰素、白介素6、肿瘤坏死因子α、白介素12)。其中血常规和肝肾功能指标分别在治疗结束后2天和30天检测,测全血,每组3只小鼠,结果见图21-24;免疫因子在治疗结束后2天检测,测血清,每组3只小鼠,结果见图25。
如图21-25所示,4个给药组的小鼠在治疗结束后2天和30天均无明显急性或慢性肝毒性与肾毒性,并且不会引起急性免疫排斥,表明本发明的B-PEG/MA在激光引发后具有低毒性,安全可靠。
综上所述,本发明的负载苦参碱的聚乙二醇化二维硼烯纳米片在660nm激光引发下能够诱导小鼠肿瘤细胞的活性氧爆发,抑制细胞的Bcl-2和HIF-1α以及谷胱甘肽的表达,以达到抑制肿瘤细胞生长的效果,从而起到抗癌作用,可在制备抑制肿瘤药物中应用,机理作用如图26所示。
以上所述的具体实施例,对本发明的目的、技术方案和有益效果进行了进一步的详细说明,应当理解,以上所述仅为本发明的具体实施例而已,并不用于限定本发明的保护范围。特别指出,对于本领域技术人员来说,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
