一种利用多能干细胞诱导分化胆囊祖细胞的方法
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及分子生物学技术领域,具体地,涉及一种利用多能干细胞诱导分化胆囊祖细胞的方法。
背景技术
多能干细胞(Pluripotent stem cells,PSC)因具备无限增殖能力与多向分化潜力而成为再生医学的重要种子细胞。近年来,PSC向肝细胞、心肌细胞、胰岛β细胞等不同体细胞类型的体外诱导分化技术依次被成功建立,帮助人类在重难疾病的破译上产生了一系列突破。
胆囊作为人体内加工运输胆汁的脏器,其发育或功能异常会引发胆固醇结石、硬化性胆管炎、胆道闭锁等疾病。据统计,全球大部分新生儿的肝脏移植是由于患儿胆囊发育异常而引发胆道闭锁;还有一部分是由于原发性硬化性胆管炎造成的肝损伤。目前,用于肝外胆管疾病研究和药物开发的体外模型主要包括人原代细胞或肿瘤细胞系;然而,原代细胞不仅来源稀缺、难以获取,且由于个体差异致使批次间结果不稳定;而肿瘤细胞在病理机制与基因表达等多个方面的差异致使预测不可靠。这些问题严重限制了新药研发的速度与成功率。倘若存在一个方法可大量地产生人源的肝外胆管细胞,将在相关疾病的病理解析与药物开发上意义重大。
有鉴于此,本领域需要一种基于PSC向胆囊上皮祖细胞诱导分化的方法。
发明内容
本发明的目的是为了克服现有技术的上述不足,提供一种利用多能干细胞诱导分化胆囊祖细胞的方法。
本发明的第一个目的是提供一种利用多能干细胞诱导分化胆囊祖细胞的方法。
本发明的第二个目的是提供所述方法制备得到的胆囊祖细胞。
为了实现上述目的,本发明是通过以下方案予以实现的:
一种利用多能干细胞诱导分化胆囊祖细胞的方法,包括以下步骤:
S1.诱导多能干细胞分化为定形内胚层细胞;
S2.诱导定形内胚层细胞分化为前肠后部细胞簇;
S3.诱导前肠后部细胞簇分化为胆胰共祖细胞簇;
S4.诱导胆胰共祖细胞簇分化为胆囊祖细胞簇。
优选地,使用的培养基中添加有50~250μM rhActA和30~100ng/ml rhBMP4。
更优选地,依次使用如下培养进行诱导培养:
培养基1为:含有50~250ng/ml rhActA+30~100ng/ml rhBMP4的IMDM培养基,
培养基2为:含有50~250ng/ml rhActA的IMDM完全培养基,所述IMDM完全培养基含0.2%(v/v)FBS,
培养基3为:含有50~250ng/ml rhActA的IMDM完全培养基,所述IMDM完全培养基含2%(v/v)FBS。
再优选地,所述步骤S1中,依次使用的培养基为如下培养:
培养基1为:含有100ng/ml rhActA+50ng/ml rhBMP4的IMDM培养基,
培养基2为:含有100ng/ml rhActA的IMDM完全培养基,所述IMDM完全培养基含0.2%(v/v)FBS,
培养基3为:含有100ng/ml rhActA的IMDM完全培养基,所述IMDM完全培养基含2%(v/v)FBS,
培养基1培养一天后更换为培养基2,培养基2培养一天后更换为培养基3再培养一天。
优选地,所述步骤S2中,使用的培养基中添加有1~10μM CHIR99021、100~500ng/ml rhFGF10和10~100ng/ml rhNOG。
更优选地,所述步骤S2中,依次使用如下培养进行诱导培养:
培养基3为:含有1~10μM CHIR99021+100~500ng/ml rhFGF10+10~100ng/mlrhNOG的IMDM完全培养基,所述IMDM完全培养基含2%(v/v)FBS,
培养基4为:含有1~10μM CHIR99021+100~500ng/ml rhFGF10+10~100ng/mlrhNOG的IMDM完全培养基,所述IMDM完全培养基含2%(v/v)FBS。
再优选地,所述步骤S2中,依次使用如下培养进行诱导培养:
培养基3为:含有2μM CHIR99021+250ng/ml rhFGF10+100ng/ml rhNOG的IMDM完全培养基,所述IMDM完全培养基含2%(v/v)FBS,期间每24h更换新培养基,
培养基4为:含有2μM CHIR99021+250ng/ml rhFGF10+100ng/ml rhNOG的IMDM完全培养基,所述IMDM完全培养基含2%(v/v)FBS,期间每24h更换新培养基,
培养基3培养三天后更换为培养基4,期间每天更换培养基,
培养基4培养两天,期间不更换培养基。
优选地,所述步骤S3中,使用的培养基中添加有30~200ng/ml rhEGF、50~300ng/ml rhFGF10、0.1~5μM SANT1和0.1~10μM RA。
更优选地,所述步骤S3中,使用如下培养进行诱导培养:
培养基5:含有30~200ng/ml rhEGF+50~300ng/ml rhFGF10+0.1~5μM SANT1+0.1~10μM RA+2%(v/v)不含Va的B27无血清添加剂的IMDM培养基和高糖DMEM培养基的混合物,其中IMDM培养基和高糖DMEM培养基的体积比为(3~6):(4~7)。
再优选地,所述步骤S3中,使用如下培养进行诱导培养:
培养基5:含有100ng/ml rhEGF+100ng/ml rhFGF10+0.25μM SANT1+2μM RA+2%(v/v)不含Va的B27无血清添加剂的IMDM培养基和高糖DMEM培养基的混合物,其中IMDM培养基和高糖DMEM培养基的体积比为1:1,
期间每天更换新培养基,培养四天。
优选地,所述步骤S4中,使用的培养基中添加有30~200ng/ml rhEGF、500~1500ng/ml rhJAG1、1~10mM cAMP、RA 0.5~10μM和3~30mM NIC。
更优选地,所述步骤S4中,使用如下培养进行诱导培养:
培养基6:30~200ng/ml rhEGF+500~1500ng/ml rhJAG1+1~10mM cAMP+0.5~10μM RA+3~30mM NIC+2%(v/v)不含Va的B27无血清添加剂的IMDM培养基和高糖DMEM培养基的混合物,其中IMDM培养基和高糖DMEM培养基的体积比为(3~6):(4~7)。
再优选地,所述步骤S4中,使用如下培养进行诱导培养:
培养基6:100ng/ml rhEGF+500ng/ml rhJAG1+0.1mM cAMP+0.1μM RA、10mM NIC+2%(v/v)不含Va的B27无血清添加剂的IMDM培养基和高糖DMEM培养基的混合物,其中IMDM培养基和高糖DMEM培养基的体积比为1:1,
期间每天更换新培养基,培养十四天。
以上培养基中加入cAMP,作为cAMP的信号激活剂。
以上所述方法制备得到的胆囊祖细胞,也属于本发明的保护范围。
与现有技术相比,本发明具有以下有益效果:
本发明提供一种利用多能干细胞诱导分化胆囊祖细胞的方法,该方法以胆囊上皮发育阶段的关键分子特征为基础,依次实现人多能干细胞向内胚层、前肠后部细胞簇、胆胰共祖细胞簇、以及胆囊祖细胞的诱导分化;为胆囊上皮的发育机制探索与病理解析提供了一个全新的人源性工具。
附图说明
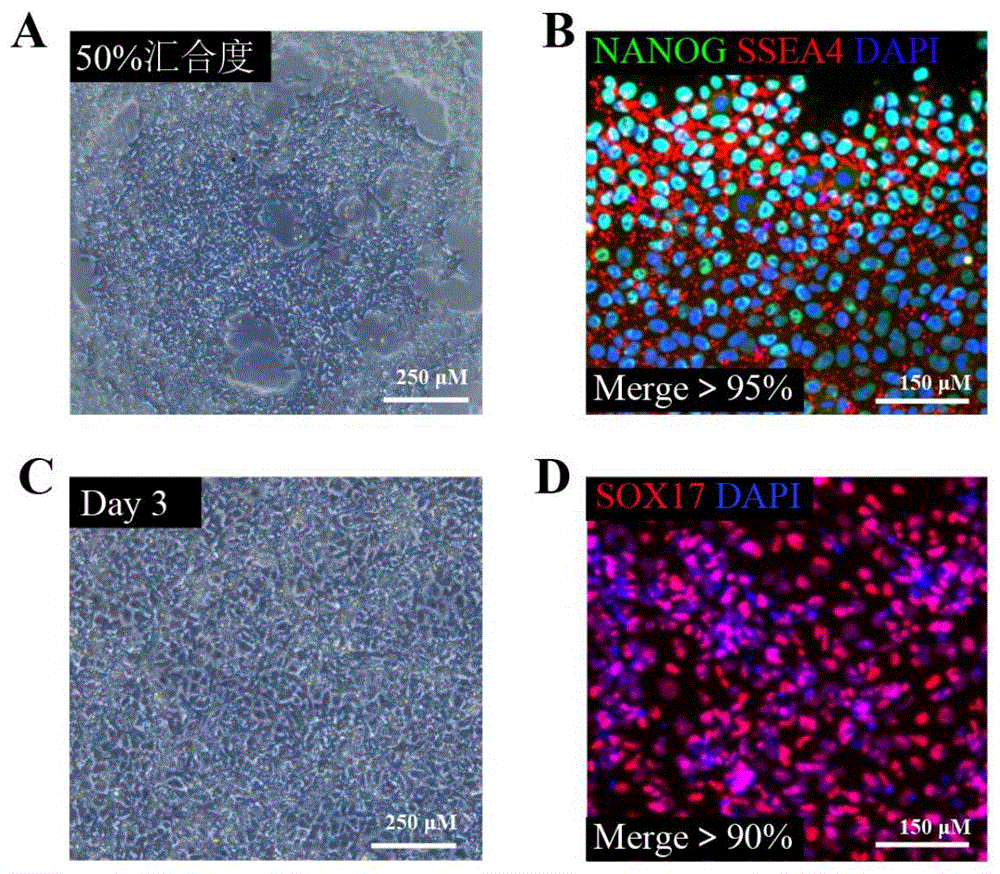
图1为诱导阶段1鉴定结果;A为分化前hPSC形态图,汇合度为80%;B为hPSC免疫荧光鉴定结果;C为Day3细胞形态图;D为Day3细胞免疫荧光鉴定结果;NANOG、SSEA4为多能性标志物,SOX17为定型内胚层标志物。
图2为诱导阶段2鉴定结果;A为Day6培养物形态图;B为Day8培养物形态图;C为Day8培养物的免疫荧光鉴定结果。DAPI为细胞核染料。
图3为诱导阶段3鉴定结果;A到E为荧光定量PCR分析标志物表达水平;其中A和B分别为胆囊上皮标志物SOX17与胆系通用标志物CK19表达水平;C和D分别为胰系标志物PTF1A与PDX1表达水平;E为肝祖细胞标志物HNF4A表达水平;所有基因以管家基因GAPDH校准;生物学重复n=4;技术重复n=3;F到H为Day 11培养物免疫荧光鉴定标志物表达。
图4为诱导阶段4鉴定结果;A为Day25培养物形态图;B到D为连续切片的免疫荧光染色结果。
图5为转录本测序聚类分析结果,数字代表样本的生物学重复,代表包含2个或3个生物学重复样本纳入分析。
具体实施方式
下面结合说明书附图及具体实施例对本发明做出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
1、试剂
以下实施例中使用到的试剂见表1。
表1:
其中,mTeSR1:PSC培养基;
IMDM:Iscove's Modified Dulbecco's Medium,Iscove改良型DMEM基础培养基;
B27(-Va):B27无血清营养补充剂(不含维生素A型);
DMEM:Dulbecco's minimum essential mediu,一种常见的上皮培养基(补充高糖型);
FBS:Fetal Bovine Serum,胎牛血清;
DMSO:Dimethyl sulfoxide,二甲基亚砜;
Y-27632:一种ROCK信号抑制剂,用于PSC传代时的细胞贴壁;
CHIR99021:一种Wnt信号激活剂;
Vc:Vitamin C,即维生素C;
SANT1:一种hedgehog信号抑制剂;
RA:Retinoic acid,全反式维甲酸;
cAMP:腺苷酸环化酶,即cAMP信号直接激活剂;
NIC:niacinamide,烟酰胺;rhActA:
Recombinant Human Acitivin A,重组人激活素A;
rhBMP4:Recombinant Human BMP4;重组人骨形成蛋白4;
rhFGF10:Recombinant Human FGF10,重组人成纤维细胞生长因子10;
rhNOG:Recombinant Human Noggin,重组人头蛋白;
rhEGF:Recombinant Human EGF,重组人上皮生长因子;
rhJAG1:Recombinant Human Jagged 1,重组人Jagged 1;
Cultrex Stem Cell Qualified Reduced Growth Factor Basement MembraneExtract:生长因子减少型基质胶;用作PSC培养与诱导分化时的2D培养;
Cultrex Reduced Growth Factor BME,Type 2:生长因子减少型基质胶;用作诱导分化时的3D培养;
Evo M-MLV RT Kit with gDNA Clean for qPCR:mRNA反转录试剂盒;
SYBR Green Premix Pro Taq HS qPCR Kit:荧光定量PCR试剂盒;
Normal donkey serum:正常驴血清,用作免疫荧光封闭抗原;
DAPI:4',6-diamidino-2-phenylindole,4',6-二脒基-2-苯基吲哚,用作细胞核染色;
Trizol,总RNA抽提液。
2、荧光定量PCR
操作方法如下:吸去培养基、PBS涮洗2次后,使用trizol裂解细胞并提取总RNA;此后分别使用Evo M-MLV RT Kit with gDNA Clean for qPCR和SYBR Green Premix ProTaq HS qPCR Kit按照说明书步骤进行反转录与荧光定量PCR分析;引物相关信息见表2。
表2引物列表:
3、免疫荧光
操作方法如下:1)whole-mount免疫荧光中,吸去培养基、PBS涮洗2次后,依次使用4%多聚甲醛固定、5%正常驴血清固定、0.5% TritonX-100透化细胞;此后分别使用细胞特异性一抗与相应荧光二抗孵育并涮洗;最后使用DAPI核染后,在荧光镜下成像与分析。2)切片免疫荧光中,经4%多聚甲醛固定后,使用OCT包被、冷冻切片机下切为厚度为10μm的切片,此后按照1)中方法继续操作即可,使用到的抗体见表3。
表3抗体列表:
实施例1定形内胚层细胞的诱导分化(Day 1~3)
一、实验方法
准备用于诱导分化的细胞培养板,将hPSC按2×10
Day1培养基为:含有100ng/ml rhActA+50ng/ml rhBMP4的IMDM培养基;
Day2培养基为:含有100ng/ml rhActA的IMDM完全培养基(含0.2%(v/v)FBS);
Day3培养基为:含有100ng/ml rhActA的IMDM完全培养基(含2%(v/v)FBS)。
取部分诱导分化至Day3的细胞,观察细胞形态,并利用免疫荧光检测NANOG、SSEA4和SOX17。
二、实验结果
细胞汇合度达50%前后,启动分化(图1A),设置为Day 0。取Day0部分样本进行免疫荧光鉴定,结果表明:>95%hPSC共表达多能性标志物NANOG与SSEA4(图1B),证明具备良好的分化潜能。诱导分化至Day3,细胞呈现典型的内胚层细胞样形态学(图1C)。免疫荧光结果表明:定形内胚层标志物SOX17阳性率>90%(图1D);显示定形内胚层分化成功。
实施例2前肠后部细胞簇的诱导分化(Day 4~8)
一、实验方法
取实施例1的得到的定形内胚层分化成功的细胞继续进行前肠后部细胞簇的分化(Day4到Day8)。
Day4到Day 6培养基为:含有2μM CHIR99021+250ng/ml rhFGF10+100ng/ml rhNOG(溶解于0.25μM抗坏血酸)的IMDM完全培养基(含2%(v/v)FBS),期间每24h更换新培养基;
Day7到Day 8培养基为:含有2μM CHIR99021+250ng/ml rhFGF10+100ng/ml rhNOG+2μM RA(溶解于0.25μM抗坏血酸)的IMDM完全培养基(含2%(v/v)FBS),期间不更换培养基;
取完成Day8培养的细胞,利用免疫荧光检测SOX2和胰系标志物PDX1。
二、实验结果
完成Day6培养时,2D的单层细胞之上出现大量直径为150~300μM的3D球状隆起(图2A);完成Day8培养时,3D球状隆起与底部2D细胞层完全脱离,以3D球形式悬浮于培养基中(图2B和图2C),免疫荧光结果表明:这些细胞同时高表达SOX2与胰系标志物PDX1,即呈现SOX2
实施例3胆胰共祖细胞簇的诱导分化(Day9~13)
一、实验方法
收集实施例2中得到完成Day8培养时,得到的3D球状体,使用Cultrex ReducedGrowth Factor BME,Type2(或Cultrex Stem Cell Qualified Reduced Growth FactorBasement Membrane Extract)进行3D包被后,进行胆胰共祖细胞簇的诱导分化(Day9~13):
Day9到Day13培养基为:含有100ng/ml rhEGF+100ng/ml rhFGF10+0.25μM SANT1+2μM RA(溶解于0.25μM抗坏血酸)+2%(v/v)B27(不含Va)的IMDM培养基和高糖DMEM培养基的混合物,其中IMDM培养基和高糖DMEM培养基的体积比为1:1,期间每24h更换新培养基。
取Day0、Day3、Day8和Day13培养的细胞进行荧光定量PCR检测,检测胆囊上皮标志物SOX17、胆系通用标志物CK19、胰系标志物PDX1和PTF1A、肝祖细胞标志物HNF4A的表达水平,以管家基因GAPDH校准。
取完成Day13培养的细胞进行免疫荧光检测,检测皮标志物EpCAM、胆囊上皮标志物SOX17、以及胰系标志物PDX1、胆系通用标志物CK19以及肝祖细胞标志物AFP
二、实验结果
Day9至Day13期间,荧光定量PCR检测结果(图3A与3B)表明:胆囊上皮标志物SOX17继内胚层(Day3)出现瞬时表达峰后,在此阶段再次快速上调;相应地,胆系通用标志物CK19亦持续上调。另一方面,胰系标志物PDX1与PTF1A的表达量亦快速上调(图3C与3D);这些结果与胆胰共祖时期的分子表达模式高度一致。
此外,重要的是,结果显示Day3到Day13诱导分化过程中,肝系细胞标志物HNF4A维持低表达(图3E),表明未产生肝系。因此,排除了CK19
与此基因表达分析结果一致,免疫荧光结果表明:这些Day13的细胞同时高表达上皮标志物EpCAM、胆囊上皮标志物SOX17、以及胰系标志物PDX1,即呈现EpCAM
实施例4胆胰共祖细胞簇分化为胆囊祖细胞簇(Day 14~25)
一、实验方法
取实施例3诱导分化得到的胆胰共祖细胞簇进行胆囊祖细胞簇的诱导(Day 14~25),其使用的培养基组分如下:
Day12到Day 25培养基为:100ng/ml rhEGF+500ng/ml rhJAG1+0.1mM cAMP+0.1μMRA+10mM NIC(溶解于0.25μm抗坏血酸)+2%B27(不含Va)的IMDM培养基和高糖DMEM培养基的混合物,其中IMDM培养基和高糖DMEM培养基的体积比为1:1,期间每24h更换新培养基。
取完成Day25培养的细胞簇,观察细胞形态,连续切片后的利用免疫荧光检测上皮标志物EpCAM、胆系通用标志物CK19、胆囊上皮标志物SOX17以及胰系标志物PDX1。
二、实验结果
诱导分化至Day25,培养物呈柱状上皮样细胞构成的囊状结构(图4A)。连续切片后的免疫荧光结果表明:培养物同时高表达上皮标志物EpCAM、胆系通用标志物CK19(图4B)、以及胆囊上皮标志物SOX17(图4C);而未表达PDX1(图4D),即呈现EpCAM
转录本测序后的聚类分析结果表明:相比于肝内胆管上皮细胞/肝内胆管上皮祖细胞、肝细胞/肝祖细胞,Day25培养物的基因表达谱更接近胆囊祖细胞与胆囊上皮细胞(图5)。
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,对于本领域的普通技术人员来说,在上述说明及思路的基础上还可以做出其它不同形式的变化或变动,这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
