五味子乙素在制备镇痛药物中的应用
文献发布时间:2024-04-18 19:58:30
技术领域
本发明属于医药领域,涉及五味子乙素制备镇痛药物中的应用,尤其是治疗和/或预防化疗诱导的神经病理性疼痛。
背景技术
化疗诱导的周围神经病变(chemotherapy-induced peripheral neuropathy,CIPN)是一种常见的、与化疗药物相关的剂量限制性不良反应,大量的化疗患者会发生CIPN,其中30%~40%会转变为慢性神经不良反应。如在接受多西紫杉醇治疗的乳腺癌患者中,42%的患者在治疗后2年仍有CIPN症状;结直肠癌患者接受奥沙利铂治疗后2年,CIPN罹患率更高达84%。一项在恶性肿瘤患者中开展的调查结果显示,化疗结束后6年仍有47%的患者有CIPN症状。目前已知可能导致CIPN的化疗药物有铂类(如顺铂、卡铂和奥沙利铂)、长春碱类(如长春新碱)和紫杉烷类(如紫杉醇和多西紫杉醇)、蛋白酶体或血管生成抑制剂类(硼替佐米和沙利度胺)等,但是,发病机制尚未完全明确,目前认为多因素参与其发生。化疗引起的周围神经病变(CIPN)临床表现为疼痛、麻木和刺痛,发病率高(奥沙利铂40%-90%,紫杉醇61-92%),且缺乏有效的防治手段和有效药物缓解。
五味子Schisandra chinensis(Turcz.)Baill是一种常用的收敛固涩药,具有益气生津、宁心安神的功效,属药食同源药材。《本草纲目》曾记载,将五味子分为北五味子与南五味子两类。五味子含有的活性化学成分主要有木脂素、多糖、挥发油等。北五味子挥发油成分、总木脂素的含量及多糖疗效均大于南五味子。其中,五味子乙素(schisandrin B,Sch B)是提取自木兰科植物五味子,也是北五味子中含量最高的联苯环辛烯类木脂素,化学式为C
五味子乙素是从我国传统中药五味子中提取纯化的活性单体,在临床上具有多种药理作用,其中包括抗炎、抑菌、抗氧化、抗肿瘤、改善肾功能、抗阿尔茨海默病、镇静催眠和神经保护等药理作用,且对正常细胞的毒副作用小。目前并没有五味子乙素对化疗引起的神经病理性疼痛的预防和治疗作用相关的研究。发明人意外的发现五味子乙素schisandrin B能作为预防或治疗镇痛的药物使用,尤其是化疗引起的神经病理性疼痛。
发明内容
本发明的目的是提供一种五味子乙素的药物新用途。
本发明提供了所述的五味子乙素或五味子乙素可药用的盐在制备镇痛药物中的应用。
更进一步的,其中所述镇痛为治疗和/或预防化疗诱导的神经病理性疼痛。
更进一步的,其中所述镇痛可减轻化疗引起的神经病理性疼痛。
更进一步的,其中所述的神经病理性疼痛是由化疗药物引起的,所述化疗药物选自铂类、长春碱类、紫杉烷类、蛋白酶体或血管生成抑制剂类,或其组合。
更进一步的,其中所述铂类选自顺铂、卡铂或奥沙利铂;所述长春碱类选自长春新碱,所述紫杉烷类选自紫杉醇或多西紫杉醇;所述蛋白酶体或血管生成抑制剂类选自硼替佐米或沙利度胺,优选地,所述铂类选自顺铂、卡铂或奥沙利铂;所述紫杉烷类选自紫杉醇或多西紫杉醇,更进一步优选,所述铂类选自奥沙利铂;所述紫杉烷类选自紫杉醇。
本发明的目的是提供一种镇痛药物,其活性成分包括五味子乙素或五味子乙素可药用盐。
本发明所述的应用,其中所述的药物为含有五味子乙素或五味子乙素可药用的盐的药物组合物。
本发明所述的应用,其中所述的药物组合物还可含有药物可接受的载体。
本发明所述的应用,所述药物组合物被制成任何可药用的剂型。
本发明所述的应用,所述可药用的剂型,选自片剂,胶囊剂,溶液剂,颗粒剂,粉剂,膏剂,丸剂,混悬剂,栓剂,擦剂,乳剂,涂抹剂,贴剂或喷剂。
本发明所述的应用,所述剂型为单位剂量形式,每个单位剂量中含有五味子乙素或五味子乙素可药用的盐:1-10mg,或10-100mg,或100-1000mg,或1000-10000mg。
以下为对本发明的名词术语的解释和说明:
五味子乙素:英文名schisandrin B,缩写为Sch B,化学式为C
五味子乙素可以从市售购买得到,也可以按照现有技术中的已知方法制备得到。
术语“药学上可接受的”是指某载体、运载物、稀释剂、辅料,和/或所形成的盐通常在化学上或物理上与构成某药物剂型的其它成分相兼容,并在生理上与受体相兼容。
本发明所述药物组合物,可以是任意一种可复用的药物制剂形式,如:口服,注射,外用等形式,口服剂型包括但不限于:片剂,胶囊剂,口服液,颗粒剂,丸剂,混悬剂,注射剂选自水针,粉针,外用制剂选自贴剂,膏剂。所有制剂均可以按照制剂学常规技术制备,如以本发明化合物,或其立体异构体、或其药学上可接受的盐中的任意一项作为药物活性成份,必要时加入药学上可接受的载体,制备成适于服用的上述药物剂型,其中,单位剂量的药物活性成份可以是0.1mg-10000mg,如片剂的每片含有0.1mg-10000mg,优选5-500mg的药物活性成份,或1-10mg的药物活性成份,或10-100mg的药物活性成份,或100-1000mg的药物活性成份,或1000-10000mg的药物活性成份。
术语“盐”和“可药用的盐”是指上述化合物或其立体异构体,与无机和/或有机酸和碱形成的酸式和/或碱式盐,也包括两性离子盐(内盐),还包括季铵盐,例如烷基铵盐。这些盐可以是在化合物的最后分离和纯化中直接得到。也可以是通过将上述化合物,或其立体异构体,与一定数量的酸或碱适当(例如等当量)进行混合而得到。这些盐可能在溶液中形成沉淀而以过滤方法收集,或在溶剂蒸发后回收而得到,或在水介质中反应后冷冻干燥制得。本发明中所述盐可以是化合物的盐酸盐、硫酸盐、枸橼酸盐、苯磺酸盐、氢溴酸盐、氢氟酸盐、磷酸盐、乙酸盐、丙酸盐、丁二酸盐、草酸盐、苹果酸盐、琥珀酸盐、富马酸盐、马来酸盐、酒石酸盐或三氟乙酸盐。
在某些实施方式中,本发明的一种或多种化合物可以彼此联合使用。也可选择将本发明的化合物与任何其它的活性试剂结合使用,用于制备调控细胞功能或治疗疾病的药物或药物组合物。如果使用的是一组化合物,则可将这些化合物同时、分别或有序地对受试对象进行给药。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
本发明的有益技术效果:本发明研究构建大鼠奥沙利铂及紫杉醇引起的两种神经病理性疼痛模型,评价五味子乙素对化疗引起的神经病理性疼痛的预防及治疗作用,本发明药效学试验证明,灌胃给予五味子乙素能够减轻化疗引起的神经病理性疼痛模型的机械痛敏和冷痛敏,从而发挥镇痛作用,表明五味子乙素可以作为镇痛药物使用。
附图说明
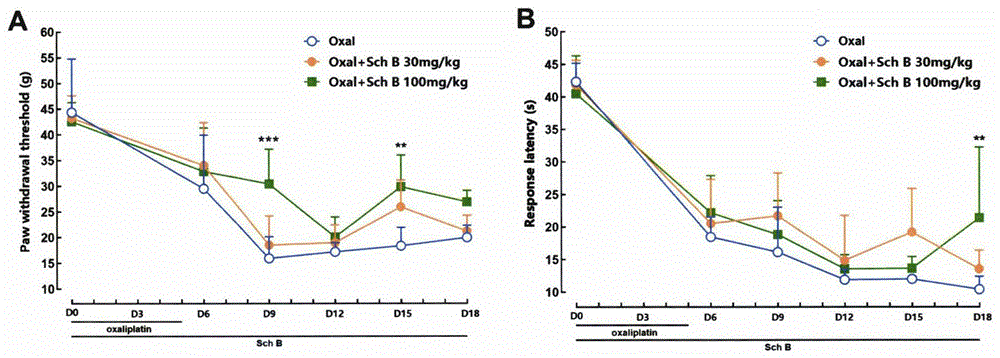
图1为实施例1中预防性给予五味子乙素能减轻奥沙利铂引起的大鼠机械痛敏(A)和冷痛敏(B);在同一时间点,与奥沙利铂模型组相比,P<0.001时用“***”表示:P<0.01时用“**”表示;
图2为实施例2中治疗性给予五味子乙素能减轻奥沙利铂引起的大鼠机械痛敏;在同一时间点,与奥沙利铂模型组相比,P<0.0001时用“****”表示;P<0.001时用“***”表示;P<0.01时用“**”表示,同一给药组中,与Pre-drug(给药前)相比,P<0.0001时用“####”表示;
图3为实施例3中治疗性给予五味子乙素能减轻奥沙利铂引起的大鼠冷痛敏;在同一时间点,与奥沙利铂模型组相比,P<0.05时用“*”表示,同一给药组中,与Pre-drug(给药前)相比,P<0.0001时用“####”表示;P<0.01时用“##”表示;
图4为实施例4中治疗性给予五味子乙素能减轻紫杉醇引起的大鼠机械痛敏;在同一时间点,与紫杉醇模型组相比,P<0.05时用“*”表示,同一给药组中,与Pre-drug(给药前)相比,P<0.01时用“##”表示;
图5为实施例5中治疗性给予五味子乙素能减轻紫杉醇引起的大鼠冷痛敏,同一给药组中,与Pre-drug(给药前)相比,P<0.01时用“##”表示。
具体实施方式
以下通过实施例进一步说明本发明,但不作为对本发明的限制。
实施例1:预防性给予五味子乙素能减轻奥沙利铂引起的大鼠机械痛敏和冷痛敏
实验方法:采用180-220g雄性SD大鼠,随机分成3组,奥沙利铂模型组、五味子乙素30mg/kg组及五味子乙素100mg/kg组,每组6只。
实验开始前对所有大鼠进行机械痛和冷痛基值测定,随后所有大鼠连续5天通过腹腔注射4mg/kg奥沙利铂,每天1次,制备CIPN模型。
使用0.5%CMC-Na溶液将五味子乙素配置成浓度为3mg/ml和10mg/ml两种混悬液。造模第一天起以灌胃的形式对大鼠给予不同浓度的五味子乙素混悬液,以满足最终给药剂量为30和100mg/kg,每天给药1次,共给药19天。在不同时间点使用电子机械测痛仪测定大鼠机械缩足阈(Paw withdrawal thresholds);使用干冰法测定大鼠冷痛反应潜伏期(response latency)。
实验结果:连续注射奥沙利铂后,大鼠逐渐机械缩足阈下降及冷痛反应潜伏期缩短。从D9(第一次注射奥沙利铂当天为D0)开始,与奥沙利铂模型组相比,给予五味子乙素的两组大鼠机械痛敏及冷痛敏均在一定程度上有所缓解,且在某些时间点,与奥沙利铂模型组相比,五味子乙素组能够明显提高大鼠机械缩足阈、延长冷痛反应潜伏期。结果见表1、2及说明书附图图1。
表1实施例1中各组大鼠机械痛敏测试结果
表2实施例1中各组大鼠冷痛敏测试结果
实施例2:治疗性给予五味子乙素能减轻奥沙利铂引起的大鼠机械痛敏
实验方法:采用180-220g雄性SD大鼠,随机分成4组,奥沙利铂模型组8只、五味子乙素30mg/kg组7只、五味子乙素100mg/kg组8只、五味子乙素300mg/kg组7只。
实验开始前对所有大鼠进行机械痛基值测定,随后所有大鼠连续5天通过腹腔注射4mg/kg奥沙利铂,每天1次,制备CIPN模型。
使用0.5%CMC-Na溶液将五味子乙素配置成浓度为3、10、30mg/ml三种浓度的混悬液。造模结束后使用电子测痛仪测定大鼠机械缩足阈(Paw withdrawal thresholds),待大鼠机械缩足阈显著降低后以灌胃的形式给予不同浓度的五味子乙素混悬液,以满足最终给药剂量为30、100、300mg/kg。并继续测定给药后1h、2h、4h各组大鼠机械缩足阈。
实验结果:腹腔注射奥沙利铂造模,D9-D13(第一次注射奥沙利铂当天为D0)给药前测定结果显示各组大鼠机械痛阈值出现明显下降,与造模前相比均具有统计学差异。通过灌胃给予剂量为30、100、300mg/kg的五味子乙素,发现在给药后1h大鼠的机械痛敏出现缓解,与给药前相比,均具有显著性差异,并一直持续至给药后4h。30、100、300mg/kg剂量的五味子乙素均能显著提高大鼠机械缩足阈,且呈剂量依赖性。结果参见表3及说明书附图图2。
表3实施例2中各组大鼠机械痛敏测试结果
实施例3:治疗性给予五味子乙素能减轻奥沙利铂引起的大鼠冷痛敏
实验方法:采用180-220g雄性SD大鼠,随机分成2组,奥沙利铂模型组8只、五味子乙素组6只。
实验开始前对所有大鼠进行冷痛基值测定,随后所有大鼠连续5天通过腹腔注射4mg/kg奥沙利铂,每天1次,制备CIPN模型。
使用0.5%CMC-Na溶液将五味子乙素配置成浓度为10mg/ml混悬液。造模结束后使用干冰测定大鼠冷痛反应潜伏期(response latency),待大鼠冷痛反应潜伏期显著降低后以灌胃的形式给予五味子乙素混悬液,以满足最终给药剂量为100mg/kg。并继续测定给药后1h、2h、4h各组大鼠冷痛反应潜伏期。
实验结果:腹腔注射奥沙利铂造模,D9-D17(第一次注射奥沙利铂当天为D0)给药前测定结果显示各组大鼠出现冷痛反应潜伏期明显缩短。通过灌胃给予100mg/kg的五味子乙素,发现在给药后1h大鼠的冷痛敏出现缓解,并一直持续至给药后4h,期间1h、2h两个时刻点与奥沙利铂模型组大鼠相比,五味子乙素组大鼠冷痛反应潜伏期明显延长。结果参见表4及说明书附图图3。
表4实施例3中各组大鼠冷痛敏测试结果
实施例4:治疗性给予五味子乙素能减轻紫杉醇引起的大鼠机械痛敏
实验方法:采用180-220g雄性SD大鼠,随机分成2组,紫杉醇模型组8只、五味子乙素100mg/kg组9只。
实验开始前对所有大鼠进行机械痛基值测定,随后所有大鼠每隔1天通过腹腔注射2mg/kg紫杉醇,共4次,制备CIPN模型。
使用0.5%CMC-Na溶液将五味子乙素配置成浓度为10mg/ml混悬液。造模结束后使用电子测痛仪测定大鼠机械缩足阈(Paw withdrawal thresholds),待大鼠机械缩足阈显著降低后以灌胃的形式给予五味子乙素混悬液,以满足最终给药剂量为100mg/kg。并继续测定给药后1h、2h、4h各组大鼠机械缩足阈。
实验结果:腹腔注射紫杉醇造模,D23-D29(第一次注射紫杉醇当天为D0)给药前测定结果显示各组大鼠出现机械痛阈值下降明显,与造模前相比均具有统计学差异。通过灌胃给予100mg/kg的五味子乙素,发现在给药后1h大鼠的机械痛敏出现缓解,与给药前相比,具有统计学差异。给药后2h,五味子乙素组与紫杉醇模型组相比具有统计学差异。结果参见表5及说明书附图图4。
表5实施例4中各组大鼠机械痛敏测试结果
实施例5:治疗性给予五味子乙素能减轻紫杉醇引起的大鼠冷痛敏
实验方法:采用180-220g雄性SD大鼠共12只,随机分成2组,紫杉醇模型组和五味子乙素100mg/kg组,每组各6只。
实验开始前对所有大鼠进行冷痛基值测定,随后所有大鼠每隔1天通过腹腔注射2mg/kg紫杉醇,共4次,制备CIPN模型。
使用0.5%CMC-Na溶液将五味子乙素配置成浓度为10mg/ml混悬液。造模结束后使用干冰测定大鼠冷痛反应潜伏期(response latency),待大鼠冷痛反应潜伏期显著降低后以灌胃的形式给予五味子乙素混悬液,以满足最终给药剂量为100mg/kg。并继续测定给药后1h、2h、4h各组大鼠冷痛反应潜伏期。
实验结果:腹腔注射紫杉醇造模,D16-D20(第一次注射紫杉醇当天为D0)给药前测定结果显示各组大鼠出现冷痛反应潜伏期缩短明显。通过灌胃给予100mg/kg的五味子乙素,虽在任意时间点,与紫杉醇模型组相比未见明显差异,但在给药后1h、4h大鼠的冷痛敏出现缓解,与给药前相比,冷痛反应潜伏期明显延长(P<0.01)。结果参见表6及说明书附图图5。
表6实施例5中各组大鼠冷痛敏测试结果
实施例6:五味子乙素片剂制备
处方如下:五味子乙素5g
聚维酮K9015g
微晶纤维素MCC10215g
交联羧甲纤维素钠CCNa15g
微粉硅胶15g
处方制备工艺:量取500ml乙醇,在其中加入15g聚维酮K90充分振荡溶解,然后加入五味子乙素5g,放入旋蒸仪,浓缩至溶剂基本挥发,骤冷,干燥,所得固体粉碎过80目筛,得到五味子乙素固体分散体。然后,15g微晶纤维素MCC102、15g交联羧甲纤维素钠CCNa、15g微粉硅胶分别过80目筛,再与五味子乙素固体体分散体混合均匀,按每片50mg五味子乙素直接压片,得到五味子乙素片剂。
实施例7:五味子乙素片剂制备
处方如下:五味子乙素5g
聚维酮K9020g
微晶纤维素MCC10210g
交联羧甲纤维素钠CCNa10g
微粉硅胶10g
处方制备工艺:量取500ml乙醇,在其中加入20g聚维酮K90充分振荡溶解。然后加入五味子乙素5g,加入旋蒸仪,浓缩至溶剂基本挥发,骤冷,干燥,所得固体粉碎过80目筛,得到五味子乙素固体分散体。然后,10g微晶纤维素MCC102、10g交联羧甲纤维素钠CCNa、10g微粉硅胶分别过80目筛,再与五味子乙素固体体分散体混合均匀,按每片50mg五味子乙素直接压片,得到五味子乙素片剂。
实施例8:五味子乙素胶囊剂制备
处方如下:五味子乙素330g
微晶纤维素250g
交联羧甲基纤维素钠16g
微粉硅胶60g
硬脂酸镁4g
5%聚乙烯吡咯烷酮水溶液适量
处方制备工艺:将处方中微晶纤维素和辅料分别过80目筛,称量处方量的五味子乙素与各辅料混合均匀后,加入5%聚乙烯吡咯烷酮水溶液制软材,制粒,干燥,整粒、加入滑石粉,混匀,填装胶囊即得1000粒。
实施例9:五味子乙素胶囊剂制备
处方如下:五味子乙素160g
微晶纤维素250g
交联羧甲基纤维素钠16g
微粉硅胶60g
硬脂酸镁4g
5%聚乙烯吡咯烷酮水溶液适量
处方制备工艺:将处方中微晶纤维素和辅料分别过80目筛,称量处方量的五味子乙素与各辅料混合均匀后,加入5%聚乙烯吡咯烷酮水溶液制软材,制粒,干燥,整粒、加入滑石粉,混匀,填装胶囊即得1000粒。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以权利要求的保护范围为准。
- 水蛭唾液在制备镇痛药物中的应用
- 2甲基-5-乙酰-4-呋喃吉玛-1(10)-烯-6-酮在制备镇痛药物中的应用
- 环烯醚萜类化合物在制备镇痛药物中的应用
- 一种JQ1或其衍生物在制备镇痛药物中的应用
- 4-异丁基-2-吡咯烷酮在制备镇痛药物中的应用、一种镇痛药物
- 抗癌镇痛的中药组合物、其制备方法和它在制备治疗抗癌产品和镇痛药物中的应用
