高密度细胞存储方法
文献发布时间:2023-06-19 10:02:03
本发明申请是基于申请日为2014年3月14日,申请号为201480015761.2(国际申请号为PCT/US2014/027757)、名称为“高密度细胞存储方法”的发明专利申请的分案申请。
相关申请
本申请要求2013年3月15日递交的美国临时申请No.61/793,021的优先权,将其内容通过提述以其整体并入本文用于全部用途。
背景技术
常规细胞存储(cell banking)广泛用于保存冷冻的、特征性的细胞,这些细胞可能被解冻用于多种应用,包括治疗相关蛋白的生产。通常而言,将冷冻保存的储液(cryopreserved stock)以较低的密度保存,或者离心以生成更高密度的等分试样用于储存。较低密度的储液不允许有效接种大体积的培养物,而基于离心的浓缩方法对于细胞可以是非常有破坏性的(在冷冻保存过程期间细胞会变得更加脆弱)。因此,需要改进的细胞存储方法。
发明内容
本公开提供了改进的创建细胞库的方法。在某些方面,本发明的细胞存储方法采用灌注培养技术和细胞的非离心浓缩以允许以出乎意料高的细胞密度进行冷冻保存,同时保持出色的细胞活力以供稍后在生产细胞培养物中使用。
因此,在一方面,本发明提供用于产生高密度冷冻细胞库的非离心方法,所述方法包括:a)在灌注生物反应器中培养细胞,其中所述生物反应器与细胞保留系统偶联;b)以非离心的方式浓缩所述细胞以产生浓缩的细胞群体;和c)冷冻保存浓缩的细胞群体以产生高密度冷冻细胞库。
在一个实施方案中,所述细胞保留系统包含交替切向流过滤系统(alternatingtangential flow filtration system),所述交替切向流过滤系统包含过滤器。在另一个实施方案中,所述过滤器具有至少0.3m
在一个实施方案中,所述过滤器具有约0.2μm的孔径。
在一个实施方案中,所述浓缩的细胞群体具有至少约1x10^8个细胞/mL的细胞密度。
在一个实施方案中,所述浓缩的细胞群体具有约1x10^8个细胞/mL的细胞密度。
在一个实施方案中,所述冷冻保存包括以约5%至约10%体积/体积的终浓度将DMSO添加至浓缩的细胞群体。在另一个实施方案中,所述冷冻保存包括将至少一部分浓缩的细胞群体冷冻在适合于在冷冻保存条件下储存的容器中。
在一个实施方案中,所述容器是小瓶。在一个实施方案中,所述容器具有至少2mL的体积。在一个实施方案中,所述容器具有约5mL的体积。
在一个实施方案中,所述高密度冷冻细胞库包含约4.5x10^8个细胞。
在一个实施方案中,所述容器是冷冻袋。在另一个实施方案中,冷冻袋具有约5至约150mL的体积。
在一个实施方案中,所述高密度冷冻细胞库具有约1x10^8个细胞/mL的细胞密度。
在一个实施方案中,所述灌注生物反应器中的灌注速率为至少约0.2nL/细胞/天。
在一个实施方案中,所述灌注生物反应器细胞培养物具有约7的pH和至少约40%的溶解氧浓度。
在一个实施方案中,所述生物反应器是柔性袋式生物反应器。在另一个实施方案中,所述柔性袋式生物反应器具有10L的体积。在另一个实施方案中,所述柔性袋式生物反应器具有至少20L的体积。在另一个实施方案中,所述柔性袋式生物反应器进一步包含至少一个汲取管(dip tube)。
在一个实施方案中,所述高密度冷冻细胞库具有至少60%的解冻后活力。在另一个实施方案中,所述高密度冷冻细胞库具有至少90%的解冻后活力。在另一个实施方案中,所述高密度冷冻细胞库具有至少95%的解冻后活力。
在一个实施方案中,所述细胞是哺乳动物细胞。在另一个实施方案中,所述哺乳动物细胞选自下组:CHO、CHO-DBX11、CHO-DG44、CHO-S、CHO-K1、Vero、BHK、HeLa、COS、MDCK、HEK-293、NIH-3T3、W138、BT483、Hs578T、HTB2、BT20、T47D、NS0、CRL7030、HsS78Bst细胞、PER.C6、SP2/0-Agl4和杂交瘤细胞。
在一个实施方案中,所述细胞是经转染的细胞。
在一个方面,本发明提供用于产生高密度冷冻细胞库的非离心方法,所述方法包括:a)在灌注生物反应器中培养细胞,所述灌注生物反应器偶联至交替切向流过滤系统,其中所述生物反应器包含柔性袋式生物反应器,并且其中所述过滤器具有至少0.3m
在一个实施方案中,所述培养物的pH和DO通过自动化方法控制。
在一个实施方案中,所述培养物的pH和DO通过非自动化方法控制。在另一个实施方案中,所述pH和DO通过以下中的任何一种或多种控制:调节引入至所述培养物中的气体的混合物,调节生物反应器的摇动速率(rock rate),或调节生物反应器的摇动角度(rockangle)。
在一个实施方案中,所述生物反应器以15rpm并以8°的摇动角度摇动。
因此,在一个方面,本发明提供用于产生高密度冷冻细胞库的非离心方法,所述方法包括:a)在灌注生物反应器中培养细胞,其中将所述生物反应器偶联至细胞保留系统;b)以非离心的方式浓缩所述细胞以产生浓缩的细胞群体;和c)冷冻保存浓缩的细胞群体以产生高密度冷冻细胞库。
在一个实施方案中,所述细胞保留系统包含交替切向流过滤系统,所述交替切向流过滤系统包含过滤器。在另一个实施方案中,所述过滤器具有至少0.3m
在一个实施方案中,所述过滤器约0.2μm的孔径。
在一个实施方案中,所述浓缩的细胞群体具有至少约1.1x10^8个细胞/mL的细胞密度。
在一个实施方案中,所述浓缩的细胞群体具有约1.1x10^8个细胞/mL的细胞密度。
在一个实施方案中,所述冷冻保存包括以约5%至约10%体积/体积(vol/vol)的终浓度将DMSO添加至浓缩的细胞群体。在另一个实施方案中,所述冷冻保存包括将至少一部分浓缩的细胞群体冷冻在适合于在冷冻保存条件下储存的容器中。
在一个实施方案中,所述容器是小瓶。在一个实施方案中,所述容器具有至少2mL的体积。在一个实施方案中,所述容器具有至少约5mL的体积。
在一个实施方案中,所述高密度冷冻细胞库包含约4.5x10^8个细胞。
在一个实施方案中,所述容器是冷冻袋。在另一个实施方案中,冷冻袋具有约5至约150mL的体积。
在一个实施方案中,所述高密度冷冻细胞库具有约1x10^8个细胞/mL的细胞密度。
在一个实施方案中,所述灌注生物反应器中的灌注速率为至少约0.2nL/细胞/天。
在一个实施方案中,所述灌注生物反应器细胞培养物具有约7的pH和至少约40%的溶解氧浓度。
在一个实施方案中,所述生物反应器是柔性袋式生物反应器。在另一个实施方案中,所述柔性袋式生物反应器具有10L的体积。在另一个实施方案中,所述柔性袋式生物反应器具有至少20L的体积。在另一个实施方案中,所述柔性袋式生物反应器进一步包含至少一个汲取管(dip tube)。
在一个实施方案中,所述高密度冷冻细胞库具有至少60%的解冻后活力。在另一个实施方案中,所述高密度冷冻细胞库具有至少90%的解冻后活力。在另一个实施方案中,所述高密度冷冻细胞库具有至少95%的解冻后活力。
在一个实施方案中,所述细胞是哺乳动物细胞。在另一个实施方案中,所述哺乳动物细胞选自下组:CHO、CHO-DBX11、CHO-DG44、CHO-S、CHO-K1、Vero、BHK、HeLa、COS、MDCK、HEK-293、NIH-3T3、W138、BT483、Hs578T、HTB2、BT20、T47D、NS0、CRL7030、HsS78Bst细胞、PER.C6、SP2/0-Agl4和杂交瘤细胞。
在一个实施方案中,所述细胞是经转染的细胞。
在一个方面,本发明提供用于产生高密度冷冻细胞库的非离心方法,所述方法包括:a)在灌注生物反应器中培养细胞,所述灌注生物反应器偶联至交替切向流过滤系统,其中所述生物反应器包含柔性袋式生物反应器,并且其中所述过滤器具有至少0.3m
在一个实施方案中,所述培养物的pH和DO通过自动化方法控制。
在一个实施方案中,所述培养物的pH和DO通过非自动化方法控制。在另一个实施方案中,所述pH和DO通过以下中的任何一种或多种控制:调节引入至所述培养物中的气体的混合物,调节生物反应器的摇动速率,或调节生物反应器的摇动角度。
在一个实施方案中,所述生物反应器以15rpm以8°的摇动角度摇动。
在一个方面,本发明提供用于产生高密度冷冻细胞库的非离心方法,所述方法包括:a)在灌注生物反应器中培养细胞,其中搅拌所述生物反应器以进行有效的混合和气体交换,其中将所述生物反应器偶联至细胞保留系统;b)以非离心的方式浓缩所述细胞以产生浓缩的细胞群体;和c)冷冻保存浓缩的细胞群体以产生高密度冷冻细胞库。
在一个实施方案中,所述细胞保留系统包含交替切向流过滤系统,所述交替切向流过滤系统包含过滤器。在另一个实施方案中,所述过滤器具有至少0.3m
在一个实施方案中,所述过滤器具有选自0.2μm、0.4μm和0.65μm的孔径。
在一个实施方案中,所述浓缩的细胞群体具有选自1.0x10^8个细胞/mL、1.1x10^8个细胞/mL、1.2x10^8个细胞/mL、1.3x10^8个细胞/mL、1.5x10^8个细胞/mL、1.7x10^8个细胞/mL和2.0x10^8个细胞/mL的细胞密度。
在一个实施方案中,所述冷冻保存包括以约5%至约10%体积/体积的终浓度将DMSO添加至浓缩的细胞群体。在另一个实施方案中,所述冷冻保存包括将至少一部分浓缩的细胞群体冷冻在适合于在冷冻保存条件下储存的容器中。
在一个实施方案中,所述容器是小瓶。在一个实施方案中,所述容器具有至少2mL的体积。在一个实施方案中,所述容器具有约5mL的体积。
在一个实施方案中,所述高密度冷冻细胞库包含约4.5x10^8个细胞。
在一个实施方案中,所述容器是冷冻袋。在另一个实施方案中,冷冻袋具有约5至约150mL的体积。
在一个实施方案中,所述高密度冷冻细胞库具有约1x10^8个细胞/mL的细胞密度。
在一个实施方案中,所述灌注生物反应器中的灌注速率为约0.2nL/细胞/天至约0.5nL/细胞/天。
在一个实施方案中,所述关注生物反应器细胞培养物具有约6.8至约7.2的pH。
在一个实施方案中,所述灌注生物反应器细胞培养物具有至少约30%的溶解氧浓度。
在一个实施方案中,所述生物反应器是柔性袋式生物反应器。在另一个实施方案,所述柔性袋式生物反应器具有10L的体积。在另一个实施方案中,所述柔性袋式生物反应器具有至少20L的体积。在另一个实施方案中,所述柔性袋式生物反应器进一步包含至少一个汲取管。
在一个实施方案中,所述高密度冷冻细胞库具有至少60%的解冻后活力。在另一个实施方案中,所述高密度冷冻细胞库具有至少90%的解冻后活力。在另一个实施方案中,所述高密度冷冻细胞库具有至少95%的解冻后活力。
在一个实施方案中,所述细胞是哺乳动物细胞。在另一个实施方案中,所述哺乳动物细胞选自下组:CHO、CHO-DBX11、CHO-DG44、CHO-S、CHO-K1、Vero、BHK、HeLa、COS、MDCK、HEK-293、NIH-3T3、W138、BT483、Hs578T、HTB2、BT20、T47D、NS0、CRL7030、HsS78Bst细胞、PER.C6、SP2/0-Agl4和杂交瘤细胞。
在一个实施方案中,所述细胞是经转染的细胞。
在一个方面,本发明提供用于产生高密度冷冻细胞库的非离心方法,所述方法包括:a)在灌注生物反应器中培养细胞,所述灌注生物反应器偶联至交替切向流过滤系统,其中所述生物反应器包含柔性袋式生物反应器,并且其中所述过滤器具有至少0.3m
在一个实施方案中,所述培养物的pH和DO通过自动化方法控制。
在一个实施方案中,所述培养物的pH和DO通过非自动化方法控制。在另一个实施方案中,所述pH和DO通过以下中的任何一种或多种控制:调节引入至所述培养物中的气体的混合物,调节生物反应器的摇动速率,或调节生物反应器的摇动角度。
在一个实施方案中,所述生物反应器至少以15rpm的速率并以至少8°的摇动角度摇动。
在一个实施方案中,所述生物反应器以15rpm并以8°的摇动角度摇动。
在一个实施方案中,所述生物反应器以22rpm并以10°的摇动角度摇动。
具体地,本发明涉及如下各项:
1.一种用于产生高密度冷冻细胞库的非离心方法,所述方法包括:
a)在灌注生物反应器中培养细胞,其中搅拌所述生物反应器以进行有效的混合和气体交换,其中将所述生物反应器偶联至细胞保留系统;
b)以非离心的方式浓缩所述细胞以产生浓缩的细胞群体;
c)冷冻保存浓缩的细胞群体以产生高密度冷冻细胞库。
2.项1的方法,其中所述细胞保留系统包含交替切向流过滤系统,所述交替切向流过滤系统包含过滤器。
3.项2的方法,其中所述过滤器具有至少0.3m
4.前述项中任一项的方法,其中所述过滤器具有选自0.2μm、0.4μm和0.65μm的孔径。
5.前述项中任一项的方法,其中所述浓缩的细胞群体具有选自1.0x10^8个细胞/mL、1.1x10^8个细胞/mL、1.2x10^8个细胞/mL、1.3x10^8个细胞/mL、1.5x10^8个细胞/mL、1.7x10^8个细胞/mL和2.0x10^8个细胞/mL的细胞密度。
6.前述项中任一项的方法,其中所述冷冻保存包括以约5%至约10%体积/体积的终浓度将DMSO添加至浓缩的细胞群体。
7.前述项中任一项的方法,其中所述冷冻保存包括将至少一部分浓缩的细胞群体冷冻在适合于在冷冻保存条件下储存的容器中。
8.项7的方法,其中所述容器是小瓶。
9.项7的方法,其中所述容器是冷冻袋。
10.前述项中任一项的方法,其中所述高密度冷冻细胞库具有约1x10^8个细胞/mL的细胞密度。
11.前述项中任一项的方法,其中所述灌注生物反应器中的灌注速率为约0.2nL/细胞/天至约0.5nL/细胞/天。
12.前述项中任一项的方法,其中所述灌注生物反应器细胞培养物具有约6.8至约7.2的pH。
13.前述项中任一项的方法,其中所述灌注生物反应器细胞培养物具有至少约30%的溶解氧浓度。
14.前述项中任一项的方法,其中所述生物反应器是柔性袋式生物反应器。
15.前述项中任一项的方法,其中所述高密度冷冻细胞库具有选自至少60%、至少约90%和至少约95%的解冻后活力。
16.前述项中任一项的方法,其中所述细胞是哺乳动物细胞。
17.前述项中任一项的方法,其中所述细胞是经转染的细胞。
18.一种用于产生高密度冷冻细胞库的非离心方法,所述方法包括:
a)在灌注生物反应器中培养细胞,所述灌注生物反应器偶联至交替切向流过滤系统,其中所述生物反应器包含柔性袋式生物反应器,并且其中所述过滤器具有至少0.3m
b)使用交替切向流过滤系统以非离心的方式浓缩所述细胞,以产生具有大于约1x10^8个细胞/mL的密度的浓缩的细胞群体;
c)冷冻保存所述浓缩的细胞群体以产生高密度冷冻细胞库,其中所述冷冻保存包括以约5%至约10%体积/体积的终浓度将DMSO添加至浓缩的细胞群体;并且其中所述高密度冷冻细胞库具有约1x10^8个细胞的细胞密度。
19.前述项中任一项的方法,其中所述培养物的pH和DO通过自动化方法控制。
20.前述项中任一项的方法,其中所述培养物的pH和DO通过非自动化方法控制。
附图简述
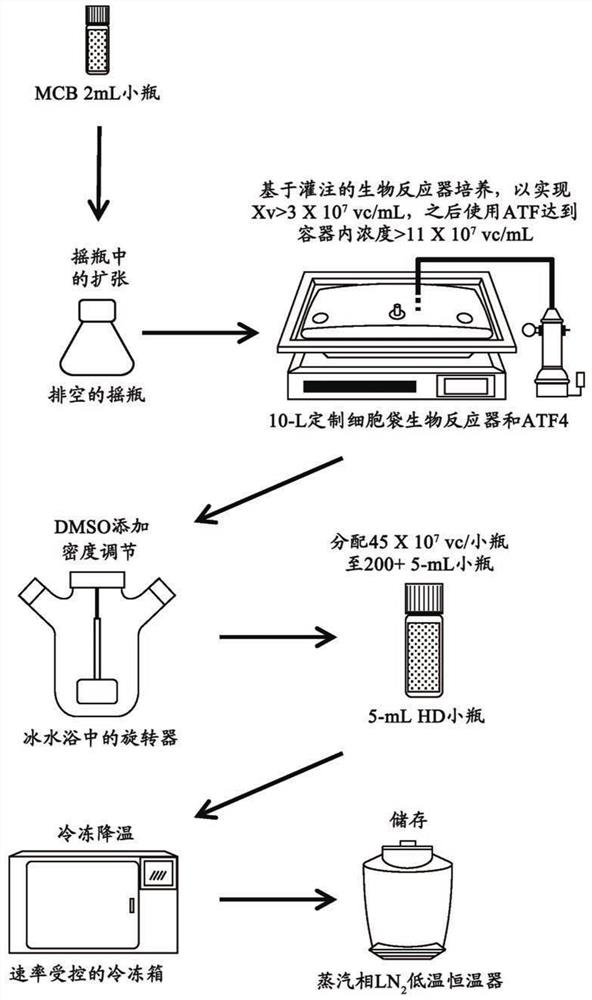
图1:是高密度细胞冷冻存储方法的图。
图2:是描述使用不同细胞保留方法的
图3:是使用在生长期间多个时间点收获的培养物制备的小型库(mini-bank)的存储后表现(活细胞密度(Xv),活力)的图。
图4:是使用在生长期间多个时间点收获的培养物制备的小型库的存储后表现(晚期凋亡)的图。
图5:是显示具有和不具有自动化pH和DO反馈控制条件下的细胞生长的图。
图6:是显示具有和不具有自动化pH和DO反馈控制的条件下的pH和DO谱的图。
图7A-B:是在以下不同阶段的细胞的活细胞密度(A)和晚期凋亡(B)的图:浓缩前、浓缩后和暴露于DMSO之后0-120分钟。
图8A-B:是与正常密度库相比,rCHO细胞系1高密度库的存储后性能(A)和晚期凋亡(B)的图。
图9A-B:是与正常密度库相比,rCHO细胞系2高密度库的存储后性能(A)和晚期凋亡(B)的图。
图10A-B:是与正常密度库相比,rCHO细胞系3高密度库的存储后性能(A)和晚期凋亡(B)的图。
图11:是表明使用不同细胞保留系统时,随时间经过的培养物的浓度的图。
发明详述
本公开提供高密度细胞冷冻存储的方法,包括使用与非离心细胞保留装置连接的灌注培养系统。
I.定义
如用于本文,术语“分批培养”指如下细胞培养技术,其中用细胞接种一定量的新鲜培养基,所述细胞快速进入对数生长期,并且其中不连续移出并用新鲜培养基替换所述培养的生长培养基。
如用于本文,术语“补料分批培养”指如下细胞培养技术,其中最初用细胞接种一定量的新鲜培养基,并在培养过程期间向培养物(连续或以不连续的增量)补料另外的培养营养物,在培养终止之前进行或不进行周期性细胞和/或产物收获。
如用于本文,术语“灌注培养”指如下细胞培养技术,其中用细胞接种一定量的新鲜培养基,所述细胞快速进入对数生长期(同上),并且其中从培养物连续移出生长培养基并且用新鲜培养基替换。
如用于本文,术语“生物反应器”应指用于培养细胞的容器。
在一个实施方案中,生物反应器是“柔性袋式生物反应器”。“柔性袋式生物反应器”是一种无菌腔,其能够容纳液体培养基并且额外地包含连接器、端口、接合器(adaptor)和柔性管道。在一个实施方案中,所述腔由塑料制成。在具体实施方案中,所述腔由多层层压透明塑料制成。在进一步的具体实施方案中,所述腔由多层层压透明塑料制成,并且具有由USP VI级乙烯醋酸乙烯酯/低密度聚乙烯共聚物制成的液体接触层,同时外层由低密度聚乙烯制成。
另外,所述连接器、端口和接合器可由任何类型的塑料制成,包括但不限于:聚乙烯、聚丙烯和聚碳酸酯;而所述管道可由任何类型的塑料构建,包括但不限于:热塑弹性体或聚硅氧烷(例如,铂固化聚硅氧烷(platinum-cured silicone))。
合适的“柔性袋式生物反应器”腔在本领域可为常见的,并且包括但不限于美国专利号6,544,788中所述的那些,将该专利通过提述整体并入本文。
所述“柔性袋式生物反应器”腔可以用培养基部分填充,然后充气至硬挺。然后可以将其置于摇动平台上(如BASE20/50EHT摇动单元,来自GE Life Sciences),所述摇动平台通过预设的摇动角度和预设的摇动速率往复移动。这种摇动运动引起培养基中的波浪状运动,促进搅拌和氧气转移,从而改进细胞培养的性能。预设摇动角度可以是至少约4度,例如约4度、5度、6度、7度、8度、9度、10度、11度或12度。另外,预设摇动速率可以按照每分钟摇动速率(rpm)设定,其为至少约6rpm,例如约7rpm、8rpm、9rpm、10rpm、11rpm、12rpm、13rpm、14rpm、15rpm、16rpm、17rpm、18rpm、19rpm、20rpm、21rpm、22rpm、23rpm、24rpm、25rpm、26rpm、27rpm、28rpm、29rpm、30rpm、31rpm、32rpm、33rpm、34rpm、35rpm、36rpm、37rpm、38rpm、39rpm或40rpm。在具体的实施方案中,每分钟的摇动速率为约8rpm。在具体的实施方案中,每分钟的摇动速率为约15rpm。在另一具体的实施方案中,每分钟的摇动速率为约22rpm。
如用于本文,术语“细胞保留系统”指能够通过使用过滤器将细胞与在其中的培养基和废料产物分开的全部装置。过滤器可以包括任何形状的膜、陶瓷或金属过滤器,所述形状包括螺旋盘绕、管状或片状。过滤器可以具有不同的表面积。例如,过滤器表面积可以是约0.3m
如用于本文,术语“冷冻保存(cryopreservation)”指如下过程,通过该过程将容易因为时间或因为酶或化学活性造成损伤的细胞、组织或任何其他物质通过将它们降温并储存至零下的温度来保存。
如用于本文,术语“冷冻储存(banking)”指如下技术,通过该技术将细胞与冷冻保护剂(例如,具有或不具有羟乙基淀粉(HES)的DMSO)混合并置于适合于在冷冻保存条件下的储存的容器中。然后将这些容器使用本领域熟知的技术冷冻,并在低温储存,通常在约-130℃至约-195℃。通过该过程获得的细胞收集物(collection)是细胞库。
在一个实施方案中,所述细胞库是高密度细胞库。如用于本文,术语“高密度细胞库”应指已经以高密度进行了冷冻的冷冻存储的细胞等分试样,其中所述是至少约7x10^7个活细胞/mL,例如,其是约7x10^7个活细胞/mL、8x10^7个活细胞/mL、9x10^7个活细胞/mL、1x10^8个活细胞/mL、2x10^8个活细胞/mL或3x10^8个活细胞/mL。可以根据本领域可用的任何方法冷冻细胞,并且在任何适合于在冷冻保存条件下的储存的容器中。
在另一个实施方案中,所述细胞库是主细胞库(master cell bank)。如用于本文,术语“主细胞库”应指细胞(例如,充分表征的细胞)的培养物,所述细胞从单个克隆培养而来,被分配至储存容器中(例如在单个操作中分配至容器中),并且储存在如上所述的冷冻保存条件下。在某些实施方案中,所述细胞适合于稍后用于生产细胞培养和由此产生的治疗相关蛋白的进一步收获。
在另一个实施方案中,所述细胞库是小型细胞库。如用于本文,术语“小型库”应指根据“冷冻存储”方法(如上所述)冷冻保存的细胞的等分试样,但由较之会正常用于创建细胞库的更少的样品构成。这种类型的库通常可用于在创建细胞库如“主细胞库”之前优化考虑用于细胞系冷冻保存的条件。作为一个例子,使用“小型库”来决定用于本公开中描述的高密度细胞存储过程的最佳细胞密度。
如用于本文,术语“适合于在冷冻保存条件下的储存的容器”包括可在适合于在约-130℃至约-195℃之间的细胞存储的条件下使用的任何容器。这些容器包括但不限于由适合于冷冻保存的材料制成的小瓶。这些材料包括聚合物(例如聚四氟乙烯、聚苯乙烯、聚乙烯或聚丙烯)。另外,可以对冷冻保存小瓶的表面应用表面处理,从而改进冷冻保存条件(例如降低吸附和变性的亲水涂层)。在示例性实施方案中,小瓶可以具有超过约0.1mL的体积,例如所述小瓶可以具有约0.1mL、约0.5mL、约0.75mL、约1mL、约2mL、约2.5mL、约5mL、约10mL、约15mL、约20mL、约25mL或约50mL的体积。所述容器也可以是冷冻袋。
如用于本文,术语“冷冻袋”是能够容纳液体培养基的无菌腔,其适合于在约-130℃-约-195℃的细胞储存,并且可额外包含连接器、端口、接合器和柔性管道。所述冷冻袋可以由任何合适材料构建,包括但不限于聚合物,如聚四氟乙烯、聚苯乙烯、聚乙烯、聚丙烯、氟化乙烯丙烯(FEP)和乙烯醋酸乙烯酯(EVA)。示例性冷冻袋包括但不限于:Kryo
如用于本文,术语“摇瓶”应指用作培养瓶的容器,其中在温育过程中不断摇动所述培养基。
如用于本文,术语“摇瓶接种物训练(shake flask seed train)”应指细胞扩充方法,其中首先将细胞的等分试样在摇瓶中培养(接种),并使其在其中生长。将细胞根据其生长速率进行培养,并且在其生长过程中通常分装至较大的和/或多个容器中,直到生物质达到足以接种生物反应器的水平。
如用于本文,术语“接种密度”应指接种烧瓶或生物反应器的初始细胞密度。
如用于本文,术语“治疗相关蛋白”应指可用于创建针对疾病或病症的治疗或用于治疗动物中的疾病或病症的任何蛋白质,所述动物包括哺乳动物如小鼠、大鼠、猴、猿和人。这些蛋白质可包括但不限于结合性多肽如单克隆抗体、Fc融合蛋白、抗凝剂、血液因子、骨形态发生蛋白、工程化蛋白支架、酶、生长因子、激素、干扰素、白介素和溶栓剂。
如用于本文,术语“结合性多肽”或“结合多肽”应指含有至少一个结合位点的多肽(例如,抗体),所述结合位点负责选择性结合至感兴趣的靶抗原(例如,人抗原)。示例性结合位点包括抗体可变结构域、受体的配体结合位点或配体的受体结合位点。在某些方面,本发明的结合性多肽包含多个(例如,两个、三个、四个或更多个)结合位点。
如用于本文,术语“抗体”指这样的组装物(例如,完整抗体分子、抗体片段或其变体),其对感兴趣的抗原(例如与抗原相关的肿瘤)具有显著的已知特异性免疫反应活性。抗体和免疫球蛋白包含轻链和重链,在它们之间具有或不具有链间共价连接。脊椎动物系统中的基础免疫球蛋白结构相对而言是得到充分理解的。
通称术语“抗体”包含五种独特的抗体类型,其能够在生物化学方面加以区分。全部五种抗体类型都明确包括在本公开的范围内,以下讨论内容会通常针对IgG类的免疫球蛋白分子。关于IgG,免疫球蛋白包含两条相同的分子量大约23000道尔顿的轻链,和两条相同的分子量53000-70000的重链。四条连通过二硫键以“Y”构型结合起来,其中从“Y”的开口开始轻链将重链托起并延续通过整个可变区。
II.
传统细胞培养涉及“分批”培养过程。在这种培养类型中,用快速进入对数生长期的细胞接种一定量的新鲜培养基。随着这些细胞的生长和分裂,它们消耗来自培养基的可用营养物并分泌有害废料产物。随着时间经过,培养物会进入静止生长期,并最进入衰减期。尽管对“分批”培养过程的修改已经使其随着时间变得更有效率,但是所得的修改过的分批培养方案仍然导致了快速的生长和衰减周期。另外,“分批”培养过程具有有限的达到允许高密度细胞存储所需细胞密度水平的能力。
“补料分批”培养过程指在传统“分批”培养技术上在细胞培养技术中进一步的改进。尽管这种方法允许更高的细胞密度生长,但是其仍然受限于其允许高密度细胞培养物有效生长并且因此有效生成用于高密度细胞存储的细胞的能力。
在优选的实施方案中,本发明采用了灌注培养方法。灌注培养是一种用于培养细胞的方法,其中用快速进入对数生长期的细胞接种一定量的新鲜培养基(同上),并且其中从培养连续移出生长培养基并用新鲜培养基替换。以这种方法,培养物不断接受具有高水平营养物的新鲜培养基,同时移出含有废料产物并具有较低水平营养物的培养基。这种培养类型允许保持细胞的对数生长,其中至少每天交换一个培养体积,并且所述细胞浓度可比在传统或改良的分批培养中实现的高得多(2倍至超过10倍之间的增加)。在本发明的一个实施方案中,细胞特异性灌注速率(CSPR)可为约0.02nL细胞
在某些实施方案中,可以调节培养物的pH、温度、溶解氧浓度(DO)和摩尔渗透压浓度以最大化培养的健康程度和生产力。控制培养物的DO和pH的一种方法是通过自动化反馈控制仪。这种类型的自动化控制仪使用基于微处理器的计算机来操作以监控和调节培养物的pH和DO,并由此保持用于细胞生长的最佳条件。然而,这些自动化反馈控制系统价格昂贵。因此,在某些实施方案中,可以采用非自动化方法控制这些参数。在一个示例性实施方案中,可使用任何如下方法来控制选择的参数(例如pH或DO):调节在培养物之上流动的气体混合物、调节
在一个实施方案中,二氧化碳气体的起始水平是在大约10%,而氧气的起始水平是在约20%,伴随约0.2升每分钟(lpm)的空气流速。如果pH不超过约6.9,那么可以将CO2设定点从10%降低至5%。如果在稍后的时间点pH仍然不超过约6.9,那么可以将CO2设定点进一步从5%降低至0%。如果pH仍然不超过约6.9,可以增加灌注速率。如果DO不超过约45%,那么应将O2设定点从20%升高至30%。如果在稍后的时间点DO不超过约45%,那么应将O2水平从30%升高至40%,应将摇动速度升高至约25rpm,并且应将摇动角度变为约12°。
在一个实施方案中,还可以在最终浓缩步骤期间调节培养物的摇动速率以避免将空气纳入所述细胞保留系统。
i.细胞培养基
可以在本发明的方法中使用适合于细胞培养的任何类型的细胞培养基。关于选择合适的细胞培养基的指南是本领域熟知的,并且在例如,Freshney,R.I.Culture ofAnimal Cells(基础技术手册),第4版2000,Wiley-Liss的第8和9章;和Doyle,A.,Griffiths,J.B.,Newell,D.G.Cell&Tissue Culture:Laboratory Procedures 1993,JohnWiley&Sons中提供。将这些参考文献中的每一篇以其整体并入本文。本领域还有其他用于在无细胞来源组分和无蛋白的条件下制备和保持细胞培养物的方法(包括涉及CHO细胞的方法),如见于国际专利申请号WO97/05240、WO 96/26266和WO 00/11102,美国专利号6,100,061、6,475,725和8,084,252中的那些方法。将前述文献中的每一篇通过提述以其整体并入本文。在本发明的一个实施方案中,可以使用无动物来源组分(ADC)的培养基。常规合成基本培养基可以含有无机盐、氨基酸、维生素、碳水化合物来源和水。在本发明的具体实施方案中,可以使用的培养基是CD-CHO(GIBCO,Invitrogen Corp.;一种无动物来源培养基,其是化学成分限定的并且不含未知来源的蛋白质、水解物或组分)。另外,培养基可以具有其他组分,包括谷氨酰胺和/或甲氨蝶呤或其他可以辅助生长或附着的因子。在具体的实施方案中,所述其他组分可以是GLUTAMAX-1或L-谷氨酰胺,其以约2mM至约8mM添加,例如以约2mM、约3mM、约4mM、约5mM、约6mM、约7mM或约8mM添加。
ii.宿主细胞和表达载体
在某些实施方案中,在本发明的细胞存储方法中采用的细胞是携带用于表达治疗相关蛋白或其他感兴趣的多肽的表达构建体的宿主细胞。能够用于表达感兴趣的多肽(例如结合性多肽)的任何细胞可以根据本文描述的方法使用。所述细胞可以任选地含有天然存在的或重组的核酸序列,例如含有感兴趣的多肽的表达载体。所述表达载体可以任选地含有合适的转录和翻译调控,并且可以使用本领域已知的重组DNA技术构建。可以将表达载体通过本领域已知的技术转移至任何宿主细胞,并且随后可以将经转化的细胞根据本发明的方法培养以创建高密度细胞库。另外,随后可将所述高密度细胞库解冻并根据本领域已知的技术培养以产生感兴趣的编码蛋白,并且在期望时可将这种蛋白进一步纯化。
在某些实施方案中,可将多种宿主表达系统用于产生治疗相关蛋白。另外,所述宿主表达系统可以是携带重组表达构建体的哺乳动物细胞系统(例如,CHO、CHO-DBX11、CHO-DG44、CHO-S、CHO-K1、Vero、BHK、HeLa、COS、MDCK、HEK-293、NIH-3T3、W138、BT483、Hs578T、HTB2、BT20、T47D、NS0、CRL7030、HsS78Bst细胞、PER.C6、SP2/0-Agl4和杂交瘤细胞),所述重组表达构建体含有源自哺乳动物细胞的基因组的启动子。也可以和哺乳动物细胞一起使用基于病毒的表达系统(参见,例如,Logan等,1984,Proc.Natl.Acad.Sci.USA 8:355-359,将其通过提述以其整体并入本文)。可以通过纳入包括(但不限于)合适的转录增强元件和转录终止子在内的元件来提高表达效率(参见,例如,Bittner等,1987,Methods inEnzymol.153:516-544,通过提述以其整体并入本文)。
在其他实施方案中,可以选择以期望的特定方式调节插入序列的表达或修饰并加工基因产物的宿主细胞株。不同宿主细胞就蛋白质和基因产物的翻译后加工和修饰而言具有特征性和特异性的机制。可以选择合适的细胞系或宿主体系以确保所表达的多肽(例如,结合性多肽)的正确修饰和加工。这些细胞包括,例如,已经建立的哺乳动物细胞系和动物细胞,以及昆虫细胞系、真菌细胞和酵母细胞。
iii.生物反应器
可在本发明的方法中使用任何适合于在灌注培养条件下培养细胞的生物反应器。可以使用细胞的等分试样以合适的接种密度来接种所述生物反应器(例如瓶装细胞或来自起子培养物(starter culture)的细胞,例如摇瓶或摇瓶接种物训练,其已经培养至该密度)。对于培养而言合适的接种密度依赖于若干因素,包括使用的细胞和所接种的生物反应器的类型。合适的接种密度可以使用本领域可用的方法来测定。
在某些实施方案中,所述生物反应器可以具有可丢弃性质,例如,所述生物反应器可以是柔性袋或塑料摇瓶,其借助柔性管道与细胞保留装置连接。其可以具有约1L、2L、5L、10L,约20L、50L、75L、85L、100L、150L或约400L的体积。在本发明的具体实施方案中,所述生物反应器是10L柔性袋,其经过定制具有两根汲取管,即用于移出培养基或产物的管。示例性可丢弃生物反应器是
反应器的工作体积是培养物占据的体积。工作体积可以是例如培养物的10%、20%、30%、40%、50%、60%、70%或更多,但优选不超过75%。
或者,所述生物反应器可以具有非可丢弃性质。例如,所述生物反应器可以由不锈钢或玻璃制成。适合在本发明使用的其他生物反应器包括但不限于:摇瓶、搅拌罐式容器、气升式容器和可丢弃的袋,其能够通过摇动、振荡或搅拌混合。
在一个实施方案中,所述生物反应器可以偶联至细胞保留系统,包括但不限于内置式过滤器、旋转篮TFF系统和ATF系统。
II.
灌注培养依赖于从培养物移出营养物枯竭且含有废料产物的培养基同时最小化对细胞的损害的能力。最初的细胞保留方法中将枯竭的培养基与培养的细胞分开,这种方法经常因为如产生剪切力这样的固有问题而损害细胞。这最终导致过滤器堵塞和灌注装置故障,这些装置中的许多在培养系统内部。因此,在一个方面中,本公开提供使用“细胞保留系统”的方法,该系统允许进行培养基交换并随后用于进一步浓缩所述细胞培养物以供冷冻存储。
在一个实施方案中,使用的细胞保留系统的类型是“内置(built in)”型过滤器,其中所述过滤器布置在生物反应器的腔室中并且在腔室内自由移动。所述过滤器可以与从腔室导出的管道之一偶联,由此使得经过过滤的培养基能够从培养抽出。“内置”型过滤器的一个实例可在美国专利6,544,788号中找到,将该专利通过提述以其整体并入本文。
在另一个实施方案中,使用的细胞保留系统是切向流过滤系统(TFF)。在一TFF系统中,将培养基从培养容器通过过滤器模块循环,然后再借助于附接于过滤器模块和培养容器之间的管道的泵返回至培养容器,产生跨越过滤器模块的切向流。将第二个泵置于过滤器模块的滤出物侧并用于控制滤出物被移出的速率。在这种系统中优选使用中空纤维膜过滤器,因为它们易于除菌并允许维持跨越过滤器模块的均一流动。然而,当在这种系统中采用中空纤维过滤器时,它们有堵塞倾向,因为单向流导致颗粒物质在管腔入口聚集。
在一个具体的实施方案中,使用的细胞保留系统的类型是交替切向流(ATF)系统。在ATF型的细胞保留系统中,将过滤隔室连接至储存容器的一端,而隔膜泵在另一端。泵首先将培养基通过过滤器元件从容器移出至泵,然后反转将培养基通过过滤器从泵送出并返回容器,产生双向或交替流。这被称作交替切向流(ATF),因为在过滤器模块处存在交替的切向流,即存在一个与过滤器模块的膜表面方向相同的流(与该表面呈切向),并且还存在另一个基本上与那些表面垂直的流。这种类型的过滤从2000年起已经存在于文献中,并产生了快速、低剪切、均一的流。ATF过滤可以通过本领域已知的方法获得,例如在美国专利6,544,424号中所述,将该专利通过提述以其整体并入本文。另外,交替切向流系统可从制造商如Refine Technology处商购,并且包括多种型号,如ATF2、ATF4、ATF6、ATF8和ATF10系统。
在本发明的另一个具体实施方案中,所述过滤器是管状膜过滤器,并且还可以是中空纤维过滤器。
如上所述,本发明的方法允许以高密度非离心浓缩细胞。在本发明的特定实施方案中,使所述培养物生长至至少1x10^7个细胞/mL的密度,例如至约1x10^7个细胞/ml、约2x10^7个细胞/ml、约3x10^7个细胞/ml、约4x10^7个细胞/ml、约5x10^7个细胞/ml、约6x10^7个细胞/ml、约7x10^7个细胞/ml或约8x10^7个细胞/ml的密度,并且在该段生长期之后,存在进一步的浓缩步骤,该浓缩步骤使用非离心方法实施。这种浓缩步骤可以将培养物浓缩至至少5x10^7个细胞/mL的密度,例如约5x10^7个细胞/mL、6x10^7个细胞/mL、7x10^7个细胞/mL、8x10^7个细胞/mL、9x10^7个细胞/mL、10x10^7个细胞/mL、11x10^7个细胞/mL、12x10^7个细胞/mL、13x10^7个细胞/mL、14x10^7个细胞/mL、15x10^7个细胞/mL、16x10^7个细胞/mL或17x10^7个细胞/mL的密度。用于进一步浓缩培养物的非离心方法可以利用任何本领域已知的细胞保留系统(例如“内置”型过滤器,TFF系统,或ATF系统,包括上文描述的那些)。
III.
冷冻保存指这样的过程,通过该过程将细胞、组织或容易受到因为时间或因为酶或化学活性造成的损害的任何其他物质通过将它们冷却并存储在零下的温度而保存。不能低估重要细胞系的冷冻保存的重要性,因为(除了其他重要的优势之外)这允许保持这些细胞系而不用将它们保持在持续培养中、降低污染的风险并降低遗传漂变(genetic drift)的风险。
当使用冷冻保存方法时,至关重要的是达到并保持在这些较低的温度而不在冷冻过程中由于冰的形成引起额外的损害。按照传统本领域的方法使用称作冷冻保护剂的减少对细胞的冷冻损害的物质。可将冷冻保护剂在冷冻过程之前添加至细胞培养的培养基。在具体的实施方案中,使用的冷冻保护剂可以是下列中的一种或多种:甘油或二甲亚砜(DMSO)。另外,冷冻保护剂可以与或不与羟乙基淀粉(HES)一起添加。在进一步的具体实施方案中,可以以至少5%的浓度添加DMSO,例如其可以以约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%,以约18%、约19%或以约20%添加。
然后可将添加有冷冻保护剂的培养物分配至适合于在冷冻保存条件下储存的容器中。在一个实施方案中,这种容器可为小瓶,其由可包括(但不限于)聚合物在内的材料制成,所述聚合物例如聚四氟乙烯、聚苯乙烯、聚乙烯或聚丙烯。在具体的实施方案中,所述小瓶可具有额外的表面处理以改进冷冻保持条件(例如,降低吸附和变性的亲水涂层)。在示例性实施方案中,所述小瓶可具有超过约0.1mL的体积,例如所述小瓶可具有约0.1mL、约0.5mL、约0.75mL、约1mL、约2mL、约2.5mL、约5mL、约10mL、约15mL、约20mL、约25mL或约50mL的体积。在另一个实施方案中,所述容器还可为冷冻袋。所述冷冻袋可由任何合适的材料构成,所述材料包括但不限于聚合物如聚四氟乙烯、聚苯乙烯、聚乙烯、聚丙烯、氟化乙烯丙烯(FEP)和乙烯醋酸乙烯酯(EVA)。示例性可丢弃生物反应器包括但不限于:Kryo
然后使用本领域熟知的技术和装置冷冻这些容器,然后储存在低温,通常为约-130℃至约-195℃。在一个实施方案中,使用的冷冻技术可以是控制速率和缓慢冷冻(也称为缓慢可程控冷冻(slow programmable freezing)或SPF)。通过所述方法获得的细胞的集合为细胞库。
在一个实施方案中,所述细胞库可以是,但不限于,高密度细胞库、主细胞库或小型库。
IV.
如上所述,本发明的方法允许以高密度进行细胞存储,同时保持卓越的细胞活力以供稍后使用。用于本文时术语“细胞活力”可定义为在给定样品中健康细胞的数目和百分比。细胞活力可使用本领域的任何可用方法在所描述的高密度细胞存储过程中的任意时间点测定。通常使用的用于测定细胞活力的方法很大程度上是基于这样的原理,即活细胞具有将特定染料如锥虫蓝(一种重氮染料)、伊红(Eosin)或丙啶(propidium)排除在外的完整细胞膜,而死细胞没有。
在一个实施方案中,锥虫蓝可以用于染色一定量的细胞,并由此表明具有完整膜的细胞的存在(未染色)和具有受到破坏的膜的细胞的存在(蓝色)。然后可以对这些细胞进行计数以测定活细胞和死细胞二者在培养物中的数目,并且作为百分数呈现以表明培养物的相对健康程度。
在具体的实施方案中,可以使用已经浓缩但尚未冷冻的培养物(即解冻前培养物(pre-thaw culture))测定细胞活力。在具体的实施方案中,细胞活力可以使用已经浓缩、冷冻、然后再解冻的培养物测定(即解冻后培养物)。
在具体的实施方案中,所述细胞活力可以超过约60%,例如约60%、65%、70%、75%、80%、85%、90%或95%。在某些实施方案中,细胞的解冻后活力为超过约80%,例如,超过85%、90%或95%,包括高达100%。
凋亡是程序性细胞死亡并且是细胞生长和增殖的活性调节途径。细胞响应于特异性诱导信号,导致特征性生理变化。在这些变化之中的是在早期凋亡途径期间磷脂酰丝氨酸(PS)相对于细胞外表面的外部化。Guava
1)非凋亡细胞(或健康细胞):
2)膜联蛋白V(-)和7-AAD(-)。
3)早期凋亡细胞:膜联蛋白V(+)和7-AAD(-)
4)晚期凋亡和死亡细胞:膜联蛋白V(+)和7-AAD(+)
晚期凋亡细胞的量是解冻后培养物健康程度的另一个量度,并且能够如图4和7八中所示来监测。在具体的实施方案中,解冻后的晚期凋亡细胞应该少于活细胞群体的30%。在另一个实施方案中,解冻后的晚期凋亡细胞应该少于活细胞群体的20%。在另一个实施方案中,解冻后的晚期凋亡细胞应该少于活细胞群体的10%。
V.
源自本发明的高密度细胞冷冻存储方法的细胞可以应用在稍后的生产阶段用于蛋白质生产。例如,根据本发明的方法在生物反应器中增殖并以高密度库等分试样冷冻的细胞可以用于生产生物物质,包括治疗相关蛋白。这些生物物质可以包括但不限于:病毒(参见例如WO200138362),结合性多肽如抗体,例如单克隆抗体及其片段,例如fab片段;Fc融合蛋白、抗凝剂、血液因子、骨形态发生蛋白、工程化蛋白支架、酶、生长因子、激素、干扰素、白介素和溶栓剂。这些生物物质可以使用任何本领域可用的方法收获。在一个实施方案中,本发明提供产生生物物质的方法,所述方法包括:在适合于生产生物物质的条件下培养能够表达生物物质的细胞,其中所述细胞获得自使用灌注培养和非离心浓缩方法产生的高密度冷冻细胞库。所述生物物质可以是(但不限于)蛋白质(例如任何治疗相关蛋白)。
实施例
通过以下实施例进一步阐述本发明,不应将这些实施例理解为进一步的限定。附图的内容和本申请通篇引用的全部参考文献、专利和公开的专利申请通过提述以其整体明确并入本文。
实施例1:高密度细胞存储方案的设计和实施
这种高密度细胞冷冻存储方案以2mL主细胞库瓶装细胞(工作体积1.5mL)以2.0-2.4x10^7个活细胞/mL的大约密度(正常细胞冷冻保持条件)开始。然后使细胞在灌注培养中生长,并经由交替切向流浓缩。在将DMOS添加至浓缩的细胞培养物之后,将这种高密度细胞培养物分配至大约200个单独的5mL小瓶(约4.5mL工作体积)用于作为高密度细胞库储存(大约10x10^7个细胞/mL)。
实施例2:测定用于支持快速细胞生长的最佳细胞保留方法和浓缩速度
为了测定用于创建高密度细胞培养物存储系统(图1)的最佳细胞保留方法,对标准GE灌注生物反应器中的内置式浮动过滤器、TFF(切向流过滤)、ATF2和ATF4评估了它们在限定参数下支持增加的细胞生长和活细胞密度的能力(表1)。
表1:用于比较细胞保留方法的实验参数
ATF4交替切向流系统支持了使用这些参数实现的较快的细胞生长以及快速的(30分钟)最终4倍培养物浓度,而没有过滤器结垢。检验的其他方法产生了较低的活细胞/mL浓度,证明了较低的浓缩效率,和/或在培养和/或浓缩过程中导致了结垢。这些结果可见于图2、图11和表2。
表2:来自对不同细胞保留方法的比较的结果
实施例3:测定收获用于浓缩和高密度存储的培养细胞的最佳时间
为了测定最佳细胞收获时机以供后续的最终浓缩和高密度细胞冷冻存储,使rCHO细胞系1的培养物在定制10-L
通过在生长速率、活力和细胞死亡(凋亡)方面比较细胞解冻后的质量来评估这些库。这些细胞在初始培养期间进行培养的参数和存储后评估中的参数示于表3。
表3:用于测定最佳细胞收获时机的实验参数
以不同细胞密度从这些培养物制备的小型库的解冻后细胞性能在它们的细胞生长速率、活力(图3)和凋亡速率(图4)方面相当。这些数据表明细胞健康且准备好可供以高达约60x10^6个细胞/mL收获。
选择了大约(30-40)x10^6个细胞/mL的收获密度以缩短培养时间段并使该过程更切实可行。然后将这些培养物在30分钟内使用交替切向流系统进一步浓缩至>11x10^7个细胞/mL。
实施例4:确定高密度细胞培养期间的最佳
为了使这种高密度细胞培养和存储方法更鲁棒(robust)并且使GMP可行,研究并限定了
在使用表4中所见参数限定的与交替切向流系统组合的灌注培养系统中测试了这些
表4:用于确定
氧传质(oxygen mass transfer)(k
应用与高灌注速率组合的包括
表5:没有pH和DO控制的生长期间的
当通过Blood Gas Anayzer(BGA)测量的离线pH≤6.9时,将CO2设定点从10%降低至5%。如果测量的离线pH再次≤6.9,将CO2设定点从5%降低至0%。如果离线pH仍然≤6.9,那么增加灌注速率。当测量的DO≤45%,将O2设定点从20%增加至30%。如果测量的DO再次≤45%,将摇动速度增加至25rpm并将摇动角度改变为12°。另外,将O2水平从30%升高至40%。
通过调节最终浓缩步骤期间的摇动速率(表6)进一步完善这种方法以避免将空气纳入ATF4系统中。
表6.浓缩期间的
包括
实施例5:测定ATF浓缩步骤和DMOS暴露对于细胞健康的作用
为了测定ATF4浓缩步骤和冷冻前DMSO暴露对细胞质量的作用,将摇瓶用在高密度细胞存储流程中的不同阶段收集的活细胞接种以供生长评估。在表7中显示的条件下收集和检验的样品为:浓缩前,浓缩后,和0-120分钟长度的DMSO暴露。
表7:用于确定
浓缩前细胞和浓缩后细胞的细胞生长(图7A)和凋亡率(图7B)是可比较的,以不同时长暴露于DMSO的细胞的细胞生长和凋亡率也是如此。这表明容器内30分钟ATF4浓缩并在90分钟内完整规模分配超过200个小瓶并同时保持冷冻前的细胞质量是可行的。
实施例6:测定存储后细胞质量和所述平台用于多种细胞系的适用性
为了测定高密度细胞库的存储后细胞质量,培养并检测了解冻后细胞以确定它们相对细胞生长速率、活力和凋亡水平。另外,采用了三种不同的细胞系(rCHO细胞系1、2和3)从而确保这种平台能够便利地应用于其他细胞系。这些细胞在存储前和存储后所生长的实验条件详细记载于表8。
表8:用于多种细胞系的HD库的存储后细胞质量的实验参数
在高密度(10x10^7个细胞/mL)和正常密度(2.0-2.4x10^6个活细胞/mL)存储样品中评估了rCHO细胞系1(图8A-B)、rCHO细胞系2(图9A-B)和rCHO细胞系3(图10A-B)解冻后的细胞生长、活力和凋亡的水平。所述细胞显示了良好的生长速率和活力,以及低水平的凋亡。回收率取决于所检测的细胞系而变化。
- 高密度细胞存储方法
- 用于植物细胞高密度培养的滚筒中空纤维反应器及番石榴叶细胞高密度培养的方法
