一种血浆中布洛芬含量的检测方法
文献发布时间:2023-06-19 10:05:17
技术领域
本发明属于生物体药品检测领域,特别是布洛芬含量的检测方法。
背景技术
布洛芬(Ibuprofen)为解热镇痛类,非甾体抗炎药,其消炎、镇痛、解热作用效果良好,不良反应较小。目前已在世界上广泛应用,成为全球最畅销的非处方药物之一,和阿司匹林、扑热息痛一起并列为解热镇痛药三大支柱产品。布洛芬作为常用的非处方止痛药之一,常用于治疗关节炎、肌肉痛、神经痛、头痛、偏头痛、牙痛、痛经或腰背疼痛。《英国医学杂志》刊登的一项最新研究发现,长期大量服用解热镇痛药布洛芬的人,患中风或心脏病的风险会增加3倍。如果能够精确检测出血浆内布洛芬的含量,调整用药量,可有效地降低布洛芬大量使用的副作用。
现有技术中,发明专利CN111157639A公开了一种高效液相质谱法测定大鼠血浆中布洛芬的浓度的方法,该方法预处理简单,使用高效液相色谱可测出大鼠血浆中布洛芬的含量,但是使用该方法检测出的布洛芬的液质信号峰的峰型差,相应不好,不能准确地确定血浆中布洛芬的含量。
发明内容
针对以上现有技术的不足,本发明提供了一种血浆中布洛芬含量的检测方法,具体通过以下技术实现。
一种血浆中布洛芬含量的检测方法,包括以下四个步骤:
S1、溶液配制:包括校正样品的配制,质控样品的配制以及内标液(I02)的配制;
S2、预处理过程:分别将S1中的校正样品和质控样品进行预处理,以及配制空白基质;
S3、浓度测定:将S2中预处理后的校正样品溶液使用液质联用(HPLC-MS/MS)方法进行测定;
S4、定量分析:以布洛芬的含量为横坐标(单位为ng/mL),峰面积为纵坐标,建立标准曲线,根据标准曲线确定线性回归方程,再使用质控样品对线性回归方程验证;
步骤S3中的液质联用方法,其色谱条件如下:
色谱柱:Venusil C18 Plus,2.1×50mm,5.0μm,Agela;
流动相A:含2mmol/L甲酸铵水溶液;
流动相B:乙腈;
自动进样器清洗溶液:甲醇;
柱温箱温度:35℃;
流速:0.800mL/min;
色谱柱平衡状态时的大致柱压:14.1Mpa;
自动进样器温度:4℃;
进样体积:10.0μL;
压脚提升量:50mm;
自动进样器清洗模式:进样前清洗,进样后清洗;
清洗液洗针体积:200μL;
自动进样器进样针清洗时浸泡时间:1s;
色谱梯度如下表所述:
表1色谱梯度的洗脱程序
0.01到0.2s,流动相B由25%到95%,0.20到2.00s,流动相B为95%,2.00到2.10s,流动相B由95%到25%,2.10到2.80s,平衡流动相并停止。
本申请中,设置特定的流动相A,并匹配相应的色谱梯度,可使布洛芬的液质信号的出峰时间适中,峰型良好,响应强,从而更准确地确定血浆中布洛芬的浓度。
优选地,步骤S1中,校正样品和质控样品的配制过程如下:
校正样品的配制为:先使用甲醇:水做为溶剂,配制不同浓度的布洛芬源溶液,再在若干离心管中分别加入同体积的空白血浆,之后往每个离心管中加入配制好的布洛芬源溶液,涡旋混合;
质控样品的配制为:先使用甲醇:水做为溶剂,配制不同浓度的布洛芬源溶液,再在若干离心管中加入同体积的空白血浆,然后往每个离心管中加入不同浓度的布洛芬源溶液,涡旋混合,保存条件在-90~-60℃条件中。
校正样品现配现用,配置后的校正样品浓度范围为20-15000ng/mL,具体浓度如下:
表2校正样品的浓度
配制的质控样品分为:高浓度质控样品,即HQC;中浓度质控样品,即MQC;低浓度质控样品,即LQC。具体的浓度如下表所示:
表3质控样品的浓度
校正样品目的是用于HPLC-MS/MS检测,从而得到布洛芬浓度和峰面积的对应关系,模拟曲线,得到线型方程;质控样品是用于检验得到的线型方程是否能够准确地检测出血浆中的布洛芬含量。
更优选地,校正样品和质控样品的配制中,溶剂为体积比为1:1的甲醇:水(R1)。
优选地,步骤S1中,I02是用R1溶剂,稀释1.00mg/mL的甲苯磺丁脲的甲醇溶液得到的。I02中的甲苯磺丁脲浓度为1.00μg/mL,I02可以避免样品前处理及进样体积误差对检测结果造成影响。
优选地,步骤S2中的校正样品和质控样品的预处理过程如下:
校正样品的预处理过程为:
P1、转移校正样品及基质至离心管中;
P2、向步骤P1中分别加入I02和含1%甲酸的乙腈溶液(R2),涡旋混合;
P3、0~4℃下,将P2中的样品放入离心机离心;
P4、转移步骤P3中的上清溶液至96孔板中,使用溶剂稀释,涡旋混合;
P5、在进样分析前,将处理后的样品保存在自动进样器中或0~10℃的冰箱中;
质控样品的预处理过程为:
Q1、转移质控样品及基质至离心管中;
Q2、向步骤P1中分别加入I02和R2,涡旋混合;
Q3、0~4℃下,将Q2中的样品放入离心机离心;
Q4、转移步骤P3中的上清溶液至96孔板中,使用溶剂稀释,涡旋混合;
Q5、在进样分析前,将处理后的样品保存在自动进样器中或0~10℃的冰箱中。
更优选地,步骤P1和步骤Q1中,基质均为含EDTA-K
本申请的预处理过程简单易操作,可增强布洛芬在血浆中的稳定性,不会对检测结果造成影响。
优选地,步骤S2中空白基质样品的制备过程如下:
K1、转移基质及蒸馏水于离心管中;
K2、向K1的离心管中分别加入溶剂和R2,涡旋混合;
K3、0~4℃下,将K2中的样品放入离心机离心;
K4、转移离心后的上清溶液至含有溶剂的96孔板中,涡旋混合;
K5、将空白基质样品保存在自动进样器中或0~10℃的冰箱中。
空白基质可以作为空白对照,对本发明提供的检测方法的基质效应的影响情况进行考察。
更优选地,步骤K1中的基质为含EDTA-K
优选地,步骤S3中的液质联用方法,其质谱条件如下:
离子源:ESI;
离子化模式:Negative;
监测模式:MRM;
电喷雾电压:-4500V;
离子喷雾温度:600℃;
气帘气种类:氮气;
雾化气种类:氮气;
辅助气种类:氮气。
与现有技术相比,本发明的有益之处在于:
1、布洛芬的液质信号的出峰时间适中,峰型良好,响应强,可准确确定血浆中布洛芬的含量;
2、预处理简单,可批量处理血浆样品,提升工作效率,同时还可以提高血浆中布洛芬的稳定性;
3、排除了基质效应的干扰,减小实验数据的误差。
附图说明
图1为实施例1的HPLC-MS/MS方法测得的布洛芬浓度-峰面积标准曲线;
图2为实施例1的峰型示意图;
图3为为定量下限样品液质信号图;
图4为定量上限样品液质信号图;
图5为定量上限后的第一个试剂空白样品液质信号图;
图6为空白基质样品的峰型示意图;
图7为对比例1的峰型示意图;
图8为本对比例的峰型示意图。
具体实施方式
下面将对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动条件下所获得的所有其它实施例,都属于本发明保护的范围。
实施例1
(一)实验仪器与试剂
实验仪器:分析天平:AS 60/220.R2十万分之一电子天平,RADWAG公司;涡旋混合仪:MX-S,大龙兴创实验仪器(北京)有限公司;离心机:TGL-16.5M高速冷冻离心机,上海卢湘仪离心机仪器有限公司;移液器:0.5~10μL,2~20μL,20-200μL,100-1000μL,德国Brand公司;色谱柱:Venusil C18 Plus,2.1×50mm,5.0μm,Agela;高效液相色谱泵:LC-20AD,Shimadzu公司;自动进样器:SIL-20AC,Shimadzu公司;柱温箱:CTO-20A,Shimadzu公司;质谱仪:API 4000,AB Sciex公司。
实验试剂:甲醇、乙腈为色谱纯,Fisher Scientific公司;甲醇铵为分析纯,国药集团;蒸馏水,屈臣氏集团;基质:含抗凝剂EDTA-K2的大鼠血浆;内标物:甲苯磺丁脲。
(二)HPLC-MS/MS检测血浆中布洛芬的含量
一种血浆中布洛芬含量的检测方法,包括以下四个步骤:
S1、溶液配制:包括校正样品的配制,质控样品的配制以及I02的配制;
S2、预处理过程:分别将S1中的校正样品和质控样品进行预处理,以及配制空白基质;
S3、浓度测定:将S2中预处理后的校正样品溶液使用液质联用(HPLC-MS/MS)方法进行测定;
S4、定量分析:以布洛芬的含量为横坐标(单位为ng/mL),峰面积为纵坐标,建立标准曲线,根据标准曲线确定线性回归方程,再使用质控样品对线性回归方程验证;
步骤S3中的液质联用方法,其色谱条件如下:
色谱柱:Venusil C18 Plus,2.1×50mm,5.0μm,Agela;
流动相A:含2mmol/L甲酸铵水溶液;
流动相B:乙腈;
自动进样器清洗溶液:甲醇;
柱温箱温度:35℃;
流速:0.800mL/min;
色谱柱平衡状态时的大致柱压:14.1Mpa;
自动进样器温度:4℃;
进样体积:10.0μL;
压脚提升量:50mm;
自动进样器清洗模式:进样前清洗,进样后清洗;
清洗液洗针体积:200μL;
自动进样器进样针清洗时浸泡时间:1s;
色谱梯度如下表所述:
表4实施例1的色谱梯度的洗脱程序
0.01到0.2s,流动相B由25%到95%,0.20到2.00s,流动相B为95%,2.00到2.10s,流动相B由95%到25%,2.10到2.80s,平衡流动相并停止。
步骤S1中,校正样品和质控样品的配制过程如下:
校正样品的配制为:先使用R1做为溶剂,配制不同浓度的布洛芬源溶液,再在若干离心管中分别加入同体积的空白大鼠血浆,之后往每个离心管中加入配制好的布洛芬源溶液,涡旋混合,配置后的校正样品浓度范围为20-15000ng/mL,具体浓度情况如下所示:
表5实施例1的校正样品的浓度
质控样品的配制为:先使用R1做溶剂,配制不同浓度的布洛芬源溶液,再在若干离心管中加入同体积的空白大鼠血浆,然后往每个离心管中加入不同浓度的布洛芬源溶液,涡旋混合,保存条件在-90~-60℃条件中。配制的质控样品分为:高浓度质控样品,即HQC;中浓度质控样品,即MQC;低浓度质控样品,即LQC,具体的浓度如下表所示:
表6实施例1的质控样品的浓度
步骤S1中,I02的配制为:在聚丙烯离心管中加入99900μL的R1溶液,然后用移液器往聚丙烯离心管中加入100μL的I01,涡旋混合,配制成1.00μg/mL的甲苯磺丁脲,备用,储存条件为:0~10℃。
步骤S2中,校正样品、质控样品预处理过程,以及空白基质的配制过程如下:
校正样品的预处理过程为:
P1、转移校正样品40.0μL及含EDTA-K
P2、向步骤P1中分别加入20.0μL的I02和400μL的R2,涡旋混合;
P3、在0~4℃下的离心机中以10000g的速度离心5min;
P4、转移步骤P3中100μL的上清溶液至96孔板中,使用400μL的R1稀释,涡旋混合;
P5、在进样分析前,将处理后的样品保存在自动进样器中或0~10℃的冰箱中。
质控样品的预处理过程为:
Q1、转移校正样品40.0μL及含EDTA-K
Q2、向步骤Q1中分别加入20.0μL的I02和400μL的R2,涡旋混合;
Q3、在0~4℃下的离心机中以10000g的速度离心5min;
Q4、转移步骤P3中100μL的上清溶液至96孔板中,使用400μL的R1稀释,涡旋混合;
Q5、在进样分析前,将处理后的样品保存在自动进样器中或0~10℃的冰箱中。
空白基质样品的制备过程如下:
K1、精密转移40.0μL的含EDTA-K
K2、向K1的离心管中分别加入20.0μL的R1和400μL的R2,涡旋混合;
K3、在0~4℃下的离心机中以10000g的速度离心5min;
K4、转移100μL的上清溶液至含有400μL的R1溶液的96孔板中,涡旋混合;
K5、在进样分析前,将处理后的样品保存在自动进样器中或0~10℃的冰箱中;
S3、浓度测定:将S2中预处理后的样品溶液进行HPLC-MS/MS方法测定。
步骤S3中,HPLC-MS/MS的质谱条件如下:
离子源:ESI;
离子化模式:Negative;
监测模式:MRM;
电喷雾电压:-4500V;
离子喷雾温度:600℃;
气帘气种类:氮气;
雾化气种类:氮气;
辅助气种类:氮气。
图1为HPLC-MS/MS方法测得的布洛芬浓度-峰面积标准曲线,线型方程为y=0.000458x+0.00205,r=0.9956,其中,x为布洛芬的浓度;按该方法测得的布洛芬的血药浓度的最低定量限为:20ng/mL。
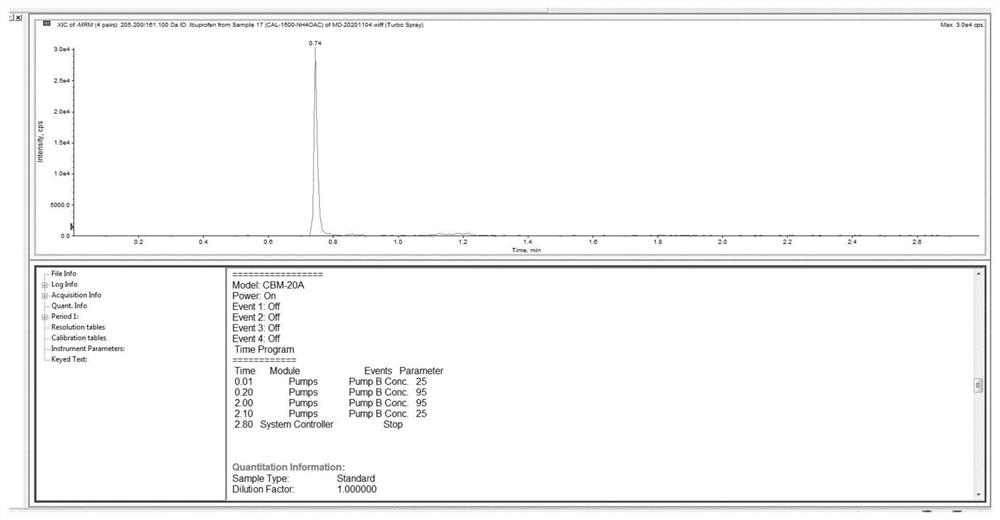
图2为本实施例的峰型示意图,此时流速为0.8mL/min,流动相A为含2mmol/L甲酸铵水溶液,有机相起始比例为25%,梯度条件如表3所示。由图可知,布洛芬信号于0.74min出峰,且布洛芬信号的出峰位置较为合适,响应和峰形比较好。
图3为定量下限样品液质信号图,左为布洛芬,右为甲苯磺丁脲;图4为定量上限样品液质信号图,左为布洛芬,右为甲苯磺丁脲;图5为定量上限后的第一个试剂空白样品液质信号图,左为布洛芬,右为甲苯磺丁脲,图5说明定量上限后的样品无残留。
实施例1方法中的基质效应
图6为空白基质样品的峰型示意图,左为布洛芬,右为甲苯磺丁脲,表4为基质效应考察的计算情况,如下所述:
表7实施例1的基质效应考察的计算情况
计算得到的基质因子均在0.85~1.15之间,可认为此条件下无基质效应或基质效应不会影响准确定量。
实施例1方法中的回收率
实施例1方法的回收率考察,计算结果如下:
表8实施例1的回收率考察计算情况
计算得到的回收率无浓度趋势且差异仅0.04%,可认为此条件下回收率为100%或不影响准确定量。
实施例1方法中的精密度和准确度
实施例1方法的精密度和准确度考察,结果如下:
表9实施例1的精密度和准确度的考察情况
准确度偏差和RSD(相对标准偏差)均在±15%以内,其精密度和准额度良好。
对比例1
本对比例和实施例1相比,区别在于流速和色谱梯度程序的设置,本对比例的流速为0.6mL/min,色梯度的洗脱程序如下表所示:
表10对比例1的色谱梯度的洗脱程序
图7为本对比例的峰型示意图,由图可知,本对比例中,布洛芬于0.45min出峰,出峰相对靠前且峰形较差。
对比例2
本对比例和实施例1相比,区别在于色谱梯度程序的设置,本对比例的色谱梯度的洗脱程序如下表所示:
表11对比例2的色谱梯度的洗脱程序
图8为本对比例的峰型示意图,由图可知,本对比例中,布洛芬于0.33min出峰,出峰相对靠前且峰形较差。
- 一种血浆中布洛芬含量的检测方法
- 一种同时测定布洛芬注射液中布洛芬及精氨酸含量的方法
