一种乙基纤维素中空微囊
文献发布时间:2023-06-19 10:18:07
技术领域
本发明属于高分子颗粒领域,具体涉及一种乙基纤维素中空微囊和应用,以及制造该所述乙基纤维素中空微囊的方法和装置。
背景技术
中空结构的高分子颗粒具有较大的空腔,常用来包覆药物、酶、蛋白质等。乙基纤维素(EC)是一种生物相容性良好的疏水性材料,在生物、医药领域有广泛的应用。近年来,许多文献报道了中空结构的EC微囊在药物缓释制剂方面的优势。中空EC微囊的制备方法有喷雾干燥法、膜乳化法、复乳法等,但这些方法的制备过程操作复杂、粒径难以控制,一定程度上限制了其在生物医药领域的使用。
发明内容
本发明的目的在于提供一种乙基纤维素中空微囊的制备方法,通过该方法可制造出具有中空结构的乙基纤维素微囊,可作为药物包覆膜使用。
为实现上述目的,本发明采用如下技术方案实现的:
一种乙基纤维素中空微囊的制备方法,包括下述步骤:
(1)制备水相溶液
按照质量比为1:5:100取表面活化剂、粘度添加剂和去离子水混合,在温度60℃的条件下搅拌均匀,冷却获得所述水相溶液;
(2)制备油相溶液
按照质量比为4:5:100取浓度为2~9%的聚甘油蓖麻醇酯、浓度为5~10%的乙基纤维素和乙酸乙酯混合,在常温下搅拌后均匀获得油相溶液;
(3)制备中空EC微囊
按照流体速度比为1:5将所述油相溶液和所述水相溶液输送至微通道中,所述微通道的出口为锥形,水相溶液流体剪切油相溶液流体形成单分散的水包油乳液,静止1h后所述水包油乳液使油水两相充分传质且油相溶液挥发获得中空EC微囊;
(4)洗涤
用去离子水洗涤所述中空EC微囊,干燥后获得乙基纤维素中空微囊。
本发明利用微通道出口为锥形结构,使水相溶液流体剪切油相溶液流体形成单分散的水包油乳液,水包油乳液内部油相具有挥发的特性,在静置过程中油水两相充分传质且油相溶液挥制备出具有中空结构的EC微囊结构;与现有技术比较,该方法具有操作简便、粒径可控、原料耗量少等优点。
进一步地,步骤(1)所述表面活性剂为浓度为0.2~2%的PluronicF127,所述粘度添加剂为浓度为5~15%的聚乙烯醇。
本发明利用PluronicF127作为水相溶液的表面活性剂,该PluronicF127可作为口服药使用,利于后续将EC微囊作为药物包覆膜使用。
本发明具体利用医用级聚乙烯醇作为粘度添加剂,聚乙烯醇是一种安全的高分子有机物,对人体无毒,无副作用,具有良好的生物相容性。
作为优选地,所述水相溶液包括质量比1:5:100的浓度为1%的PluronicF127、浓度为5%的聚乙烯醇和去离子水。
上述给出制造中空EC微囊的水相溶液的优先质量比的组分,同时还可在上述水相溶液的聚乙烯醇通过聚乙二醇代替,或者是将聚乙烯醇和聚乙二醇两者混合代替。
作为优选地,所述油相溶液包括质量比4:5:100取浓度为6%的聚甘油蓖麻醇酯、浓度为5%的乙基纤维素和乙酸乙酯。
上述给出制造中空EC微囊的油相溶液的优先质量比的组分,同时所述乙酸乙酯作为挥发剂,还可通过所述甲苯、二甲苯和氯仿等挥发性良好的溶剂代替。
作为优先地,所述油相溶液的流体速度为5μL/min,水相溶液的流体速度为25μL/min。
本发明还提供了一种由上述的乙基纤维素中空微囊的制备方法制备的乙基纤维素中空微囊。该微囊具有中空结构,可在中空腔体内设置药物,将其作为药物包覆膜使用,可应用于生物医药领域。
本发明还提供了一种制造上述乙基纤维素中空微囊的装置,包括第一注射泵、第二注射泵、微通道和收集管,所述微通道包括管体、以及设置在管体上的两个入口和一个出口,第一注射泵和第二注射泵分别与两个入口连通,所述微通道的出口为锥形,出口的直径沿溶液流动方向逐渐减小,所述微通道的出口与收集管连通。
本发明通过将微通道与两个注射泵连接,通过控制注射泵来控制油相和水相溶液的流速,然后在微通道的锥形出口处水相溶液速度快,以及界面张力和粘性力作用,可剪断油相溶液并形成单分散的水包油乳液,水包油乳液通过收集管收集进入容器。
进一步地,所述第一注射泵和第二注射泵采用流速可控制的微量进样电子注射泵。
本发明采流速可控制的微量进样电子注射泵,实现水油两相流速自动化控制,可实现工业化大批量生产,并且生产的微囊质量良好。
进一步地,所述微通道的管体直径为550μm,其一端的锥形出口长度为4.5cm,最小直径为50~80μm;所述收集管的直径为500μm,收集管连接有PE软管,PE软管一端没入收集容器内去离子水中。
本发明提供了最优的微通道结构参数,使生产EC微囊结构优良,适用于批量化生产本发明所述的EC微囊。
附图说明
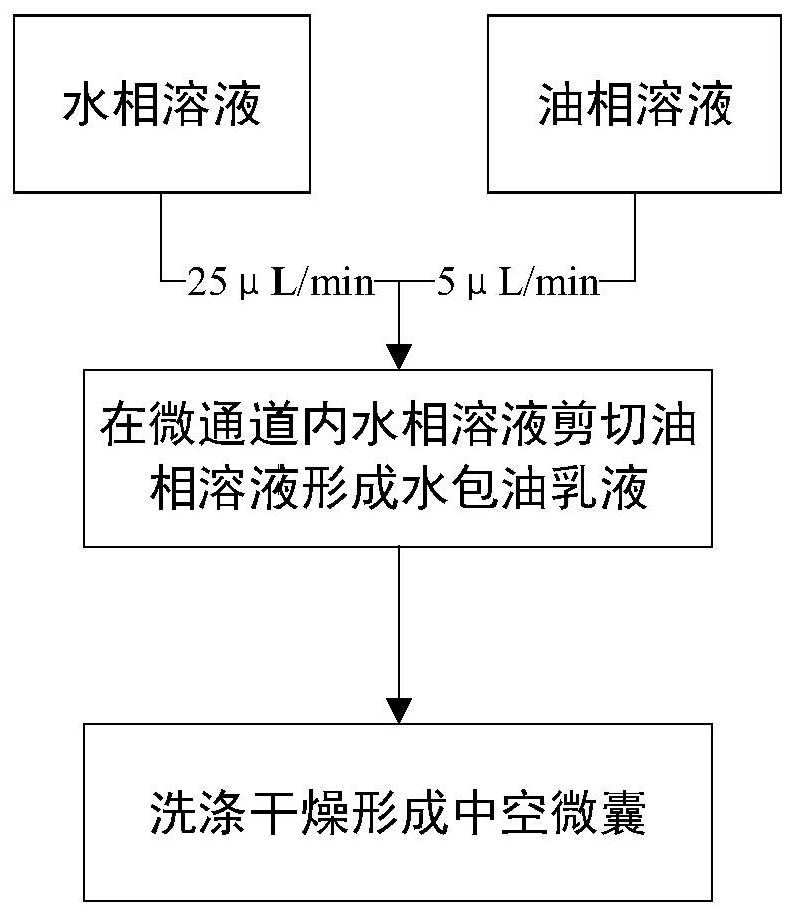
图1为本发明的制造方法流程示意图。
图2为本发明的微囊生成过程示意图。
图3为本发明的制造装置结构示意图。
图4为不同PGPR含量的EC微囊整体的扫描电镜图。
图5为不同PGPR含量的EC微囊截面的扫描电镜图。
图6为不同EC含量的微囊扫描电镜图
图7为三种不同载药量的微囊在pH=6.8释放介质中的体外释放曲线。
图8为三种不同载药量的微囊在pH=7.4释放介质中的体外释放曲线。
图中标记:10、微通道;11、锥形出口;21、第一注射泵;22、第二注射泵;30、收集管;40、收集容器;50、软管;60、方管。
具体实施方式
实施例1
本实施例提供的一种乙基纤维素中空微囊,该中空微囊可用于包覆药物、酶、蛋白质等。本实施例采用一种操作简单、粒径可控制的方法来制备所述中空微囊。
如图1所示,制备方法:
(1)制备水相溶液
取浓度为1%的PluronicF127 0.5g、浓度为5%的聚乙烯醇2.5g和去离子水50ml放入烧杯混合,将烧杯置于温度65℃的水浴锅中搅拌均匀,冷却获得所述水相溶液。
(2)制备油相溶液
取浓度为5%的聚甘油蓖麻醇酯0.4g、浓度为6%的乙基纤维素0.5g和乙酸乙酯10ml放入烧杯混合,在常温下搅拌均匀后获得油相溶液。
(3)制备中空EC微囊
使用单级微流控装置制备所述中空EC微囊,如图3所示,所述单级微流控装置包括第一注射泵21、第二注射泵22、微通道10和收集容器40,所述微通道10包括直径为550μm的管体、以及设置在管体上的两个入口和一个出口11,两个入口分别与第一注射泵21和第二注射泵22连通,第一注射泵21和第二注射泵22均采用流速可控制的微量进样电子注射泵,将步骤(1)制备的水相溶液和步骤(2)制备的油相溶液分别装入第一注射泵21和第二注射泵22内。所述微通道10的出口11为锥形,如图3所示,出口11的直径沿溶液流动方向逐渐减小,其长度为4.3mm,出口11处最小的直径为50~80μm,所述微通道10的出口11与直径为500μm且长度为6cm的收集管30连通,收集管30通过软管50与装有去离子水的收集容器40连通,为固定所述微通道10和收集管30,在所述微通道10和收集管30接触处的外壁上套有方管60。
控制装有水相溶液的第一注射泵21的流速为25μL/min,控制装有油相溶液的第二注射泵22的流速为5μL/min,当水相溶液和油相溶液在锥形出口11处,因水相溶液的流动速度更快,以及界面张力和粘性力作用,可将油相溶液剪断,形成单分散的水包油(O/W)乳液,静止1h,所述水包油乳液使油水两相充分传质且油相溶液挥发获得中空EC微囊。
(4)洗涤
用去离子水洗涤所述中空EC微囊,干燥后获得乙基纤维素中空微囊,如图2所示,中空EC微囊形成过程;以单级微流控装置制备的O/W乳液为模板,由于乙酸乙酯具有较强的挥发性和一定的水溶性,在油水界面水分子与其进行相互传质,水分子通过油水界面进入油相中并发生聚并形成大水滴,EC分子固化后,水滴形成了EC微囊内部的中空腔。
研究聚甘油蓖麻醇酯(PGPR)含量对微囊的影响
按照实施例1提供的装置和方法分别采用浓度为0%、2%、4%和9%的PGPR制备所述微囊,并将微囊放在扫描电子显微镜(SEM)下观察。
如图4所示,不同PGPR含量的EC微囊整体的扫描电镜图。PGPR含量分别为0%(w/v)(a)、2%(w/v)(b)、4%(w/v)(c)、9%(w/v)(d),标尺为50μm。从图中可以看出:无PGPR含量(0%)的微囊,表面有多孔结构;浓度2%PGPR含量的微囊,表面有尺寸较小凹陷坑洼;浓度4%PGPR含量的微囊,表面有尺寸较大的凹陷坑洼;浓度为9%PGPR含量的微囊,表面一侧有尺寸较大的凹陷,几乎占据了微囊一半空间。在添加量不变的情况下,随着PGPR浓度增加,PGPR的含量增加;由此表明:随着油相中PGPR含量的增加,微囊表面的凹陷坑洼尺寸会越来越大,直至占据微囊一半的空间。由于EC固化形成微囊膜后,富集在油水界面的水滴会破裂,从而在囊壁表面形成尺寸不同的凹陷。
如图5所示,不同PGPR含量的EC微囊截面的扫描电镜图。PGPR含量分别为0%(w/v)(a)、2%(w/v)(b)、4%(w/v)(c)、6%(w/v)(d),标尺为50μm,从图中可以看出:无PGPR含量(0%)的微囊内部呈现多孔结构但没有空腔部分;浓度为2%PGPR含量的微囊内部疏松多孔且有空腔;浓度为4%PGPR含量的微囊内部结构致密且有较大空腔;浓度为6%PGPR含量的微囊内部结构致密且有大的空腔。由此表明:随着油相PGPR含量增加,微囊内部空腔越来越大,由于表面活性剂PGPR含量的增加,使得水相中的水分子更容易穿越油水界面,大量水分子穿越相界面扩散到乳液内部聚并形成更大的水滴,EC固化成囊层后,水滴形成了微囊的空腔。因此,油相中PGPR含量越多,微囊内部空腔越大,并且微囊壁层结构由多孔变为致密。
乙基纤维素EC含量对微囊的影响
按照实施例1提供的装置和方法分别采用浓度为5%、6%、7%和8%的乙基纤维素EC制备所述微囊,并将微囊放在扫描电子显微镜(SEM)下观察。
如图6所示,不同EC含量的微囊扫描电镜图。浓度5%EC含量的微囊(a)及其截面(b)的扫描电镜图;浓度6%EC含量的微囊(c)及其截面(d)的扫描电镜图;浓度7%EC含量的微囊(e)及其截面(f)的扫描电镜图;浓度8%EC含量的微囊(g)及其截面(h)的扫描电镜图,标尺为25μm。
从图中可以看出:EC浓度为5%时,微囊内部空腔尺寸为84μm;EC浓度为6%时,微囊内部空腔尺寸为70μm;EC浓度为7%时,微囊内部空腔尺寸为55μm;EC浓度为8%时,微囊内部空腔尺寸为50μm。由此表明:随着油相中EC含量的增加,内部空腔尺寸逐渐减小,O/W乳液界面传质时,油相的乙酸乙酯向外扩散,水相的水分子向内扩散,随着油相乙酸乙酯逐渐向水相扩散并挥发,油相中EC的含量越高,其EC的析出速度越快,析出的EC将形成囊膜会对水分子向内传质有阻力,能够扩散到油相内部的水分子较少,从而在油相内部聚并的水滴尺寸也较小,EC固化后在微囊内部形成的空腔尺寸也较小。
流速比(外相:内相)对微囊粒径尺寸和单分散性的影响,在不同流速比条件下制备EC微囊。
流速比(外相:内相)分别为3、5、10按照实施例1的方法制备EC微囊,微囊粒径均一,呈正态分布,计算得出流速比为3、5、10的微囊粒径变异系数(CV值)分别为2.8%、2.2%、3.1%,低于5%,说明不同流速比制备的微囊单分散性均良好,且流速比为5的微囊单分散性最好。同时,流速比为3时,微囊平均粒径为158μm;流速比为5时,微囊平均粒径为141μm;流速比为10时,微囊平均粒径为107μm。由此表明:随着流速比的增加,微囊平均粒径会减小。这是由于流速比的增加,加强了油水两相间的剪切作用,使锥口剪切出的乳液尺寸变小,因此固化后的微囊粒径变小。
微胶囊控制释放特性研究
分别在微囊内载入不同量的药物量(6.14%、10.44%和13.7%)分别在弱酸性pH=6.8和弱碱性pH=7.4的环境下测试其释放性。
如图7所示,在pH=6.8释放介质中,6.14%和10.44%载药量的微囊表现出先快后慢释放特征,符合一般缓释制剂的特征,在释放时间达到8h后,药物释放曲线平缓,药物不再释放,药物累计释放率分别达到99.06%和99.13%;13.7%载药量的微囊表现出恒速的释放特征,符合零级缓释制剂的特征,在释放时间达到4h时,药物完全释放,药物累计释放率达到100%。在载药微囊释药过程中,低载药量微囊的累计释放率低于高载药量微囊的累计释放率,由于高载药量微囊中药物占据了微囊囊层的更多空间,当释放介质溶解药物时,会形成更多的孔通道,药物释放速率也越快。
如图8所示,在pH=7.4释放介质中,三种不同载药量的微囊都表现出先快后慢的非恒速释放特征,符合一般缓释制剂的特征。随着体外释放时间增加,药物释放曲线逐渐平缓。在释放时间达到6h时,6.14%载药量的微囊药物累计释放率达到86.13%;在释放时间达到12h时,10.44%载药量的微囊药物累计释放率达到99.79%;在释放时间达到10h时,13.7%载药量的微囊药物累计释放率达到100%。在载药微囊释药过程中,低载药量微囊的累计释放率低于高载药量微囊的累计释放率,这是由于高载药量微囊中药物占据了微囊囊层的更多空间,当释放介质溶解药物时,会形成更多的孔通道,药物释放速率也越快。
本实施例利用单级微流控装置制备了高单分散的O/W乳液,以此乳液为模板,利用易挥发易溶于水的有机溶剂乙酸乙酯与水分子之间的传质,引起EC相分离而形成具有中空结构的EC微囊。在不同流速比条件下所制备的微囊粒径均一,单分散性良好。同时,随着流速比的增大,微囊的平均粒径会减小。在油水界面传质过程中,随着油相PGPR含量的增加,水分子向油相的传质更容易,大量水分子在相界面汇聚并向油相扩散,在界面处聚并形成许多水滴。微囊内部空腔的形成与PGPR含量密切相关,当油相中PGPR含量为0时,微囊内部无空腔结构,随着油相中PGPR含量的增加,微囊内部出现空腔结构且空腔尺寸增大。随着EC含量的增加,微囊内部空腔尺寸减小。
研究了三种不同载药量微囊在pH=6.8和pH=7.4两种释放介质中的体外释放性能。结果表明:载药量是影响药物释放的重要因素,载药量越低的微囊的累计释放率越小,在pH=6.8的释放介质中,6.14%载药量的微囊缓释效果最佳,释药时间达到8h时,累计释放率为99%,药物基本释放完全;在pH=7.4的释放介质中,6.14%载药量的微囊缓释效果较好,但其释药时间仅有6h且药物释放不完全,而10.44%载药量的微囊释药时间可达12h。在pH=6.8的释放介质中,6.14%和10.44%载药量的微囊的体外释放符合Higuchi方程,释放速率受扩散定律控制。13.7%载药量的微囊的体外释放符合零级释放方程,释放速率与时间无关,可能与微囊的溶蚀崩解有关;在pH=7.4的释放介质中,三种不同载药量微囊的体外释放均符合一级释放方程,释放速率与时间成正比。
以上所述仅是本发明优选的实施方式,但本发明的保护范围并不局限于此,任何基于本发明所提供的技术方案和发明构思进行的改造和替换都应涵盖在本发明的保护范围内。
- 一种乙基纤维素中空微囊
- 一种高效催化二氧化碳转化甲醇的生物活性中空纳米纤维和中空微囊
