Fusarielin M及其衍生物、药学上可接受的盐的应用
文献发布时间:2023-06-19 10:35:20
技术领域
本发明涉及药学领域,具体涉及Fusarielin M及其衍生物、药学上可接受的盐的应用。
技术背景
结核病是由结核分枝杆菌(Mycobacterium tuberculosis,Mtb)引起的慢性传染病,是全世界最主要的致命传染病之一。根据世界卫生组织2019全球结核病控制报告,在2018年,共有1000万新发患者,约120万人死于结核病(TB)。我国是结核病与耐药结核病高负担国家,加上耐药菌的不断出现,抗结核药物的研发迫在眉睫!
结核分枝杆菌酪氨酸磷酸酶B(Mycobacterium tuberculosis protein tyrosinephosphatase,MptpB),是结核分枝杆菌侵染宿主细胞所必须的分泌型毒力因子,具有酪氨酸磷酸酶活性。MptpB也是Mtb体外生长的非必需基因,MptpB的缺失不影响Mtb在培养基中的生长,但是严重抑制Mtb在IFN-γ激活巨噬细胞中的增殖,并且削弱Mtb感染豚鼠的能力。MptpB与人PTP1B的同源性仅为6%,较低的同源相似性会提高以MptpB为靶点的抗结核药物特异性。因此,以MptpB为靶点进行抗结核药物的筛选,是研制新的强力低毒抗结核药物的重要策略。
发明内容
本发明的目的在于克服现有技术中问题,提供Fusarielin M及其衍生物、药学上可接受的盐的应用。
本发明的目的通过以下技术方案予以实现:
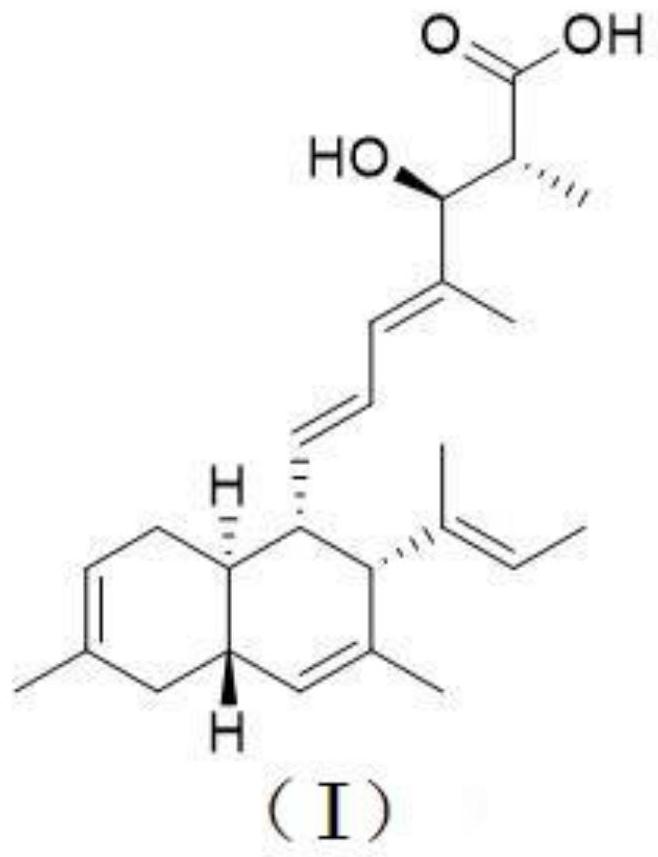
化合物Fusarielin M,其结构式如式(I):
Fusarielin M及其衍生物或其药学上可接受的盐在作为酪氨酸磷酸酶抑制剂的应用。
所述化合物分离自海葵共附生真菌Fusarium graminearum SYSU-MS5127的菌体;所述菌株Fusarium graminearum SYSU-MS5127于2020年1月17日保藏于广东省微生物菌种保藏中心,保藏号为GDMCC No:60964。
Fusarielin M及其衍生物或其药学上可接受的盐在制备抑制酪氨酸磷酸酶的药物上的应用。
优选地,所述酪氨酸磷酸酶为结核分枝杆菌酪氨酸磷酸酶B。
Fusarielin M及其衍生物或其药学上可接受的盐在制备抗结核病的药物中的应用。
优选地,所述Fusarielin M或其衍生物或其药学上可接受的盐的浓度为0.95~1.12μM。
与现有技术相比,本发明具有以下技术效果:
本发明提供了化合物Fusarielin M或其衍生物或其药学上可接受的盐的应用,化合物Fusarielin M对结核分枝杆菌酪氨酸磷酸酶B具有很强的抑制活性,其IC
附图说明
图1结核分枝杆菌酪氨酸磷酸酶B蛋白纯化后的SDS-PAGE电泳结果;其中M泳道为蛋白质分子量标准(Thermo 26616),1、2泳道为纯化后的MptpB(每孔上样量为1μg纯化蛋白);
图2化合物Fusarielin M对结核分枝杆菌酪氨酸磷酸酶B酶活性抑制的IC
图3化合物Fusarielin M对结核分枝杆菌酪氨酸磷酸酶B的抑制类型鉴定;
图4化合物Fusarielin M对细胞内MptpB介导的MAPK通路激活的western blot检测结果;
图5不同浓度化合物Fusarielin M处理时细胞内结核杆菌数;
图6化合物Fusarielin M分子结构式图;
图7化合物Fusarielin M的
图8化合物Fusarielin M的
图9化合物Fusarielin M的HRESIMS谱图。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面结合具体实施例将对本发明的技术方案进行详细的描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施方式,都属于本发明所保护的范围。
除特殊说明,本实施例中所用的设备均为常规实验设备,所用的材料、试剂无特殊说明均为市售得到,无特殊说明的实验方法也为常规实验方法。
实施例1
一、Fusarielin M的分离和鉴定
化合物Fusarielin M,是从海洋真菌Fusarium graminearum SYSU-MS5127的菌体中分离得到的天然代谢活性产物。该海洋真菌是从广东省深圳市赖氏洲海葵中分离得到,并保存于广东省微生物菌种保藏中心,保藏编号为GDMCC NO:60964。化合物Fusarielin M的分离方法如下:
(1)菌种
Fusarium graminearum SYSU-MS5127,4℃保存在PDA斜面培养基中。
(2)培养基
种子培养基:马铃薯200g,葡萄糖20g,双蒸水1L。
发酵培养基:大米6000g,海盐180g,双蒸水6L。
(3)菌种活化和摇瓶培养
将菌体从保存斜面挑出,接种在种子培养基,置28℃恒温摇床(转速180rpm),振荡培养72h获得种子培养液。
(3)发酵培养
将菌株种子液接种到发酵培养基中,25℃静置培养28天。
(4)提取与分离
1)粗提物提取
过滤发酵物,得到真菌菌体。菌体采用甲醇浸泡提取,浸泡液在低于50℃下减压浓缩得浸膏。
2)硅胶柱层析第一次分离
提取物浸膏使用硅胶柱层析进行第一次分离,分别用20%,30%,40%,50%,60%,70%,80%,100%的乙酸乙酯-石油醚梯度洗脱。收集30%乙酸乙酯-石油醚洗脱液,并浓缩得粗提组分。
3)葡聚糖凝胶和硅胶柱层析第二次分离
以葡聚糖凝胶Sephadex LH-20(洗脱剂为CH
4)HPLC分离
使用ACE 5C18-AR色谱柱(250×10.0mm,5μm)进行半制备型的正向HPLC分离,流动相为正己烷-异丙醇(v/v=90:10),洗脱液进一步浓缩后获得淡黄色油状的化合物Fusarielin M。
(5)化合物的结构分析
对提取纯化的化合物进行结构分析测试,得到以下理化性质数据:
Fusarielin M:淡黄色油状物;
表1化合物Fusarielin M的
二、结核分枝杆菌酪氨酸磷酸酶B(MptpB)的表达与纯化
将表达MptpB的大肠杆菌BL21(DE3)工程菌接种于含有卡那霉素(50μg/mL)的LB培养液,37℃震荡培养过夜获得培养物。将2mL上述培养物接种于100mL含卡那霉素的LB培养液中,37℃震荡培养至OD
三、Fusarielin M对结核分枝杆菌酪氨酸磷酸酶B(MptpB)的酶抑制活性分析
采用对硝基苯磷酸二钠(pNPP)为底物,在反应缓冲液(50mM Tris,100mM NaCl,pH7.0)中进行化合物抑制结核分枝杆菌酪氨酸磷酸酶B的抑制实验,所用的结核分枝杆菌酪氨酸磷酸酶B是上述纯化得到的重组结核分枝杆菌酪氨酸磷酸酶B蛋白。
(1)半抑制浓度IC
反应总体积为200μL,3个平行孔,在96孔板中依次加入1.5μg的MptpB,梯度的化合物(终浓度:0μM,0.05μM,0.1μM,0.5μM,1μM,5μM,10μM),化合物和MptpB在室温预混合5min。孵育结束后,加入终浓度为1.3mM的pNPP,37℃反应5min,读取405nm下各孔的吸收值。同时,设立空白对照(只加DMSO或化合物),用于扣除背景。根据吸光值按照以下计算方法算出化合物对MptpB酶的抑制活性:抑制率(%)=[1-(实验组-空白组)/(阴性对照-空白组)]×100%。以化合物浓度的对数为横坐标,抑制率为纵坐标作图,由Origin Pro 8软件拟合计算IC
(2)抑制类型分析
如上所述,测定不同化合物浓度(0μM,0.5μM,1μM,2.5μM)下,浓度梯度的pNPP底物(0.1mM,0.2mM,0.4mM,0.8mM,1.6mM,3.2mM)对应的吸光值,然后以底物浓度的倒数为横坐标,反应速率的倒数为纵坐标,进行双倒数作图,判定抑制类型和计算抑制常数K
(3)化合物的酶抑制特异性分析
测定化合物对同源蛋白结核分枝杆菌酪氨酸磷酸酶A(MptpA)、人酪氨酸磷酸酶1B(PTP1B)的酶抑制活性,反应体系同MptpB。不同地,反应中加入0.75μg的MptpA,化合物浓度为0μM、1.5625μM、3.125μM、6.25μM、12.5μM、25μM、50μM,化合物与MptpA预孵育5min后加入终浓度1.2mM底物;反应中加入1μg的PTP1B,化合物浓度为0μM、1.5625μM、3.125μM、6.25μM、12.5μM、25μM、50μM,化合物与PTP1B预孵育5min后加入终浓度2mM底物。每个样品测定3个平行孔,计算出化合物对MptpA和PTP1B的半抑制浓度IC
(4)实验结果
实验测得化合物Fusarielin M对结核分枝杆菌酪氨酸磷酸酶B半抑制浓度IC
表2化合物Fusarielin M的体外酶抑制活性结果(IC
SI=selectivity index.SI
表3化合物Fusarielin M对MptpB酶抑制常数测定结果(K
四、化合物Fusarielin M的细胞增殖毒性实验
(1)细胞培养
人肺癌细胞株A549在含10%FBS和双抗(青霉素和链霉素)的RPMI 1640培养基中培养,小鼠肺泡巨噬细胞J774A.1与人肝癌细胞HepG2在含10%FBS和双抗(青霉素和链霉素)的DMEM培养基中培养。
(2)细胞铺板
当小鼠肺泡巨噬细胞J774A.1贴壁汇聚度达到80%~90%时,弃培养基,用PBS洗细胞两次后,加入胰酶消化,培养基终止消化,转移至离心管,1000rpm离心3min。弃上清,用培养基重悬细胞,取少量细胞悬液进行计数。用培养基将细胞重悬液的密度调节至5×10
(3)化合物处理
向接种细胞的96孔板中加入含有不同浓度化合物的培养液(25,50,100,120,150,180,200μM),同时设立阴性对照组(含1%DMSO)和空白对照组(只加培养基),三个平行孔。将细胞培养板置于37℃的CO
(4)MTS处理
弃去原孔内培养基,每孔加入0.1mL培养基和20μL MTS(promega),继续培养0.5-1h。取出培养板,测量490nM下各孔的吸光值。根据吸光值按照以下计算方法算出不同浓度化合物处理对细胞增殖的抑制活性:抑制率(%)=[1-(实验组-空白组)/(阴性对照-空白组)]×100%。以化合物浓度的对数为横坐标,抑制率为纵坐标作图,由Origin Pro 8软件拟合计算IC
(5)实验结果
实验结果显示,化合物Fusarielin M对人肺癌细胞株A549,人肝癌细胞株HepG2,小鼠巨噬细胞株J774A.1没有很强的细胞毒性,IC
表4化合物Fusarielin M的细胞增殖毒性实验结果(IC
实施例2
一、化合物Fusarielin M的体外抗结核菌生长活性测定
本实验采用刃天青作为细菌生长的指示试剂,测定化合物Fusarielin M对4株分枝杆菌菌株(M.smegmatis,M.marinum,M.bovis,M.tuberculosis)、1株金黄色葡萄球菌(Staphylococcus aureus)和1株大肠杆菌菌株(Escherichia coli)的体外抑菌活性,以最低抑菌浓度(minimum inhibitory concentration,MIC)为指标评价化合物的抗菌活性。
(1)菌株
分枝杆菌:M.tuberculosis H
金黄色葡萄球菌(Staphylococcus aureus ATCC6538)、大肠杆菌(Escherichiacoli ATCC25922)在LB培养基中培养。
(2)采用刃天青(aladdin)作为细菌生长的指示剂,检测化合物的体外抑菌活性。在96孔板上,将梯度稀释的化合物(100μL)与细菌(100μL)共培养一段时间,然后每孔加入30μL的0.01%刃天青溶液,继续培养过夜,测定每孔荧光值(激发波长530nm,发射波长590nm),计算得到化合物对各个细菌的最低抑菌浓度(MIC)。
(3)实验结果:化合物Fusarielin M对结核分枝杆菌H
表5化合物Fusarielin M的体外抗菌活性(MIC,mg/L)
二、化合物Fusarielin M对细胞内MptpB抑制活性分析
在结核菌感染细胞时,毒力蛋白MptpB能通过激活细胞Akt信号、抑制ERK1/2和p38活化,从而抑制细胞凋亡与下调免疫反应。如果化合物Fusarielin M能够抑制细胞内MptpB,就能反转MptpB对细胞通路的调节作用,引起上述指标的相反变化,即Akt通路激活减少,ERK1/2和p38激活增多。据此,在巨噬细胞Raw264.7中瞬时转染过表达MptpB(野生型)、MptpB/C160S(酶活缺失型),用干扰素IFN-γ刺激细胞免疫,并加入化合物处理,收集并提取细胞总蛋白,进行Western blot检测细胞中pERK1/2、ERK1/2、pp38、p38的蛋白表达量。
(1)小鼠巨噬细胞Raw264.7培养
小鼠巨噬细胞Raw264.7培养在含10%FBS和双抗(青霉素和链霉素)的DMEM培养基,置于37℃的CO
(2)细胞瞬时转染表达MptpB
准备含3ug表达质粒(MptpB、MptpB/C160S、Vector)的150μL Opti-MEM,加入9μL
(3)化合物处理
转染24h后,更换含有不同浓度化合物的新鲜培养基(0,10,20μM),37℃培养1h。每孔加入终浓度为40ng/mL IFN-γ,继续培养2h后收集细胞进行蛋白提取。
(4)细胞总蛋白提取
弃去培养上清液,用PBS清洗细胞两次(2mL/孔)。按200μL/孔,加入IP Lysis/washbuffer(含1×蛋白酶抑制剂,Pierce),混匀,置于冰上裂解15min。13000×g,4℃离心10min,取上清进行蛋白浓度测定及Western blot实验。
检测抗体:兔抗p-ERK1/2(Thr202/Tyr204),兔抗ERK1/2,兔抗p-p38(Thr180/Tyr182),兔抗p38购自CST公司;鼠抗α-tubulin,辣根过氧化物酶(HRP)标记山羊抗小鼠IgG二抗,HRP标记山羊抗兔二抗购自Proteintech公司。
(5)实验结果:
MptpB能抑制IFN-γ刺激下细胞内MAPK通路的激活,减少p38与ERK1/2的磷酸化水平;MptpB对MAPK通路抑制是依赖于其磷酸酶活性,故点突变缺失酶活MptpB/C160S失去了对MAPK的抑制作用,与转染空载一致(图4)。因此,本实验中,MptpB对细胞内MAPK通路的抑制作用与文献报道一致。化合物Fusarielin M对细胞内MptpB产生抑制后,p-p38与p-ERK1/2增多且呈浓度依赖;在转染空载与点突变酶活缺失MptpB/C160S的细胞内,化合物Fusarielin M不影响-pp38与p-ERK1/2的表达量(图4)。因此,Fusarielin M能够阻断MptpB对细胞内MAPK通路的抑制作用。
三、化合物Fusarielin M对巨噬细胞内分枝杆菌的生长抑制活性
鉴于化合物Fusarielin M具备良好的体内外抑制MptpB活性,进一步研究化合物在细胞水平上的抗结核活性。以小鼠肺泡巨噬细胞J774A.1为宿主细胞,用牛分枝杆菌(M.bovis BCG)菌株感染细胞,测定Fusarielin M抑制胞内结核菌增殖的活性。
(1)牛分枝杆菌M.bovis BCG菌株培养
7H9(含0.2%甘油,0.05%Tween-80,10%OADC)液体培养基,7H10(含0.2%甘油,10%OADC)固体培养基(BD)。
将-80℃冻存的牛分枝杆菌BCG菌株接种于7H10固体培养基,37℃倒置培养2-3周,直至平板上长出一层菌苔,即可用于细胞感染或传代。
(2)J774A.1细胞培养与铺板
小鼠肺泡巨噬细胞J774A.1培养在含10%FBS和双抗(青霉素和链霉素)的DMEM培养基,置于37℃的CO
(3)细胞感染
刮取2-3周菌龄的BCG菌苔至50mL离心管,并用20mL预热的PBS缓冲液重悬,加入5mL玻璃珠涡旋震荡10min。600rpm离心10min,吸取上清液,用含10%牛血清的DMEM培养基将菌液稀释至1×10
三天后,小心弃掉细胞培养上清,按1mL/孔用预热的PBS洗细胞2次。每孔加入0.2mL 0.05%SDS,37℃静置5min,裂解细胞释放胞内活菌。将细胞裂解液转移至1.5mL离心管,涡旋震荡5min,充分裂解细胞和重悬菌体。用7H9培养基对裂解液进行100倍稀释,取200μL稀释液涂布于7H10平板,37℃倒置培养3-4周后,对平板上的生长菌落计数,计算抑菌率。
(4)实验结果
化合物Fusarielin M对巨噬细胞J774A.1内BCG的增殖具有抑制作用,且呈化合物浓度依赖,如图5,在化合物浓度分别为5μM,10μM,20μM时,细胞内活菌数分别减少了42%,58%,62%。之前的实验证明了40μM化合物Fusarielin M对J774A.1无明显细胞毒性作用,所以此处观察到的胞内抑菌效果是由化合物抗菌活性导致,而不是化合物的毒性引起细胞凋亡,破坏了细菌生存环境导致的活菌数降低。
最后应当说明的是,以上实施例仅用以说明本发明的技术方案,而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细地说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
- Fusarielin M及其衍生物、药学上可接受的盐的应用
- Fusarielin M及其衍生物、药学上可接受的盐的应用
