用于检测外泌体miRNA的MDTs-CHA体系、电化学传感器及其应用
文献发布时间:2023-06-19 11:16:08
技术领域
本发明涉及外泌体miRNA检测技术领域,特别是涉及一种用于检测外泌体miRNA的MDTs-CHA体系、电化学传感器及其应用。
背景技术
作为液体活检重要组成部分的外泌体(exosomes)是由细胞内多泡体通过细胞质膜融合向细胞外环境释放并进入循环系统的具有脂质双分子层的膜性囊泡,其直径在30-150nm之间。目前大量的研究已经证实,在各种肿瘤细胞分泌的exosome中存在异常表达miRNA (exo-miRNA),如miRNA-21与乳腺癌转移密切相关,miRNA-375可用于诊断乳腺癌,miRNA-124介导肿瘤免疫逃逸等。因此,exo-miRNA可以作为早期无创检测癌症和预后评估的可靠生物标记物。而且,外泌体膜可以保护miRNA在不被RNA酶降解,这为exo-miRNA 作为肿瘤标志物提供了强有力的保障。
Exo-miRNA的检测亟具挑战,但现有检测方法存在一些不足之处。定量逆转录聚合酶链反应(quantitative reverse transcription polymerase chain reaction,qRT-PCR)是目前exo-miRNA 定量检测的“金标准”,尽管广泛应用于exo-miRNA的临床检测,但qRT-PCR仍然存在耗时长,检测仪器昂贵和易导致假阳性等缺陷。近年来,已经开发出多种无需PCR反应的 exo-miRNA检测方法,例如纳米材料辅助信号扩增方法,滚环扩增反应(rolling circle amplification,RCA)及引物交换反应(primer exchange reaction,PER)等酶辅助的等温扩增方法。尽管上述策略具有快速、敏感的检测性能,但复杂的操作和严格的酶反应条件限制了这些检测方法的实际应用。
为了解决上述缺陷,目前基于催化发夹组装(catalytic hairpin assembly,CHA)、杂交链式反应(hybridization chain reaction,HCR)和熵驱动电路(entropydriven circuit,EDC)等无酶扩增策略的miRNA检测平台已经被提出。无酶扩增策略具有高特异性、易于使用和稳定性高的特性,进一步提高了exo-miRNA的检测效率。但是,灵敏度低限制了基于无酶扩增的生物传感器的分析能力。
发明内容
鉴于以上所述现有技术的缺点,本发明的目的在于提供一种用于检测外泌体miRNA的 MDTs-CHA体系、电化学传感器及其应用,用于解决现有技术中外泌体miRNA检测手段操作复杂、灵敏度低等问题。
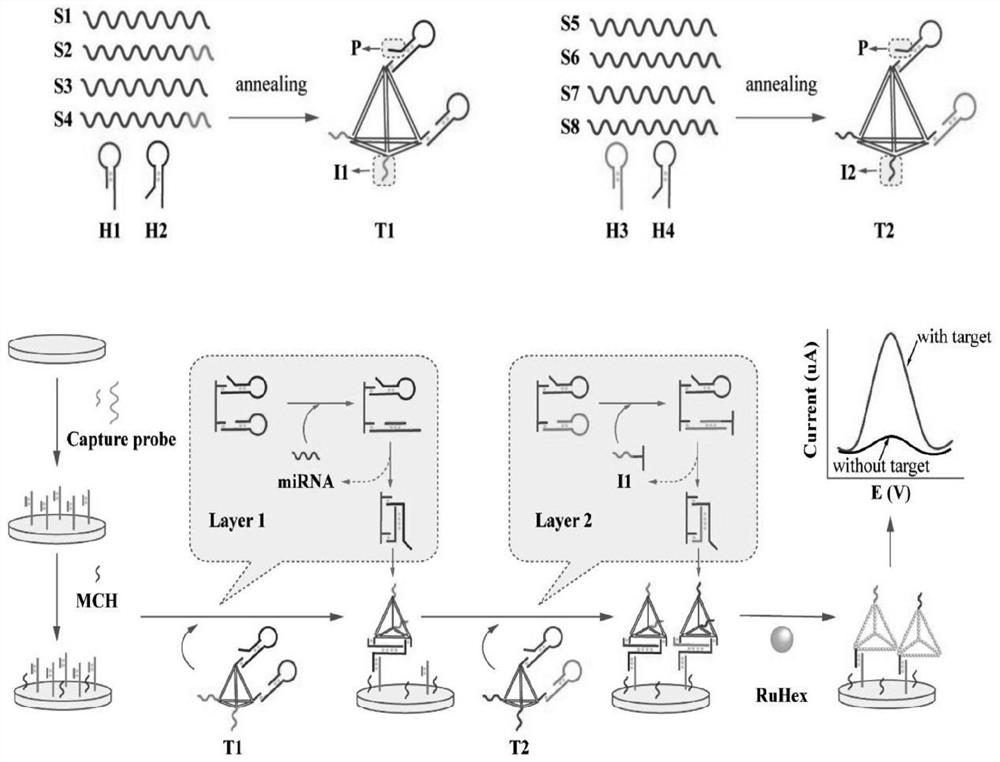
为实现上述目的及其他相关目的,本发明第一方面提供一种用于检测外泌体miRNA的 MDTs-CHA体系,所述MDTs-CHA(Multifunctional DNA tetrahedrons assistedcatalytic hairpin assembly)体系为多功能DNA四面体辅助催化发夹组装体系,所述MDTs-CHA体系包括N 层相互叠加的T1结构和T2结构,所述T1结构包括一个DNA四面体DT1及两个发夹H1、 H2,所述T2结构包括一个DNA四面体DT2及两个发夹H3、H4,所述发夹H1和H3含有与靶标miRNA或触发链互补的区域,所述发夹H2和H4的3’端分别含有游离的触发链I1 和I2,所述发夹H2和H4中还具有与捕获探针CP1互补的区域P链;当靶标miRNA或触发链存在时,所述T1结构上的CHA反应被启动,暴露出发夹H2上封闭的P链,P链与捕获探针CP1特异性杂交,置换出与CP1特异性互补的捕获探针CP2链,此时触发链I1固定于电极表面,触发启动T2结构的CHA反应,暴露出发夹H4上封闭的P链和触发链I2,以类似的方式循环往复,启动MDTs-CHA体系的T1、T2结构依次交替进行N层CHA循环反应;部分P链被“锁定”在发夹的茎结构中,只有在MDTs-CHA反应启动后才能完全释放出来与捕获探针结合,从而将MDTs-CHA固定在电极表面上;所述DNA四面体带有电化学信号报告分子,所述捕获探针通过捕获带有电化学信号报告分子的DNA四面体,使电化学信号扩增,用于外泌体miRNA检测。
进一步,所述DNA四面体DT1由四条单链S1、S2、S3、S4通过一步退火法合成。
进一步,所述单链S1的序列如SEQ ID NO.1所示:
5’-TATCACCAGGCAGTTGACAGTGTAGCAAGCTGTAATAGATGCGAGGGTCCAATACTTTGTGTAGCAGGAGAGG-3’;
所述单链S2的序列如SEQ ID NO.2所示:
5’-TCAACTGCCTGGTGATAAAACGACACTACGTGGGAATCTACTATGGCGGCTCTTCTTTGATCAAGTATGCCAAAGACACTC-3’;
所述单链S3的序列如SEQ ID NO.3所示:
5’-TTCAGACTTAGGAATGTGCTTCCCACGTAGTGTCGTTTGTATTGGACCCTCGCATTTAAGGTTTGACGTGTGG-3’;
所述单链S4的序列如SEQ ID NO.4所示:
5’-ACATTCCTAAGTCTGAAACATTACAGCTTGCTACACGAGAAGAGCCGCCATAGT ATTTGATCAAGTATGCCAAAGACACTC-3’。
进一步,所述DNA四面体DT2由四条单链S5、S6、S7、S8通过一步退火法合成。
进一步,所述单链S5的序列如SEQ ID NO.5所示:
5’-TATCACCAGGCAGTTGACAGTGTAGCAAGCTGTAATAGATGCGAGGGTCCAATACTTTGTGTAGCAGGAGAGG-3’;
所述单链S6的序列如SEQ ID NO.6所示:
5’-TCAACTGCCTGGTGATAAAACGACACTACGTGGGAATCTACTATGGCGGCTCTTCTTAATGGATTTTTGGAGCAGG-3’;
所述单链S7的序列如SEQ ID NO.7所示:
5’-TTCAGACTTAGGAATGTGCTTCCCACGTAGTGTCGTTTGTATTGGACCCTCGCATTTAAGGTTTGACGTGTGG-3’;
所述单链S8的序列如SEQ ID NO.8所示:
5’-ACATTCCTAAGTCTGAAACATTACAGCTTGCTACACGAGAAGAGCCGCCATAGTATTAATGGATTTTTGGAGCAGG-3’。
进一步,所述发夹H1的序列如SEQ ID NO.9所示:
5’-TTTTTGGAGCAGGGATGTACTAGGCCTGCTCCAAAAATCCATTTTTCCACACGT CAAACCTT-3’;
所述发夹H2的序列如SEQ ID NO.10所示:
5’-CTACTCAGATGTACTAGGTTTTGGAGCAGGCCTAGTACATCCCTGCTTTTCCTCTCCTGCTACACA-3’;
所述发夹H3的序列如SEQ ID NO.11所示:
5’-TATGCCAAAGACACTCGATGTACTAGGGAGTGTCTTTGGCATACTTGATCATTTCCACACGTCAAACCTT-3’;
所述发夹H4的序列如SEQ ID NO.12所示:
5’-CTACTCAGATGTACTAGGTATGCCAAAGACACTCCCTAGTACATCGAGTGTCTTTTCCTCTCCTGCTACACA-3’。
进一步,所述P链的长度为14nt,被“锁定”在发夹的茎结构中的部分P链长度为7nt。
进一步,所述捕获探针CP1的序列如SEQ ID NO.13所示:
Capture probe-1:5’-GTACATCTGAGTAGACTTCAACACGATTT-SH(CH2)6-3’。
进一步,所述捕获探针CP2的序列如SEQ ID NO.14所示:
Capture probe-2:5’-TGAAGTCTACTCA-3’。
进一步,所述电化学信号报告分子选自六氨合钌(RuHex)、链霉亲和素标记的碱性磷酸酶 (ST-AP)或亚甲基蓝(MB)中的一种;优选地,所述电化学信号报告分子为六氨合钌(RuHex)。
进一步,所述MDTs-CHA体系的制备方法为:将四条单链通过一步退火法组装形成DNA 四面体,然后再将组装好的DNA四面体与CHA发夹一起孵育,使CHA发夹与DNA四面体的延长链连接,形成MDTs-CHA体系。
可选地,所述一步退火法为:将四条单链在95℃下变性5min。
可选地,所述发夹的变性条件为:95℃,5min。
可选地,所述DNA四面体与CHA发夹的孵育在室温下进行,时间为30min。
本发明第二方面提供一种含有如第一方面所述的MDTs-CHA体系的用于检测外泌体 miRNA的电化学传感器,参与电化学传感器反应的组分包括:MDTs-CHA体系、电极和电化学信号报告分子溶液。
进一步,所述缓冲液选自TNaK缓冲液、1×TE缓冲液、TrisHCl缓冲液中的至少一种。
进一步,所述电极为经过预处理的金电极,预处理方式为:将裸金电极先用捕获探针修饰,再用MCH修饰,封闭活性位点。
可选地,所述金电极的预处理方式为:将用巯基标记的捕获探针滴加到裸金电极表面,置于4℃过夜,然后用PBS缓冲液将金电极表面冲洗干净后,将MCH溶液滴加到金电极表面,置于避光阴凉的地方孵育60min,然后用PBS溶液将电极表面冲洗干净。
进一步,所述电化学信号报告分子选自六氨合钌(RuHex)、链霉亲和素标记的碱性磷酸酶 (ST-AP)或亚甲基蓝(MB)中的一种;优选地,所述电化学信号报告分子为六氨合钌(RuHex)。
本发明第三方面提供一种采用如第一方面所述的MDTs-CHA体系或如第二方面所述的电化学传感器检测外泌体miRNA的方法,包括如下步骤:
(1)将四条单链通过一步退火法组装形成DNA四面体,变性退火后的CHA发夹与DNA四面体在室温下共同孵育,使CHA发夹与DNA四面体延长链相连接,形成MDTs-CHA体系;
(2)将组装MDTs-CHA体系、待测外泌体miRNA(待测样品)和缓冲液混合形成反应体系,将混合好的反应体系滴加到电极表面,进行反应,反应结束后,将电极浸泡于电化学信号报告分子溶液中进行反应,反应结束后进行电化学检测。
进一步,所述步骤(1)中,所述一步退火法为:将四条单链在95℃下变性5min,组装形成DNA四面体。
进一步,所述步骤(1)中,变性退火后的CHA发夹与DNA四面体在室温下共同孵育30min。
进一步,所述步骤(1)中,所述发夹的变性条件为:95℃,5min。
进一步,所述步骤(1)中,所述反应体系中,DNA四面体与CHA发夹的终浓度比为: 1∶1。
进一步,所述步骤(2)中,将混合好的反应体系滴加到电极表面,在25℃条件下反应 15min。
可选地,所述组装好的MDTs-CHA的浓度为25nM。
进一步,所述步骤(2)中,所述缓冲液选自TNaK缓冲液、1×TE缓冲液、TrisHCl缓冲液中的至少一种。
进一步,所述步骤(2)中,电极在电化学信号报告分子溶液中于室温下反应10min。
进一步,所述电化学信号报告分子选自六氨合钌(RuHex)、链霉亲和素标记的碱性磷酸酶 (ST-AP)或亚甲基蓝(MB)中的一种;优选地,所述电化学信号报告分子为六氨合钌(RuHex)。
进一步,所述电化学检测方法选用示差脉冲伏安法(DPV)、循环伏安法(DV)、交流阻抗法(EIS)、SWV(方波伏安法)中的至少一种。
进一步,所述外泌体miRNA来源于MDA-MB-231细胞系、MCF-7细胞系、16HBE细胞系和血浆。
如上所述,本发明的用于检测外泌体miRNA的MDTs-CHA体系、电化学传感器及其应用,具有以下有益效果:
本发明构建了一种多功能DNA四面体辅助催化发夹(Multifunctional DNAtetrahedrons assistedcatalytic hairpin assembly,MDTs-CHA)体系,该体系通过层叠、局域化的催化发夹组装反应,以MDTs作为电化学报告信号分子的载体,运用电化学传感平台检测外泌体miRNA。相较于RNA测序、芯片和RT-qPCR等传统的外泌体miRNA检测方法,本发明的MDTs-CHA 体系组装及合成方法简单,且MDTs-CHA体系稳定性好,反应时不需要苛刻的反应条件和复杂的操作步骤,检测快速、灵敏且高效。而且,本发明的MDTs-CHA体系可以检测不同细胞系(如MDA-MB-231、MCF-7、16HBE)的外泌体miRNA,还可以检测血浆外泌体miRNA。另外,由于本发明的MDTs-CHA体系是由DNA链组装形成的,所以具有较低的生物毒性和免疫原性,有利于其生物应用。
附图说明
图1显示为本发明中基于MDTs-CHA体系构建的电化学传感器检测外泌体miRNA的原理图。
图2显示为本发明实施例1中用聚丙烯酰胺凝胶电泳(PAGE)表征催化发夹组装的实验结果图。
图3显示为本发明实施例1中琼脂糖凝胶电泳表征四面体组装的实验结果图。
图4显示为本发明实施例1中MDTs-CHA催化发夹组装反应可行性验证实验结果图。其中,曲线a代表CHA without miR-1246,曲线b代表MDTs-CHA without miR-1246,曲线c代表CHA with miR-1246,曲线d代表MDTs-CHA with miR-1246。
图5显示为本发明实施例1中以MDTs--CHA构建电化学传感器过程的表征实验结果图。其中,左图为交流阻抗(EIS)图,中间图为方波伏安法(SWV)图,右图为循环伏安(CV)图;曲线a代表裸金电极,曲线b代表捕获探针组装,曲线c代表MCH封闭,曲线d代表miR-1246与MDTs-CHA反应。
图6显示为本发明实施例1中电化学传感器层叠反应的DPV信号实验结果图。
图7显示为本发明实施例1中电化学传感器层叠反应的扩增效率实验结果图。
图8显示为本发明实施例2中MDTs-CHA检测细胞系来源外泌体miR-1246的实验结果图。
图9显示为本发明实施例3中MDTs-CHA检测血浆外泌体miR-1246的实验结果图。
具体实施方式
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
经典的CHA反应由一段单链核酸启动探针和两条互补的DNA链参与,两条互补的DNA链被设计成稳定的发夹结构,互补区域限制在发夹茎内以阻断其自发杂交作用。由于立足点的特性,加入核酸启动探针后发夹结构会相继打开,并通过链置换反应形成稳定的互补DNA双链结构,从而实现检测靶标的循环放大。CHA与其他无酶等温核酸扩增技术相比,具有催化效率高、背景信号低、反应体系稳定的优点。此外,CHA可与电化学、荧光、比色、表面等离子体共振等多种分析技术相结合,提高基于无酶扩增的生物传感器的灵敏度,通过结合多种技术对信号进行级联扩增。在各种纳米结构中,DNA四面体(DNATetrahedron) 是最经典的三维框架,由于出色的可寻址性和可控性,DNA四面体作为一种出色的DNA 纳米结构,可用于生物传感、药物传输、纳米设备等多个领域。通过化学修饰和DNA自组装,DNA四面体可以标记多种信号分子,如电化学信号报告分子六氨合钌(RuHex),RuHex 是一种电活性物质,它可以通过静电吸附作用与DNA主链结合从而导致电化学信号的放大。
因此,为了解决级联扩增的缺陷,并进一步提高exo-miRNA检测的灵敏度,在本发明中,我们基于多功能DNA四面体(Multifunctional DNA tetrahedronsassistedcatalytic hairpin assembly,MDTs-CHA),同时实现层叠、局域化的催化发夹组装反应,并以MDTs作为信号分子的载体,建立一种快速且灵敏、高效的电化学平台,用于外泌体miRNA的检测,以取代RNA测序、芯片和RT-qPCR等传统检测外泌体miRNA的方法。
本发明的具体实施过程如下:
实施过程中所使用的DNA序列如下表1所示:
表1
上述DNA序列均在生工生物工程(上海)有限公司合成。
在生工生物工程(上海)有限公司合成上述序列后,按说明书用1×TE缓冲液溶解,溶解后的序列浓度为10μM,置于-20℃保存以及后续使用。
实验过程中所使用的缓冲液及六氨合钌溶液配制方法如下:
TNaK缓冲液:配制500ml的TNaK缓冲需要称量Tris-base 1.2114g、3.6525g氯化钠、0.7455g氯化钾,随后用去离子水定容至500ml,充分摇晃混匀,待完全溶解后用盐酸溶液调节pH值至7.5。
1×TE缓冲液:pH为8.0,成分为10mM Tris、1mM EDTA缓冲液(购买于生工生物工程(上海)有限公司)Lot:6703569。
TrisHCl溶液:10mM,pH为7.4,由Tris、Nacl、MgCl
RuHex溶液的配置方法及浓度:在AlfaAesar公司购买RuHex粉剂,用去离子水溶解至 5μM。本发明实施例中采用的电化学信号报告分子为六氨合钌(RuHex),除此之外,还可以链霉亲和素标记的碱性磷酸酶(ST-AP)或亚甲基蓝(MB)作为电化学信号报告分子,其技术效果相同。本发明的实验设计原理如图1所示。首先,MDTs-CHA由两个DNA四面体及4 个发夹(H1/H2、H3/H4)组成。其中H1与H3含有与靶标miRNA或者触发链互补的区域,当靶标或触发链存在时即可启动CHA反应。H2与H4的3’端设计了游离的触发链(即I1和I2),因此两个DNA四面体不需要靶标miRNA即可相互触发并启动CHA反应;H2和H4发夹中还具有与捕获探针CP1(Capture probe-1)互补的区域(即P链,共 14nt),部分P链(7nt)被“锁定”在发夹的茎结构中,只有在MDTs-CHA反应后才能完全释放出来与捕获探针(CP)结合,从而将MDTs-CHA固定在电极表面上。通过“一步退火法”即可合成DNA四面体(DNA tetrahedron,DT),将相应发夹与DT在室温下进行反应孵育即可组装成MDTs-CHA。
当靶标miRNA存在时,MDTs-CHA的第一层迅速启动。miRNA通过“立足点”介导的链置换反应(Toehold-mediated strand displacement reaction,TMSDR)触发T1结构上的催化发夹组装反应,具体为:靶标miRNA打开T1结构上的H1发夹结构,H1暴露出来的“立足点”片段继续打开H2的发夹结构,在DNA四面体DT1上即可形成H1/H2双链复合体并将miRNA从H1上置换出来,miRNA继续参与下一循环的反应,从而实现靶标的循环,进而产生大量的DT-H1/H2双链复合体。此时,H2发夹上与捕获探针(Capture probe-1)CP1互补的P链完全暴露,通过链置换反应将捕获探针(Capture probe-2)CP2置换下来,并与金电极表面的捕获探针(Capture probe-1)CP1杂交;同时,T1结构上游离的触发链I1也固定于电极表面,用于触发MDTsCHA的第二层(CP2链有13个碱基,均与 CP1互补,当CHA反应被启动,暴露出H2和/或H4中的P链后,因为P链有14个碱基与 CP1互补,所以P链会竞争和CP1互补结合,从而置换出CP2)。用Tris-HCl缓冲液将游离的靶标miRNA、MDTs-CHA冲洗去除,随后将组装好的T2结构滴加在电极表面,T2结构上的CHA即被触发链I1启动,继而大量的DNA四面体DT2进一步聚积在电极表面。当 T1结构和T2结构相继滴加至电极表面上后,即可启动MDTs-CHA的N层循环。电化学信号报告分子(RuHex)通过静电吸附作用直接结合在DNA四面体的磷酸盐骨架上,捕获探针CP1、CP2捕获大量带有电活性分子RuHex的DTs,从而导致电化学信号扩增,用于exo-miRNA检测。
在Tris-HCl缓冲液中即可检测电化学信号。以下实施例中,使用差分脉冲伏安法(Differential pulse voltammetry,DPV)实现对靶标miRNA的定量分析;除此之外,还可以循环伏安法(DV)、交流阻抗(EIS)等其他电化学检测方法。
实施例1
多功能DNA四面体辅助催化发夹组装(MDTs-CHA)体系的构建
1、配制CHA反应体系
(1)将所需的核酸序列95℃,5min变性后,按照表1配制包含发夹H1、H2的CHA 反应体系1(反应体积为20μL),各组分的反应终浓度为500nM。将CHA扩增反应管放置于室温,反应30min后产物用聚丙烯酰胺凝胶电泳(PAGE)表征催化发夹组装,结果如图 2a所示。
表2 CHA反应体系1
如图2a所示,泳道1为捕获探针。泳道4为H1和H2的混合产物,分别与泳道2和泳道3中单独的发夹H1和H2对应,说明在靶标miR-1246不存在的情况下H1和H2 不发生反应;泳道5为靶标与H1及H2共同反应,产生了一条接近200bp分子量的反应条带,说明miR-1246触发了催化发夹组装反应,生成了杂交产物。
(2)将所需的核酸序列95℃,5min变性后,按照表3配制包含发夹H3、H4的CHA 反应体系2(反应体积为20μL),各组分的反应终浓度为500nM。将CHA扩增反应管放置于室温,反应30min后产物用聚丙烯酰胺凝胶电泳(PAGE)表征催化发夹组装,结果如图 2b所示。
表3 CHA反应体系2
如图2b所示,泳道1为捕获探针。泳道4为H3和H4的混合产物,分别与泳道2和泳道3中单独的发夹H3和H4对应,说明在I1不存在的情况下H3和H4不发生反应;泳道5为I1与H3及H4共同反应,产生了一条接近200bp分子量的反应条带,说明I1 触发了催化发夹组装反应,生成了杂交产物。
2、配制DNA四面体组装体系
将所需核酸序列95℃,5min变性后,按照表2配制DNA四面体组装体系(反应体积为20μL),各组分的反应终浓度为500nM。室温下反应30min后取产物进行琼脂糖凝胶电泳表征四面体组装,结果如图3所示。
表3 DNA四面体DT1组装体系
如图3a所示,泳道1~4电泳条带分子量逐渐增加,结果说明DNA四面体组装成功;泳道5为DNA四面体DT1与发夹H1、H2共同反应,可见电泳的条带分子量较DNA四面体进一步增加,并且由于形成了相对复杂的空间结构,电泳移动速率减慢,说明H1和 H2与DNA四面体DT1成功组装成T1结构。
如图3b所示,泳道1~4电泳条带分子量逐渐增加,结果说明DNA四面体组装成功;泳道5为DNA四面体DT2与发夹H3、H4共同反应,可见电泳的条带分子量较DNA四面体进一步增加,并且由于形成了相对复杂的空间结构,电泳移动速率减慢,说明H3和 H4与DNA四面体DT2成功组装成T2结构。3、构建MDTs-CHA体系
核酸序列如表4所示,将DNA四面体DT1的序列采取“一步法”组装,即组成四面体的S1、S2、S3、S4四条链通过一同变性(95℃,5min),随着温度稳定下降,组装成完整的DNA四面体DT1,组成四面体DT2的S5、S6、S7、S8四条链通过一同变性(95℃, 5min),随着温度稳定下降,组装成完整的DNA四面体DT2。H1、H2、H3、H4四个发夹序列在变性(95℃,5min)后恢复成发夹形状,将组装好的DNA四面体和相应的发夹在室温下反应30min,使发夹与DNA四面体的延长链连接,形成MDTs-CHA结构。
表4验证MDTs-CHA催化发夹组装反应可行性核酸序列
发夹结构H1、发夹结构H2的浓度调整为1μM,靶标miR-1246的浓度调整为2μM。
催化发夹反应各组分用量:
实验组:6μl DNA四面体+6μl发夹H1+6μl发夹H2+6μl靶标miR-1246+36μl TNaK 缓冲液;
空白对照组:6μl DNA四面体+6μl发夹H1+6μl发夹H2+42μl TNaK缓冲液;
对照组:6μl发夹H1+6μl发夹H2+46μl TNaK缓冲液。
反应总体积为60μl,DNA四面体DT1、发夹H1、发夹H2和靶标miR1246的终浓度分别为150nM、100nM、100nM和200nM。用荧光仪检测其荧光值,验证多功能DNA 四面体辅助催化发夹组装反应可行性,结果如图4所示。
图4展示了等温扩增反应30min时间内MDTs-CHA和CHA反应的进行情况。当没有加入靶标miR1246时,可以观察到荧光强度明显低于靶标存在的实验组,并且30min内荧光强度无明显变化(a、b);单纯的CHA反应在加入靶标miR-1246可以观察到荧光强度随着反应的进行逐渐升高,并在30min荧光强度尚未完全到达平台期(c);MDTs-CHA在加入靶标miR-1246后,荧光强度迅速增加,并在8-10min左右即可到达平台期(d),荧光强度明显高于单纯的CHA反应,说明MDTs-CHA反应效率明显高于CHA,为构建高效的外泌体miRNA检测平台提供了依据。
4、构建电化学传感器
根据电极的修饰过程,按照裸金电极、捕获探针修饰后的电极、MCH修饰后的电极、等温扩增反应后的电极进行分组。
电极的预处理方式为:
A.裸金电极;
B.捕获探针修饰:10μl 200nM巯基标记的模板滴加在金电极表面,放置在冰箱4℃;
C.MCH修饰:第二天将电极从冰箱中取出,用PBS缓冲液冲洗电极3次,滴加8μl 的MCH溶液,置于避光阴凉的地方孵育60min,然后用PBS溶液将电极表面冲洗3次;
D.等温扩增反应修饰:向EP管中先后加入5μl 200nM的组装好的DNA四面体模板、5μl 200nM的发夹H1及发夹H2底物链、4μl 100nM的目标miR-1246和21μl TNaK 缓冲液,使得最终体积为40μl,将体系混合溶液滴加到电极表面,在25℃条件下孵育15 min;
反应后检测EIS、SWV和CV,表征DNA四面体-CHA在构建电化学传感器不同步骤,结果如图5所示。
图5表明SWV表征结果与EIS表征结果相符,即随着修饰过程的进行,阻抗值逐渐增大,SWV结果逐渐减小。CV表征结果与EIS表征结果相符。EIS、SWV和CV结果共同提示电极修饰过程与检测原理一致,DNA四面体-CHA可以在电极界面成功组装。
5、电化学传感器放大性能考察
为了验证构建的MDTs-CHA电化学传感器的层叠反应信号放大效果,比较单层、双层、三层和四层的MDTs-CHA反应的电化学信号。不加入靶标miRNA的MDTs-CHA反应体系作为空白对照。
通过图6发现,100pM miR-1246分别与25nM反应浓度的MDTs-CHA层叠反应,单层的反应时间为15min,双层、三层和四层的每一层的反应时间均为15min,总反应时间分别为30min、45min和60min。不同反应层数的DPV信号值产生了明显差异。如图6 示,DPV信号随着反应层数的增加而增大,单层MDTs-CHA的DPV信号峰值约为 1.8-2.1μA,双层、三层和四层的峰值分别可达7.3-7.7μA、8.5-8.9μA和13.5-14.1μA,DPV 信号倍数约为单层的3.5、4.5和7.2倍。但同时空白对照的信号值也随着层叠次数增大。因此选择扩增因子和信噪比作为评价不同层叠次数MDTs-CHA的信号扩增效率的指标。如图7示,扩增因子与DPV信号值的趋势相同,即随着层叠次数的增多而增大(黑色)。但信噪比(蓝色)在双层MDTs-CHA中最佳,可达到15.3。而单层、三层和四层MDTs-CHA 信噪比则分别为6.9、10.7和7.1(如图7所示)。双层MDTs-CHA的催化发夹组装反应效率高于单层、三层和四层MDTs-CHA。为了获得最佳的信号扩增效果,选用了信噪比最高的双层MDTs-CHA用于验证其灵敏度、特异性。
实施例2
检测不同细胞系中的外泌体miRNA
提取MDA-MB-231、MCF-7、16HBE细胞的外泌体,再提取其miRNA,作为待测样品。向EP管中先后加入5μl 200nM组装好的DNA四面体DT1、5μl 200nM的发夹H1及发夹H2、4μl待测样品和21μl TNaK缓冲液,混合得到最终体积为40μl的反应体系混合溶液;将反应体系混合溶液滴加到预处理好的金电极表面,在25℃条件下反应15min,再加入5μl 200nM组装好的DNA四面体DT2、5μl 200nM的发夹H3及发夹H4,在25℃条件下反应15min,将电极浸泡于5uM的RuHex溶液中反应10min,后将电极在10mM 的TrisHCl溶液中进行DPV检测。与qRT-PCR检测方法对比,结果显示miRNA表达水平趋势一致(如图8所示)。
实施例3
检测血浆中的外泌体miRNA
提取1ml乳腺癌患者或健康者血浆中的外泌体,再提取其总RNA。向EP管中先后加入 5μl 200nM的组装好的DNA四面体DT1、5μl 200nM的发夹H1及发夹H2底物链、4 μl待测样品和21μl TNaK缓冲液,使得最终体积为40μl,将反应体系混合溶液滴加到电极表面,在25℃条件下反应15min,再加入5μl 200nM组装好的DNA四面体DT2、5μl 200nM 的发夹H3及发夹H4,在25℃条件下反应15min,将电极浸泡于5uM的RuHex溶液中反应10min,后将电极在10mM的TrisHCl溶液中进行DPV检测。两者的检测结果具有统计学差异(如图9所示)。
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
SEQUENCE LISTING
<110> 南方医科大学南方医院
<120> 用于检测外泌体 miRNA的MDTs-CHA体系、电化学传感器及其应用
<130> PCQNF2015082-HZ
<160> 14
<170> PatentIn version 3.5
<210> 1
<211> 73
<212> DNA
<213> Artificial
<220>
<223> S1
<400> 1
tatcaccagg cagttgacag tgtagcaagc tgtaatagat gcgagggtcc aatactttgt 60
gtagcaggag agg 73
<210> 2
<211> 81
<212> DNA
<213> Artificial
<220>
<223> S2
<400> 2
tcaactgcct ggtgataaaa cgacactacg tgggaatcta ctatggcggc tcttctttga 60
tcaagtatgc caaagacact c 81
<210> 3
<211> 73
<212> DNA
<213> Artificial
<220>
<223> S3
<400> 3
ttcagactta ggaatgtgct tcccacgtag tgtcgtttgt attggaccct cgcatttaag 60
gtttgacgtg tgg 73
<210> 4
<211> 81
<212> DNA
<213> Artificial
<220>
<223> S4
<400> 4
acattcctaa gtctgaaaca ttacagcttg ctacacgaga agagccgcca tagtatttga 60
tcaagtatgc caaagacact c 81
<210> 5
<211> 73
<212> DNA
<213> Artificial
<220>
<223> S5
<400> 5
tatcaccagg cagttgacag tgtagcaagc tgtaatagat gcgagggtcc aatactttgt 60
gtagcaggag agg 73
<210> 6
<211> 76
<212> DNA
<213> Artificial
<220>
<223> S6
<400> 6
tcaactgcct ggtgataaaa cgacactacg tgggaatcta ctatggcggc tcttcttaat 60
ggatttttgg agcagg 76
<210> 7
<211> 73
<212> DNA
<213> Artificial
<220>
<223> S7
<400> 7
ttcagactta ggaatgtgct tcccacgtag tgtcgtttgt attggaccct cgcatttaag 60
gtttgacgtg tgg 73
<210> 8
<211> 76
<212> DNA
<213> Artificial
<220>
<223> S8
<400> 8
acattcctaa gtctgaaaca ttacagcttg ctacacgaga agagccgcca tagtattaat 60
ggatttttgg agcagg 76
<210> 9
<211> 62
<212> DNA
<213> Artificial
<220>
<223> H1
<400> 9
tttttggagc agggatgtac taggcctgct ccaaaaatcc atttttccac acgtcaaacc 60
tt 62
<210> 10
<211> 66
<212> DNA
<213> Artificial
<220>
<223> H2
<400> 10
ctactcagat gtactaggtt ttggagcagg cctagtacat ccctgctttt cctctcctgc 60
tacaca 66
<210> 11
<211> 70
<212> DNA
<213> Artificial
<220>
<223> H3
<400> 11
tatgccaaag acactcgatg tactagggag tgtctttggc atacttgatc atttccacac 60
gtcaaacctt 70
<210> 12
<211> 72
<212> DNA
<213> Artificial
<220>
<223> H4
<400> 12
ctactcagat gtactaggta tgccaaagac actccctagt acatcgagtg tcttttcctc 60
tcctgctaca ca 72
<210> 13
<211> 29
<212> DNA
<213> Artificial
<220>
<223> Capture probe-1
<400> 13
gtacatctga gtagacttca acacgattt 29
<210> 14
<211> 13
<212> DNA
<213> Artificial
<220>
<223> Capture probe-2
<400> 14
tgaagtctac tca 13
- 用于检测外泌体miRNA的MDTs-CHA体系、电化学传感器及其应用
- 一种检测外泌体miRNA的电化学传感器及其制备与应用
