用于免疫检查点抑制的组合物和方法
文献发布时间:2023-06-19 11:21:00
优先权要求
本申请要求2018年9月7日提交的美国专利申请系列号62/728,459和2019年1月10日提交的62/790,953的权益,其全部内容通过引用并入本文。
联邦资助的研究或开发
本发明由美国国立卫生研究院(National Institutes of Health)授予的授权号CA163461在政府的支持下完成。美国政府享有本发明的某些权利。
技术领域
本文公开了用于治疗例如胰腺癌等癌症的治疗性组合物和方法,所述组合物和方法使用连接至例如siRNA等抑制性核酸的纳米颗粒,靶向例如程序化细胞死亡1配体1(PD-L1)等免疫检查点分子。
背景技术
最近已经见证了使用免疫治疗性治疗各种恶性肿瘤的惊人进展。最有前途的方法之一涉及免疫检查点抑制剂。
尽管有可能将检查点抑制用于癌症免疫疗法,但应答通常是可变的,许多患者未能应答。FDA批准的PD-L1抑制剂的著名实例包括用于转移性非小细胞肺癌(NSCLC)
发明内容
本文描述了治疗癌症的策略,其包括将诸如吉西他滨等化疗药物与免疫检查点分子抑制剂,例如称为MN-siPDL1的程序化死亡配体1(PD-L1)抑制剂组合。例如,MN-siPDL1混入针对与磁性纳米载体(MN)缀合的PD-L1(siPDL1)的小干扰RNA。如本文所示,由于MN载体是超顺磁性的,因此可以通过非侵入性磁共振成像(MRI)半定量地监测MN-siPDL1向肿瘤的递送。在同系鼠胰腺癌模型中,由诸如吉西他滨等化疗药物和MN-siPDL1组成的联合疗法导致肿瘤生长的显著降低并提高生存率。优化剂量后,开始治疗后3周,肿瘤体积达到90%减少。而在开始治疗后6周,100%的对照动物死于肿瘤,在第5周,实验组中无死亡,并且67%的实验动物存活了12周。这些方法可用于有益地治疗尚无有效治疗方法且表征为仅1%的5年生存率的顽固性疾病。
因此,本文提供治疗性纳米颗粒,其中所述纳米颗粒具有10nm至30nm之间的直径;并且优选包含铁氧化物核、聚合物涂层、和靶向共价连接至纳米颗粒的例如程序化细胞死亡1配体1(PD-L1)等免疫检查点分子的抑制性核酸。
在一些实施方案中,核酸包含与SEQ ID NO:1互补的至少10个连续核苷酸的序列。
在一些实施方案中,核酸包含至少一种修饰的核苷酸,例如,锁核苷酸。
在一些实施方案中,聚合物涂层包含葡聚糖。
在一些实施方案中,核酸是小干扰RNA(siRNA)分子。
在一些实施方案中,核酸通过包含二硫键或硫醚键的化学部分共价连接至纳米颗粒。
在一些实施方案中,纳米颗粒是磁性的。
还提供药物组合物,其包含本文所述的治疗性纳米颗粒,和任选的化学治疗剂。
此外,本文提供用于治疗患有癌症的受试者的方法。所述方法包括向患有癌症的受试者施用治疗有效量的如本文所述的治疗性纳米颗粒,优选地和化学治疗剂联合施用。还提供本文所述的治疗性纳米颗粒,优选和化学治疗剂联合,用于治疗受试者的癌症的用途。
在一些实施方案中,癌症选自由以下组成的组:乳腺癌、结肠癌、肾癌、肺癌、皮肤癌、卵巢癌、胰腺癌、前列腺癌、直肠癌、胃癌、甲状腺癌、和子宫癌。
在一些实施方案中,方法包括成像受试者的组织以确定受试者中癌细胞的位置或数量,或受试者中治疗性纳米颗粒的位置。
在一些实施方案中,治疗性纳米颗粒以两个或多个剂量施用于受试者。在一些实施方案中,治疗性纳米颗粒以每周至少一次施用于受试者。
在一些实施方案中,治疗性纳米颗粒通过静脉内、皮下、动脉内、肌内、或腹膜内施用而施用于受试者。
在一些实施方案中,受试者患有胰腺癌。
在一些实施方案中,化学治疗剂是吉西他滨。
还提供含有本文所述的任何磁性颗粒的药物组合物。
还提供降低患有癌症(例如,胰腺癌)的受试者中肿瘤生长的方法,所述方法包括向患有癌症的受试者施用治疗性纳米颗粒(本文所述的任何治疗性纳米颗粒),其中治疗性纳米颗粒以足以受试者中的肿瘤生长的量施用。在一些实施方案中,癌症细胞选自以下的组:乳腺癌细胞、结肠癌细胞、肾癌细胞、肺癌细胞、皮肤癌细胞、卵巢癌细胞、胰腺癌细胞、前列腺癌细胞、直肠癌细胞、胃癌细胞、甲状腺癌细胞、和子宫癌细胞。这些方法的一些实施方案还包括成像受试者的组织以确定受试者中癌细胞的位置或数量,或受试者中治疗性纳米颗粒的位置(例如,含有共价连接的荧光团的治疗性磁性纳米颗粒或治疗性纳米颗粒的位置)。
在另一方面,本公开描述治疗受试者中转移性癌症的方法。这些方法包括向患有转移性癌症的受试者施用治疗性纳米颗粒(本文所述的任何治疗性纳米颗粒),其中治疗性纳米颗粒以足以抑制受试者中的转移性进展的量施用。在一些实施方案中,转移性癌症源自原发性胰腺癌。在一些实施方案中,施用导致受试者中原发性或转移性肿瘤大小的减小(例如,显著的、可检测的、或可观察的减小)或稳定,或原发性或转移性肿瘤的生长速率的降低(例如,显著的、可检测的、或可观察的降低)。
在本文所述的任何方法中,治疗性纳米颗粒可以以多个剂量施用于受试者。在本文所述的方法的一些实施方案中,治疗性纳米颗粒以每周至少一次施用于受试者。在本文所述的方法的一些实施方案中,治疗性纳米颗粒通过静脉内、皮下、动脉内、肌内、或腹膜内施用而施用于受试者。在本文所述的方法的一些实施方案中,还将化学治疗剂施用于受试者。
术语“磁性”用于描述响应于磁场的组合物。磁性组合物(例如,本文所述的任何治疗性纳米颗粒)的非限制性实例可包含为顺磁性、超顺磁性、铁磁性、或抗磁性的材料。磁性组合物的非限制性实例包含选自以下的组的金属氧化物:磁铁矿;铁氧体(例如,锰、钴、和镍的铁氧体);Fe(II)氧化物;和赤铁矿,及其金属合金。另外的磁性材料在本文中描述并且在本领域中是已知的。
术语“抗磁性”用于描述具有小于或等于1的相对磁导率并且被磁场排斥的组合物。
术语“顺磁性”用于描述仅在存在外部施加磁场的情况下才产生磁矩的组合物。
术语“铁磁性”用于描述对磁场非常敏感并且能够在去除外部施加磁场后保持磁性(磁矩)的组合物。
术语“纳米颗粒”是指直径在约2nm至约200nm之间(例如,在10nm和200nm之间,在2nm和100nm、在2nm和40nm之间,在2nm和30nm之间,在2nm和20nm之间,在2nm和15nm之间,在100nm和200nm之间,和在150nm和200nm之间)的物体。纳米颗粒的非限制性实例包括本文所述的治疗性纳米颗粒。
术语“磁性纳米颗粒”是指磁性(如本文所定义)的纳米颗粒(例如,本文所述的任何治疗性纳米颗粒)。本文描述磁性纳米颗粒的非限制性实例。其它的磁性纳米颗粒在本领域中是已知的。
术语“聚合物涂层”是指将至少一种聚合物(例如,葡聚糖)的至少一个分子层(例如,均质或非均质)涂布至三维物体(例如含有例如金属氧化物等磁性材料的三维物体)的表面。本文描述可用于产生聚合物涂层的聚合物的非限制性实例。可用于产生聚合物涂层的聚合物的其它实例是本领域已知的。本文描述将聚合物涂层涂布至物体(例如含有磁性材料的三维物体)的方法,并且在本领域中也是已知的。
术语“核酸”是指任何单链或双链多核苷酸(例如,DNA或RNA、cDNA、半合成、或合成来源)。术语核酸包括含有至少一种修饰的核苷酸(例如,含有碱基中的修饰和/或糖中的修饰)和/或连接两个核苷酸的磷酸二酯键中的修饰的寡核苷酸。在一些实施方案中,核酸可以含有至少一种锁核苷酸(LNA)。本文描述核酸的非限制性实例。核酸的其它实例是本领域已知的。
术语“修饰的核苷酸”是指在其碱基中含有至少一种修饰和/或在其糖(核糖或脱氧核糖)中含有至少一种修饰的DNA或RNA核苷酸。修饰的核苷酸还可以在如下的原子中含有修饰,所述原子在核酸序列中两个相邻核苷酸之间形成磷酸二酯键。
术语“荧光团”是指吸收第一波长的光并发射第二波长的光的分子,其中第一波长比第二波长更短(更高的能量)。在一些实施方案中,荧光团吸收的第一波长可以在近红外范围内。本文描述荧光团的非限制性实例。荧光团的其它实例是本领域已知的。
术语“近红外光”是指波长在约600nm至约3,000nm之间的光。
术语“靶向肽”是指通过存在于靶细胞(例如,癌细胞)的质膜中或质膜上的分子(例如,蛋白质、糖、或脂质、或其组合)结合的肽。如本文所述,靶向肽可以共价连接至次级分子或组合物(例如,本文所述的任何治疗性纳米颗粒)以将次级分子或组合物靶向靶细胞(例如,癌细胞)。在一些实施方案中,共价连接至次级分子或组合物(例如,本文所述的任何治疗性纳米颗粒)的靶向肽导致靶细胞摄取次级分子或组合物(例如,通过胞吞作用或胞饮作用的细胞摄取)。本文描述靶向肽的非限制性实例。靶向肽的其它实例是本领域已知的。
术语“小干扰RNA”或“siRNA”是指能够在细胞中介导RNA干扰的双链核酸分子。RNA干扰的过程描述于Ebalshir等人(Nature 411:494-498,2001)中。siRNA的每条链的长度可以在19到23个核苷酸之间。如本文所用,siRNA分子不必限于那些仅含有天然或内源RNA核苷酸的分子,而是可以进一步涵盖化学修饰的核苷酸。本文描述siRNA的非限制性实例。siRNA的其它实例是本领域已知的。
短语“肿瘤生长”是指受试者中肿瘤块的扩展。肿瘤生长的非限制性实例包括:新肿瘤细胞的形成、现有肿瘤细胞的增殖、对现有肿瘤细胞中的凋亡的抗性。本文描述用于检测和确定肿瘤生长的示例性方法。用于检测和确定肿瘤生长的其它方法是本领域已知的。
术语“转移”是指原发性肿瘤中存在的癌细胞向受试者中继发性非相邻组织的迁移。转移的非限制性实例包括:从原发性肿瘤转移至淋巴结(例如,区域淋巴结)、骨组织、肺组织、肝组织、和/或脑组织。术语转移还包括在淋巴结中发现的转移性癌细胞向次级组织(例如,骨组织、肝组织、或脑组织)的迁移。在一些非限制性实施方案中,存在于原发性肿瘤中的癌细胞是乳腺癌细胞、结肠癌细胞、肾癌细胞、肺癌细胞、皮肤癌细胞、卵巢癌细胞、胰腺癌细胞、前列腺癌细胞、直肠癌细胞、胃癌细胞、甲状腺癌细胞、或子宫癌细胞。转移的其它方面和实例是本领域已知的或在本文描述。
术语“原发性肿瘤”是指存在于肿瘤进展开始并继续产生癌块的解剖部位的肿瘤。在一些实施方案中,医生可能无法清楚地识别受试者中原发性肿瘤的部位。
术语“转移性肿瘤”是指受试者中的肿瘤,该肿瘤源自从该受试者中原发性肿瘤转移的肿瘤细胞。在一些实施方案中,医生可能无法清楚地识别受试者中原发性肿瘤的部位。
术语“淋巴结”是指免疫系统的球形或椭圆形小器官,其中含有多种细胞,包括B淋巴细胞、T淋巴细胞、和巨噬细胞,这些细胞通过淋巴管连接至淋巴系统。哺乳动物中存在多种淋巴结,包括但不限于:腋窝淋巴结(例如,侧腺、前腺或胸腺、后腺或肩胛下腺、中央或中间腺、或内侧腺或锁骨下腺)、前哨淋巴结、下颌下淋巴结、颈前淋巴结、颈后淋巴结、锁骨上淋巴结、颏下淋巴结、股骨淋巴结、肠系膜淋巴结、纵隔淋巴结、腹股沟淋巴结、亚段淋巴结、节段性淋巴结、大叶淋巴结、叶间淋巴结、肺门淋巴结、滑车上腺、三角胸肌腺、腹股沟浅淋巴结、腹股沟深淋巴结、肱淋巴结、和腘淋巴结。
术语“成像”是指使用生物物理技术(例如,电磁能量吸收和/或发射)可视化受试者的至少一种组织。成像的非限制性实施方案包括:磁共振成像(MRI)、X射线计算机断层摄影、和光学成像。
短语“肿瘤大小的稳定化”是指肿瘤已经达到其中受试者中的肿瘤的总体积或近似体积随时间仅发生微不足道的或不可检测的变化的阶段。
短语“肿瘤生长的速率”是指受试者中肿瘤的总体积或近似体积或肿瘤中存在的细胞的总数或近似数随时间的变化。肿瘤生长的速率可以使用本文所述的示例性方法来确定。用于确定肿瘤生长的速率的其它方法是本领域已知的。
除非另有定义,否则本文中使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常所理解的相同含义。本文描述用于本发明的方法和材料;也可以使用本领域已知的其它合适的方法和材料。材料、方法和实例仅是说明性的,而不意欲进行限制。本文提及的所有出版物、专利申请、专利、序列、数据库条目和其它参考文献通过引用其整体并入本文。在有冲突的情况下,以本说明书,包括定义为准。
本发明的其它特征和优点将从以下详细描述和附图以及从权利要求中变得显而易见。
附图说明
图1A-B。示例性MN-siPDL1的结构、合成和特征。A.MN-siPDL1是通过将20-nm胺化的葡聚糖-包被的超顺磁性铁氧化物纳米颗粒与针对PD-L1的异双功能不稳定接头SPDP和siRNA依次缀合来合成的。B.MN-siPDL1特征。
图2A-C。MN-siRNA至肿瘤的图像引导的递送。A.荷瘤动物的T2图。与对比前(pre-contrast)的图像相比,MN-siPDL1在肿瘤组织中的定位导致T2弛豫时间缩短,并导致负对比度。B.在治疗的前三周期间,在实验动物和对照动物的肿瘤感兴趣区域(ROI)上进行MN-siPDL1浓度测定。在治疗的前三周期间,MN-siPDL1的积累速率是MN-siSCR的1.5倍快。C.在治疗的第3至12周期间,在实验动物和对照动物中肿瘤感兴趣区域(ROI)上进行MN-siPDL1浓度测定。用MN-siSCR处理的对照组的试剂浓度是用MN-siPDL1处理的实验组下降的5.1倍快。
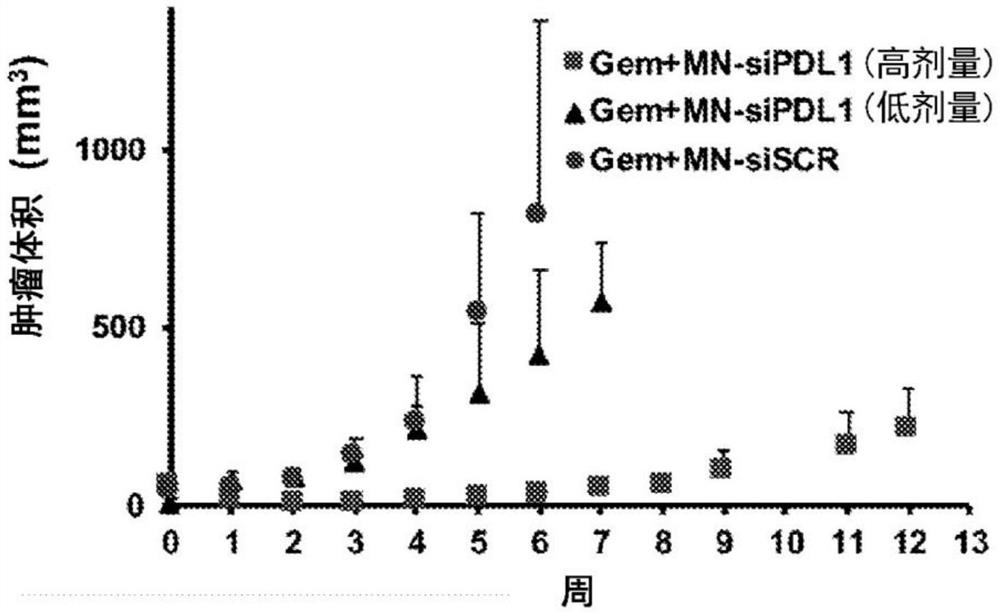
图3A-D。吉西他滨和MN-siPDL1的联合治疗。A.在治疗过程中代表性颜色编码的T2加权MR图像。B.治疗期间肿瘤体积的变化。最早从第2周开始,高剂量活性MN-siPDL1和与吉西他滨联合的非活性MN-siSCR治疗之间的应答的显著差异。在低剂量MN-siPDL1组中,这种差异在第6周后就很明显。C.Kaplan-Meier生存期分析表明,与MN-siSCR+吉西他滨相比,用MN-siPDL1+吉西他滨处理的动物的生存期改善。D.第6周的荷瘤小鼠的照片表明对照肿瘤中的坏死和溃疡。
图4A-B。来自MN-siPDL1和吉西他滨处理的小鼠的肿瘤的免疫荧光。A.代表性显微照片和B.荧光信号强度的定量分析,表面有效的PD-L1抑制、TIL募集和激活、Treg衰减、和肿瘤细胞增殖的抑制。TL:T淋巴细胞;CTL:细胞毒性T淋巴细胞;Treg:调节性T细胞;Ki-67:增殖。
图5A-D。吉西他滨和MN-siPDL1的联合治疗。每个治疗组在治疗期间的肿瘤体积的变化。A,MN-siPDL1高剂量应答物;B,MN-siPDL1高剂量无应答物;C,MN-siPDL1低剂量;D,MN-siSCR(加扰对照)。研究的样本量为6。在高剂量组中,有2只小鼠没有应答,即,它们的肿瘤体积没有消退;其结果示于图5B。
图6。用于抑制癌细胞中PD-L1 mRNA的示例性纳米药物(MN-siPDL1)的制备的其它细节的示意图。
具体实施方式
尽管它们前景广阔,但使用检查点抑制剂的临床结果已显示出应答的变化性。特别是胰腺癌,已被证明对最初的免疫疗法具有耐性。
胰腺癌是美国癌症相关死亡的第四大原因,其5年总生存率仅为8%。
在胰腺癌中,基于检查点抑制剂的疗法的进展显示令人失望的临床结果。在一项抗CTLA-4、伊匹单抗的II期试验中,单一疗法无效,试验未产生应答。
鉴于这种疾病所造成的巨大痛苦以及迄今为止通过细胞毒性治疗所取得的适度进展,很明显,我们需要从多个角度探索对这种疾病进行治疗的根本性、变革性方法。
过去的十年已见证了癌症免疫疗法领域中的巨大进步。实际上,自1940年代第一种化学疗法发展以来,免疫疗法代表了最有前途的新癌症治疗方法。检查点抑制剂已针对例如黑色素瘤和一些肺癌等致死性癌症起作用-有时取得了巨大的成功-并已在许多其它类型的癌症中进行试验。
可以有效地递送至肿瘤细胞和肿瘤驻留巨噬细胞(residentresidentmacrophage)的创新性检查点抑制剂、和增强T淋巴细胞对肿瘤渗透的策略。
本文提出了一种替代策略,其依赖于将例如吉西他滨(Gem)、5-氟尿嘧啶、FOLFIRINOX等化疗药物和例如PD-L1抑制剂(称为MN-siPDL1)等新型免疫检查点抑制剂组合,其中混入在体内高效率地递送至肿瘤细胞的纳米颗粒载体
在本研究中,在同系鼠胰腺癌模型中施用由吉西他滨和MN-siPDL1组成的联合疗法7周。该方法引起发病率和毒性的显著降低,导致肿瘤消退和生存率的明显提高。特别地,在优化剂量之后,在开始治疗后3周实现肿瘤体积的90%的减少。在开始治疗后第6周,100%的对照动物死于肿瘤,在第5周,实验组中无死亡,并且67%的实验动物存活了12周。
所描述的方法代表了用于药物递送、递送过程的图像引导、以及治疗应答的同步生物标志物的集成工具(integrated tool)。
组合物
本文提供治疗性纳米颗粒,其具有在约2nm至约200nm之间(例如,在约10nm至约30nm之间、在约5nm至约25nm之间、在约10nm至约25nm之间、在约15nm至约25nm之间、在约20nm和约25nm之间、在约25nm至约50nm之间、在约50nm和约200nm之间、在约70nm和约200nm之间、在约80nm和约200nm之间、在约100nm和约200nm之间、在约140nm至约200nm之间、和在约150nm至约200nm之间)的直径,并且含有聚合物涂层,和含有与人免疫检查点分子互补的序列内至少10个(例如,至少11、12、13、14、15、16、17、18、19、20、或21个)连续核苷酸的核酸,所述人免疫检查点分子例如PD-L1、PD-1、CTLA-4(细胞毒性T淋巴细胞相关蛋白-4;CD152);LAG-3(淋巴细胞激活基因3;CD223);TIM-3(T细胞免疫球蛋白结构域和粘蛋白结构域3;HAVCR2);TIGIT(具有Ig和ITIM结构域的T细胞免疫受体);B7-H3(CD276);VSIR(V-set免疫调节受体,又名VISTA、B7H5、C10orf54);BTLA(B和T淋巴细胞衰减因子CD272);GARP(糖蛋白A重复主导序列;PVRIG(含PVR相关免疫球蛋白结构域;或VTCN1(含T细胞活化抑制剂1的V-set结构域,又名B7-H4)。
PD-L1
PD-L1也称为CD274,B7-H;B7H1;PDL1;PDCD1L1;和PDCD1LG1。人PD-L1的示例性序列在NCBI GenBank Acc.No.中提供,如表A所示。
表A–人PD-L1的示例性序列
根据NCBI参考注释,变体1是最长的转录本,并编码最长的同种型(同种型a前体)。与变体1相比,变体2在5'编码区缺少替代的框内外显子,产生较短的蛋白质同种型b。变体4缺少几个外显子,并且其3'末端外显子延伸超过变体1中使用的剪接位点,与变体1相比,产生新的3'编码区和新的3'UTR,并编码同种型c(与同种型a相比更短并且具有独特的C末端)。
在本方法和组合物中,可以使用靶向上述任意的或全部的(例如,靶向上述所有三种都共用的区域)siRNA。人变体1mRNA的序列如下:
表B–其它人免疫检查点分子的示例性序列
尽管本方法例示人受试者,但是也可以使用本方法治疗其它哺乳动物受试者,例如兽医受试者,例如猫、狗、马、猪和绵羊。在优选的实施方案中,核酸靶向来自与待治疗的受试者相同物种的序列。
在一些实施方案中,本文提供的治疗性纳米颗粒可以是球形或椭圆形,或者可以具有无定形形状。在一些实施方案中,本文提供的治疗性纳米颗粒可以具有约2nm至约200nm之间(例如,约10nm至约200nm之间、约2nm至约30nm之间、约5nm至约25nm之间、约10nm至约25nm之间、约15nm至约25nm之间、约20nm至约25nm之间、约50nm至约200nm之间、约70nm至约200nm之间、约80nm至约200nm之间、约100nm至约200nm之间、约140nm至约200nm之间、和约150nm至约200nm之间)的直径(治疗性纳米颗粒的外表面的任何两个点之间)。在一些实施方案中,具有约2nm至约30nm之间的直径的治疗性纳米颗粒定位于受试者的淋巴结中。在一些实施方案中,具有约40nm至约200nm之间的直径的治疗性纳米颗粒定位于肝脏中。
在一些实施方案中,组合物可含有两种或多种不同的本文所述的治疗性纳米颗粒的混合物。在一些实施方案中,组合物包含至少一种含有共价连接至纳米颗粒(用于降低靶细胞中miR-10b水平的纳米颗粒)的靶序列内的至少10个连续核苷酸的治疗性纳米颗粒,和至少一种含有与存在于序列内的至少10个其它连续核苷酸的序列互补的序列的治疗性纳米颗粒。
在一些实施方案中,治疗性纳米颗粒可以是磁性的(例如,含有磁性材料的核)。
纳米颗粒
在一些实施方案中,本文所述的任何治疗性纳米颗粒可含有磁性材料的核(例如,治疗性磁性纳米颗粒)。在一些实施方案中,磁性材料或颗粒可含有响应于磁场的抗磁性、顺磁性、超顺磁性、或铁磁性材料。治疗性磁性纳米颗粒的非限制性实例包含含有选自以下的组的金属氧化物的磁性材料的核:磁铁矿;铁氧体(例如,锰、钴、和镍的铁氧体);Fe(II)氧化物,和赤铁矿,及其金属合金。磁性材料的核可通过使用本领域已知的方法将金属盐转化为金属氧化物来形成(例如,Kieslich等人,Inorg.Chem.2011)。在一些实施方案中,纳米颗粒含有环糊精金或量子点。可用于生产治疗性磁性纳米颗粒的方法的非限制性实例描述于Medarova等人,Methods Mol.Biol.555:1-13,2009;和Medarova等人,Nature Protocols1:429-431,2006中。其它磁性材料和制造磁性材料的方法是本领域已知的。在本文所述方法的一些实施方案中,治疗性磁性纳米颗粒的位置或定位可以在受试者中成像(例如,在施用一个或多个剂量的治疗性磁性纳米颗粒后在受试者中成像)。
在一些实施方案中,本文所述的治疗性纳米颗粒不含有磁性材料。在一些实施方案中,治疗性纳米颗粒可以部分地包含含有聚合物(例如,聚(乳酸-乙醇酸共聚物))的核。本领域技术人员将理解,可以使用任何数量的本领域已知材料来制备纳米颗粒,包括但不限于树胶(例如,阿拉伯胶,瓜尔胶)、壳聚糖、明胶、藻酸钠、和白蛋白。可用于产生本文所述的治疗性纳米颗粒的其它聚合物是本领域已知的。例如,可用于产生治疗性纳米颗粒的聚合物包括但不限于,纤维素制品、聚(甲基丙烯酸-2-羟乙酯)、聚(N-乙烯基吡咯烷酮)、聚(甲基丙烯酸甲酯)、聚(乙烯醇)、聚(丙烯酸)、聚丙烯酰胺、聚(乙烯-乙酸乙烯酯共聚物)、聚(乙二醇)、聚(甲基丙烯酸)、聚丙交酯(PLA)、聚乙交酯(PGA)、聚(丙交酯乙交酯共聚物)(PLGA)、聚酸酐、聚原酸酯、聚氰基丙烯酸酯和聚己酸内酯。
本领域技术人员将理解,用于纳米颗粒的组成的材料、制备方法、涂层、以及用于控制纳米颗粒的大小的方法可以有很大的不同。然而,这些方法是本领域技术人员众所周知的。关键问题包括纳米颗粒的可生物降解性、毒性概况、以及药代动力学/药效学。纳米颗粒的组成和/或大小是其生物命运的关键决定因素。例如,较大的纳米颗粒通常被肝脏摄取并降解,而较小的纳米颗粒(直径<30nm)通常循环很长时间(有时在人中超过24小时血液半衰期)并积聚在淋巴结和例如肿瘤等具有高通透性脉管系统的器官的间质中。聚合物涂层
本文所述的治疗性纳米颗粒含有在核磁性材料上(例如,在磁性材料的表面上)的聚合物涂层。聚合物材料可以适合于连接或偶联一种或多种生物试剂(例如,本文所述的任何核酸、荧光团、或靶向肽)。一种或多种生物制剂(例如,核酸、荧光团、或靶向肽)可以通过化学偶联(共价键)固定至聚合物涂层。
在一些实施方案中,治疗性纳米颗粒通过包括用在水中相对稳定的聚合物涂布磁性材料的核的方法形成。在一些实施方案中,治疗性纳米颗粒通过以下方法形成,所述方法包括用聚合物涂布磁性材料或将磁性材料吸收至其上具有还原基团的热塑性聚合物树脂中。也可以使用以下中描述的方法将涂层涂布于磁性材料:美国专利号5,834,121、5,395,688、5,356,713、5,318,797、5,283,079、5,232,789、5,091,206、4,965,007、4,774,265、4,770,183、4,654,267、4,554,088、4,490,436、4,336,173、和4,421,660;和WO 10/111066(其各公开内容通过引用并入本文)。
铁氧化物纳米颗粒的合成方法包括例如物理和化学方法。例如,可以通过在水溶液中共沉淀Fe2+和Fe3+盐来制备铁氧化物。生成的核由磁铁矿(Fe
例如,美国专利号4,421,660指出,无机材料的聚合物涂布的颗粒通常通过以下制备:(1)用酸、酸和碱的组合、醇或聚合物溶液处理无机固体;(2)将可加成聚合的单体分散在经处理的无机固体的水分散液中和(3)使所得分散液经受乳液聚合条件。(第1栏,第21-27行)。美国专利号4,421,660也公开用聚合物涂布无机纳米颗粒的方法,其包括以下步骤:(1)在无机固体的离散颗粒的水性胶体分散液中乳化疏水性的、乳液可聚合单体和(2)使所得乳液经受乳液聚合条件以形成分散在疏水性单体的水不溶性聚合物的基质中的无机固体颗粒的稳定的流体胶体水分散液(第1栏,第42-50行)。
可选地,可以商业上获得满足尺寸的起始要求的聚合物涂布的磁性材料。例如,可商购的超小型超顺磁性超铁氧化物纳米颗粒包括NC100150注射剂(Nycomed Amersham,Amersham Health)和纳米铁氧化物(Ferumoxytol)(AMAG Pharmaceuticals,Inc.)。
可用于涂布磁性材料的核的合适的聚合物包括但不限于:聚苯乙烯、聚丙烯酰胺、聚醚氨酯、聚砜、例如聚氯乙烯等氟化或氯化聚合物、聚乙烯、和聚丙烯、聚碳酸酯、和聚酯。可用于涂布磁性材料的核的聚合物的其它实例包括聚烯烃,例如聚丁二烯、聚二氯丁二烯、聚异戊二烯、聚氯丁二烯、聚偏二乙烯卤化物(polyvinylidene halide)、聚偏二乙烯碳酸酯(polyvinylidenecarbonate)、和多氟乙烯。也可以使用多种共聚物,包括苯乙烯/丁二烯、α-甲基苯乙烯/二甲基硅氧烷、或其它聚硅氧烷来涂布磁性材料的核(例如,聚二甲基硅氧烷、聚苯甲基硅氧烷、和聚三氟丙基甲基硅氧烷)。可用于涂布磁性材料的核的其它聚合物包括聚丙烯腈或含丙烯腈的聚合物,例如聚α-丙烯腈共聚物、醇酸或萜类树脂、以及聚亚烷基多磺酸酯。在一些实施方案中,聚合物涂层是葡聚糖。
核酸
提供的治疗性纳米颗粒含有至少一种包含与共价连接至纳米颗粒的免疫检查点分子,例如PD-L1序列,例如SEQ ID NO:1的序列内的至少10个(例如,至少11、12、13、14、15、16、17、18、19、20、21、或22个)连续核苷酸互补的序列的核酸。在一些实施方案中,共价连接的核酸分子含有与编码免疫检查点蛋白(例如,本文所述的任何免疫检查点蛋白)的全部或部分mRNA互补的序列。例如,共价连接的核酸可与编码免疫检查点蛋白(例如,本文所述的任何免疫检查点蛋白)的核苷酸序列的编码链的全部或部分非编码区互补。非编码区(“5'和3'非翻译区”)是位于基因编码区侧翼且不翻译成氨基酸的5'和3'序列。在一些实施方案中,共价连接至治疗性纳米颗粒的核酸与翻译起始密码子或编码免疫检查点蛋白(例如,本文所述的任何免疫检查点蛋白)的氨基酸1至5的序列互补。
连接的核酸可以是单链或双链。在一些实施方案中,核酸具有23个核苷酸至50个核苷酸之间(例如,23-30个核苷酸之间、30-40个核苷酸之间、以及40-50个核苷酸之间)的总长度。在一些实施方案中,核酸可以是反义RNA或siRNA。
反义核酸分子可以共价连接至本文所述的治疗性纳米颗粒。
基于本文提供的序列(例如,例如PD-L1等人免疫检查点分子的序列,例如SEQ IDNO:1以及表A和B中的其它序列),本领域技术人员可以容易地选择并合成许多合适的反义分子(例如,靶向例如PD-L1等免疫检查点分子的反义分子)中的任意者。例如,靶向PD-L1的反义核酸可包含有与SEQ ID NO:1中存在的至少10个(例如,至少15或20个)连续核苷酸互补的序列或本领域已知的PD-L1的序列。
可以使用本领域已知的方法,使用化学合成和酶促连接反应来构建反义核酸。例如,反义核酸(例如,反义寡核苷酸)可以使用天然存在的核苷酸或修饰的核苷酸(例如,本文所述的任何修饰的寡核苷酸)化学合成,所述天然存在的核苷酸或修饰的核苷酸被设计成增加分子的生物稳定性或增加在反义和有义核酸之间形成的双链体的物理稳定性,例如可使用硫代磷酸酯衍生物和吖啶取代的核苷酸。可选地,可以使用其中已经以反义方向(即,转录自插入的核酸的RNA对目标靶核酸具有反义方向)亚克隆核酸的表达载体生物学地产生反义核酸。在一些实施方案中,本文所述的反义核酸分子可通过常规核苷酸互补性与靶核酸杂交并形成稳定的双链体。
反义核酸分子可以是α-异头核酸分子。α-异头核酸分子与互补RNA形成特定的双链杂交体,所述互补RNA与通常的β-单元相反,链彼此平行(Gaultier等人,Nucleic AcidsRes.15:6625-6641,1987)。反义核酸分子还可以包含2'-O-甲基核糖核苷酸(Inoue等人,Nucleic Acids Res.,15:6131-6148,1987)或嵌合RNA-DNA类似物(Inoue等人,FEBSLett.215:327-330,1987)。
在一些实施方案中,核酸是小干扰RNA(siRNA)。RNAi是其中RNA在宿主细胞中降解的过程。为了降低RNA的表达,将含有对应于靶RNA(例如,免疫检查点分子,例如人PD-L1)的一部分的序列的双链RNA(dsRNA)引入细胞中。dsRNA被消化成21-23个核苷酸长的双链体,称为短干扰RNA(或siRNA),其与核酸酶复合物结合形成所谓的RNA诱导的沉默复合物(或RISC)。RISC通过siRNA链之一与内源RNA之间的碱基配对相互作用靶向内源靶RNA。然后,它从siRNA的3'末端切割内源RNA约12个核苷酸(参见Sharp等人,Genes Dev.15:485-490,2001,和Hammond等人,Nature Rev.Gen.2:110-119,2001)。
可以使用标准分子生物技术来产生siRNA。短干扰RNA可以是化学合成的、重组产生的,例如通过从例如质粒等模板DNA表达RNA,或从例如Dharmacon等商业供应商获得。用于介导RNAi的RNA可以包括修饰的核苷酸(例如,本文所述的任何修饰的核苷酸),例如硫代磷酸酯核苷酸。用于降低成熟人miR-10b水平的siRNA分子可以多种方式变化。例如,它们可以包括3'羟基和21、22或23个连续核苷酸的链。它们可以是平末端的,也可以在3'端、5'端、或两端包括突出端。例如,RNA分子的至少一条链可具有长度约1至约6个核苷酸(例如1-5、1-3、2-4或3-5个核苷酸(嘧啶或嘌呤核苷酸))的3'突出。如果两条链都包含突出,则每条链的突出的长度可以相同或不同。为了进一步增强RNA双链体的稳定性,可以稳定3'突出以防止降解(例如,通过包括嘌呤核苷酸,例如腺苷或鸟苷核苷酸,或用修饰的核苷酸取代嘧啶核苷酸(例如,2'-脱氧胸苷取代尿苷二核苷酸的3'突出端是被接受的,并且不影响RNAi的效率)。可以使用任何siRNA,只要其具有与目标靶标足够的同源性即可。可以使用的siRNA的长度没有上限(例如,siRNA的范围可以是约21-50、50-100、100-250、250-500、或500-1000个碱基对)。
在一些实施方案中,核酸分子可含有至少一个修饰的核苷酸(含有修饰的碱基或糖的核苷酸)。在一些实施方案中,核酸分子可以在磷酸酯(磷酸二酯)主链中含有至少一种修饰。这些修饰的引入可以增加稳定性,或改善核酸分子的杂交或溶解性。
本文所述的分子可包含一种或多种(例如,两种、三种、四种或五种)修饰的核苷酸。修饰的核苷酸可含有修饰的碱基或修饰的糖。修饰的碱基的非限制性实例包括:8-氧代-N
修饰碱基的其它非限制性实例包括以下中所述的那些核碱基:美国专利号5,432,272和3,687,808(通过引用并入本文),Freier等人,Nucleic Acid Res.25:4429-4443,1997;Sanghvi,Antisense Research and Application,第15章,S.T.Crooke和B.Lebleu编辑,CRC Press,1993;Englisch,等人,AngewandteChemie 30:613-722,1991,Kroschwitz,Concise Encyclopedia of PolymerScience and Engineering,John Wiley&Sons,858-859页,1990;和Cook,Anti-Cancer Drug Design 6:585-607,1991。修饰的碱基的其它非限制性实例包括通用碱基(例如3-硝基吡咯和5-硝基吲哚)。其它修饰的碱基包括芘和吡啶噁唑衍生物、芘基和芘基甲基甘油衍生物等。其它优选的通用碱基包括吡咯、二唑、或三唑衍生物,包括本领域已知的那些通用碱基。
在一些实施方案中,修饰的核苷酸可以在其糖部分中含有修饰。含有修饰的糖的修饰的核苷酸的非限制性实例是锁核苷酸(LNA)。LNA单体描述于WO 99/14226和美国专利申请公开号20110076675、20100286044、20100279895、20100267018、20100261175、20100035968、20090286753、20090023594、20080096191、20030092905、20020128381、和20020115080(通过引用并入本文)。LNA的其它非限制性实例公开于:美国专利号6,043,060、美国专利号6,268,490、WO 01/07455、WO 01/00641、WO 98/39352、WO 00/56746、WO00/56748、和WO 00/66604(通过引用并入本文)以及Morita等人,Bioorg.Med.Chem.Lett.12(1):73-76,2002;Hakansson等人,Bioorg.Med.Chem.Lett.11(7):935-938,2001;Koshkin等人,J.Org.Chem.66(25):8504-8512,2001;Kvaerno等人,J.Org.Chem.66(16):5498-5503,2001;Hakansson等人,J.Org.Chem.65(17):5161-5166,2000;Kvaerno等人,J.Org.Chem.65(17):5167-5176,2000;Pfundheller等人,NucleosidesNucleotides18(9):2017-2030,1999;和Kumar等人,Bioorg.Med.Chem.Lett.8(16):2219-2222,1998。在一些实施方案中,修饰的核苷酸是氧-LNA单体,例如WO 03/020739中描述的那些。
修饰的核苷酸还可以包括antanomirs(2'-O-甲基修饰的、胆固醇缀合的单链RNA类似物);ALN(-L-LNA);ADA(2'-N-金刚烷基甲基羰基-2'-氨基-LNA);PYR(2'-N-芘基-1-甲基-2'-氨基-LNA);OX(氧杂环丁烷-LNA);ENA(2’-O,4”-C-乙烯桥连核酸);AENA(2’-脱氧-2’-N,4’-C-乙烯-LNA);CLNA(2’,4’-碳环-LNA);和CENA(2’,4’-碳环-ENA);HM修饰的DNA(4'-C-羟甲基-DNA);2’-取代的RNA(具有2’-O-甲基、2’-氟、2’-氨乙氧基甲基、2’-氨基丙氧基甲基、2’-氨乙基、2’-胍基乙基、2’-氰乙基、2’-氨丙基);以及具有核糖糖环的自由基修饰的RNA,例如解锁核酸(UNA)、阿卓糖醇核酸(ANA)和己糖醇核酸(HNA)(参见,Bramsen等人,Nucleic Acids Res.37:2867-81,2009)。
本文所述的分子还可在磷酸二酯主链中含有修饰。例如,分子中任何两个连续(邻接)核苷酸之间的至少一个连接可以通过含有2至4个选自以下组的基团/原子的部分连接:—CH
在一些实施方案中,可以修饰核酸的脱氧核糖磷酸主链以产生肽核酸(参见Hyrup等人,Bioorganic&Medicinal Chem.4(1):5-23,1996)。肽核酸(PNA)是核酸模拟物,例如DNA模拟物,其中脱氧核糖磷酸主链被伪肽主链代替,并且仅保留四个天然核碱基。允许PNA的中性骨架在低离子强度的条件下与DNA和RNA特异性杂交。PNA低聚物的合成可以使用标准的固相肽合成方案进行,例如,如Hyrup等人,1996,同上;Perry-O'Keefe等人,Proc.Natl.Acad.Sci.U.S.A.93:14670-675,1996中所述。
通过将亲脂性或其它辅助基团连接至PNA、通过PNA-DNA嵌合体的形成、或通过使用脂质体或本领域已知的其它递送技术,可以修饰PNA,例如以增强其稳定性或细胞摄取。例如,可以产生可以结合PNA和DNA的有利性质的PNA-DNA嵌合体。这种嵌合体允许例如RNA酶H等DNA识别酶与DNA部分相互作用,而PNA部分将提供高结合亲和性和特异性。PNA-DNA嵌合体可以使用适当长度的接头连接,所述接头的长度根据碱基堆积、核碱基之间的键数、和方向选择(Hyrup,1996,同上)。PNA-DNA嵌合体的合成可以如Hyrup,1996,同上,和Finn等人,Nucleic Acids Res.24:3357-63,1996中所述进行。例如,可以使用标准亚磷酰胺偶联化学和修饰的核苷类似物在固体支撑物上合成DNA链。诸如5'-(4-甲氧基三苯甲基)氨基-5'-脱氧胸苷亚磷酰胺等化合物可用作PNA与DNA的5'末端之间的连接(Mag等人,NucleicAcids Res.,17:5973-88,1989)。然后将PNA单体以逐步的方式偶联以产生具有5'PNA区段和3'DNA区段的嵌合分子(Finn等人,Nucleic Acids Res.24:3357-63,1996)。可选地,嵌合分子可以用5'DNA区段和3'PNA区段合成((Peterser等人,Bioorganic Med.Chem.Lett.5:1119-11124,1975)。
在一些实施方案中,本文所述的任何核酸可通过本领域已知的任何类型的修饰在3'或5'末端修饰(取决于核酸如何共价连接至治疗性纳米颗粒)。例如,任一末端可以用保护基团封端,连接至挠性连接基团、或连接至反应性基团以帮助连接至基底表面(聚合物涂层)。3'或5'封端基团的非限制性实例包括:2-氨基-2-氧乙基、2-氨基苯甲酰基、4-氨基苯甲酰基、乙酰基、乙酰氧基、(乙酰氨基)甲基、3-(9-吖啶基)、三环[3.3.1.1(3,7)]癸-1-基氧基、2-氨基乙基、丙烯基、(9-蒽基甲氧基)羰基、(1,1-二甲基甲基丙氧基)羰基((1,1-dmimethylpropoxy)carbonyl)、(1,1-二甲基丙氧基)羰基、[1-甲基-1-[4-(苯基偶氮)苯基]乙氧基]羰基、溴乙酰基、(苯甲酰基氨基)甲基、(2-溴乙氧基)羰基、(二苯基甲氧基)羰基、1-甲基-3-氧代-3-苯基-1-丙烯基、(3-溴-2-硝基苯基)硫基、(1,1-二甲基乙氧基)羰基、[[((1,1-二甲基乙氧基)羰基]氨基]乙基、2-(苯基甲氧基)苯氧基、(1=[1,1'-联苯基]-4-基-1-甲基乙氧基)羰基、溴、(4-溴苯基)磺酰基、1H-苯并三唑-1-基、[(苯基甲基)硫代]羰基、[(苯基甲基)硫代]甲基、2-甲基丙基、1,1-二甲基乙基、苯甲酰基、二苯甲基、苯甲基、羧乙酰基、氨基羰基、氯二氟乙酰基、三氟甲基、环己基羰基、环庚基、环己基、环己基乙酰基、氯、羧甲基、环戊基羰基、环戊基、环丙基甲基、乙氧羰基、乙基、氟、甲酰基、1-氧己基、碘、甲基、2-甲氧基-2-氧乙基、硝基、叠氮基、苯基、2-羧基苯甲酰基、4-吡啶基甲基、2-哌啶基、丙基、1-甲基乙基、磺基和乙烯基。5’和3’封端基团的其它实例是本领域已知的。在一些实施方案中,5’或3’封端基团防止分子的核酸酶降解。
可以使用本领域已知的用于合成核酸的任何方法来合成本文所述的核酸(参见,例如Usman等人,J.Am.Chem.Soc.109:7845,1987;Scaringe等人,Nucleic Acid Res.18:5433,1990;Wincott等人,Methods Mol.Biol.74:59,1997;和Milligan,Nucleic AcidRes.21:8783,1987)。这些通常利用常见的核酸保护和偶联基团。可以使用由制造商提供的方案在例如394Applied Biosystems,Inc.合成仪等为此目的设计的商用设备上进行合成。合成本文所述分子的其它方法是本领域已知的。可选地,可以从合成寡核苷酸的商业供应商特别订购核酸。
在一些实施方案中,核酸在其5'末端连接至治疗性纳米颗粒。在一些实施方案中,核酸在其3'末端连接至治疗性纳米颗粒。在一些实施方案中,核酸通过核酸中存在的碱基连接至治疗性纳米颗粒。
在一些实施方案中,核酸(例如本文所述的任何核酸)通过含有硫醚键或二硫键的化学部分连接至治疗性纳米颗粒(例如,至治疗性纳米颗粒的聚合物涂层)。在一些实施方案中,核酸通过含有酰胺键的化学部分连接至治疗性纳米颗粒。可用于将核酸共价连接至治疗性纳米颗粒的其它化学部分是本领域已知的。
可以使用多种不同的方法将核酸共价连接至治疗性纳米颗粒。可用于将核酸连接至磁性颗粒的方法的非限制性实例描述于EP 0937097;USRE41005;Lund等人,NucleicAcid Res.16:10861,1998;Todt等人,MethodsMol.Biol.529:81-100,2009;Brody等人,J.Biotechnol.74:5-13,2000;Ghosh等人,Nucleic Acids Res.15:5353-5372,1987;美国专利号5,900,481;美国专利号7,569,341;美国专利号6,995,248;美国专利号6,818,394;美国专利号6,811,980;美国专利号5,900,481;和美国专利号4,818,681(其各自通过引用其整体并入本文)。在一些实施方案中,碳二亚胺用于核酸与治疗性纳米颗粒的末端连接。在一些实施方案中,核酸通过其碱基之一与存在于治疗性纳米颗粒表面上的活化部分的反应(例如,亲电性碱基与治疗性纳米颗粒表面上的亲核部分的反应,或亲核性碱基与治疗性纳米颗粒表面上的亲电性残基的反应)连接至治疗性纳米颗粒。在一些实施方案中,将5’-NH
在示例性方法中,可以产生包含反应性胺或反应性硫醇基的核酸。核酸中的胺或硫醇可与另一个反应性基团连接。进行此反应的两种常见策略是将核酸连接至类似的反应性部分(胺至胺或硫醇至硫醇),这称为同双功能连接,或将核酸与相对的基团连接(胺至硫醇或硫醇至胺),称为异双功能连接。两种技术都可以用于将核酸连接至治疗性纳米颗粒(参见,例如,Misra等人,Bioorg.Med.Chem.Lett.18:5217-5221,2008;Mirsa等人,Anal.Biochem.369:248-255,2007;Mirsa等人,Bioorg.Med.Chem.Lett.17:3749-3753,2007;和Choithani等人,Methods Mol Biol.381:133-163,2007)。
传统的连接技术,尤其是对于胺基团(amine group)的连接技术,都依赖于同双功能连接。最常见的技术之一是使用例如戊二醛等双醛。由Syngene(Frederick,MD)作为合成核酸探针(SNAP)技术商业化的辛二酸二琥珀酰亚胺酯(DSS),或对苯二异硫氰酸酯试剂也可用于在核酸和治疗性纳米颗粒之间产生共价连接。N,N'-亚苯基双马来酰亚胺可用于使硫醇基交联。在所有同双功能交联剂的情况下,核酸首先被活化,然后添加到治疗性纳米颗粒中(参见,例如,Swami等人,Int.J.Pharm.374:125-138,2009,Todt等人,MethodsMol.Biol.529:81-100,2009;和
异双功能接头也可用于将核酸连接至治疗性纳米颗粒。例如,N-琥珀酰亚胺基-3-(2-吡啶基二硫代)丙酸酯(SPDP)首先连接到伯胺上,得到二硫醇修饰的化合物。然后其可以与硫醇反应以将吡啶硫醇与引入的硫醇交换(参见,例如,Nostrum等人,J.ControlRelease 15;153(1):93-102,2011,和Berthold等人,Bioconjug.Chem.21:1933-1938,2010)。
用于硫醇的替代方法是硫醇交换反应。如果将硫醇化的核酸引入二硫化物治疗性纳米颗粒上,则可以发生二硫化物交换反应,从而导致核酸通过二硫键共价键合至治疗性纳米颗粒。多种潜在的交联化学反应可用于胺和硫醇的异双功能交联。通常,这些步骤已与硫醇化核苷酸一起使用。通常使用的试剂是NHS(N-羟基琥珀酰亚胺酯)、MBS(间马来酰亚胺基苯甲酰基-N-琥珀酰亚胺酯)、和SPDP(基于吡啶基二硫化物的体系)。通常使用的异双功能接头依赖于胺化的核酸。将核酸共价连接至治疗性纳米颗粒的其它方法是本领域已知的。
靶向肽
在一些实施方案中,治疗性纳米颗粒还含有共价连接的靶向肽,例如,如WO2013/016126中所述。术语“靶向肽”是指通过存在于靶细胞(例如癌细胞)的质膜中或质膜上的分子(例如蛋白质、糖、或脂质、或其组合)结合的肽。如本文所述,靶向肽可以共价连接至二级分子或组合物(例如本文所述的任何治疗性纳米颗粒),以将二级分子或组合物靶向靶细胞(例如癌细胞)。在一些实施方案中,共价连接至二级分子或组合物(例如,本文所述的任何治疗性纳米颗粒)的靶向肽导致二级分子或组合物被靶细胞摄取(例如,通过胞吞或胞饮作用的细胞摄取)。靶向肽的非限制性实例如本文所述。在一些实施方案中,靶向肽含有RGD肽、EPPT肽、NYLHNHPYGTVG(SEQ ID NO:2)、SNPFSKPYGLTV(SEQ ID NO:3)、GLHESTFTQRRL(SEQ ID NO:4)、YPHYSLPGSSTL(SEQ ID NO:5)、SSLEPWHRTTSR(SEQ ID NO:6)、LPLALPRHNASV(SEQ ID NO:7)、或βAla-(Arg)7-Cys(SEQ ID NO:8)。在一些实施方案中,靶向肽通过含有二硫键的化学部分共价连接至纳米颗粒。在一些实施方案中,治疗性纳米颗粒是磁性的。靶向肽的其它实例、以及将它们连接至纳米颗粒的方法是本领域已知的;参见,例如,WO2013/016126。药物组合物
本文还提供含有如本文所述的治疗性纳米颗粒的药物组合物。本文所述的任何类型的治疗性纳米颗粒中的两种或更多种(例如,两种、三种、或四种)可以以任何组合存在于药物组合物中。可以以本领域已知的任何方式配制药物组合物。
将药物组合物配制成与其预期的施用途径(例如静脉内、动脉内、肌内、皮内、皮下、或腹膜内)相容。该组合物可以包括无菌稀释剂(例如,无菌水或盐水)、固定油、聚乙二醇、甘油、丙二醇或其它合成溶剂,例如苯甲醇或对羟基苯甲酸甲酯、氯丁醇、苯酚、抗坏血酸和硫柳汞等抗菌剂或抗真菌剂,例如抗坏血酸或亚硫酸氢钠等抗氧化剂,例如乙二胺四乙酸等螯合剂,例如乙酸盐、柠檬酸盐、或磷酸盐等缓冲剂,和例如糖(例如葡萄糖)、多元醇(例如甘露糖醇或山梨糖醇)、或盐(例如氯化钠)等等渗剂,或其任何组合。脂质体悬浮液也可以用作药学上可接受的载体(参见,例如,美国专利号4,522,811)。可以配制组合物的制剂并将其封装在安瓿、一次性注射器、或多剂量小瓶中。在需要时(例如,在注射制剂中),可以通过例如使用诸如卵磷脂或表面活性剂等涂层来保持适当的流动性。通过包含延迟吸收的试剂(例如,单硬脂酸铝和明胶)可延长治疗性纳米颗粒的吸收。可选地,可以通过植入物和微囊化的递送系统来实现控释,其可以包括可生物降解的生物相容性聚合物(例如,乙烯乙酸乙烯酯、聚酸酐、聚乙醇酸、胶原蛋白、聚原酸酯、和聚乳酸;Alza Corporation和NovaPharmaceutical,Inc.)。
含有本文所述的任何治疗性纳米颗粒中的一种或多种的组合物可以配制为以剂量单位形式(即,包含预定量活性化合物的物理分散单元,易于施用和剂量均匀)进行肠胃外(例如静脉内、动脉内、肌内、皮内、皮下、或腹膜内)施用。
组合物的毒性和疗效可以通过细胞培养或实验动物(例如猴子)中的标准药学方法来确定。例如,可以确定LD50(对50%的群体致死的剂量)和ED50(对50%的群体有效的治疗剂量):治疗指数是LD50:ED50的比。表现出高治疗指数的试剂是优选的。如果试剂表现出不良的副作用,则应注意将潜在的损害降到最低(即,减少不期望的副作用)。毒性和疗效可通过其它标准药物程序确定。
从细胞培养检测和动物研究获得的数据可用于配制适当剂量的任何给定试剂以用于受试者(例如人)。一种或多种(例如,一种、两种、三种、或四种)治疗性纳米颗粒(例如,本文所述的任何治疗性纳米颗粒)的治疗有效量将是以下的量:在受试者(例如,人)中治疗减少患有癌症(例如乳腺癌)的受试者的癌细胞侵袭或转移、治疗受试者淋巴结中的转移性癌症、减小或稳定受试者淋巴结中的转移性肿瘤的大小、降低受试者淋巴结中转移性肿瘤生长的速率、在受试者(例如,人)中降低受试者淋巴结中的转移性癌症的一种或多种症状的严重性、频率、和/或持续时间、或减少受试者淋巴结中转移性癌症的症状数量(例如,与患有相同疾病但未接受治疗或接受不同治疗的对照受试者相比,或与治疗之前相同的受试者相比)。
可以由卫生保健专业人员使用本领域已知的方法,以及通过观察受试者(例如,人)淋巴结中转移性癌症的一种或多种症状,来确定本文所述的任何治疗性纳米颗粒的有效性和剂量。某些因素可能影响有效治疗受试者所需的剂量和时间(例如,疾病或病症的严重程度、先前的治疗、受试者的总体健康和/或年龄、以及其它疾病的存在)。
示例性剂量包括每千克受试者体重的毫克或微克量的本文所述的任何治疗性纳米颗粒。尽管这些剂量涵盖广泛的范围,但是本领域普通技术人员将理解,包括本文所述的治疗性纳米颗粒的治疗剂的功效不同,并且可以通过本领域已知的方法确定有效量。通常,首先要施用相对低的剂量,随后的医疗保健专业人员(在治疗应用的情况中)或研究人员(在仍处于开发阶段时)可以随后逐渐增加剂量直到获得适当的反应为止。另外,应当理解,任何特定受试者的具体剂量水平将取决于多种因素,包括所用特定化合物的活性,受试者的年龄、体重、总体健康状况、性别和饮食,施用时间,施用途径,排泄速率,和治疗性纳米颗粒在体内的半衰期。
药物组合物可以与施用说明书一起包含在容器、包装或分配器中。
治疗方法
发现本文所述的治疗性纳米颗粒减少癌症的生长。鉴于该发现,本文提供了治疗受试者的癌症的方法。这些方法的具体实施方案和各个方面在下文中描述。
癌症的治疗方法
方法通常包括识别患有肿瘤例如癌症的受试者。如本文所用,术语“癌症”是指具有自主生长能力的细胞,即表征为迅速增殖的细胞生长的异常状态或状况。过度增殖和赘生性疾病状态可以分类为病理性的,即表征或构成疾病状态,或者可以分类为非病理性的,即偏离正常状态但不与疾病状态相关。通常,癌症将与一种或多种肿瘤即异常细胞团的存在有关。术语“肿瘤”旨在包括所有类型的癌性生长或致癌过程、转移组织或恶性转化的细胞、组织、或器官,而与组织病理学类型或侵袭性阶段无关。“病理性过度增殖”细胞出现在表征为恶性肿瘤生长的疾病状态中。尽管本研究由于胰腺癌的不良预后以及缺乏针对其转移形式的进展而集中于胰腺癌,但是本发明的组合物和方法广泛地适用于实体恶性肿瘤。因此,癌症可以是任何类型的实体瘤,包括但不限于:乳腺癌、结肠癌、肾癌、肺癌、皮肤癌、卵巢癌、胰腺癌、直肠癌、胃癌、甲状腺癌或子宫癌。
肿瘤包括各种器官系统的恶性肿瘤,例如影响肺、乳腺、甲状腺、淋巴、胃肠道和生殖泌尿道,以及包括恶性肿瘤的腺癌,例如大多数结肠癌、肾细胞癌、前列腺癌和/或睾丸肿瘤、肺非小细胞癌、小肠癌和食道癌。术语“癌”是本领域公认的,并且是指上皮或内分泌组织的恶性肿瘤,包括呼吸系统癌、胃肠道系统癌、泌尿生殖系统癌、睾丸癌、乳腺癌、前列腺癌、内分泌系统癌、和黑色素瘤。在一些实施方案中,所述疾病是肾癌或黑色素瘤。示例性癌包括由子宫颈、肺、前列腺、乳腺、头颈、结肠和卵巢的组织形成的那些癌。该术语还包括癌肉瘤,例如,其包括由癌组织和肉瘤组织组成的恶性肿瘤。“腺癌”是指源自腺组织或其中肿瘤细胞形成可识别的腺结构的癌。术语“肉瘤”是本领域公认的,并且是指间充质来源的恶性肿瘤。
在一些实施方案中,通过本文描述的方法评价或治疗的癌症包括上皮癌,例如肺癌(例如,非小细胞肺癌(NSCLC))、乳腺癌、结肠直肠癌、肾癌、头颈癌、前列腺癌、胰腺癌(例如,胰腺导管腺癌(PDAC))或卵巢癌。上皮恶性肿瘤是影响上皮组织的癌症。
医护专业人员(例如,医师、医师助手、护士、或实验室技术人员)可以使用本领域已知的方法在受试者中诊断癌症。例如,如本领域已知,可以部分地通过观察或检测受试者中癌症的至少一种症状来诊断受试者中的转移性癌症。还可以使用多种成像技术(例如,单独或结合观察受试者中一种或多种癌症症状)在受试者中诊断癌症。例如,可以使用计算机断层摄影、磁共振成像、正电子发射断层摄影、和X射线在受试者中检测癌症的存在。癌症也可以通过对来自受试者的组织进行活组织检查来诊断。还可以从例如CA19.9、CEA、PSA等血清生物标志物诊断癌症。
在一些实施方案中,所述方法可以包括确定癌症是否表达或过表达例如PD-L1等免疫检查点分子。用于检测例如PD-L1等免疫检查点分子在癌症例如在活组织检查或包含来自癌症的细胞的其它样品中的表达的方法是本领域已知的,所述方法例如包括市售或实验室开发的免疫组织化学(IHC);参见,例如,Udall等人,Diagn Pathol.2018;13:12。可以将该水平与阈值或参考水平进行比较,如果发现例如PD-L1等免疫检查点分子的表达水平高于阈值或参考水平,则可以选择受试者进行如本文所述的治疗。在一些实施方案中,该方法可以包括确定癌症是否具有高水平的微卫星不稳定性(MSI),例如,如Kawakami等人,Curr Treat Options Oncol.2015年7月;16(7):30;Zeinalian等人,Adv BiomedRes.2018;7:28中所述,并选择进行MSI高或MSI水平高于阈值或参考水平的癌症的治疗。
可将本文所述的任何一种或多种治疗性纳米颗粒施用于患有癌症的受试者。可将一种或多种治疗性纳米颗粒施用于保健设施(例如医院或诊所)或辅助保健设施中的受试者。在一些实施方案中,所述受试者先前已经被诊断为患有癌症。在一些实施方案中,所述受试者已经接受了针对癌症的治疗。在一些实施方案中,在用本文所述的治疗性纳米颗粒之一治疗之前,已经通过外科手术去除了一种或多种肿瘤。
在一些实施方案中,至少一种治疗性纳米颗粒的施用导致肿瘤大小的减小(例如,显著或可观察到的减小)、肿瘤大小的稳定化(例如,没有显著或可观察到的尺寸改变)、或受试者中存在的肿瘤生长速率的降低(例如,可检测或可观察到的降低)。卫生保健专业人员可以使用多种不同的成像技术来监视受试者中肿瘤的大小和/或肿瘤大小的变化,所述成像技术包括但不限于:计算机断层摄影、磁共振成像、正电子发射断层摄影、和X射线。例如,可以在治疗之前和之后确定受试者的肿瘤大小,以确定响应于治疗在受试者中肿瘤大小是否已经减小或稳定。可以将肿瘤的生长速率与未接受治疗或接受不同治疗的另一受试者或受试者群体中肿瘤的生长速率进行比较。还可以通过比较治疗性治疗(例如,用本文所述的任何治疗性纳米颗粒治疗)之前和之后的肿瘤生长速率来确定肿瘤生长速率的降低。在一些实施方案中,可以使用成像技术进行肿瘤的可视化,所述成像技术利用与肿瘤中的癌细胞特异性结合的标记的探针或分子(例如,与存在于癌细胞表面的表位选择性结合的标记的抗体)。
在一些实施方案中,向受试者施用治疗性纳米颗粒降低患有(例如,被诊断为患有)原发性癌症(例如,原发性乳腺癌)的受试者发生转移性癌症(例如,淋巴结中的转移性癌症)的风险(例如,与患有相似原发性癌症但未接受治疗或接受替代治疗的受试者发生转移性癌症的比率相比)。还可以将患有原发性癌症的受试者中发生转移性肿瘤的风险的降低与未接受治疗或癌症疗法的替代形式的受试者群体中转移性癌症形成的速率进行比较。
卫生保健专业人员还可以通过观察受试者中癌症症状数量的减少或通过观察受试者中一种或多种癌症症状的严重性、频率和/或持续时间的减少来评价癌症的治疗效果。癌症的多种症状在本领域中是已知的,并且在本文中进行了描述。
在一些实施方案中,施用可导致受试者的寿命或存活或癌症机会的增加(例如,显著的增加)(例如,与患有相似癌症但接受不同治疗性治疗或未接受治疗性治疗的受试者群体相比)。在一些实施方案中,施用可导致患有癌症的受试者的改善的预后(例如,与患有相似癌症但接受不同治疗性治疗或未接受治疗性治疗的受试者群体相比)。
剂量、施用和组合物
在本文所述的任何方法中,治疗性纳米颗粒可以由卫生保健专业人员(例如,医师、医师的助手、护士、或实验室或诊所工作人员)、受试者(即,自我施用)、或该受试者的朋友或家人施用。可以在临床环境中(例如在诊所或医院中)、在辅助生活设施中、或在药房中进行施用。
在本文描述的任何方法的一些实施方案中,将治疗性纳米颗粒施用于已经被诊断为患有癌症的受试者。在一些实施方案中,受试者已被诊断为患有乳腺癌或胰腺癌。在一些非限制性实施方案中,所述受试者是男性或女性,成人、青少年、或儿童。所述受试者可已经经历了一种或多种癌症或转移性癌症的症状(例如,淋巴结中的转移性癌症)。所述受试者还可被诊断为患有严重或晚期癌症(例如,原发性或转移性癌症)。在一些实施方案中,所述受试者可已经被识别为在至少一个淋巴结中存在转移性肿瘤。在一些实施方案中,所述受试者已经进行了手术切除,例如部分或全部胰腺切除术、淋巴切除术和/或乳房切除术。
在本文描述的任何方法的一些实施方案中,向受试者施用至少1个(例如,至少2、3、4、5、6、7、8、9、10、15、20、25或30个)剂量的组合物,所述组合物含有本文所述的任何磁性颗粒或药物组合物中的至少一种(例如,一种、两种、三种、或四种)。在本文所述的任何方法中,可以将至少一种磁性颗粒或药物组合物(例如,本文所述的任何磁性颗粒或药物组合物)静脉内、动脉内、皮下、腹膜内、或肌内施用于受试者。在一些实施方案中,将至少磁性颗粒或药物组合物直接施用(注射)于受试者的淋巴结中。
在一些实施方案中,向受试者施用至少一种治疗性纳米颗粒或药物组合物(例如,本文所述的任何治疗性纳米颗粒或药物组合物)和至少一种其它治疗剂。至少一种其它治疗剂可以是化学治疗剂。术语“化学治疗剂”是指可用于降低受试者(例如,人)中癌细胞的生长速率或用于诱导或介导癌细胞的死亡(例如,坏死或凋亡)的分子。在非限制性实例中,化学治疗剂可以是小分子,蛋白(例如抗体、抗体的抗原结合片段、或其衍生物或缀合物)、核酸、或其任何组合。化学治疗剂的非限制性实例包括一种或多种烷基化剂;蒽环类;细胞骨架破坏剂(紫杉烷类);埃博霉素;组蛋白脱乙酰基酶抑制剂;拓扑异构酶I的抑制剂;拓扑异构酶II的抑制剂;激酶抑制剂;核苷酸类似物和前体类似物;肽类抗生素;铂基试剂;类维生素A;和/或长春花生物碱及其衍生物;或其任何组合。在一些实施方案中,化学治疗剂是核苷酸类似物或前体类似物,例如,阿扎胞苷;硫唑嘌呤;卡培他滨;阿糖胞苷;多西氟尿啶;氟尿嘧啶;吉西他滨;羟基脲;巯基嘌呤;甲氨蝶呤;或硫鸟嘌呤。其它实例包括环磷酰胺、氮芥、苯丁酸氮芥(chlorabucil)、美法仑、柔红霉素、多柔比星、表柔比星、伊达比星、米托蒽醌、戊柔比星、紫杉醇、多西他赛、依托泊苷、替尼泊苷、塔夫鲁肽、博来霉素、卡铂、顺铂、奥沙利铂、全反式视黄酸、长春碱、长春新碱、长春地辛、长春瑞滨、和贝伐单抗(或其抗原结合片段)。化学治疗剂的其它实例是本领域已知的。
在一些实施方案中,基于癌症类型或基于癌症的遗传分析来选择化学治疗剂;例如,对于胰腺癌,使用ABRAXANE(与白蛋白结合的紫杉醇)、Gemzar(吉西他滨)、卡培他滨、5-FU(氟尿嘧啶)和ONIVYDE(伊立替康脂质体注射液)、或其组合中的一种或多种,可以施用例如FOLFIRINOX(三种化学疗法药物(5-FU/亚叶酸钙、伊立替康和奥沙利铂)的组合)或改良的FOLFIRINOX(mFOLFIRINOX)。可以使用可以通过互补机制协同作用的靶标的进一步组合。例如,可以使用通过重组人透明质酸酶(PEGPH20)、
所述方法和组合物还可以包括镇痛药(对乙酰氨基酚、双氯芬酸、二氟尼柳、依托度酸、氟诺洛芬、氟比洛芬、布洛芬、吲哚美辛、酮洛芬、酮咯酸、甲氯芬那酸、芬非那酸、美洛昔康、萘丁美酮、萘普生、奥沙普秦、苯基丁氮酮、吡罗昔康、舒林酸、托美汀、塞来昔布、丁丙诺啡、布托啡诺、可待因、氢可酮、氢吗啡酮、左啡诺、哌替啶、美沙酮、吗啡、纳布芬、羟考酮、羟吗啡酮、喷他佐辛、丙氧芬、和曲马多)的施用。
在一些实施方案中,以相同的组合物(例如,相同的药物组合物)施用至少一种其它治疗剂和至少一种治疗性纳米颗粒(例如,本文所述的任何治疗性纳米颗粒)。在一些实施方案中,使用不同的施用途径将至少一种其它治疗剂和至少一种治疗性纳米颗粒施用于受试者(例如,通过口服施用递送的至少一种其它治疗剂和通过静脉内施用递送的至少一种治疗性纳米颗粒。
在本文所述的任何方法中,可以将至少一种治疗性纳米颗粒或药物组合物(例如,本文所述的任何治疗性纳米颗粒或药物组合物)和任选的至少一种其它治疗剂每周至少一次(例如,每周一次、每周两次、每周三次、每周四次、每天一次、每天两次、或每天三次)施用于受试者。在一些实施方案中,以相同的组合物(例如,液体组合物)施用至少两种不同的治疗性纳米颗粒。在一些实施方案中,以相同组合物(例如,液体组合物)施用至少一种治疗性纳米颗粒和至少一种其它治疗剂。在一些实施方案中,以两种不同的组合物(例如,含有至少一种治疗性纳米颗粒的液体组合物和含有至少一种其它治疗剂的固体口服组合物)施用至少一种治疗性纳米颗粒和至少一种其它治疗剂。在一些实施方案中,至少一种其它治疗剂以丸剂、片剂、或胶囊剂的形式施用。在一些实施方案中,至少一种其它治疗剂以持续释放的口服制剂施用。
在一些实施方案中,可以在施用至少一种治疗性纳米颗粒或药物组合物(例如,本文所述的任何治疗性纳米颗粒或药物组合物)之前向受试者施用一种或多种其它治疗剂。在一些实施方案中,可以在施用至少一种治疗性纳米颗粒或药物组合物(例如,本文所述的任何磁性颗粒或药物组合物)之后向受试者施用一种或多种其它治疗剂。在一些实施方案中,将一种或多种其它治疗剂和至少一种治疗性纳米颗粒或药物组合物(例如,本文所述的任何治疗性纳米颗粒或药物组合物)施用于受试者,使得受试者中存在一种或多种其它治疗剂和至少一种治疗性纳米颗粒(例如,本文所述的任何治疗性纳米颗粒)的生物活性期的重叠。
在一些实施方案中,可以在延长的时间段内(例如,在至少1周、2周、3周、1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月、1年、2年、3年、4年、5年、或10年的时间段内)向受试者施用至少一种治疗性纳米颗粒或药物组合物(例如,本文所述的任何治疗性纳米颗粒或药物组合物)。熟练的医疗专业人员可以使用本文所述的用于诊断或跟踪治疗效果的任何方法(例如,使用上述方法和本领域已知的方法)来确定治疗期的长度。如本文所述,熟练的医学专业人员还可以改变施用于受试者的治疗性纳米颗粒(和/或一种或多种其它治疗剂)的身份(identity)和数量(例如,增加或减少),并且还可以调整(例如,增加或减少)基于治疗效果的评估(例如,使用本文所述和已知的任何方法)向受试者施用至少一种治疗性纳米颗粒(和/或一种或多种其它治疗剂)的剂量或频率。熟练的医疗专业人员可以进一步确定何时停止治疗(例如,当受试者的症状明显减轻时)。
监测治疗
我们的治疗方法的另一个关键优势来自以下事实:它为开发临床相关的、图像指导的治疗方案提供了独特的机会,该方案结合了有关靶组织中药物生物利用度的知识和治疗结果。该能力通过以下事实成为可能:MN-siPDL1结合了20-nm超顺磁性纳米颗粒载体,确保向肿瘤细胞的高效递送,并且其在组织中的积累可以通过定量非侵入性MRI进行监测。该能力在所有其它可用的治疗方法中是唯一的,这些方法不存在在治疗过程中非侵入性地测量药物生物利用度的可能性。
如本研究所示,关于通过Δ-R
因此,本方法可以包括使用检测磁性纳米颗粒的成像模态。
实施例
在以下实施例中进一步描述本发明,这些实施例不限制权利要求中描述的本发明的范围。
方法
小干扰RNA(siRNA)寡核苷酸
针对pd-l1的siRNA寡核苷酸序列(siPDL1;MW=13,788.9g/mol),由5'-ThioMC6-D/GGUCAACGCCACAGCGAAUUU-3'(正义序列;SEQ IDNO:2)和5'-PAUUCGCUGUGGCGUUGACCUU-3'(反义序列;SEQ ID NO:3)组成。乱序siRNA寡核苷酸的序列(siSCR;MW=13,728.8g/mol)为5'-ThioMC6-D/UGGUUUACAUGUCGACUAAUU-3'(正义序列;SEQ IDNO:4)和5'-PUUAGUCGACAUGUAAACCAUU-3'(反义序列;SEQ ID NO:5)。两种siRNA均由Dharmacon(Lafayette,CO)设计和合成。在正义序列中引入5'-硫醇修饰剂C6二硫化物(5’-ThioMC6)以与磁性纳米颗粒结合。
葡聚糖包被的磁性纳米颗粒(MN)的合成
按照先前公开的方案合成MN
纳米药物的合成与表征
纳米药物的合成是根据先前公开的方案
细胞系
按照供应商的说明,将鼠胰腺导管腺癌PAN 02细胞系(NCI,Frederick,MD)在补充有10%FBS(Thermoscientific,Waltham,MA)、1%抗生素(Invitrogen,Carlsbad,CA)、和2mM L-谷氨酰胺的RPMI 1640培养基(Sigma)中培养。每周更换培养基3次,并经胰蛋白酶消化,每周进行一次传代培养。
免疫组织学组织染色和荧光显微
一抗和二抗购自Abcam(Cambridge,MA),包括:抗CD3(产品编号:AB16669)、抗CD8(产品编号:AB25478)、抗FoxP3(产品编号:AB75763)、颗粒酶B(产品编号:AB4069)、抗Ki67(产品编号:AB16667)、和抗PDL1(产品编号:AB80276)作为一抗,山羊抗大鼠IgG H&L(DyLight 488预吸附,AB98420)和山羊抗兔IgG H&L(DyLight 488预吸附,AB96899)作为二抗。
按照用于各个生物标志物的方案进行免疫组织学组织染色。简而言之,将切除的肿瘤组织包埋在组织-Tek OCT化合物(Sakura Finetek,Torrance,CA)中,并在液氮中速冻。将组织切成7μm的切片,并在4%甲醛中固定10分钟。必要时,使用PBS中的0.1%TritonX-100进行洗涤剂透化作用。用PBS中0.5%牛血清白蛋白中的5%山羊血清封闭后,将每张玻片与相应的一抗(稀释度1/200)在5℃孵育过夜。每张玻片与二抗(稀释度1/200)孵育60分钟,并用具有DAPI的Vectashield固定培养基(Vector Laboratories,Inc.Burlingame,CA)固定。使用配有必要的滤光片组(MVI Inc.,Avon,MA)的Nikon E400荧光显微镜(Nikon,Tokyo,Japan)对玻片进行分析。使用具有近红外灵敏度的电荷耦合设备相机(SPOT7.4Slider RTKE;诊断仪器,Sterling Heights,MI)采集图像。使用SPOT 4.0高级版本软件(诊断仪器)和ImageJ(1.51c版,NIH)对图像进行分析。
体内MR成像
MR成像是在每周一次使用MN-siPDL1/SCR治疗之前和之后,使用具有梯度插入物的Bruker 9.4T水平孔磁体(Magnex Scientific)并使用ParaVision 5.1软件运行下进行的。小鼠在接种后2周形成肿瘤,并通过MR成像进行监测,以定量测量肿瘤体积,采用松弛增强(RARE)T
动物模型
将小鼠胰腺癌细胞系Pan02细胞(0.25x10
治疗
将小鼠(n=6)随机分为实验组(用MN-siPDL1+吉西他滨处理)或对照组(用MN-siSCR+吉西他滨处理)。用溶液中的低剂量MN-siPDL1(以铁计10mgkg
统计分析。
数据表示为平均值±s.d.或s.e.m.,如果有。使用双尾t检验(SigmaStat 3.0;Systat软件,Richmond,CA)进行统计比较。P<0.05的值被认为具有统计学显著性。
实施例1.用于胰腺癌免疫疗法的RNAi介导的PD-L1抑制。
MN-siPDL1可以体内递送至原发性肿瘤并且可以通过非侵入性MRI监测递送。
为了在静脉注射后成功地将治疗量的siRNA递送至肿瘤细胞,我们需要根据流体动力学大小、缀合方法、和每纳米颗粒的siRNA寡核苷酸的数量优化MN-siPDL1的设计。MN-siPDL1的示例性合成方案在图1A中示出。为确保长循环时间(>4小时)并在整个血管内皮和整个肿瘤间质有效扩散,我们设计了MN-siPDL1,使其与SPDP接头和寡核苷酸顺序缀合后的最终大小为23.2±0.9nm。将每个纳米颗粒的siRNA寡核苷酸的数量调整为不超过4.8±0.7,目的是最大程度地减少对生物缀合的空间干扰。优化设计以通过增强的渗透保留(EPR)效应增强肿瘤组织对纳米药物的吸收。此外,选择SPDP接头是因为其具有可还原性,可确保寡核苷酸从癌细胞中的纳米颗粒上解离,并有效进入RNA诱导的沉默复合物(RISC)。最后,为了允许通过磁共振成像检测MN-siPDL1,通过改变[Fe
为了建立有效的治疗方案的目的,我们需要确认MN-siPDL1向胰腺肿瘤组织的递送,并证明MRI半定量测量肿瘤中MN-siPDL1生物利用度的能力。我们使用PAN02同基因胰腺癌模型检验了我们的假设。这些动物在接种后2周形成肿瘤,并使用单回波和多回波T
如图2A所示,与对比前图像相比,MN-siPDL1在肿瘤组织中的定位导致T2弛豫时间的缩短并且导致负对比度。在最初的三周内,Δ-R
吉西他滨和MN-siPDL1的联合治疗在同基因胰腺癌模型中有效
我们的治疗性研究表明吉西他滨和MN-siPDL1联合治疗胰腺癌的潜力。在这些研究中,通过将鼠胰腺癌细胞系PAN02植入六周龄的雌性C57BL/6小鼠的右肋中来产生胰腺癌的同基因模型。
为了确定吉西他滨和MN-siPDL1的联合治疗是否能抑制肿瘤生长,用通过尾静脉静脉内递送(i.v.)的溶液中的吉西他滨与低剂量的MN-siPDL1或siSCR(两组中均为10mg/kg Fe;520纳摩尔/kg siRNA)或高剂量的MN-siPDL1或siSCR(两组中均为10mg/kg Fe,937纳摩尔/kg siRNA)处理小鼠。当通过解剖MR成像测量的肿瘤大小达到>50mm
相对于无活性的MN-siSCR对照,MN-siPDL1和吉西他滨共处理的小鼠表现出对肿瘤生长的显著抑制作用(P<0.05)。从治疗开始到第2周,这种差异是明显的,肿瘤体积从第0周的52.8±6.7mm
在高剂量MN-siPDL1组中,67%的小鼠表现出对定义为抑制肿瘤生长的治疗的客观应答。33%的小鼠无应答并在6周后死亡,表明应答存在差异。表I列出了根据应答将实验动物分层的肿瘤生长的时间常数。
表I.用MN-siPDL1或MN-siSCR和吉西他滨处理的动物中的肿瘤生长速率常数。
最后,在评估动物存活率时清楚地看到了联合治疗的优势(图3C)。67%的用吉西他滨和MN-siPDL1(高剂量)处理的小鼠存活至第12周。67%的用吉西他滨和MN-siPDL1(低剂量)处理的小鼠存活至第8周。所有用MN-siSCR和吉西他滨处理的对照小鼠在第6周死亡。
有趣的是,吉西他滨和MN-siSCR处理组中的所有小鼠都出现了大的坏死性肿瘤,这可能是由于肿瘤的高生长率所致。在实验动物中未观察到肿瘤坏死和溃疡(图3D)。
联合治疗防止细胞毒性T细胞失活
为了评估治疗对抗肿瘤免疫应答的影响,我们分析了治疗小鼠的肿瘤中免疫细胞募集和激活的组织生物标志物。用MN-siPDL1和吉西他滨联合治疗后,PD-L1表达显著降低。存在关于CD8+肿瘤浸润淋巴细胞(TIL)的募集和细胞介导的细胞毒性的增加的证据,如较高水平的颗粒酶B所证明的。免疫抑制性Foxp3+调节性T(Treg)细胞对肿瘤的浸润也显著减少。最后,肿瘤细胞的增殖被抑制(图4A-B)。有趣的是,这些生物标志物在用高剂量MN-siPDL1和吉西他滨处理的非应答性动物中的表达介于对照动物和回归实验动物之间,这表明需要临界水平的PD-L1抑制以观察到宏观应答(图4A-B)。这些结果表明观察到的治疗效果是成功诱导抗肿瘤免疫应答的结果。
参考文献
1Sheahan,A.V.,Biankin,A.V.,Parish,C.R.&Khachigian,L.M.Targetedtherapies in the management of locally advanced and metastaticpancreaticcancer:a systematic review.Oncotarget 9,21613-21627(2018).
2Oberstein,P.E.&Olive,K.P.Pancreatic cancer:why is it so hard totreat?Therap Adv Gastroenterol 6,321-337(2013).
3McAllister,F.et al.Current Status and Future Directions forScreeningPatients at High Risk for Pancreatic Cancer.Gastroenterol Hepatol(NY)13,268-275(2017).
4Dauer,P.,Nomura,A.,Saluja,A.&Banerjee,S.Microenvironmentindetermining chemo-resistance in pancreatic cancer:Neighborhoodmatters.Pancreatology 17,7-12(2017).
5Erstad,D.J.et al.Orthotopic and heterotopic murine models ofpancreaticcancer and their different responses to FOLFIRINOX chemotherapy.DisModelMech 11(2018).
6 Conroy,T.et al.FOLFIRINOX versus gemcitabine formetastaticpancreatic cancer.N Engl J Med 364,1817-1825(2011).
7 Vogel,A.et al.Efficacy and safety profile of nab-paclitaxelplusgemcitabine in patients with metastatic pancreatic cancer treated todiseaseprogression:a subanalysis from a phase 3 trial(MPACT).BMC Cancer 16,817(2016).
8 Wilden,S.M.,Lang,B.M.,Mohr,P.&Grabbe,S.Immune checkpointinhibitors:a milestone in the treatment of melanoma.J Dtsch Dermatol Ges 14,685-695(2016).
9 Pabani,A.&Butts,C.A.Current landscape of immunotherapy forthetreatment of metastatic non-small-cell lung cancer.Curr Oncol 25,S94-S102(2018).
10 Beatty,G.L.&Gladney,W.L.Immune escape mechanisms as a guideforcancer immunotherapy.Clin Cancer Res 21,687-692(2015).
11 Ghosh,S.K.et al.Targeted imaging of breast tumor progressionandtherapeutic response in a human uMUC-1 expressing transgenic mousemodel.Int J Cancer 132,1860-1867(2013).
12 Ghosh,S.K.et al.Sequence-dependent combination therapywithdoxorubicin and a survivin-specific small interfering RNAnanodrugdemonstrates efficacy in models of adenocarcinoma.Int J Cancer 134,1758-1766(2014).
13 Kumar,M.,Yigit,M.,Dai,G.,Moore,A.&Medarova,Z.Image-guidedbreasttumor therapy using a small interfering RNA nanodrug.Cancer Res 70,7553-7561(2010).
14 Medarova,Z.,Pham,W.,Farrar,C.,Petkova,V.&Moore,A.In vivoimaging ofsiRNA delivery and silencing in tumors.Nat Med 13,372-377(2007).
15 Yigit,M.V.et al.Context-dependent differences in miR-10bbreastoncogenesis can be targeted for the prevention and arrest of lymphnodemetastasis.Oncogene 32,1530-1538(2013).
16 Yigit,M.V.,Moore,A.&Medarova,Z.Magnetic nanoparticles forcancerdiagnosis and therapy.Pharm Res 29,1180-1188(2012).
17 Yoo,B.et al.Design of nanodrugs for miRNA targeting in tumorcells.JBiomed Nanotechnol 10,1114-1122(2014).
18 Yoo,B.et al.Combining miR-10b-Targeted Nanotherapy with Low-DoseDoxorubicin Elicits Durable Regressions of Metastatic BreastCancer.CancerRes 75,4407-4415(2015).
19 Yoo,B.et al.Therapy targeted to the metastatic niche is effectivein amodel of stage IV breast cancer.Sci Rep 7,45060(2017).
20 Medarova,Z.,Balcioglu,M.&Yigit,M.V.Controlling RNA ExpressioninCancer Using Iron Oxide Nanoparticles Detectable by MRI and In VivoOpticalImaging.Methods Mol Biol 1372,163-179(2016).
21 Yoo,B.,Ifediba,M.A.,Ghosh,S.,Medarova,Z.&Moore,A.Combinationtreatment with theranostic nanoparticles for glioblastomasensitization toTMZ.Mol Imaging Biol 16,680-689(2014).
22 Powles,T.et al.Efficacy and Safety of Durvalumab in LocallyAdvancedor Metastatic Urothelial Carcinoma:Updated Results From a Phase 1/2Open-label Study.JAMA Oncol 3,e172411(2017).
23 Crist,M.&Balar,A.Atezolizumab in invasive and metastaticurothelialcarcinoma.Expert Rev Clin Pharmacol 10,1295-1301(2017).
24 Balar,A.V.et al.Atezolizumab as first-line treatment incisplatin-ineligible patients with locally advanced and metastatic urothelialcarcinoma:a single-arm,multicentre,phase 2 trial.Lancet 389,67-76(2017).
25 Powles,T.et al.Atezolizumab versus chemotherapy in patients withplatinum-treated locally advanced or metastatic urothelial carcinoma(IMvigor211):a multicentre,open-label,phase 3randomised controlledtrial.Lancet 391,748-757(2018).
26AstraZeneca.AstraZeneca reports initial results from the ongoingMYSTIC trial in Stage IV lung cancer..(2016).
27Royal,R.E.et al.Phase 2trial of single agent Ipilimumab(anti-CTLA-4)for locally advanced or metastatic pancreatic adenocarcinoma.J Immunother33,828-833(2010).
28Brahmer,J.R.et al.Safety and activity of anti-PD-L1 antibody inpatients with advanced cancer.N Engl J Med 366,2455-2465(2012).
29Renouf,D.J.D.,N.C.;Kavan,P.;Jonker,D.J.;Chia-chi,W.A.;Hsu,T.TheCanadian Cancer Trials Group PA.7trial:results from the safety run in ofarandomized phase II study of gemcitabine(GEM)and nab-paclitaxel(Nab-P)versusGEM,nab-P,durvalumab(D),and tremelimumab(T)as first-line therapy inmetastatic pancreatic ductal adenocarcinoma(mPDAC).J Clin Oncol 36(2018).
30Doherty,G.J.,Tempero,M.&Corrie,P.G.HALO-109-301:a Phase III trialof PEGPH20(with gemcitabine and nab-paclitaxel)in hyaluronic acid-high stageIV pancreatic cancer.Future Oncol 14,13-22(2018).
31Neesse,A.,Algul,H.,Tuveson,D.A.&Gress,T.M.Stromal biology andtherapy in pancreatic cancer:a changing paradigm.Gut 64,1476-1484(2015).
其它实施方案
应理解,尽管已经结合本发明的详细描述描述了本发明,但是前述描述旨在说明而不是限制本发明的范围,本发明的范围由所附权利要求的范围限定。其它方面、优点和修改在所附权利要求的范围内。
- 用于治疗免疫检查点抑制剂相关结肠炎的方法和组合物
- 用于鉴定患有癌症的受试者是否将获得对免疫检查点抑制剂的应答的方法和组合物
