二氢卟吩衍生物与超声医疗系统的组合
文献发布时间:2023-06-19 12:05:39
技术领域
本发明属于生物医疗领域;更具体地,本发明涉及一种二氢卟吩衍生物或其可药用盐与超声医疗系统的组合,用于对患者进行全方位治疗。
背景技术
光动力学治疗(Photodynamic therapy,PDT)与声动力学治疗(Sonodynamictherapy,SDT),分别是通过光敏剂(photosensitizer)或声敏剂(sonosensitizer)经光或超声动力激发,从而引发生化学反应杀死肿瘤细胞的近代医疗技术。
光动力学治疗(PDT)是用光敏药物和激光活化治疗肿瘤或疾病的一种新方法,其是在有氧存在的环境中,利用光敏剂在特定波长辐照下,产生单线态氧(
声动力学治疗(SDT)是在光动力学治疗(PDT)的基础上发展起来的一种用于恶性、深部肿瘤临床治疗的新疗法。超声波具有可穿透机体、无创伤及非侵入等特点。使用的声敏感分子具有肿瘤组织靶向性,如同分子机器,给予超声动力后产生应答,高效运转,发挥抗肿瘤药效。以超声波为动力,在声敏感药剂富集的肿瘤部位形成超声空化、产生具有肿瘤细胞杀伤力的单线态氧及生化反应等作用,引发肿瘤细胞凋亡或死亡,并且对化学治疗、光动力治疗等有叠加作用。与光动力治疗相比,声动力治疗具有以下优点:1.它不仅能治疗人体表浅肿瘤,而且可治疗人体任何部位的深部肿瘤,对深部肿瘤的治疗无须通过内窥镜,治疗时采用体外超声辐照,患者无痛苦;2.患者治疗后无需避光,可随时重复治疗;3.可有效防止恶性肿瘤发生转移,是杀死恶性肿瘤的有效途径。
迄今报道的声感剂呈现对肿瘤细胞选择性差异大,治疗窗口偏窄,生理条件下溶解性较差以及在体内清除速率较慢,难以体现临床价值等缺点。此外,目前在进行声动力治疗时,所采用的治疗系统结构单一,体积小,仅能作用于患者的局部,而不能对患者进行全方位的治疗,无法有效杀死目前医疗设备和仪器还未能检测到的人体中已经发生病变的极微小恶性肿瘤。因此,对于恶性肿瘤已经发生全身转移的患者,或者对于癌症手术后,恶性肿瘤正在发生全身转移的患者,现有的治疗系统无法对其进行及时有效治疗。由于现有的超声治疗系统的都是单头换能器,并且对同一患者的不同部位的病灶,医生不能根据治疗的需要对其进行同时治疗和对超声换能器进行选择。而且,采用单头超声换能器对患者进行全身治疗,需要连续工作几十小时以上才能完成,因此极大地增加了医生的工作量,既造成患者无法承受的治疗时间又错过了最佳的治疗时机。所以,医学界人士希望有一种能对人体驱干进行全面辐照,其能量超过光的能量,可达到人体深部,激活药物杀死人体深部的癌细胞的设备。
因此,亟需开发一种水溶性良好的声敏剂,并利用该声敏剂与超声医疗系统的组合,来对患者进行全方位声动力治疗,以推动声动力学治疗的发展。
发明内容
有鉴于此,本发明设计了一种二氢卟吩衍生物或其可药用盐与超声医疗系统的组合,以对患者进行全方位声动力治疗。具体而言,根据该组合,可以先行让患者服用本发明的二氢卟吩衍生物或其可药用盐,然后在对患者进行全方位声动力治疗过程中,根据患者身体各部位的治疗需要和患者的感受随时修改各部位超声换能器治疗参数,从而达到最佳疗效的超声医疗系统。
根据本发明的第一方面,本发明提供了一种二氢卟吩衍生物或其可药用盐与超声医疗系统的组合,所述二氢卟吩衍生物或其可药用盐具有下式(I)所示的结构:
其中,
R
R
其中R
在R
在R
其中R
并且R
M为2H或者金属离子,例如二价金属离子如Cu
所述超声医疗系统包括换能器声床和接触剂,其中,所述换能器声床包括底部和从底部向上延伸的壁部;所述底部在与目标的头、躯干和四肢相对应的位置处分别具有至少一个超声换能器,以用于向位于其上方的目标发射超声波;所述壁部在其与目标头部和四肢相对应的位置处分别具有至少一个超声换能器,以用于向目标发射超声波;所述接触剂用于在所述目标与所述超声换能器之间传递超声波。
本发明的有益效果:
本发明提供的全方位超声医疗系统有效解决了肿瘤患者特别是恶性肿瘤患者由于肿瘤扩散转移导致死亡的难题,可全方位辐照人体的超声波不仅可以达到人体的深部组织而且可以穿透人体,其能量可成功激活声敏剂药物二氢卟吩衍生物或其可药用盐,使其杀死人体各个部位的肿瘤。
并且,本发明在声动力治疗过程中可灵活地对超声换能器工作参数进行选择,从而增加了医生在治疗时的便利性,极大地缩短了患者的治疗时间。本发明是通过体外超声,对人体正常组织无任何损伤,而且是在无痛的情况下杀死恶性肿瘤,是一种选择性好、副作用小的恶性肿瘤治疗新系统。
此外,本发明通过对二氢卟吩e6进行修饰得到二氢卟吩衍生物以及相应的可药用盐,在保留二氢卟吩e6作为声敏剂的同时,极大地提高了其水溶性,本发明提供的二氢卟吩衍生物或其可药用盐可作用注射剂,与上述全方位超声医疗系统组合使用时,可以有效减小肿瘤的体积和重量,抑制原发性肿瘤的转移,并且极大地提高了对肿瘤细胞的杀伤能力,对肿瘤的抑制和治疗具有良好的效果。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的实施方案。
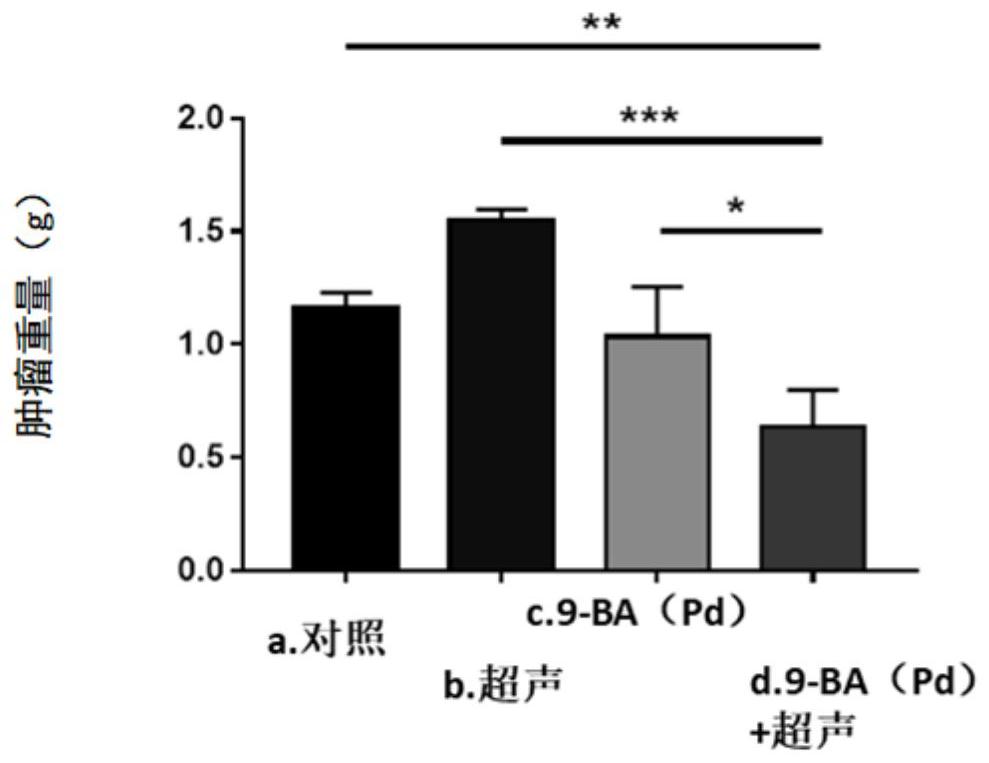
图1是示出根据本发明的化合物9-BA(Pd)治疗和超声动力治疗单独地或者组合地对原发性乳腺癌小鼠中的肿瘤组织的重量影响的柱状图(*P<0.01~0.001)。
图2是示出根据本发明的化合物9-BA(Pd)治疗和超声动力治疗单独地或者组合地对原发性乳腺癌肺转移的抑制作用的照片。
图3是示出根据本发明的化合物17-MPA治疗和超声动力治疗单独地或者组合地对结肠癌肿瘤肝转移的抑制作用的照片。
图4是示出根据本发明的化合物17-MPA治疗和超声动力治疗单独地或者组合地对小鼠肝脏重量的影响的柱状图(*P<0.01~0.001)。
图5示出了根据本发明的一个实施方案的换能器声床1的俯视图。
图6示出了根据本发明的另一个实施方案的换能器声床2的俯视图。
图7示出了根据本发明的一个实施方案的换能器模组3的侧视图。
图8示出了根据本发明的另一实施方案的带有二维数控运动装置的换能器模组4的侧视图。
图9示出了根据本发明的一个实施方案的超声医疗系统100的俯视图。
图10示出了根据本发明的另一实施方案的超声医疗系统300的俯视图。
图11示出了根据本发明的又一实施方案的带有PLC自动控制系统的超声医疗系统500的框图。
图12示出了根据本发明的一个实施方案的超声换能器8的换能头。
图13示出了根据本发明的一个实施方案的超声医疗系统100的工作流程图。
图14示出了根据本发明的另一实施方案的超声医疗系统300的工作流程图。
图15示出了根据本发明的又一实施方案的带有PLC自动控制系统的超声医疗系统500的工作流程图。
图16示出了根据本发明的PLC自动控制系统的主画面的人机界面。
图17示出了根据本发明的PLC自动控制系统的患者治疗区域选择的人机界面。
图18示出了根据本发明的PLC自动控制系统的工作方式以及声强设置的人机界面。
图19示出了根据本发明的超声医疗系统所生成的病灶信息。
具体实施方式
下面将结合本发明的实施方案和附图,对本发明进行清楚、完整地描述。显然,所描述的实施方案仅仅是本发明的一部分实施方案,而不是全部的实施方案。基于本发明中的实施方案,本领域普通技术人员可以获得的所有其他实施方案,都属于本发明保护的范围。
本发明所用的术语“烷基”是指具有指定数目碳原子的直链或支链烷基。在本发明中,“烷基”的说明性实例包括甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、正戊基或正己基等。
本发明所用的术语“卤代烷基”是指烷基中的一个或多个氢原子被卤素诸如F、Cl、Br、I取代后生成的基团。根据卤原子种类不同,本发明的“卤代烷基”包括氟代烷基、氯代烷基、溴代烷基和碘代烷基。根据卤原子数不同,本发明的“卤代烷基”包括一卤代烷基、二卤代烷基、多卤代烷基。在本发明中,“卤代烷基”的说明性实例包括一氟甲基、二氟甲基、三氟甲基、三氟乙基、三氟正丙基、三氟正丁基、三氟正丁基等。
本发明所用的术语“烷氧基”是指具有指定数目碳原子的直链或支链烷基与氧连接并通过氧与分子的其他部分连接的基团。“烷氧基”的实例包括甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基、叔丁氧基、正戊氧基或正己氧基等。
本发明所用的术语“取代端烯”是指碳碳双键(-C=C-)位于末端的烯烃。在本发明中,“取代端烯”的实例包括丙烯、1-己烯、对甲氧基苯乙烯、对三氟甲基苯乙烯等。
在声动力治疗中,声敏剂作为反应的桥梁起着重要的作用。在声动力治疗肿瘤领域,二氢卟吩e6是一种很重要的声敏剂,其是叶绿素降解衍生物中的一种,具有理想的肿瘤声动力效应。二氢卟吩e6作为声敏剂具有肿瘤特异性聚集高、肿瘤部位吸收快、体内清除的速度快、毒副作用小等诸多优点。同时,二氢卟吩e6在作为声敏剂时也存在水溶性差、活性相对较低等缺点。本发明通过对二氢卟吩e6结构进行一些功能基团的修饰来改善其声动力活性和水溶性等。
因此,本发明提供了一种二氢卟吩衍生物或其可药用盐与超声医疗系统的组合,所述二氢卟吩衍生物或其可药用盐具有下式(I)所示的结构:
其中,
R
R
其中R
在R
在R
其中R
并且R
M为2H或者金属离子,例如二价金属离子如Cu
所述超声医疗系统包括换能器声床和接触剂,其中,所述换能器声床包括底部和从底部向上延伸的壁部;所述底部在与目标的头、躯干和四肢相对应的位置处分别具有至少一个超声换能器,以用于向位于其上方的目标发射超声波;所述壁部在其与目标头部和四肢相对应的位置处分别具有至少一个超声换能器,以用于向目标发射超声波;所述接触剂用于在所述目标与所述超声换能器之间传递超声波。
在本发明中,
在本发明中,C
在本发明中,C
在本发明中,
在本发明中,二氢卟吩衍生物的可药用盐为与二氢卟吩衍生物中的羧酸根相对应的钠盐或钾盐,或者任何其他合适的可药用盐形式。
在一个实施方案中,所述二氢卟吩衍生物或其可药用盐为:
其中,
R
R
其中R
M如上所定义。
在一个实施方案中,所述二氢卟吩衍生物或其可药用盐为:
其中M如上所定义。
所谓“声敏剂”是指这样的一类物质,该物质在超声辐射下会被活化,并且在活化之后会与周围的氧分子发生一系列反应,从而产生具有高氧化活性的活性物质如单线态氧。单线态氧是具有很强活性的氧自由基,具细胞毒性作用,以细胞膜、线粒体等部位对其最为敏感,能与细胞中多种生物大分子发生作用,通过与分子结合造成细胞膜系统的损伤。
在实践中,声敏剂常常用于声动力治疗中。声动力治疗是用声敏剂和超声波治疗肿瘤疾病的一种新方法。该治疗利用超声波在生物组织中穿透能力强、无创及超声可准确聚焦传递能量的特点,将能量传递到肿瘤部位,激活预先与肿瘤组织特异结合的声敏剂,引发化学反应产生化学能,从而破坏肿瘤,达到进一步改善肿瘤生存率的目的。
如上所述,本发明的二氢卟吩衍生物或其可药用盐是通过对二氢卟吩e6的结构进行改造而获得的,所述改造的目的是为了获得相对于二氢卟吩e6性能得到进一步改进(例如肿瘤选择性更强、水溶性好)的二氢卟吩衍生物,并且在下文实施例中也进一步证实了其性能得到改善,并且依然保留了二氢卟吩e6原有的声敏性能。因此,本发明的二氢卟吩衍生物或其可药用盐可以用于声动力治疗中。
在一个实施方案中,所述超声医疗系统还包括换能器模组,其中,所述换能器模组安装在所述换能器声床的上方,包括至少一个超声换能器,用于向位于其下方的目标发射超声波,所述接触剂也用于在所述目标与所述至少一个超声换能器之间传递超声波。
在一个实施方案中,所述换能器模组还包括数控运动装置,用于控制所述换能器模组在水平和/或竖直方向移动。
在一个实施方案中,所述超声波为脉冲波或连续波。
在一个实施方案中,所述超声波频率为0.3-3MHz;优选地,所述超声波的声强为为0.1-3W/cm
在一个实施方案中,所述接触剂是水和真空脱气冷/热水中的至少一种。
在一个实施方案中,所述超声医疗系统还包括可编程序逻辑控制器自动控制系统和接触剂供应系统,其中,所述接触剂供应系统与换能器声床相连接,用于向所述换能器声床供应接触剂;所述可编程序逻辑控制器自动控制系统分别与所述换能器声床、所述换能器模组以及所述接触剂供应系统相连接,用于控制以所述接触剂供应系统向所述换能器声床供应接触剂,并用于控制所述换能器声床和所述换能器模组中的至少一部分超声换能器的操作。
在一个实施方案中,所述可编程序逻辑控制器自动控制系统还包括监视系统,用于显示至少以下内容之一:a.所述换能器声床和所述换能器模组中的至少一部分超声换能器的工作参数;b.目标内的病灶信息。
在一个实施方案中,所述二氢卟吩衍生物或其可药用盐通过下述方法制备获得:
a
b
c
其中R
d
e
其中M为2H,或者在与金属氯化物或乙酸根络合物发生反应后而成为金属离子,例如二价金属离子如Cu
可选地,在碱性条件下,使式II(a)化合物发生水解反应,生成相应的盐,即式II(b)化合物;
或
a
b
其中R
其中M为2H,或者在与金属氯化物或乙酸根络合物发生反应后而成为金属离子,例如二价金属离子如Cu
c
d
其中M为2H,或者在与金属氯化物或乙酸根络合物发生反应后而成为金属离子,例如二价金属离子如Cu
可选地,在碱性条件下,式III(a)化合物发生水解反应,生成相应的盐,即式III(b)化合物;
或
a
b
其中R
其中M为2H,或者在与金属氯化物或乙酸根络合物发生反应后而成为金属离子,例如二价金属离子如Cu
可选地,在碱性条件下,式IV(a)化合物发生水解反应,生成相应的盐,即IV(b)化合物。
根据本发明的一个优选实施方案,在所述制备二氢卟吩衍生物或其可药用盐的方法中,在步骤a
根据本发明的一个优选实施方案,在所述制备二氢卟吩衍生物或其可药用盐的方法中,在步骤b
根据本发明的一个优选实施方案,在所述制备二氢卟吩衍生物或其可药用盐的方法中,在步骤c
根据本发明的一个优选实施方案,在所述制备二氢卟吩衍生物或其可药用盐的方法中,在步骤d
根据本发明的一个优选实施方案,在所述制备二氢卟吩衍生物或其可药用盐的方法中,在步骤e
根据本发明的一个优选实施方案,在所述制备二氢卟吩衍生物或其可药用盐的方法中,在步骤a
根据本发明的一个优选实施方案,在所述制备二氢卟吩衍生物或其可药用盐的方法中,在步骤b
根据本发明的一个优选实施方案,在所述制备二氢卟吩衍生物或其可药用盐的方法中,在步骤c
根据本发明的一个优选实施方案,在所述制备二氢卟吩衍生物或其可药用盐的方法中,在步骤d
根据本发明的一个优选实施方案,在所述制备二氢卟吩衍生物或其可药用盐的方法中,在步骤a
根据本发明的一个优选实施方案,在所述制备二氢卟吩衍生物或其可药用盐的方法中,在步骤b
在一个任选的实施方案中,其中M为2H形式的式II(a)、式II(b)、式III(a)、式III(b)、式IV(a)或式IV(b)化合物可以通过与金属氯化物或乙酸根络合物发生反应,从而得到其中M为金属离子形式的相应化合物。
在另一个任选的实施方案中,在碱性条件下,式II(a)、式III(a)、或式IV(a)化合物可以发生水解反应,从而生成相应的盐形式,即式II(b)、式III(b)、或式IV(b)化合物。
如上所述,所述盐形式可以为钠盐或钾盐,或者任何其他合适的可药用盐形式。
当然,在上述制备方法的各个步骤中,也可以使用本领域已知的能够实现上述反应的其他溶剂、溶液、缩合剂、催化剂等,本发明不对此作进一步的限定。
在一个具体的实施方案中,所述制备二氢卟吩衍生物或其可药用盐的方法包括如下步骤:
a
b
c
d
e
e
f
f
在这里,化合物6和7即为式II(a)化合物,而化合物8和9即为式II(b)化合物。
在上述制备方法中,具体的反应过程如下所示:
其中,
R
R
其中R
M为2H或者金属离子,例如二价金属离子如Cu
在另一个具体的实施方案中,所述制备二氢卟吩衍生物或其可药用盐的方法包括如下步骤:
a
b
b
c
d
e
e
在这里,化合物15和16即为式III(a)化合物,而化合物17和18即为式III(b)化合物。
在上述制备方法中,具体的反应过程如下所示:
其中,
R
R
其中R
M为2H或者金属离子,例如二价金属离子如Cu
在又一个具体的实施方案中,所述制备二氢卟吩衍生物或其可药用盐的方法包括如下步骤:
a
b
b
c
c
在这里,化合物21和22即为式IV(a)化合物,而化合物23和24即为式IV(b)化合物。
在上述制备方法中,具体的反应过程如下所示:
其中,
R
R
其中R
M为2H或者金属离子,例如二价金属离子如Cu
下面结合具体实施例进一步详细地描述本发明的二氢卟吩衍生物或其可药用盐,以及其作为声敏剂与超声医疗系统组合使用时的抗肿瘤作用。
实施例
实施例1.化合物8-BA和9-BA(Pd)的制备
化合物8-BA和9-BA(Pd)的合成路线如下:
上述合成路线中的各个步骤具体如下:
将541mg化合物1溶于5%的硫酸甲醇溶液中,浓度0.1M,反应10小时后减压浓缩,所得酸用等体积的二氯甲烷(DCM)稀释,水洗,收集有机相,浓缩得到化合物2,不经分离直接用于下步反应。
将上步产物化合物2溶于二甲基甲酰胺(DMF)中,浓度0.1M,加入435mg苯并三氮唑-N,N,N',N'-四甲基脲六氟磷酸盐(HBTU)和189μL N,N-二异丙基乙胺(DIEA),搅拌0.5-1小时后,依次加入417mgβ-丙氨酸叔丁酯盐酸盐与379μL DIEA,继续反应1-2小时,反应结束后,用二氯甲烷(DCM)稀释反应液,水洗,收集有机相,浓缩,200-300目硅胶柱层析,石油醚/丙酮=3:1洗脱,得到545mg化合物3,两步收率80%。
化合物3(C
500mg化合物3与1.660mL 1-己烯溶于二氯甲烷(DCM)中,浓度0.03M,加入169mg第二代格拉布斯催化剂后回流反应20小时,反应液过滤后滤液转移至分液漏斗中,饱和氯化铵水溶液洗,收集有机相,浓缩,200-300目硅胶柱层析,石油醚/丙酮=9:2洗脱,得到376mg化合物4-B(C
300mg化合物4溶于体积分数为25%的三氟乙酸(TFA)的二氯甲烷(DCM)溶液中,浓度0.1M,搅拌反应2-5小时后浓缩反应液,残渣DCM溶解,水洗涤,收集有机相浓缩,得到279mg化合物5-B。
直接称取250mg化合物5-B溶于二甲基甲酰胺(DMF),浓度0.1M,加入189mg苯并三氮唑-N,N,N',N'-四甲基脲六氟磷酸盐(HBTU)与87μL N,N-二异丙基乙胺(DIEA)后,搅拌反应0.5-1小时后加入197mg L-天冬氨酸甲酯盐酸盐与174μL N,N-二异丙基乙胺(DIEA),继续反应1小时,反应结束后,加入二氯甲烷(DCM)稀释反应液,水洗多次,收集有机相,浓缩,200-300目硅胶柱层析,石油醚/丙酮=1:1洗脱,得到253mg化合物6-BA(C
将200mg化合物6-BA溶于二氯甲烷(DCM)中,浓度为0.1M,加入79mg二氯化钯,加热回流反应5小时,反应水洗,收集有机层,浓缩,200-300目硅胶拌和,石油醚/丙酮=3:1洗脱,得到239mg金属络合物7-BA,在水中易溶,收率90%。
分别将200mg化合物6-BA和7-BA溶于丙酮(acetone)中,浓度0.03M,加入等体积的0.5N的NaOH水溶液,搅拌反应5小时后,向反应液中加入无水乙醇,析出固体,过滤,得到205mg化合物8-BA和206mg 9-BA(Pd)。化合物9-BA(Pd):C
实施例2.化合物9-BA(Pd)对乳腺癌及乳腺癌转移的影响
以实施例1中合成的水溶性二氢卟吩衍生物9-BA(Pd)作为声敏感剂(简称声敏剂),利用实施例7提供的超声医疗系统对乳腺癌肺转移荷瘤小鼠的声动力治疗进行评价。
将水溶性二氢卟吩衍生物9-BA(Pd)溶于生理盐水中,制备成用于给药的药液。将4T1小鼠乳腺癌细胞接种于Balb/c(雌性,18~22g)小鼠左侧第二对乳头正下方,构建小鼠乳腺癌肺转移模型,接种第7天开始记录肿瘤体积以及小鼠体重,隔天测量一次。将荷瘤小鼠随机分为4组:(1)a对照组(单用生理盐水),(2)b超声组,(3)c给药(9-BA(Pd))组,(4)d给药+超声(9-BA(Pd)+超声)组(即声动力治疗组)。分别在肿瘤接种的第12、14、18、20、24、26天进行给药超声治疗。小鼠尾静脉注射16mg/kg的声敏剂,给药后2h后,进行超声动力治疗;隔24h后再次给药,并在2h后再次进行超声动力治疗,所述超声动力治疗是用1.88W/cm
通过观察发现,对照组和超声组小鼠肿瘤的平均体积增长速度较快;而单纯声敏感剂9-BA(Pd)给药组对肿瘤的生长产生轻微的抑制作用,声动力治疗组对肿瘤的抑制作用最为明显,肿瘤生长也最为缓慢(与其余各组比较,P<0.01)。
实验结束后,对剥离出来的肿瘤组织称重计量。图1示出各处理组对原发性乳腺癌小鼠中的肿瘤组织的重量的影响。从图1中可以看出,9-BA(Pd)联合超声处理(即声动力治疗组)后,相对于其他各组,肿瘤组织重量减轻,且具有显著性差异。相应地,通过观察剥离出来的肿瘤组织亦可发现声动力治疗组中,肿瘤明显缩小,统计学分析P<0.01~0.001。
图2是示出化各处理组对原发性乳腺癌肺转移的抑制作用的照片。从图2可以看出,各处理组中的荷瘤小鼠均发生不同程度的肿瘤肺转移,对照组小鼠肺转移的程度较为严重,肺部肿瘤结节数量较多。经治疗后,小鼠肺部肿瘤结节的数目有所减少,其中声敏感剂+超声动力组中,肿瘤肺转移的程度明显减轻,这说明化合物9-BA(Pd)联合自由场超声动力可以抑制乳腺肿瘤的肺转移。
综上,在本发明中,化合物9-BA(Pd)等系列水溶性二氢卟吩类声敏感剂与超声相结合从而进行超声动力治疗,对肿瘤及肿瘤组织具有显著的抑制作用,同时可以抑制小鼠原发性乳腺癌肺转移,展示出临床价值。
实施例3.化合物17-MPA和18-MPA(Pd)的制备
化合物17-MPA和18-MPA(Pd)的合成路线如下:
上述合成路线中的各个步骤具体如下:
1000mg化合物1-二氢卟吩e6溶解于二甲基甲酰胺(DMF)中,浓度为0.1M,加入1043μL碘甲烷和4633mg无水碳酸钾,搅拌反应2小时后,二氯甲烷(DCM)稀释反应液,以水洗涤,收集有机相浓缩,200-300目硅胶柱层析,乙酸乙酯/二氯甲烷=1:100洗脱,得到962mg化合物10,收率90%。
取800mg化合物10与675μL的对甲氧基苯乙烯溶于二氯甲烷(DCM)中,浓度0.03M,加入319mg格拉布斯催化剂后回流反应20小时,反应液过滤后滤液转移至分液漏斗中,水溶液洗多次,收集有机相,浓缩,200-300目硅胶柱层析,乙酸乙酯/二氯甲烷=1:100洗脱,得到654mg化合物11-MP,收率70%。
将500mg化合物11-MP溶于二氯甲烷(DCM)中,浓度为0.1M,加入79mg醋酸钯,加热回流反应5小时,反应液水洗,收集有机层浓缩,200-300目硅胶柱层析,石油醚/丙酮=5:1洗脱,得到490mg金属络合物12-MP(Pd),收率86%。
分别将400mg化合物11-MP和金属络合物12-MP(Pd)溶于体积比为1:1的四氢呋喃(THF)与1M的KOH水溶液中,浓度0.05M,反应4小时后,减压浓缩除去THF,加水,调节pH5-6,固体析出,过滤得350mg化合物13-MP和345mg化合物14-MP(Pd),不经分离直接用于下步反应。
分别将上述化合物13-MP和14-MP(Pd)溶于二甲基甲酰胺(DMF)中,浓度0.1M,再依次加入170mg 1-乙基-3(3-二甲基丙胺)碳二亚胺(EDCI)、318mg天冬氨酸甲酯盐酸盐、452μL Et
分别将200mg化合物15-MPA和16-MPA(Pd)溶于丙酮中,浓度0.03M,加入等体积的0.5N的NaOH水溶液,反应10小时后,向反应液中加入无水乙醇,析出固体,过滤得到180mg化合物17-MPA和175mg化合物18-MPA(Pd),二个化合物均易溶于水。
化合物17-MPA:C
实施例4.化合物17-MPA对结直肠癌及结直肠癌转移的影响
以实施例3中合成的水溶性二氢卟吩衍生物17-MPA为声敏感剂,利用实施例7提供的超声医疗系统对结肠癌肝癌转移荷瘤小鼠的声动力治疗进行评价。
将水溶性二氢卟吩衍生物17-MPA溶于生理盐水中,制备成用于给药的药液。本方案中使用CT26鼠结肠癌细胞,接种于Balb/c(雌性,18~22g)小鼠的半脾中,构建小鼠半脾转移肝癌模型,接种第7天开始记录小鼠体重,隔天测量一次。将肝癌小鼠随机分为4组:(1)对照组(单用生理盐水),(2)给药(17-MPA)组,(3)超声组,(4)给药+超声(17-MPA+超声)组,(5)他拉泊芬(Talaporfin sodium,一种光动力治疗药)作为对照药组。在接种的第12天,小鼠尾静脉注射16mg/kg的17-MPA,4h后采用1.88W/cm
图3的图像显示:对照组以及超声组的小鼠存在大量肉眼可见的肿瘤肝转移,给药(17-MPA)组的肿瘤组织略有减少,而给药+超声(17-MPA+超声)组的转移性病变显著减少。
图4示出了各处理组的肝脏平均重量。由图4可以看出,17-MPA+超声组的肝脏的平均重量显著低于对照组,并且也显著低于给药组、超声组和对照药组。
通过以上实验可知,化合物17-MPA可以与超声联合用于超声动力治疗,用于有效地降低治愈结肠癌转移。
实施例5.化合物17-MPA的药代动力学实验研究
应用高效液相色谱法研究化合物17-MPA在SD大鼠体内的药代动力学性质以及17-MPA在ICR荷瘤小鼠内的分布情况,以为药效学研究中的连续给药时间以及声动力治疗的介入时间提供依据。
建立高效液相色谱法检测血浆样品的日间日内精密度、稳定性(室温储存、低温保存、反复冻融)。得到的血浆样品的日间日内精密度实验以及稳定性实验的精密度均小于15%,准确度在±20%之内。检测到17-MPA在血浆中的高、中、低以及最低检测下限浓度的提取回收率分别为65.89±2.38%、69.71±0.22%、74.39±1.13%以及80.73±0.35%,内标的提取回收率为68.10±0.99%。在建立的定量分析方法的基础上检测尾静脉注射给药后SD大鼠血浆中的药物浓度,确定17-MPA在SD大鼠中的药代动力学房室模型符合二室模型,分布半衰期(t1/2α)为0.627±0.256h,消除半衰期(t1/2β)为7.421±0.802h。此外,采用平衡透析法测定DYSP-C07与SD大鼠血浆蛋白的结合率,最终得到高、中、低浓度的DYSP-C07与SD大鼠血浆蛋白结合率分别是90.94±1.90%、92.25±1.40%、95.78±1.20%。17-MPA在ICR荷瘤小鼠的心脏、肝脏、脾脏、肺部、肾脏以及肿瘤组织中均能检测到,其中17-MPA在肝脏与肾脏组织中显示高浓度,在肿瘤组织中逐渐聚集,并在6h~12h维持一个较高的浓度。
通过药代动力学实验的研究,验证了化合物17-MPA在SD大鼠体内的药代动力学符合二室模型,化合物与SD大鼠血浆蛋白结合量高,在ICR荷瘤小鼠的肝脏与肾脏中聚集程度较高,在肿瘤组织中呈逐渐聚集趋势。最终建立了高效液相色谱紫外检测法应用于17-MPA静脉注射给药后在鼠体内的动力学及组织分布的研究。根据所得到的药代动力学数据,建议以化合物17-MPA的消除半衰期为光照治疗时间的参考起始研究点,对化合物17-MPA进行系统的药效学评价。
小鼠在尾静脉给予16mg/kg的化合物17-MPA,并检测1h至12h各时间段里化合物17-MPA在ICR小鼠各组织中的分布及各时间点组织中化合物17-MPA浓度情况。结果如下:
1h:肾脏>肺>脾脏、心脏>肿瘤、肝脏;
2h:肝脏>肾脏>肺、心脏、脾脏>肿瘤;
4h:肝脏>肾脏>肺、心脏、脾脏、肿瘤;
6h:肝脏>肾脏>肿瘤、肺、脾脏、心脏;
8h:肝脏>肾脏>脾脏、肿瘤、心脏、肺;
12h:肝脏>肾脏>肿瘤、肺、脾脏、心脏;
实施例6.化合物25-tFPL和26-tFPL(Pd)的制备
化合物25-tFPL和26-tFPL(Pd)的合成路线如下:
上述合成路线中的各个步骤具体如下:
以化合物19为原料,将500mg化合物19溶于二甲基甲酰胺(DMF)中,浓度0.1M,加入479mg苯并三氮唑-N,N,N',N'-四甲基脲六氟磷酸盐(HBTU)与220μL N,N-二异丙基乙胺(DIEA)后,搅拌反应0.5小时后加入393mg赖氨酸甲酯盐酸盐与293μL N,N-二异丙基乙胺(DIEA),继续反应1小时,将反应液用二氯甲烷(DCM)稀释后,水洗,浓缩,所得残渣溶于1%的甲醇钠的甲醇溶液中,搅拌反应8小时,调节pH=6-7,减压浓缩,二氯甲烷(DCM)溶解残渣后,水洗,收集有机相浓缩,200-300目硅胶柱层析,甲醇/二氯甲烷=1:15洗脱,得到550mg化合物20-L,收率85%。
将400mg化合物20-L与1540μL的对三氟甲基苯乙烯溶于二氯甲烷(DCM)中,浓度0.03M,加入133mg格拉布斯催化剂后回流反应24小时,反应液过滤后滤液转移至分液漏斗中,水溶液洗多次,收集有机相,浓缩,200-300目硅胶柱层析,甲醇/二氯甲烷=1:15洗脱,得到309mg化合物21-tFPL,收率65%。
将200mg化合物21-tFPL溶于DCM中,浓度为0.1M,加入79mg醋酸钯,加热回流反应5小时,反应液经水洗,收集有机层浓缩,200-300目硅胶柱层析,石油醚/丙酮=3:1洗脱,得到205mg金属络合物22-tFPL(Pd),收率93%。
将200mg化合物21-tFPL和22-tFPL(Pd)分别溶于3mL二氯甲烷(DCM)中,加入1mL三氟乙酸(TFA)搅拌反应1h,反应液减压浓缩至干,得190mg化合物23-tFPL和185mg化合物24-tFPL(Pd)粗品(TFA盐)。
分别将150mg化合物23-tFPL和24-tFPL(Pd)溶于丙酮中,浓度0.03M,加入等体积的0.5N的NaOH水溶液,搅拌反应5小时后,向反应液中加入无水乙醇,析出固体,过滤,得到140mg化合物25-tFPL和143mg水溶性化合物26-tFPL(Pd)。
化合物26-tFPL(Pd)C
实施例7.超声医疗系统
图5示出了根据本发明的一个实施方案的换能器声床1的俯视图。如图5所示,换能器声床1包括底部10和从底部10向上延伸的壁部11。底部10按人体的形状分为头12、躯干13和四肢14三个区域,在该三个区域中分别布置有若干个超声换能器8。虽然图5具体示出了超声换能器8的数量,但是这仅是出于示例的目的,而不是为了限制。根据所需的治疗效果和换能器声床1的机械强度,可以增加或减少各个区域中的所布置的超声换能器8的数量。优选地,在底部10均匀布置127个超声换能器8。另外,图5中所示的换能器声床1的底部10是一个躯干13和四肢14区域略低于其他区域的平坦的区域,但是本领域技术人员所熟知的能使病人置于其上接受超声波辐射的其他形状的底部也是适合的,例如凹形、曲面、甚至波浪形等。虽然未在图中示出,但换能器声床1底部也可以具有与人体形状相适应的凹陷,以便于人体置放于其中。而此情况下,上述多个超声换能器8优选地设置在该凹陷中。
图6示出了根据本发明的另一个实施方案的换能器声床2的俯视图。如图6所示,换能器床2包括底部20和从底部20向上延伸的壁部21。底部20和壁部21都布置有超声换能器8,由于底部20的布置方式和形状与图5的底部10相同,因此,出于简洁的目的,不再赘述。在壁部21上,根据人体的形状分为头顶部212、肩部2141和脚底部2142三个区域,在该三个区域中分别布置有若干个超声换能器8,虽然图6具体示出了超声换能器8的数量,但是这仅是出于示例的目的,而不是为了限制,根据所需的治疗效果和换能器声床2的机械强度,可以增加或减少各个区域中的所布置的超声换能器8的数量。优选地,在头顶部212、肩部2141和脚底部2142上布置的超声换能器8的数量分别是2、2和4。
应当指出,虽然图5和6中示出的换能器声床基本为矩形的浴缸形式,但换能器声床也可以采用其他形状,例如椭圆形等。换能器声床的壁部相对于竖直方向的倾斜角度也可以变化,而且也可以是曲面等各种形状。这些变化都应被认为是在本发明的范围之内。
图7示出了根据本发明的一个实施方案的换能器模组3的侧视图。如图7所示,换能器模组3包括上表面31和下表面32,上表面31布置散热电风扇,33侧用于与固定装置连接,该固定方式可为本领域中任何所熟知的可适合固定换能器模组3的方式。在下表面32上,布置有若干个超声换能器8。根据所需的治疗效果和换能器模组3的机械强度,可以增加或减少所布置的超声换能器8的数量。优选地,在下表面32上均匀布置28个超声换能器8。
虽然图7中示出的换能器模组3为矩形结构,并具有平坦的下表面32,但应当理解的是,换能器模组不局限于该结构和形状,也可以是门形结构,其下表面也可以是弧形面或其他形状。
图8示出了根据本发明的另一实施方案的带有二维数控运动装置40的换能器模组4的侧视图。如图8所示,二维数控运动装置40通过安装于其上的悬臂41与换能器模块42相连接。在工作时,换能器模块42能够在二维数控运动装置40的控制下,沿X轴和Y轴移动。此处X轴是指与换能器声床纵向平行的水平方向延伸的轴,而Y轴是指与换能器声床的水平面垂直的竖直方向延伸的轴。在该示例性实施方案中,换能器模块42的形状和超声换能器8的布置方式与图7中所示的换能器模组3相同,因此,出于简洁的目的,不再赘述。
应当指出,虽然在图8中示出的换能器模块42在水平方向只沿换能器声床纵向移动,但根据需要,比如换能器声床横向尺寸比较大,例如同时治疗多个目标的时候,可以将换能器模块42设计成也可以在换能器声床横向移动的形式。此时二维数控运动装置40将由三维数控运动装置替代。
图9示出了根据本发明的一个实施方案的超声医疗系统100的俯视图。如图9所示,超声医疗系统100包括换能器声床1和接触剂9,超声换能器8浸泡在接触剂9中。接触剂9可以为其声阻介于超声换能器8与人体组织之间形成声学界面的耦合物质(接触剂),可以是水、真空脱气(冷、热)水等。优选地,使用真空脱气(冷、热)水。由于上文已详细描述了换能器声床1,因此,出于简洁的目的,不再赘述。替代地,可以用换能器声床2替换换能器声床1。
图10示出了根据本发明的另一实施方案的超声医疗系统300的俯视图。如图10所示,超声医疗系统300包括换能器声床1、换能器模组4和接触剂9,换能器模块42位于换能器声床1的上方,超声换能器8浸泡在接触剂9中。由于上文已详细描述了换能器声床1、换能器模组4和接触剂9,在此,出于简洁的目的,不再赘述。替代地,可以用换能器声床2替换换能器声床1,或用换能器模组3替换换能器模组4或者将上述两者均替换。
图11示出了根据本发明的又一实施方案的带有PLC自动控制系统的超声医疗系统500的框图。如图11所示,超声医疗系统500包括换能器声床5001、接触剂供应系统5003、换能器模组5005以及PLC自动控制系统5007。PLC自动控制系统5007分别与换能器声床5001、接触剂供应系统5003、换能器模组5005相连接,以根据治疗需要来控制后三者之间的协同工作。接触剂供应系统5003连接到换能器声床5001,以便于在PLC自动控制系统5007的控制下,向换能器声床5001供应接触剂9。其中,所述连接可以是有线连接,也可以是无线连接。所述换能器声床5001可以是换能器声床1或2,也可以是其他任何合适的换能器声床1或2的变体。所述换能器模组5005可以是换能器模组3或4,也可以是其他任何合适的换能器模组3或4的变体。
优选地,PLC自动控制系统5007还包括监视系统5008(未示出)。监视系统5008包括监视器5009,例如10.4触摸屏,用于显示所述换能器声床和所述换能器模组中的至少一部分超声换能器的工作参数,该工作参数可以如图17所示的患者治疗区域选择,如图18所示的工作方式和声强设置等。更优选地,监视器5009还能够显示人体内的病灶信息,该病灶信息可以是如图19所示的患者治疗方案等,从而达到治疗时,视患者的感受随时修改治疗参数,从而达到最佳疗效。
图12示出了根据本发明的一个实施方案的超声换能器8的换能头。如图12所示,将晶片807放入晶片座内腔,晶片的外球面与晶片座内腔面紧密接触,两者之间形成导体和限位,在晶片的内表面侧放入O型橡胶圈806,并将一个上部焊有导线810的压缩弹簧808放入紧固铜螺栓内孔后,再将铜螺栓811与晶片座805拧紧。将组装好的晶片座805放入换能器声床1或2的壁部11或21上的预留的换能头圆孔内,二者之间放入橡胶平垫圈804,同时铜螺栓还具有与换能器声床1或2连接固定的功能,在其上放入密封橡胶圈803、平垫圈802后,将圆螺母809旋入铜螺栓811上,将换能头与换能器声床1或2的壁部11或21锁紧。
上文具体描述了超声医疗系统中的各个组成部分,接下来将通过举例的方式描述超声医疗系统的具体工作流程。
图13示出了超声医疗系统100的工作流程图。如图13所示,在步骤901,向换能器声床中注入接触剂,使得接触剂淹没换能器声床上的所有超声换能器。在步骤903,将人体置于换能器声床的底部上。步骤905,打开超声换能器,向人体发射超声波,超声波的声强应当处于人体能够承受并且有效激活声敏剂的范围,例如声强的设置范围为0.1-3W/cm
图14示出了超声医疗系统300的工作流程图。如图14所示,在步骤1001,向换能器声床中注入接触剂,使得接触剂淹没换能器声床上的所有超声换能器。在步骤1003,将人体置于换能器声床的底部上。在步骤1005,向下移动换能器模组,使其浸入接触剂中。在步骤1007,打开超声换能器,向人体发射超声波,从超声换能器和换能器模组发射的超声波的频率为0.3-3MHz,波形为连续波或脉冲波。优选地,向换能器声床中注入足够多的接触剂,以便于使人体能够漂浮于其中,并由此产生轻微的横向漂移,此漂浮和横向漂移可以使得人体在换能器声床中受到更密集的超声波辐照。优选地,接触剂为真空脱气(冷、热)水。优选地,从换能器声床所发射的超声波为1MHz的脉冲波。优选地,从换能器模组所发射的超声波为1MHz的连续波。优选地,从换能器声床的壁部和底部同时向人体发射超声波。优选地,换能器模组在水平移动中向人体发射超声波。
图15示出了超声医疗系统500的工作流程图。如图15所示,步骤1101,启动PLC自动控制系统,通过PLC自动控制系统的人机界面,例如如图16所示的彩色触摸屏来对该医疗系统进行远程控制。在步骤1103,启动接触剂供应系统。在步骤1105,接触剂供应系统开始向换能器声床中注入接触剂。在步骤1107,判断换能器声床中的接触剂的液面高度是否达到预定高度,如果偏低,则转入步骤1105,对换能器声床继续注入接触剂;否则,进入步骤1109,将人体置于换能器声床的底部上。在步骤1111,对患者的治疗区域进行选择,如图17所示,例如可以根据患者的病情选择局部区域进行治疗,也可以选择全身治疗。在步骤1113,设置所选的治疗区域的超声波的强度,例如设置声强为0.1-3W/cm
在上述治疗过程中,可以利用PLC自动控制系统随时暂停治疗,从而重新进行步骤1111至步骤1117的操作,修改相应的设置,即时适应患者的治疗需要。在步骤1111,进行选择治疗区域时,可以根据患者的病情需要,仅选择换能器声床上的超声换能器工作,或者选择换能器模组的超声换能器工作,或者选择两者都工作。更优选地,可以选择换能器声床底面上的一部分超声换能器工作,或者换能器声床壁部的一部分超声换能器工作,或底部的一部分超声换能器和壁部的一部分超声换能器一起工作,或者只选择换能器模组的一部分超声换能器工作,或者换能器模组的一部分超声换能器和换能器声床底面和/或壁部上的一部分超声换能器一起工作。具体的选择依照治疗需要而定。在步骤1113,设置超声波的强度时,可根据每个所选的治疗区域的不同情况,选择相同或不同的声强,声强范围为0.1-3W/cm。在步骤1115,设置超声波的波形时,可根据每个所选的治疗区域的不同情况,选择脉冲或连续,其中脉冲方式可以是治疗时间的1%-99%,优选为30%、50%或75%。在步骤1117,设置治疗时间时,可根据每个所选的治疗区域的不同情况,选择治疗时间为5-30分钟。在步骤1123,换能器模组上的超声换能器工作时,可以固定在人体上方的某一位置处向人体发射超声波,也可以在人体上方的水平方向上均匀移动,向人体移动发射超声波,移动的速度为人体的身高与治疗时间的比值。
更优选地,PLC自动控制系统还可以构造为使得位于不同区域的超声换能器以不同的强度对人体进行照射。
应当理解,换能器模组也可以构造成上盖的形状,或构形为换能器声床的上盖的一部分。此时换能器模组的多个超声换能器可以以各种形式分布于上盖上。上盖可以在治疗目标置于换能器声床上后,盖在换能器声床上。此时超声换能器发射频率为0.3MHz-3MHz,优选地为0.5、1、1.5MHz。
利用本系统可有效解决了恶性肿瘤患者由于恶性肿瘤扩散转移导致死亡的难题,可全方位辐照人体的超声波不仅可以达到人体的深部组织而且可以穿透人体,其能量可成功激活声敏剂药物,使其杀死人体各个部位的恶性肿瘤。并且,本系统在声动力治疗过程中可灵活地对超声换能器进行选择,从而增加了医生在治疗时的便利性,极大地缩短了患者的治疗时间。本发明是通过体外超声,对人体正常组织无任何损伤,而且是在无痛的情况下杀死恶性肿瘤,是一种选择性好、副作用小的恶性肿瘤治疗新系统。
尽管本发明已结合优选实施方案和特定实施例进行了描述,但并不意旨本发明的范围被前文中特定的实施方案所限制,因为此处的实施方案在所有方面均为描述而不为了限制。例如,在上述实施方案中,所描述的换能器模组是一个小于换能器声床的矩形部件,但是也可以将换能器模组制造成与换能器声床互补的结构,或者其他任何能够满足治疗需要的合适的结构。另外,除非特别说明,此处提出的任何工作流程均不应被解释成需要以实施方案中所列举的特定顺序来执行其步骤。显然,本发明除了对人体治疗之外,也可应用于动物或其他需要治疗的目标。
虽然在本说明书中仅举出了利用二氢卟吩衍生物或其可药用盐与本超声医疗系统的组合来治疗恶性肿瘤,但是对于药物激活、心脑血管治疗、美体以及理疗等方面,本发明所提供的超声医疗系统也适用。
以上仅为本发明的较佳实施方案,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 二氢卟吩衍生物与超声医疗系统的组合
- 二氢卟吩衍生物及其铁螯合物及其制备与应用
