一种双特异性识别阿苯达唑和多菌灵的抗体制备和应用
文献发布时间:2023-06-19 12:22:51
技术领域
本发明涉及免疫检测技术领域,具体为一种双特异性识别阿苯达唑和多菌灵的抗体制备和应用。
背景技术
阿苯达唑(Albendazole)是一种高效低毒的广谱驱虫药,为苯并咪唑类衍生物,可用于人或兽类的多种寄生虫的驱除,是目前防治畜禽寄生虫病的首选药物。其作用机理是通过在体内迅速代谢为亚砜类或砜类代谢物,使虫体无法吸收糖份,导致虫体内源性糖原不足,并抑制胡索酸还原酶系统,最终导致寄生虫无法生长和繁殖,其化学结构如式(I)
阿苯达唑的广泛使用使得其在动物源性食品中的残留存在着一定的安全隐患。当人们长期食用含有兽药残留的食品时,就有可能产生胚胎毒性、骨骼畸形、肺水肿、腹泻等多种危害。许多国家都已将阿苯达唑列入限制使用兽药中,并制定了相应的限量标准。
多菌灵(Carbendazim)是一种苯并咪唑类杀菌剂,具有广谱、高效、低毒等特性,是我国主要的内吸性杀菌剂之一,被广泛应用于农业生产当中,其化学结构如式(II)
多菌灵主要用于防治农作物由真菌引起的病害,其作用机理是通过影响菌体内微管蛋白的形成从而影响真菌的细胞分裂。由于多菌灵的化学性质稳定且难以分解,其半衰期较长,能在土壤环境中长时间残留。有许多研究指出,环境中残留的多菌灵会对人和其他动物有一定的毒性作用,例如对哺乳动物所产生的胚胎毒性、肝细胞功能异常、发育毒性以及影响造血功能等,或是对水生动物产生毒害作用导致其死亡,从而影响环境的生物多样性。
目前,针对阿苯达唑及其代谢物的残留检测方法主要为仪器分析方法,如气相色谱、液相色谱和串联质谱等。而针对多菌灵的检测方法则较多,例如气相色谱、高效液相色谱、紫外可见光谱、串联质谱、伏安法、以及新型的免疫分析方法等。由于传统的仪器分析方法有操作繁琐、耗时且成本高等缺点,新型的免疫分析方法便成了发展的新趋势。
免疫分析方法的原理是利用抗原抗体的特异性免疫反应实现对目标物的定性或定量检测,因此抗原抗体的制备对免疫分析方法的建立起决定性作用。由于这两类物质都是小分子物质,无法直接诱导机体产生免疫应答,因此需要对其化学结构进行设计改造,并偶联蛋白大分子,制成具有免疫原性的完全抗原。
中国专利201910153401.3一种阿苯达唑半抗原及其制备方法和应用,公开了一种阿苯达唑的新型半抗原,并利用其与载体蛋白偶联制备人工抗原、特异性抗体,最终使用该抗原、抗体进行对阿苯达唑的免疫检测,结果表示:最佳小鼠多抗血清IC
中国专利201510973048.5检测多菌灵的酶联免疫试剂盒及其应用,公开了一种检测多菌灵的免疫试剂盒,其通过对多菌灵半抗原的偶联处理制备人工抗原,使用人工抗原制备出多菌灵特异性抗体,再利用抗原、抗体进行免疫试剂盒的建立,结果表示:按照常规方法测定试剂盒灵敏度,标准曲线的范围为0.1~8.1μg/L,IC
综上,说明现有技术还未公开过能同时用于检测阿苯达唑和多菌灵的高灵敏度免疫检测方法。
发明内容
本发明的目的是为了克服现有技术的上述不足,提供一种双特异性识别阿苯达唑和多菌灵的抗体制备方法和应用,本发明设计了一种新型的半抗原,制备出完全抗原,并通过动物免疫和细胞融合制备出能同时用于检测阿苯达唑和多菌灵的高灵敏度的单克隆抗体,为建立阿苯达唑和多菌灵的免疫分析方法提供了有利的条件。
本发明的第一个目的是提供阿苯达唑和/或多菌灵的半抗原。
本发明的第二个目的是提供所述阿苯达唑和/或多菌灵半抗原在制备阿苯达唑和/或多菌灵检测试剂盒中的应用,和/或在检测阿苯达唑和/或多菌灵中的应用。
本发明的第三个目的是提供阿苯达唑和/或多菌灵的完全抗原。
本发明的第四个目的是提供一种阿苯达唑和/或多菌灵完全抗原组合。
本发明的第五个目的是提供一种特异性识别阿苯达唑和/或多菌灵的特异性抗体。
本发明的第六个目的是提供所述半抗原、完全抗原、和/或特异性抗体在检测阿苯达唑和/或多菌灵中的应用,和/或在制备检测阿苯达唑和/或多菌灵的试剂盒或试纸条中的应用。
本发明的第七个目的是提供一种检测阿苯达唑和/或多菌灵的试剂盒。
为了实现上述目的,本发明是通过以下方案予以实现的:
本发明通过将半抗原偶联到载体蛋白上,制得两种人工抗原,将两个人工抗原分别用于动物免疫和作为包被原,通过细胞融合,制备能分泌抗阿苯达唑和/或多菌灵抗体的杂交瘤细胞,再利用包被原进一步建立一种基于间接竞争酶联免疫法的检测方法。
因此,本发明要求保护以下内容:
阿苯达唑和/或多菌灵的半抗原,其结构式如式(III)或式(IV)所示:
阿苯达唑和/或多菌灵的完全抗原,其结构式如式(V)或式(VI)所示:
优选地,所述完全抗原,其载体蛋白选自牛乳铁蛋白、牛血清白蛋白、血蓝蛋白或卵清蛋白中的一种或多种。
最优选地,结构式如式(V)所示的完全抗原的载体蛋白为牛乳铁蛋白。
最优选地,结构式如式(VI)所示的完全抗原的载体蛋白为牛血清白蛋白。
一种阿苯达唑和/或多菌灵完全抗原组合,包括如式(V)和式(VI)所示的完全抗原。
优选地,所述阿苯达唑和/或多菌灵完全抗原组合,由式(V)所示的完全抗原作为免疫原,式(VI)所示的完全抗原做为包被原;
结构式如式(V)所示的完全抗原的载体蛋白为牛乳铁蛋白;
结构式如式(VI)所示的完全抗原的载体蛋白为牛血清白蛋白。
一种特异性识别阿苯达唑和/或多菌灵的特异性抗体,使用所述的半抗原中的一种或两种,和/或采用所述的完全抗原中的一种或两种制备所得。
优选地,所述特异性抗体是由式(V)所示的完全抗原制备而得。
所述半抗原、完全抗原、和/或特异性抗体在检测阿苯达唑和/或多菌灵中的应用,和/或在制备检测阿苯达唑和/或多菌灵的试剂盒或试纸条中的应用。
一种检测阿苯达唑和/或多菌灵的检测试剂盒,由所述的阿苯达唑和/或多菌灵完全抗原组合制备得到。
优选地,式(V)所示的完全抗原作为免疫原,式(VI)所示的完全抗原做为包被原。
更优选地,结构式如式(V)所示的完全抗原的载体蛋白为牛乳铁蛋白;
结构式如式(VI)所示的完全抗原的载体蛋白为牛血清白蛋白。
更优选地,所述检测试剂盒还包括:
50mM碳酸缓冲液(pH9.6)、96孔酶标板、5%脱脂奶粉(w/v)、PBST、HRP-羊抗鼠、TMB底物溶液、10%H
更优选地,所述检测试剂盒既可以用于动物性食品中阿苯达唑的检测,也可以用于蔬菜中多菌灵的检测。
更优选地,所述检测试剂盒的使用方法为:
S1.用50mM的碳酸缓冲液(pH9.6)稀释式(VI)所示完全抗原至500ng/mL加入96孔酶标板中进行包被,每孔100μL,于37℃包被12小时;
所述酶标板洗涤2次后,拍干,每孔加入120μL封闭液,37℃封闭3h,甩干孔内的封闭液,于37℃烘箱中烘干后放4℃保存备用;
S2将50μL待测样品加入S1的酶标板中(同时做空白、阴性及阳性孔对照),然后加入50μL上述工作浓度(82.3ng/mL)的特异性抗体,于37℃孵育40分钟,洗涤5次,拍干;
S3用PBST稀释5000倍的HRP-羊抗鼠加入S2的酶标板中,每孔加入100μL,于37℃孵育30分钟,洗涤5次,拍干;
S4 TMB底物溶液与底物缓冲溶液等体积混合,加入S3的酶标板中,每孔加入100μL混合液,于37℃孵育10分钟后每孔加入50μL 10%H
S5用酶联免疫检测仪测定S4中每孔A
所述底物缓冲液为14.2g十二水合磷酸氢二钠、9.33g柠檬酸及0.6mL30%的过氧化氢溶液用去离子水定容至1L的缓冲液;
所述待测样品既可以为动物性食品,也可以为蔬菜。
与现有技术相比,本发明具有以下有益效果:
本发明通过将半抗原偶联到载体蛋白上,制得两种人工抗原,将两个人工抗原分别用于动物免疫和作为包被原,通过细胞融合,制备能分泌抗阿苯达唑和/或多菌灵抗体的杂交瘤细胞,再利用包被原进一步建立一种基于间接竞争酶联免疫法的检测方法。该检测方法检测阿苯达唑和/或多菌灵具有特异性强、灵敏度高、快速简便等特点,其中,阿苯达唑IC
多菌灵是一种常用的农药,而阿苯达唑是一种常用的兽药。虽然两者的结构类似,但两者所使用的食品范围不一样,所以检测场景一般不存在重合。根据GB 2763-2019《食品安全国家标准食品中农药最大残留限量》的规定,多菌灵的最大残留限量主要在0.5~5mg/kg,GB31650-2019《食品安全国家标准食品中兽药最大残留限量》的规定,阿苯达唑最大残留限量为0.1~5mg/kg,限量值均较高。因此,本发明所建立的检测方法可以分别应用于这两种物质的检测。
附图说明
图1为完全抗原A的紫外吸收鉴定图。
图2为完全抗原B的紫外吸收鉴定图。
图3为SDS-PAGE检测纯化后的单克隆抗体纯度。
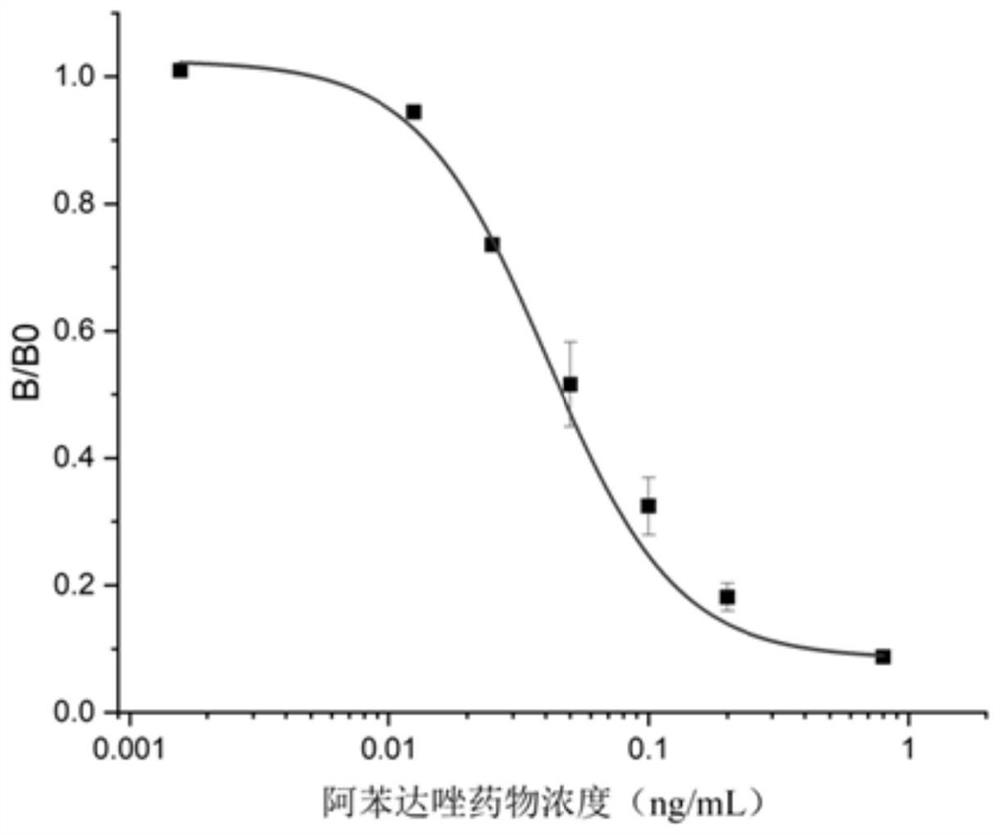
图4为竞争ELISA检测阿苯达唑标准曲线。
图5为竞争ELISA检测多菌灵标准曲线。
具体实施方式
下面结合说明书附图及具体实施例对本发明做出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
实施例1半抗原及完全抗原的合成
一、半抗原合成
1、半抗原A的制备方法其步骤如下:
(1)低温下将多菌灵溶解于1.5~2g的浓氯磺酸中,升温至40℃搅拌2.5小时,制得多菌灵氯磺酸溶液;冰浴搅拌下,在50mL 95%乙醇中滴入上述多菌灵氯磺酸溶液,经纯化,得到多菌灵氯磺化物固体;
(2)在室温下,将甲酸、蒸馏水和48%氢溴酸(v/v),按甲酸:水:氢溴酸体积比1.5:2:1的比例混匀,再依次加入步骤(1)制备的多菌灵氯磺化物固体和铝粉,在40℃下反应1.5小时,再升至65℃反应1.5小时,降至室温搅拌;将反应液过滤,滤液用蒸馏水洗涤,再用50%NaOH(v/v)调节pH至3,室温搅拌12h,经过滤纯化后得到多菌灵巯基取代物固体;
(3)在蒸馏水中加入0.3~0.6gNaOH固体、0.4~0.6g步骤(2)制备的多菌灵巯基取代物固体及0.4~0.5g溴丁酸,40℃下搅拌1.5小时,降至室温搅拌。过滤后,用6mol/L的盐酸调节pH至中性,室温下搅拌12小时,过滤纯化后得到如式(III)所示结构式的半抗原A:
2、半抗原B的制备方法其步骤如下:
(1)将多菌灵固体溶解于4~6mL的浓硫酸中,在低温下滴加等体积的浓硝酸,搅拌30分钟,升温至室温下搅拌2小时;冰浴下用20%NaOH(v/v)水溶液调节溶液pH至8左右,搅拌30分钟后过滤,经纯化后得到多菌灵硝基取代物固体;
(2)将步骤(1)制备的多菌灵硝基取代物固体加入30mL的甲醇中搅拌,按照多菌灵硝基取代物固体:锌粉:浓盐酸摩尔比为1:1.2:1加入反应,在70℃下,回流4小时,旋蒸除去甲醇并用20%NaOH(v/v)水溶液将pH调至8左右,用二氯甲烷萃取,旋蒸干燥,纯化后得到如式(IV)所示结构式的半抗原B:
二、完全抗原的合成
1、完全抗原A(免疫原)的制备方法其步骤如下:
(1)将半抗原A溶于0.6~1mLN,N-二甲基甲酰胺中,在搅拌下,加入N-羟基琥珀酰亚胺和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐,室温下避光搅拌4小时,获得所述半抗原A的活化液。其中,所述半抗原A、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和N-羟基琥珀酰亚胺的摩尔比为1:1.5:1.5;
(2)用50mM碳酸缓冲液(pH 9.6)配制浓度为5~10mg/mL的载体蛋白溶液,在冰浴搅拌下将步骤(1)中的半抗原A活化液滴加到载体蛋白溶液中,滴毕,用3M NaOH将pH调节至8~9,避光反应过夜,透析纯化后获得如式V所示结构完全抗原A:
所述载体蛋白溶液中所用的载体蛋白为牛乳铁蛋白,所述载体蛋白与半抗原A的摩尔比为40~50:1。
2、完全抗原B(包被原)的制备方法其步骤如下:
(1)用10mM的磷酸盐缓冲液(pH 7.4)配制浓度为5~10mg/mL的载体蛋白溶液,加入占载体蛋白溶液0.1~0.2%的25%戊二醛溶液(v/v),室温下避光搅拌4h,用pH 7.4的磷酸盐缓冲液透析三次,获得载体蛋白-戊二醛交联液;
(2)在低温下,将溶于N,N-二甲基甲酰胺的半抗原B加入步骤(1)中的载体蛋白-戊二醛交联液,避光反应过夜;回收反应液后滴加占半抗原-载体蛋白混合液4%的1mg/mL硼氢化钠溶液,室温下反应1小时,透析纯化后获得如式VI所示结构完全抗原B:
所述载体蛋白溶液中所用的载体蛋白为牛血清白蛋白,所述载体蛋白与半抗原B的摩尔比为40~50:1。
三、实验结果
通过分别扫描半抗原、偶联物及载体蛋白溶液在紫外区(200~400nm)的吸收光如图1~2所示,偶联物的紫外吸收特征峰相对于原载体蛋白和半抗原,均有一定程度的红移或蓝移,证明人工完全抗原制备成功。
实施例2单克隆抗体的制备
一、动物免疫
选取8周龄的雌性Bal b/c小鼠,采用低剂量长程免疫法进行免疫,免疫方法为:取50μL/只的完全抗原A(实施例1中制备所得)与等体积的佐剂混合,完全乳化后,用皮下多点注射的方式进行免疫,共免疫4~5次。初次免疫用弗氏完全佐剂,加强免疫用弗氏不完全佐剂,免疫间隔时间为14天。第3次免疫后第七天对小鼠进行尾部静脉取血,用竞争ELISA法检测血清效价,用完全抗原B(实施例1中制备所得)作为包被原,包被浓度为1μg/mL。具体操作为:
(1)包被:用pH 9.6的包被液将包被原稀释至1μg/mL,以每孔100μL的体积加至酶标板中,37℃水浴箱孵育过夜;
(2)封闭:用洗涤液洗涤2次后,将酶标板拍干,以每孔120μL的体积加入5%脱脂奶粉(w/v)封闭,37℃水浴箱孵育2h;甩尽酶标板中的液体,拍干后于37℃烘箱中倒置45min;
(3)加血清及药物:小鼠抗血清用0.01mol/L PBS从1000倍开始两倍梯度稀释至64000倍,标准品用0.01mol/L PBS稀释至100ng/mL,备用;效价列每孔加入50μL 0.01mol/LPBS及50μL抗血清,最后一孔不加抗血清作空白对照;抑制列每孔加入50μL标准品及50μL抗血清,最后一孔不加抗血清作空白对照;于37℃水浴箱孵育30min,洗板5次,拍干;
(4)加二抗:用PBST缓冲液对HRP-羊抗鼠IgG进行5000倍稀释,酶标板中每孔加入100μL,37℃水浴箱孵育30min,洗板5次,拍干;
(5)显色:TMB底物溶液与14.2g十二水合磷酸氢二钠和9.33g柠檬酸用去离子水定容至1L的缓冲液等体积混合,以每孔100μL的体积加入上述酶标板中,37℃水浴箱孵育10min;
(6)终止显示:在酶标板中,每孔加入终止液10%硫酸(v/v)终止反应;
(7)读数:用酶标仪读取在450nm下的吸光值(OD值),选择吸光值在1.0~1.5之间的抗血清稀释倍数作为抗血清的效价,抗血清的特异性由效价和抑制的OD值计算出的抑制率体现。
根据第四次免疫后七天取血所得的ELISA结果(见表1),综合效价和抑制,根据ELISA检测抗血清的结果选出效价和抑制最好的小鼠(四号小鼠),对四号小鼠进行冲击免疫,即取100μg所述完全抗原A进行腹腔注射,3~5天后取小鼠脾脏进行细胞融合。
表1小鼠抗血清表征
二、细胞融合
1、获取sp2/0骨髓瘤细胞
融合前一周进行sp2/0培养,在无菌环境下将提前培养的处于指数生长期的sp2/0骨髓瘤细胞收集至无菌离心管中,离心后,用无血清1640培养基洗两遍并重悬,进行活细胞计数。
2、获取免疫脾细胞
将上述冲击免疫3天后的小鼠处死,在无菌环境下取其脾脏,去除脾脏表面的脂肪组织与包膜,置于含有无血清1640培养基的平皿中研磨,过100μm的一次性无菌细胞筛网,收集至无菌离心管中,离心后,用无血清1640培养基洗两遍并重悬,进行活细胞计数。
3、sp2/0骨髓瘤细胞与免疫脾细胞融合
将步骤1的sp2/0骨髓瘤细胞和步骤2的免疫脾细胞按照以下具体步骤进行融合:
(1)将上述重悬的sp2/0骨髓瘤细胞和免疫脾细胞按数量比5:1的比例混合于无菌离心管中,用无血清1640培养基清洗一遍后,将培养基倒出并将底部的混合细胞轻轻弹松后,置于37℃的水浴箱中温浴5分钟;
(2)取160~200mL的无菌水到无菌烧杯中,并将提前温浴的1mL50%PEG(v/v)溶液以及(1)中温浴的装有混合细胞的离心管取出,将装有混合细胞的离心管温浴在37℃的无菌水中;
(3)用1mL移液管吸取(2)中的PEG溶液,将移液管靠近(2)中的离心管底部,在1分钟内,一边转动离心管一边缓慢滴加PEG,滴加完毕,静置1分钟;
(4)立即往(3)中的离心管中滴加预热至37℃的无血清1640培养基,滴加速度按照第一分钟加1mL,第二分钟加3mL,第三分钟到第四分钟分别加8mL;
(5)将(4)中的离心管在900rpm下离心8分钟分层,弃上清,将上述混合细胞沉淀,用预热至37℃的HAT培养基(含有16.6%胎牛血清(v/v)和2%HAT(v/v/)的1640培养基)轻轻吹散,重悬,并全部转移到160mL的HAT培养基中,混匀;
(6)将上述均匀的布有混合细胞的HAT培养基铺到96孔细胞培养皿中,每孔加200μL,将培养皿转移至37℃、5%CO
三、细胞筛选及克隆培养
上述混合细胞在细胞培养皿中融合后培养第5天,用HT培养基(含有16.6%胎牛血清(v/v)和2%HT(v/v)的1640培养基)进行半换液,第8天用HT培养基全换液,第10天用ELISA法检测培养基上清液中的抗体滴度,具体方法包括以下步骤:
(1)第5天将上述细胞培养皿中每孔200μL的细胞上清吸出100μL,加入100μL的HT培养基;第8天将每孔200μL的细胞上清全部吸出,加入200μL的HT培养基;
(2)融合培养第10天,将96孔培养板中的细胞上清吸出100μL,用ELISA法进行阳性杂交瘤细胞筛选(第一轮筛选),具体方法为:用50mM的碳酸缓冲液(pH 9.6)稀释完全抗原B(包被原)至1μg/mL加入96孔酶标板中进行包被,37℃包被12小时;洗涤后用5%脱脂奶粉(w/v)作为封闭液封闭,每孔120μL;每孔加入100μL对应克隆孔的细胞上清液,37℃孵育40分钟,充分洗涤后加入100μL的1:5000的酶标二抗(HRP-山羊抗小鼠IgG),37℃孵育30分钟,充分洗涤后加入TMB底物溶液显色,37℃孵育10分钟后终止显色,读取A
(3)第二轮筛选时,用步骤(2)的ELISA法筛选出阳性克隆孔,将阳性克隆孔再次进行有限稀释,稀释至96孔培养板,每孔约0.5~1个细胞,用步骤(2)的ELISA法筛出阳性克隆细胞株(第三轮筛选);
(4)将第三轮筛选后的阳性细胞株转移至24孔培养板进行扩大培养,用步骤(2)的ELISA法,选取对阿苯达唑和多菌灵竞争明显的细胞株3G5进行扩大培养(见表2),冻存于液氮。
表2阳性细胞株的筛选结果
注:抑制率药物浓度为100ng/mL。
四、获取腹水
选取10周龄的Bal b/c雌性小鼠,注射细胞前7~10天,预先在其腹腔注射0.5mL液体石蜡,用无血清1640培养基将阳性细胞配制成2.0×10
五、腹水纯化
用商品化protein A/G亲和柱进行小鼠腹水的纯化,具体步骤为:
(1)将protein A/G介质重悬,根据纯化蛋白所需要的量加入层析柱中,静置铺平,用5~10倍柱体积的10mM PBS(pH7.4)洗涤层析柱,进行平衡;
(2)用10mM PBS(pH7.4)稀释腹水,并用0.45μm的水相膜进行微滤,将处理后的腹水进行上样,上样完毕后用5~10倍柱体积的10mM PBS(pH7.4)洗涤层析柱,收集流穿液;
(3)用10mM甘氨酸作为洗脱缓冲液,将抗体洗脱并收集;洗脱后立即用1M Tris-HCl(pH 9.0)中和收集的抗体;
(4)对收集的抗体用10m M PBS(pH 7.4)进行透析,并用SDS-PAGE检测纯度;用PEG20000对抗体进行浓缩,并用Nanodrop检测抗体浓度,浓度控制在1~10mg/mL,于-20℃保存。
二、实验结果
SDS-PAGE检测结果如图3所示。图3中出现的两个条带说明单克隆抗体被还原成重链和轻链,没有其他杂带,说明纯化效果较好。
实施例3检测阿苯达唑和/或多菌灵的试剂盒
用棋盘法确定实施例2中制备所得到的单克隆抗体和实施例1中制备的完全抗原B(包被原)的工作浓度,所述单克隆抗体工作浓度为82.3ng/mL,完全抗原B的工作浓度为500ng/mL,做三组平行试验(n=3)。
一、试剂盒的组成
50mM碳酸缓冲液(pH9.6)、实施例1中制备所得的完全抗原B(包被原)、96孔酶标板、封闭液5%脱脂奶粉(w/v)、实施例2制备所得的特异性抗体、PBST、HRP-羊抗鼠、TMB底物溶液、10%H
二、试剂盒的使用
检测阿苯达唑和/或多菌灵的试剂盒的使用方法如下:
S1.用50mM的碳酸缓冲液(pH9.6)稀释所述完全抗原B(包被原)至500ng/mL加入96孔酶标板中进行包被,每孔100μL,于37℃包被12小时;
所述酶标板洗涤2次后,拍干,每孔加入120μL封闭液,37℃封闭3h,甩干孔内的封闭液,于37℃烘箱中烘干后放4℃保存备用
S2将50μL待测样品加入S1的酶标板中(同时做空白、阴性及阳性孔对照),然后加入50μL上述工作浓度(82.3ng/mL)的特异性抗体,于37℃孵育40分钟,洗涤5次,拍干;
S3用PBST稀释5000倍的HRP-羊抗鼠加入S2的酶标板中,每孔加入100μL,于37℃孵育30分钟,洗涤5次,拍干;
S4 TMB底物溶液与14.2g十二水合磷酸氢二钠和9.33g柠檬酸用去离子水定容至1L的缓冲液等体积混合,加入S3的酶标板中,每孔加入100μL混合液,于37℃孵育10分钟后每孔加入50μL 10%H
S5用酶联免疫检测仪测定S4中每孔A
其中,所述检测试剂盒用于检测的待测样品既可以为动物性食品,也可以为蔬菜。
实施例4检测阿苯达唑和/或多菌灵的试剂盒检测阿苯达唑标准曲线的建立
一、实验方法
用10mM PBS(pH 7.4)将阿苯达唑稀释成系列梯度标准液,浓度分别为1000ng/mL、200ng/mL、40ng/mL、8ng/mL、1.6ng/mL和0.32ng/mL,依次加入实施例3中试剂盒已包被的酶标板中,每孔加入量50μL,每个浓度进行3孔重复试验;使用实施例3中的试剂盒进行检测;用酶联免疫检测仪测定每孔A
二、实验结果
所述试剂盒检测阿苯达唑的标准曲线见图4。所得IC
实施例5检测阿苯达唑和/或多菌灵的试剂盒检测多菌灵标准曲线的建立
一、实验方法
用10mM PBS(pH 7.4)将多菌灵稀释成系列梯度标准液,浓度分别为1000ng/mL、200ng/mL、40ng/mL、8ng/mL、1.6ng/mL和0.32ng/mL,依次加入实施例3中试剂盒已包被的酶标板中,每孔加入量50μL,每个浓度进行3孔重复试验;使用实施例3中的试剂盒进行检测;用酶联免疫检测仪测定每孔A
二、实验结果
所述试剂盒检测多菌灵的标准曲线见图5。所得IC
实施例6检测阿苯达唑和/或多菌灵的试剂盒检测阿苯达唑、多菌灵的特异性
一、实验方法
配置阿苯达唑和多菌灵的结构类似物(苯菌灵、甲基硫菌灵、2-氨基苯并咪唑和噻苯达唑)的标准溶液,使用实施例3中的试剂盒,检测本实验中的4中阿苯达唑和多菌灵的结构类似物标准溶液,用酶标仪读取450nm处的OD值。绘制标准曲线,计算IC
二、实验结果
所述单克隆抗体检测阿苯达唑、多菌灵的特异性如表3所示。阿苯达唑IC
表3阿苯达唑、多菌灵的特异性检测
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,对于本领域的普通技术人员来说,在上述说明及思路的基础上还可以做出其它不同形式的变化或变动,这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
- 一种双特异性识别阿苯达唑和多菌灵的抗体制备和应用
- 一种特异性识别蛋白MEX3D的多克隆抗体制备方法及其应用
