测定人体血清中白介素-8含量的磁微粒化学发光试剂盒
文献发布时间:2023-06-19 13:45:04
技术领域
本发明涉及医用诊断试剂领域,特别是涉及一种化学发光检测技术与生物素-链霉亲和素体系相结合的原理检测人体血清中白介素-8(IL-8)含量的磁微粒化学发光试剂盒及其制备方法。
背景技术
白细胞介素即是由多种细胞产生并作用于多种细胞的一类细胞因子。目前至少发现了38个白细胞介素,分别命名为IL-1~IL-38,功能复杂;在免疫细胞的成熟、活化、增殖和免疫调节等一系列过程中均发挥重要作用,此外它们还参与机体的多种生理及病理反应。免疫系统细胞的增殖、分化和功能受到一系列细胞因子的调节。根据细胞因子的结构同源性可将其分为几个蛋白质家族,如IL-1家族、IL-6家族、IL-10家族、肿瘤坏死因子家族和造血因子家族等。
白介素-8(IL-8)属于趋化因子家族。它是一种多功能因子,其生物学功能无种属特异性,是Yoshimura等于1987年首次从细菌脂多糖刺激人外周血单核白细胞上清液中纯化得来,并证实对中性粒细胞有趋化作用,故当时被命名为粒细胞激活因子。分子生物学实验最终证实其隶属于白细胞介素成员,并于1988年伦敦学术会议上将该因子确定为中性粒细胞活性肽(NAP)/IL-8。
IL-8是一种分子量很小的蛋白(M=8.359KDa)。它的细胞来源较为广泛,主要来源于人血液单核细胞和内皮细胞。另外还有淋巴细胞、中性粒细胞、成纤维细胞、软骨细胞、人类多种肿瘤细胞等。细胞中IL-8的表达是诱导型的,需在IL-1、TNF-a、PHA和LPS等诱导剂作用下以上细胞才能合成并释放一定形式的IL-8。
IL-8的主要生物学功能是在炎症反应中趋化中性粒细胞(Neutrophils,Neu)、T淋巴细胞以及嗜碱粒细胞(Basophils)至病灶部位,并且它的趋化性对不同细胞有差异。中性粒细胞与IL-8接触后发生形态变化,定向游走到反应部位并释放一系列活性产物。这些作用可导致机体局部的炎症反应,达到杀菌和细胞损伤的目的。它的产生于以单核巨噬细胞为主的多种细胞、组织,主要靶细胞为粒细胞,广泛影响粒细胞的生物活性。它在感染、炎症、胰腺炎、黄疸及其它疾病的发病、预后中发挥重要作用。
目前检测IL-8采用双抗体夹心ELISA法,该方法生物素化的抗人IL-8抗体与IL-8结合,采用辣根过氧化物酶标记亲和素,生物素与亲和素特异性结合,辣根过氧化物酶催化无色的显色剂氧化成蓝色,这种酶联免疫吸附法自动化程度低且操作复杂繁琐,辣根过氧化物酶系统的磁微粒化学发光免疫法试剂的稳定性有待提高。
本发明所采用的的方法为化学发光分析技术和生物素-链霉亲和素系统相结合,生物素-链霉亲和素系统是利用1分子亲和素可以结合4分子生物素的特性而建立的一种放大标记技术,因此基于生物素-链霉亲和素系统的化学发光技术既具有抗原抗体反应的高特异性、化学发光反应的高灵敏度,又有生物素-链霉亲和素系统的级联放大作用,该技术继承了以ELISA为代表的传统免疫检测技术无放射性污染、操作简便等优点,同时由于采用了磁微粒作为分离载体,用碱性磷酸酶作为标记酶,选用高灵敏度发光底物。试剂盒在灵敏度、线性范围、检测精密度等方面有了全面的提高。
发明内容
本发明旨在开发一种灵敏度高、无污染、操作简单、特异性好、稳定性好并且成本低廉的一种测定人体血清中IL-8含量的磁微粒化学发光试剂盒。另外本发明的目的在于提供上述试剂盒的制备方法。
基于上述目的,本发明的技术方案是:
提供一种测定人体血清中IL-8含量的磁微粒化学发光检测试剂盒,包括:R1试剂、R2试剂、磁分离试剂、校准品和质控品;
其中R1试剂为生物素化的IL-8单克隆抗体A及R1试剂稀释液配制而成,
R2试剂为碱性磷酸酶标记的IL-8单克隆抗体B及R2试剂稀释液配制而成,
磁分离试剂为商品化链霉亲和素磁珠和磁分离试剂稀释液配制而成,
校准品和质控品为含有不同浓度IL-8抗原及含蛋白的稀释液配制而成;实验过程中需要的化学发光底物液为碱性磷酸酶催化发光的底物液;实验过程还包括清洗液,该清洗液主要用于在反应过程中清洗与磁微粒试剂反应后的样品。
优选地,两种单克隆抗体都是鼠单抗。
所述R1试剂中生物素化的IL-8单克隆抗体A偶联物(偶联物就是抗体A与生物素的连接物)工作浓度为0.5~1.5μg/mL。所述R1试剂稀释液pH值为7.2~8.0,R1试剂稀释液的组分包括:Tris,工作浓度为12.0~12.3g/L;叠氮钠,工作浓度为0.48~0.55g/L;氯化钠,工作浓度为5.5~6.0g/L;牛血清白蛋白,工作浓度为9~10g/L;甲基纤维素,工作浓度为0.5~1.0g/L;其余为纯化水。
优选地,所述R1试剂中生物素化的IL-8单克隆抗体A偶联物工作浓度为1.0μg/mL。所述R1试剂稀释液pH值为7.4±0.1,包括:Tris,工作浓度为12.1g/L;叠氮钠,工作浓度为0.5g/L;氯化钠,工作浓度为6.0g/L;牛血清白蛋白,工作浓度为9.5g/L;甲基纤维素,工作浓度为0.8g/L;其余为纯化水。
所述R2试剂中碱性磷酸酶标记的IL-8单克隆抗体B偶联物(偶联物就是抗体B与碱性磷酸酶的连接物)工作浓度为0.5~1.5μg/mL。所述R2试剂稀释液pH值为7.2~8.0,包括:Tris,工作浓度为11.0~14.3g/L;叠氮钠,工作浓度为1.20~2.50g/L;氯化钠,工作浓度为3.5~6.0g/L;氯化镁,工作浓度为0.1~0.5g/L;氯化锌,工作浓度为0.01~0.1g/L;牛血清白蛋白,工作浓度为5~10g/L;AP酶保护剂(StabilZyme AP Conjugate Stabilizer,厂家SurModics,货号SA01),工作浓度为200~500g/L;其余为纯化水。
优选地,所述R2试剂中碱性磷酸酶标记的IL-8单克隆抗体B偶联物工作浓度为1.5μg/mL。所述R2试剂稀释液的pH值为7.4±0.1,包括:Tris,工作浓度为12.0g/L;叠氮钠,工作浓度为2.0g/L;氯化钠,工作浓度为5.8g/L;氯化镁,工作浓度为0.2g/L;氯化锌,工作浓度为0.01g/L;牛血清白蛋白,工作浓度为9.5g/L;AP酶保护剂,工作浓度为400g/L;其余为纯化水。
所述磁分离试剂为商品化链霉亲和素磁珠和磁分离试剂稀释液配制成浓度为1.0~3.0mg/mL的磁微粒溶液。所述磁分离试剂稀释液pH值为7.5~9.0,包括:Tris,工作浓度为10.8~12.0g/L;叠氮钠,工作浓度11.12~12.50g/L;氯化钠,工作浓度为1.5~2.1g/L;牛血清白蛋白,工作浓度为9.5~10.5g/L;其余组分为纯化水。
优选地,所述磁分离试剂为商品化链霉亲和素磁珠和磁分离试剂稀释液配制成浓度为1.0mg/mL的磁微粒溶液。所述磁分离试剂稀释液pH值为8.0±0.1,包括:Tris,工作浓度为11.6g/L;叠氮钠,工作浓度为11.46g/L;氯化钠,工作浓度为1.8g/L;牛血清白蛋白,工作浓度为10.0g/L;其余组分为纯化水。
所述校准品和质控品为含有不同浓度IL-8抗原和含蛋白缓冲液。用来配制校准品和质控品的含蛋白缓冲液pH值为6.5~6.9,包括:MOPS,工作浓度为1.5~4.5g/L;硫酸镁,工作浓度为1.4~4.5g/L;十二水合磷酸氢二钠,工作浓度为2.1~5.2g/L,叠氮钠,工作浓度为1.0~5.0g/L;牛血清白蛋白,工作浓度为5.0~20.0g/L;海藻糖,工作浓度为10.0~30.0g/L。
所述校准品和质控品,浓度范围为0~7500pg/mL。
优选地,所述用来配制校准品和质控品的含蛋白缓冲液pH值为6.7±0.1,优选pH值为6.75,包括:MOPS,工作浓度为2.5g/L;硫酸镁,工作浓度为2.4g/L;十二水合磷酸氢二钠,工作浓度为2.8g/L,叠氮钠,工作浓度为1.8g/L;牛血清白蛋白,工作浓度为10.0g/L;海藻糖,工作浓度为20g/L。
优选地,所述校准品的不同浓度为0pg/mL、20pg/mL、100pg/mL、500pg/mL、2500pg/mL、7500pg/mL。所述质控品的不同浓度为100pg/mL和2500pg/mL。
所述化学发光底物液是摩尔浓度0.1~0.3M的碱性磷酸酶催化发光的化学发光底物液,pH值为8~10的摩尔浓度0.2M的Tris-HCl缓冲液,并含有0.2~0.4mg/mL的二氧杂环乙烷化合物(APCL)。
优选地,所述化学发光底物液是摩尔浓度为0.2M,pH值为9.3的摩尔浓度0.2M的Tris-HCl缓冲液,并含有0.3mg/mL的二氧杂环乙烷化合物(APCL)。
同时,本发明还提供了所述试剂盒的制备方法,主要包括R1试剂、R2试剂的制备方法。将生物素和碱性磷酸酶分别和IL-8单克隆抗体A和单克隆抗体B偶联,分别获得R1偶联物和R2偶联物,然后以对应的稀释液稀释,获得R1试剂和R2试剂。
生物素化的IL-8单克隆抗体A的制备流程如下:
将IL-8单克隆抗体A加入到超滤离心管中,加入PBS稀释液,充分混匀后,7500~8000rpm离心,去除上清液,再加入PBS稀释液,如此反复3~5次,取出剩下的浓缩液至EP管中并用PBS稀释液定容至2~4mg/mL。生物素与IL-8单克隆抗体A摩尔比为15:1~25:1,反应时间为30~60min,加入终止剂后室温反应10~30min,将反应液加入到超滤离心管中,加入PBS稀释液,混合均匀后,7500~8000rpm离心,去除上清液,再加入PBS稀释液,如此反复3~5次,最后取出剩下的浓缩液至EP管中并用标记通用稀释液定容至一定体积,保证终浓度在1~4mg/mL之间。再加入等体积的甘油,放入-20℃冰箱保存。
所述碱性磷酸酶标记IL-8单克隆抗体B的制备流程如下:碱性磷酸酶的处理:用标记专用稀释液将碱性磷酸酶稀释至5~10mg/mL,然后读取紫外分光光度计在280nm处的吸光值,该吸光值应该在一定的范围内。然后用Sulfo-SMCC(胺-巯基交联剂)对处理后的碱性磷酸酶进行活化处理,活化时间10~30min,碱性磷酸酶活化剂加入的量=IL-8单克隆抗体B定容体积*(30~60);
抗体的处理:将IL-8单克隆抗体B加入到超滤离心管中,加入标记通用稀释液,混合均匀后,7500~8000rpm离心,去除上清液,再加入标记通用稀释液,如此反复3~5次,最后取出剩下的浓缩液至EP管中并用标记通用稀释液定容至一定体积,保证终浓度在2~4mg/mL之间。然后用Traut’s Reagent对处理后的抗体进行活化处理,活化时间20min~60min,抗体活化剂加入的量=IL-8单克隆抗体B定容体积*(5~15);
将活化后的碱性磷酸酶和IL-8单克隆抗体B抗体按照摩尔比为(1:2)~(1:4),优选活化后的碱性磷酸酶和IL-8单克隆抗体B的摩尔比为1:(2~3)的比例,进行充分混合后放入2~8℃冰箱中,充分反应18~24小时后,加入终止液,7500~8000rpm离心,定容至1~2mL,使用标记通用稀释液平衡凝胶层析分离柱,分离纯化后得到碱性磷酸酶标记的IL-8标记抗体。
另一方面,本发明还提供了利用这种试剂盒检测人体血清中IL-8含量的方法,该试剂盒适用机型包括本司七种全自动化学发光免疫分析仪。该方法包括以下步骤:
(1)加50μL待测样本或校准品或质控品至检测管中;
(2)分别加R1试剂、R2试剂于检测管中,混合;
(3)(37±0.5)℃温育15min;
(4)加25μL磁微粒试剂至检测管中;
(5)(37±0.5)℃温育5min;
(6)加600μL清洗液至检测管中,混匀;
(7)磁分离去上清,去除未反应的物质;
(8)重复步骤6、7,两遍;
(9)加入150μL发光底物至检测管中,混匀3s;
(10)ALP催化底物发光后测定相对发光强度(RLU);
注:该检测程序由仪器自动完成。
在一定范围内RLU与IL-8抗原浓度呈正相关,通过内插法就可以从标准曲线上读取待测样本的IL-8含量。
采用本发明中的检测试剂盒测定人体血清IL-8含量时的数据可达到如下指标:
分析灵敏度为5pg/mL;
线性检测范围,10~7500pg/mL;
准确度:将NIBSC国际标准品89/520按照说明书要求处理后,用校准品稀释液配制3~5个浓度点,测试结果与理论结果相对偏差在-8%~7%之间;
精密度-分析内精密度:单次实验对高浓度质控品、低浓度质控品、高浓度血清样本、低浓度血清样本10个重复,变异系数(CV)整体在2.54%~4.87%之间,批内精密度能控制在8%以内;分析间精密度:三次实验测试这四个样本各10个重复,变异系数(CV)整体在4.28%~6.89%之间,可以看出,精密度远低于国家要求,说明本发明试剂盒在实验过程中具有很好的可重复性;
分析特异性-与添加浓度为10000pg/mL的白介素-1β、白介素-2R、白介素-6、白介素-10、肿瘤坏死因子α的交叉反应率均小于0.1%。
与现有技术相比,本发明的有益效果是:
本发明首次利用化学发光检测技术与生物素-链霉亲和素体系相结合实现了定量检测人血清样品中的IL-8含量的目的,确保了检测的灵敏度,本反应体系无污染、特异性强、操作简单、并且对样品的前处理要求低、可快速高通量检测大批量样本,为临床检测人血清中的IL-8提供了一种更准确、精确、方便、快捷和简单的方法。
与异硫氰酸荧光素(FITC)-抗FITC抗体体系相比,相同的稀释液体系下,本申请的生物素-链霉亲和素系统检测白介素IL-8的稳定性更好,对光照不敏感,避免采用异硫氰酸荧光素(FITC)-抗FITC抗体体系配制的试剂盒,由于因其对光较敏感,随着试剂开瓶时间的延长,其信号值越来越低,而导致稳定性不好的问题,便于临床试剂应用。本申请采用的是商品化的磁珠,它是偶联了链霉亲和素的亲水性磁珠,可以抑制蛋白质、核酸等对于磁珠表面的非特异性吸附,故能够从样品中对生物素标记的分子进行高纯度的特异性回收,利用这种商品化的磁珠进行实验,增强了抗原抗体反应度。
本发明中R2试剂的稀释液中增加不同种类的盐离子,多种盐类加一起对R2试剂这种酶结合物的活性保存效果更好,多种盐的加入增强了体系离子强度,同时引入AP酶保护剂使得对于白介素IL-8这一检测对象能够使体系更加稳定,降低体系背景值,提高试剂盒的灵敏度,也保证试剂盒在效期末的时候各项性能指标和样本测试的准确性。
另外本发明体系采用碱性磷酸酶标记抗体,生物素标记抗体,以偶联链霉亲和素的超顺磁性微粒作为分离试剂,碱性磷酸酶催化底物发光后,通过仪器测量发光强度,实现了对IL-8有效测定的目的。
本发明制备方法中,生物素化的IL-8单克隆抗体A和碱性磷酸酶标记IL-8单克隆抗体B的制备流程中各反应时间、活化剂加入量、摩尔比的控制等对于实现稳定性高精确检测具有重要作用,如抗体活化剂加入太少不利于抗体活化的效率,加入太多的话抗体化学键打开的太彻底导致抗体自身发生交联,从而影响抗体与酶的结合,最终影响后续整个反应强度即发光值的大小。
附图说明
图1为本发明中IL-8测定试剂盒的校准品浓度-发光值标准曲线图;
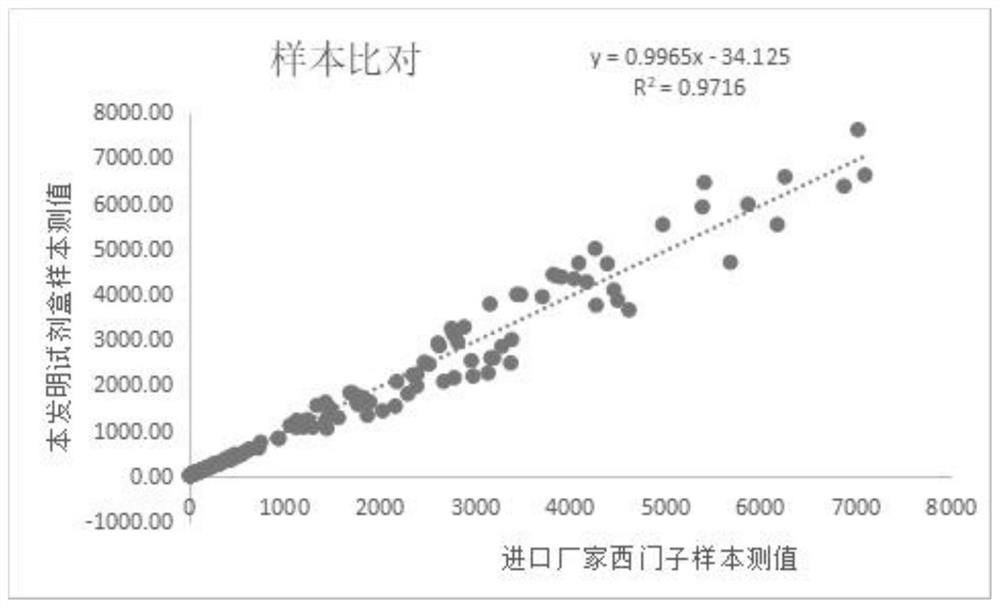
图2为本发明中IL-8测定试剂盒样本测值与进口检测试剂盒样本测试的方法学比对图。
具体实施方式
下面结合附图和实施例对本发明做具体说明,但并不以此作为对本申请保护范围的限定。
实施例1:
一、配制各种缓冲液及稀释液,具体如下:
1、校准品用含蛋白缓冲液的配制
取干燥洁净的烧杯,去皮称重,加入500g的纯化水,随后依次加入2.5g的MOPS、2.4g的硫酸镁、2.8g的十二水合磷酸氢二钠、1.8g的叠氮钠、10.0g的牛血清白蛋白、20g的海藻糖,充分搅拌至完全溶解,用盐酸或者氢氧化钠调整pH为6.7,纯化水定容至1L,再复测pH,要求pH在6.7±0.1之间。
2、R1试剂稀释液的配制
取干燥洁净的烧杯,去皮称重,加入500g的纯化水,随后依次加入12.1g的Tris、0.5g的叠氮钠、6.0g的氯化钠、9.5g的牛血清白蛋白、0.8g的甲基纤维素,充分搅拌至完全溶解,用盐酸或者氢氧化钠调整pH为7.4,纯化水定容至1L,再复测pH,要求pH在7.4±0.1之间。
3、R2试剂稀释液的配制
取干燥洁净的烧杯,去皮称重,加入500g的纯化水,随后依次加入12.0g的Tris、2.0g的叠氮钠、5.8g的氯化钠、9.5g的牛血清白蛋白、0.2g氯化镁、0.01g氯化锌、400g的AP酶保护剂,充分搅拌至完全溶解,用盐酸或者氢氧化钠调整pH为7.4,纯化水定容至1L,再复测pH,要求pH在7.4±0.1之间。
4、磁微粒试剂稀释液
取干燥洁净的烧杯,去皮称重,加入500g的纯化水,随后依次加入11.6g的Tris、11.46g的叠氮钠、1.8g的氯化钠、10.0g的牛血清白蛋白,充分搅拌至完全溶解,用盐酸或者氢氧化钠调整pH为8.0,纯化水定容至1L,再复测pH,要求pH在8.0±0.1之间。
5、发光底物缓冲液
配制摩尔浓度为0.2M的Tris-HCl缓冲液,pH值为9.3±0.1之间。
二、IL-8测定试剂盒的制备
1、校准品和质控品的制备如下:
对于外购的IL-8抗原,加入0.5mL纯化水复溶,充分混匀后得到抗原浓缩液,用校准品含蛋白缓冲液溶解该抗原浓缩液配制一定浓度的校准品和质控品。
校准品一共6个浓度水平,分别为0pg/mL、20pg/mL、100pg/mL、500pg/mL、2500pg/mL、7500pg/mL。
质控品一共2个浓度水平,分别为100pg/mL和2500pg/mL。
2、R1试剂的制备如下:
将与IL-8单克隆抗体A加入到超滤离心管中,加入PBS稀释液,混合均匀后,7800rpm离心,去除上清液,再加入PBS稀释液,如此反复4次,最后取出剩下的浓缩液至EP管中并用PBS稀释液定容至3mg/mL。生物素与与IL-8单克隆抗体A摩尔比选择20:1,反应时间为30min,加入终止剂后室温反应10min,将反应液加入到超滤离心管中,加入PBS稀释液,混合均匀后,7800rpm离心,去除上清液,再加入PBS稀释液,如此反复4次,最后取出剩下的浓缩液至EP管中并用标记通用稀释液定容至2mg/mL。再加入等体积的甘油,放入-20℃冰箱保存。
由上得到的R1偶联物加入到R1试剂稀释液中,配制浓度为1μg/mL,充分混匀得到R1试剂。
3、R2试剂的制备如下:
碱性磷酸酶的处理:用标记专用稀释液将碱性磷酸酶稀释至5mg/mL,然后读取紫外分光光度计在280nm处的吸光值。然后用Sulfo-SMCC对处理后的碱性磷酸酶进行活化处理,活化时间20min,碱性磷酸酶活化剂加入的量=IL-8单克隆抗体B定容体积*50;
抗体的处理:将IL-8单克隆抗体B加入到超滤离心管中,加入标记通用稀释液,混合均匀后,7800rpm离心,去除上清液,再加入标记通用稀释液,如此反复4次,最后取出剩下的浓缩液至EP管中并用标记通用稀释液定容至3mg/mL。然后用Traut’s Reagent对处理后的IL-8单克隆抗体B进行活化处理,活化时间30min,抗体活化剂加入的量=抗体定容体积*10;
将活化后的碱性磷酸酶和IL-8单克隆抗体B按照摩尔比为1:3的比例进行充分混合后放入2~8℃冰箱中,充分反应18小时后,加入终止液,7800rpm离心,定容至2mL,使用标记通用稀释液平衡凝胶层析分离柱,分离纯化后得到碱性磷酸酶标记的IL-8标记抗体。
由上得到的R2偶联物加入到R2试剂稀释液中,配制浓度为1.5μg/mL,充分混匀得到R2试剂。
4、磁分离试剂的制备如下:
充分混匀商品化链霉亲和素磁珠后,加入到磁分离试剂稀释液中,配制浓度为1mg/mL,充分混匀得到磁分离试剂。
5、发光底物的制备如下:
取一定量的二氧杂环乙烷化合物(APCL)加入到0.2M的Tris-HCl中,配制浓度为0.3mg/mL,充分混匀,验证pH值为9.3。
6、将配制好的校准品、质控品、R1试剂、R2试剂、磁分离试剂、发光底物按照装量要求独立分装到合适的试剂瓶中,包括校准品、质控品、R1试剂、R2试剂、磁分离试剂在内即可得到IL-8测定试剂盒。
三、本实施例制备的试剂盒性能评价结果
通过四参数非线性拟合校准品目标浓度值和发光强度(RLU)获得标准曲线的四参数方程,标准曲线如图1所示,其中,横轴代表校准品的浓度值,纵轴代表发光强度(RLU)。
1、性能指标测试结果
为了考察本发明中IL-8测定试剂盒的稳定性、灵敏度和重复性,本实施例中涉及了三批不同时间生产的试剂盒,大体反应条件相同,均考察了曲线相关系数、分析灵敏度、准确度、批内精密度、批间精密度指标,挑选第一批进行加速稳定性和机载稳定性跟踪,考察结果分别如表1和表2。
表1:IL-8测定试剂盒性能指标测试结果汇总表
表2:IL-8测定试剂盒机载稳定性测试结果汇总表
批内精密度和批间精密度-分别对高浓度质控品、低浓度质控品测试10个重复,变异系数(CV)均在8%范围内,可以看出,精密度远低于国家要求,说明本发明试剂盒在实验过程中具有很好的可重复性;
分析特异性-与添加浓度为10000pg/mL的白介素-1β、白介素-2R、白介素-6、白介素-10、肿瘤坏死因子α的交叉反应率均小于0.1%。
质控品在28天内目标偏差均控制在±20%以内,说明试剂盒机载稳定性较好,减少了后期定标操作。
可以看出曲线相关系数、分析灵敏度、准确度、批内精密度、批间精密度、机载稳定性和加速稳定性都符合要求,说明本发明的试剂盒有较好的稳定性、灵敏度和重复性。
2、本发明测定试剂盒与西门子检测试剂盒检测结果的比对如下:
选取180份有西门子测值的临床血清样本,以参考值62pg/mL为截断,高于62pg/mL的样本有138例,低于62pg/mL的样本有42例,对180例样本进行线性回归分析,可以得到回归方程y=0.9965x-34.125,R
3、采用本发明测定试剂盒参考区间确定过程:
测试200例健康个体,该群体无类风湿性关节炎、银屑病、特发性肺纤维化等相关疾病。对实验过程中的200例血清样本用MedCalc进行了正态性验证,及百分位数计算。
D'Agostino-Pearson test正态性检验,P<0.05,可以认为该数据不属于正态分布。对于不属于正态分布的数据,应用百分位数(PERCENTILE),返回数组的K百分比数值点计算正常值范围,本试剂盒K值定为95%。采用本发明中的IL-8测定试剂盒,严格按照产品说明书要求进行操作K值为95%的血清中IL-8含量≤62.6pg/mL。
可以看出,本发明中的IL-8测定试剂盒灵敏度高、线性范围宽、稳定性好,可与我司全自动化学发光免疫分析仪配合使用,临床样本测试结果跟进口厂家西门子测试结果的相关性较好。
本发明提供的人体血清中IL-8含量的磁微粒化学发光检测试剂盒可以与全自动化学发光分析仪联用,操作步骤极大简化,加大了检测速度和检测通量,提高了检测效率,同时避免了人为操作导致的误差。
所属领域的普通技术人员应当理解:以上任何实施例的讨论仅为示例性的,并非旨在暗示本发明的范围(包括权利要求)被限于这些例子;在本发明的思路下,以上实施例或者不同实施例中的技术特征之间也可以进行组合,并存在如上所述的本发明的不同方面的许多其它变化,为了简明它们没有在细节中提供。因此,凡在本发明的精神和原则之内,所做的任何省略、修改、等同替换、改进等,均应包含在本发明的保护范围之内。
本发明未述及之处适用于现有技术。
- 测定人体血清中白介素-8含量的磁微粒化学发光试剂盒
- 测定人体胃泌素G17含量的磁微粒化学发光检测试剂盒
