浓度梯度微流控芯片及其应用
文献发布时间:2023-06-19 18:29:06
技术领域
本申请属于浓度梯度微流控芯片技术领域,涉及一种浓度梯度微流控芯片及其应用,尤其涉及一种三维细胞微球培养—药物筛选一体化的浓度梯度微流控芯片。
背景技术
药物开发包括药物临床前研究阶段和临床研究阶段。药物临床前研究均在细胞分子水平或动物模型上进行,其研究结果可推断化学物质对人体的可能影响,从而指导临床试验。而如今药物开发过程中临床试验失败率很高,为了显著降低临床试验的失败率和体外模型制备的相关成本,有必要开发更好的药物预测平台来进行药物筛选。
传统的药物筛选多采用体外二维静态培养模式和实验动物培养模型来筛选药物。二维静态培养模式不能模拟体内细胞复杂的三维微环境和细胞外基质的支持,无法长期维持细胞形态及功能,阻止了正常的细胞行为和对被测药物的反应。临床前实验动物培养模型虽考虑了体内环境的影响,但成本高、培养周期长、涉及伦理等问题,还存在种属差异,无法准确预测药物在人体内的毒副作用。
药物筛选时采用的传统多孔板技术,需经历配制和分配药物不同浓度溶液的复杂操作,样本、试剂消耗大,存在浓度偏差,无法进行高通量删选。浓度梯度芯片可通过改变网络通道构型设计、初始液流的浓度和组合顺序,在耗液量极低的情况下,即可获得一系列精准复杂的浓度梯度。且在浓度梯度芯片中,流体主要做层流流动,当两种或多种不同试剂流入同一通道时,各试剂能够保持各自流型不变,而只在相与相接触面上发生反应或分子扩散现象,从而使得形成的浓度梯度具有较高的稳定性和重现性。但经典的“树枝状”浓度梯度芯片,因其产生的线性药物浓度梯度和狭窄的浓度范围限制了该类芯片在药物筛选中的应用。
发明内容
本申请的主要目的旨在提供一种能够更好地在体外模拟体内细胞行为以进行药物筛选的浓度梯度微流控芯片,其构建了三维细胞微球培养和药物筛选一体化的结构。
本申请的另一目的旨在提供一种上述浓度梯度微流控芯片的应用。
为了实现上述目的,本申请提供以下技术方案:
作为第一方面,本申请涉及一种浓度梯度微流控芯片,包括依次叠放的顶层芯板、中间芯板及底层芯板,所述中间芯板与底层芯板之间形成有三维细胞微球培养空间及药物流动通道,所述三维细胞微球培养空间及药物流动通道之间连通,所述顶层芯板设有微球注入孔及药物注入孔,所述微球注入孔与所述三维细胞微球培养空间连通,所述药物注入孔与所述药物流动通道连通;
所述药物流动通道包括分流通道、环形流道及药物流出道,所述分流通道由内向外至少同心设置两组,所述环形流道设于相邻的两组分流通道之间,且位于同一所述环形流道外侧的分流通道的数量大于位于该环形流道内的分流通道的数量,所述药物流出道与位于最外侧的分流通道一一对应设置。
进一步设置:所述环形流道由内向外同心设置三圈,所述分流通道以三圈环形流道间隔地设置四组,且四组所述分流通道的数量由内向外呈倍数依次递增。
进一步设置:所述微球注入孔及药物注入孔设于所述顶层芯板的顶面,所述顶层芯板的底面设有与所述微球注入孔连通的微球注入通道,所述微球注入通道的末端设置掉球孔,所述中间芯板的顶面对应设置落球孔,所述落球孔与中间芯板和底层芯板之间形成的三维细胞微球培养空间连通。
进一步设置:所述微球注入通道包括注入主通道、注入次通道及注入分通道,所述注入主通道的始端与微球注入孔连通,其末端分流形成两条所述注入次通道,两条所述注入次通道的末端再分流形成两条注入分通道,每条所述注入分通道的末端一一对应设置所述掉球孔。
进一步设置:所述中间芯板的底面及底层芯板的顶面设有正对设置的分流通道、环形流道、药物流出道及三维细胞微球培养槽,所述中间芯板底面及底层芯板顶面的分流通道、环形流道、药物流出道合并对接构成药物流动通道,所述中间芯板底面及底层芯板顶面的三维细胞微球培养槽构成三维细胞微球培养空间。
进一步设置:所述药物注入孔以顶层芯板的中心为对称地设置两个,且两个所述药物注入孔贯通所述顶层芯板,所述中间芯板顶面设有与所述药物注入孔对接的药物导入孔,所述药物导入孔与中间芯板底面位于最内圈的分流通道始端连通,且位于最内圈的分流通道一一对应两个药物注入孔设置两条分流通道。
进一步设置:所述中间芯板的药物流出道与三维细胞微球培养槽连通,所述底层芯板顶面的药物流出道与三维细胞微球培养槽之间设有在两者间形成限制细胞微球通过的限流通道的门槛结构。
进一步设置:所述分流通道设置为弯曲通道。
进一步设置:所述顶层芯板及中间芯板上均开设有连通至所述药物流出道末端的药物流出孔。
作为第二方面,本申请涉及一种如上所述的浓度梯度微流控芯片的应用,其包括在药物筛选或者细胞微球培养中的应用。
进一步设置,上述在药物筛选中的应用包括以下步骤:
对所述浓度梯度微流控芯片进行消毒灭菌处理;
往所述浓度梯度微流控芯片注入直径为200μm-300μm的三维肝细胞微球;
往所述浓度梯度微流控芯片注入药剂;
待药剂作用预设时间后,检测各个三维细胞微球培养空间中的细胞活性、细胞微球的三维排列及功能表达情况、细胞基因表达及代谢产物成分的数据;
根据上述数据来筛选目标浓度的药剂。
相比现有技术,本申请的方案具有以下优点:
1.在本申请的浓度梯度微流控芯片中,将三维细胞微球培养和药物筛选集成于一体,构建了类体内的动态微环境,能够保留三维细胞结构,更好地模拟体内细胞行为功能,提高药物敏感以进行药物筛选,使得所得药筛结果更为准确可靠。
2.在本申请的浓度梯度微流控芯片中,采用环形的浓度梯度形成结构,不仅扩大了浓度梯度形成范围,克服了经典的“树枝状”浓度梯度芯片产生线性浓度梯度和所产生的浓度范围狭窄的缺陷,同时还可根据实际需要,通过改变浓度梯度形成的环形圈数和初始注入药物浓度,获得所需的一系列复杂浓度梯度,简化了人工配制溶液浓度的一些列复杂操作,减少了人力消耗,降低了样品和试剂的损耗,削减了药物开发成本,大大提高了药物筛选的准确度和效率。
本申请附加的方面和优点将在下面的描述中部分给出,这些将从下面的描述中变得明显,或通过本申请的实践了解到。
附图说明
本申请上述的和/或附加的方面和优点从下面结合附图对实施例的描述中将变得明显和容易理解,其中:
图1为本申请浓度梯度微流控芯片的顶层芯板的顶面示意图;
图2为本申请浓度梯度微流控芯片的顶层芯板的底面示意图;
图3为本申请浓度梯度微流控芯片的中间芯板的顶面示意图;
图4为本申请浓度梯度微流控芯片的中间芯板的底面示意图;
图5为本申请浓度梯度微流控芯片的底层芯板的顶面示意图;
图6为本申请浓度梯度微流控芯片的底层芯板用于示意门槛结构的示意图。
具体实施方式
下面详细描述本申请的实施例,所述实施例的示例在附图中示出,其中自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过参考附图描述的实施例是示例性的,仅用于解释本申请,而不能解释为对本申请的限制。
针对目前三维细胞微球维持培养及药物筛选的问题,本申请提供了一种浓度梯度微流控芯片,具体涉及一种三维细胞微球培养—药物筛选一体化的浓度梯度微流控芯片,其通过将三维细胞微球培养和药物筛选集成于一体,来构建与体内相类似的动态微环境,保留了完整的三维细胞结构,从而能够更好地模拟体内细胞行为,提高药物敏感以进行药物筛选。
请结合图1至图6,所述浓度梯度微流控芯片包括从上到下依次叠放的顶层芯板1、中间芯板2及底层芯板3,所述中间芯板2与底层芯板3之间形成有三维细胞微球培养空间及药物流动通道,所述三维细胞微球培养空间及药物流动通道相互连通。所述顶层芯板1上设有与所述三维细胞微球培养空间连通的微球注入孔11,所述顶层芯板1上亦设有与所述药物流动通道连通的药物注入孔12,通过所述微球注入孔11和药物注入孔12分别将细胞和药物注入到中间芯板2和底层芯板3之间构成的三维细胞微球培养空间和药物流动通道中。
具体地,所述微球注入孔11及药物注入孔12设于所述顶层芯板1的顶面,所述微球注入孔11位于所述顶层芯板1的中心位置,所述顶层芯板1的底面设有微球注入通道13,且在所述微球注入通道13的末端设置掉球孔14,所述掉球孔14沿圆周方向设置多个。
优选地,本实施例的掉球孔14沿圆周方向设置有十六个,所述微球注入孔11与掉球孔14之间设置四组微球注入通道13,每组所述微球注入通道13呈“树枝状”设置,具体包括注入主通道131、注入次通道132及注入分通道133,所述注入主通道131的始端与微球注入孔11连通,其末端分流形成两条所述注入次通道132,两条所述注入次通道132的末端再分别分流形成两条注入分通道133,即每组所述微球注入通道13包含有四条注入分通道133,四组所述微球注入通道13的注入分通道133能够一一对应于十六个掉球孔14设置。
所述药物注入孔12以位于顶层芯板1中心的微球注入孔11为对称中心设置两个,所述药物注入孔12贯通顶层芯板1,所述中间芯板2的顶面设有两个与顶层芯板1的药物注入孔12对接的药物导入孔25,所述药物导入孔25与位于中间芯板2与底层芯板3之间的药物流动通道连通。同时,在所述中间芯板2的顶面亦设有十六个沿圆周方向设置并与顶层芯板1的十六个掉球孔14一一对应的落球孔26,所述落球孔26与位于中间芯板2与底层芯板3之间的三维细胞微球培养空间连通。
所述药物流动通道包括分流通道、环形流道及药物流出道,本申请的分流通道、环形流道及药物流出道是由中间芯板2底面设置的分流顶槽21、环形顶槽22、药物流出顶槽23和底层芯板3顶面设置的分流底槽31、环形底槽32、药物流出底槽33对接合成,其中,所述分流通道至少设置两组,所述环形流道设于相邻的两组分流通道之间,且位于同一所述环形流道外侧的分流通道的数量大于位于该环形流道内的分流通道的数量,所述药物流出道与位于最外侧的分流通道一一对应设置。
具体地,本申请的环形流道设置由内向外直径依次增大的三圈,且三圈环形流道同心设置,对应地,本实施例的分流通道间隔地对应三圈环形流道设置四组,且四组所述分流通道的数量由内向外呈倍数递增。
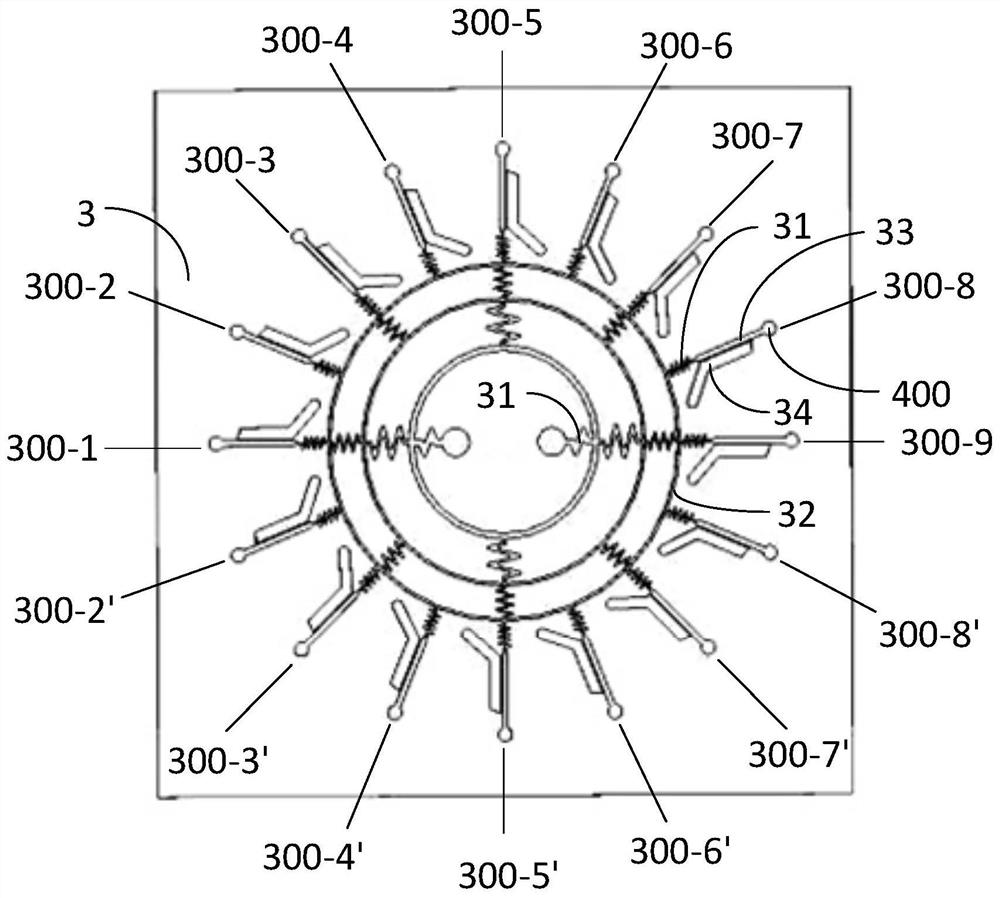
进一步地,本实施例的四组分流通道的数量由内向外呈二倍数进行递增,且每组分流通道按圆周方向均布。其中,位于最内圈的分流通道对应两个药物导入孔25设置两条;位于次内圈的分流通道设置四条,其中两条次内圈的分流通道对应于最内圈的两条分流通道的液体流动方向相同;位于次外圈的分流通道设置八条,其中四条次外圈的分流通道对应于次内圈的四条分流通道的液体流动方向相同;位于最外圈的分流通道设置十六条,其中最外圈的八条分流通道对应于次外圈的八条分流通道的液体流动方向相同,同时,所述药物流出道一一对应于最外圈的十六条分流通道设置十六条,即请结合图5,本实施例的分流通道以最内圈的两个分流通道的连线为中心线对称设置,则可将本实施例的十六个药物流出道以最内圈的两个分流通道的连线为中心线划分为对称的两组,并分别标记为300-1、300-2、300-3、300-4、300-5、300-6、300-7、300-8、300-9和300-1’、300-2’、300-3’、300-4’、300-5’、300-6’、300-7’、300-8’、300-9两组,其中两组药物流出道均以300-1和300-9作为端点。
已知按照浓度梯度微流控芯片中的流体流动原理,在微流控芯片通道网络中,流体主要做层流流动,当存在两种或多种不同试剂进入同一通道时,各试剂能够保持各自的流型不变,而旨在相与相接触面上发生反应或分子扩散现象,形成的浓度梯度具有较高的稳定性和重现性,且通过改变通道网络的构型设计及初始液流的浓度和组合顺序,可以获得系列的浓度梯度。从而可以利用微流控浓度梯度芯片来模拟外界环境,建立化学物质浓度梯度,以在细胞以及个体水平上研究生物体对外界环境变化的反应。
因此,本申请将两种不同的药剂分别从两个所述药物注入孔12经过所述药物导入孔25输入到位于最内圈的两条分流通道中,随后药剂进入到内圈的环形流道,再通过内圈的环形流道分别输入至位于次内圈的不同分流通道中,药剂在输入分流通道时发生接触混合,而位于次内圈在原流动方向的分流通道仍保持与最内圈的分流通道相同的流体浓度不便并继续向前。依据上述规律,药剂流体由内向外经过多圈稀释混合后,最后在每组药物流出道形成顺序递增或递减的9个浓度梯度,再作用于与各浓度梯度的药物流出道连通的三维细胞微球培养槽,从而能够构建含有不用浓度梯度药剂的三维细胞培养空间。
并且由上述浓度梯度芯片内流体流通的规律可知,药物流出道300-1、300-2、300-3、300-4、300-5、300-6、300-7、300-8、300-9与药物流出道300-1’、300-2’、300-3’、300-4’、300-5’、300-6’、300-7’、300-8’、300-9形成了相互对称的浓度梯度。
需要说明的是,本申请的浓度梯度微流控芯片能够根据实际需要,可通过改变环形流道的圈数、分流通道的条数及初始注入的药物浓度,从而获得所需的一系列复杂的浓度梯度。
所述三维细胞微球培养空间一一对应于所述药物流出道设置,所述三维细胞微球培养空间是由中间芯板2底面设置的三维细胞微球培养顶槽24和底层芯板3顶面设置的三维细胞微球培养底槽34对接合成的三维立体框,所述中间芯板2底面的三维细胞微球培养顶槽24与对应的药物流出道连通,而底层芯板3的三维细胞微球培养底槽34与其对应的药物流出道之间设置门槛结构35,从而可在三维细胞微球培养空间与药物流出道之间形成限制三维细胞微球培养空间中的细胞进入药物流出道的限流通道,所述药物流出道的药剂可通过限流通道进入到三维细胞微球培养空间中。
具体地,本实施例进行直径为200μm-300μm的三维细胞微球的培养,由中间芯板2底面的三维细胞微球培养顶槽24和底层芯板3顶面设置的三维细胞微球培养底槽34对接合成的三维细胞微球培养空间的高度为0.3mm,底层芯板3的三维细胞微球培养底槽34与其对应的药物流出道之间设置的门槛结构35的高度为0.15mm,因受到0.15mm门槛结构35的限制,所述限流通道的宽度为0.15mm,从而能将进入到三维细胞培养空间的直径为200μm-300μm的三维细胞微球束缚在培养空间内而不会溢出到药物流出道中。
此外,所述顶层芯板1及中间芯板2上均开设有连通至所述药物流出道末端的药物流出孔400,可通过药物流出孔400将浓度梯度微流控芯片内的药剂排出或进行药剂的替换更新。
因此,基于上述浓度梯度微流控芯片的结构,本申请的浓度梯度微流控芯片可应用于药物筛选或者细胞微球培养。
其中,本申请浓度梯度微流控芯片在药物筛选中应用包括以下步骤:
首先,对所述浓度梯度微流控芯片进行消毒灭菌处理。
其次,往所述浓度梯度微流控芯片注入三维肝细胞微球,本实施例选择直径为200μm-300μm的三维细胞微球进行培养。即本申请的浓度梯度微流控芯片在进行药物筛选的同时,可同步进行直径为200μm-300μm的三维细胞微球的细胞微球培养的应用,针对三维细胞微球在芯片不同位置的三维细胞微球培养空间中的培养情况来获取培养细胞微球的药物最佳培养浓度。
具体地,从顶层芯板1中心的微球注入孔11注入三维肝细胞微球,肝细胞微球悬液注入微球注入孔11后,分别通过与微球注入孔11相连通的微球注入通道13流向四周,并在所述微球注入通道13末端的掉球孔14受重力的影响下往下一层掉落,经过中间芯板2的落球孔26进入到中间芯板2与底层芯板3之间的三维细胞微球培养空间中。
随后,往所述浓度梯度微流控芯片注入药剂。
通过注射器搭配微量注射泵分别从顶层芯板1的两个药物注入孔12持续同步注入由培养基稀释的两种不同浓度的药剂稀释液,即从药物注入孔12注入药物浓度为“0”的药剂稀释液,从药物注入孔12注入药物浓度为“1”的药剂稀释液,药剂稀释液分别经过分流通道和环形流道分流至十六个药物流出道中,而两种不同浓度的药物稀释剂经过多圈稀释混合后,最后在分流通道末端的药物流出道形成沿顺时针或逆时针方向的浓度梯度,具体为药物流出道300-1、300-2、300-3、300-4、300-5、300-6、300-7、300-8、300-9依次形成药物浓度为“0”、“0.125”、“0.25”、“0.375”、“0.5”、“0.625”、“0.75”、“0.875”、“1”的9个浓度梯度,相应地,与其对称的药物流出道300-1’、300-2’、300-3’、300-4’、300-5’、300-6’、300-7’、300-8’、300-9的药物浓度亦形成了“0”、“0.125”、“0.25”、“0.375”、“0.5”、“0.625”、“0.75”、“0.875”、“1”的9个浓度梯度,不同浓度的药剂稀释液分别作用于与药物流出道相连的三维细胞微球培养槽内的三维肝细胞微球。
待药剂作用预设时间后,检测各个三维细胞微球培养空间中的细胞活性、细胞微球的三维排列及功能表达情况、细胞基因表达及代谢产物成分的数据。
本实施例设定培养时间为48-72小时,具体可通过CCK-8或者其他细胞活性检测试剂盒测定细胞活性,通过特定的细胞免疫荧光染色观察细胞微球的三维排列及功能表达情况,利用qRT-PCR、western blot、ELISA等方式检测细胞基因表达及代谢产物成分。
最后,根据上述数据来筛选目标浓度的药剂,待三维细胞培养基药物筛选完毕后,通过药物流出孔400将所述浓度梯度微流控芯片中的药物排出。
综上,本申请提供的浓度梯度微流控芯片集三维细胞微球培养和药物筛选于一体,能够在体外更为仿生地维持细胞体内的状态及功能,使得所得药筛结果更为准确可靠。并且,本申请的浓度梯度微流控芯片采用环形的浓度梯度形成结构,不仅扩大了浓度梯度形成范围,克服了经典的“树枝状”浓度梯度芯片产生线性浓度梯度和所产生的浓度范围狭窄的缺陷,同时还可根据实际需要,通过改变浓度梯度形成的环形圈数和初始注入药物浓度,获得所需的一系列复杂浓度梯度,简化了人工配制溶液浓度的一些列复杂操作,减少了人力消耗,降低了样品和试剂的损耗,削减了药物开发成本,大大提高了药物筛选的准确度和效率。
值得注意的是,本申请提供的浓度梯度微流控芯片所起的作用包括但不限于如实施例中实现的对肝细胞作用药物的筛选,还可用于其他类型细胞的三维细胞微球培养和药物筛选,前文所述的从两药物浓度注入孔分别注入的药物可以是不同种浓度的同种药物,也可是各自浓度的两种药物或者多种不同种药物匹配而成的两个药物体系,而药物包括一般意义的药物,也包括化学意义上的广义的试剂,即凡可对细胞产生影响的物质均可利用本发明的浓度梯度芯片进行研究。
以上所述仅是本申请的部分实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本申请原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本申请的保护范围。
