一种酶法合成2-氨基阿糖腺苷的方法
文献发布时间:2024-04-18 19:58:21
技术领域
本发明属于生物转化技术领域,特别涉及一种酶法合成2-氨基阿糖腺苷的方法。
背景技术
2-氨基阿糖腺苷是由阿拉伯糖与2-氨基腺嘌呤连接形成的核苷类似物,它是抗白血病药物氟达拉滨(Fludarabine)的重要中间体。氟达拉滨对B-细胞慢性淋巴细胞白血病(CLL)疗效显著,特别是对常规治疗方案失效的患者有效。此外,2-氨基阿糖腺苷还可以作为医药中间体,用于合成奈拉滨等药物。2-氨基阿糖腺苷还对于医药研究、生物研究和药物合成研究具有重要的意义,国内外的需求量较大。
目前,2-氨基阿糖腺苷的制备方法主要有以下两类:
第一类采用化学法合成。申请号为201510355848.0的专利中,报道了一种制备2-氨基阿糖腺苷的方法。该法以阿糖腺苷为主要原料用苯甲酰氯保护腺嘌呤的6-氨基(收率约90%)后,用三氟乙酸酐保护阿拉伯糖的2、3、5-位羟基,并将腺嘌呤的2-硝基化(收率约80%),最后在氨饱和的甲醇溶液中完成2-氨基阿糖腺苷的合成(收率约80%)。该法共需要三步反应,且每次反应完毕后都需要吧产品提取、精制,而后才能进行下一步反应,工艺较为复杂,三废产量较高,三步反应的综合收率也仅有57.6%。专利号为4210745的美国专利中,报道了以乙酰基保护的2,6-二氨基嘌呤和1-氯-2,3,5-三-O-苄基阿拉伯糖为主要原料,经催化剂催化缩合、钯碳催化脱苄基、异构体分离等反应后,获得2-氨基阿糖腺苷。该法使用的1-氯-2,3,5-三-O-苄基阿拉伯糖的制备过程复杂、性质不稳定、价格较高,此外,为了获取高手性纯度的终产品,还需要增加了异构体分离的步骤,收率低、成本较高。Hansske等(Hansske F.et al.Tetrahedron 1984,40,125-135)以3’,5’-硅醚保护2’-羰基核苷后,而后经硼氢化钠还原得到目标产物。但这种方法使用1,3-二氯-1,1,3,3-四异丙基二硅烷为保护剂,其价格较为昂贵。Muraoka等(Muraoka M.et al.Chem Pharm Bull,1986,34,2609-2613;Muraoka M.Chem Pharm Bull 1981,29,3449-3454)人则以2-氨基腺苷为主要原料,经9步反应以1.8%的收率可获得2-氨基阿糖腺苷。上述化学合成法制备2-氨基阿糖腺苷的方法存在路线长、反应时间长、原材料价格高、有异构体产生、分离困难、收率低、反应条件苛刻、有机溶剂用量大等诸多缺陷。
第二类方法为生物合成法。用该法生产2-氨基阿糖腺苷的案例较少,Krenitsky等人(Krenitsky T A et al.Carbohydrate Res,1981,97,139-146)报道了以微生物转化合成2-氨基阿糖腺苷的案例,但该反应使用野生微生物发酵,产品生产时的产率不稳定,且发酵周期长、催化周期也超过70小时,产品转化率也仅有70%。尽管采用生物合成法生产阿糖腺苷的案例较多,但这些反应存在如下缺陷:1.产品收率为70%~85%之间;2.2-氨基腺嘌呤并不是自然界存在的碱基,也不是酶的天然底物,因此酶催化合成2-氨基阿糖腺苷时的效率低。
发明内容
本发明针对现有技术中存在的技术问题,提供一种酶法合成2-氨基阿糖腺苷的方法,将原料、酶溶解在同一反应体系中,利用活性好、耐高温的嘧啶核苷磷酸化酶突变体催化底物转化,然后以嘌呤核苷磷酸化酶的协同作用使可逆反应向正向向进行,消除逆反应的发生,2-氨基阿糖腺苷的转化率可达90%以上。
本发明采用的技术方案是:一种酶法合成2-氨基阿糖腺苷的方法,使用阿糖尿苷和2-氨基腺嘌呤为原料,在同一反应体系中完成如下两个反应:反应一,嘧啶核苷磷酸化酶(PyNP)催化的阿糖尿苷与磷酸反应生成阿拉伯糖-1-磷酸和尿嘧啶;反应二,嘌呤核苷磷酸化酶(PNP)催化的阿拉伯糖-1-磷酸和2-氨基腺嘌呤反应生成2-氨基阿糖腺苷。
反应一和反应二的反应式分别为:
进一步的,嘧啶核苷磷酸化酶来源于Shewanella oneidensis,或其耐高温、催化活性更强的的突变体,其氨基酸序列如SEQ ID NO 31所示;
嘌呤核苷磷酸化酶来源于土壤中分离的Thermoclostridium属微生物或Thermoclostridium caenicola,该酶耐高温、对于2-氨基腺嘌呤催化活性较强,其氨基酸序列如SEQ ID NO 32、SEQ ID NO29所示。
进一步的,嘧啶核苷磷酸化酶采用其他尿苷磷酸化酶时,也可获得收率不一的2-氨基阿糖腺苷,其他尿苷磷酸化酶的氨基酸序列如SEQ ID NO 1、SEQ ID NO 2、SEQ ID NO3、SEQ ID NO 4、SEQ ID NO 5、SEQ ID NO 6、SEQ ID NO 7、SEQ ID NO 8、SEQ ID NO 9、SEQID NO 10、SEQ ID NO 11所示。
进一步的,嘌呤核苷磷酸化酶采用其他嘌呤核苷磷酸化酶时,也可获得收率不一的2-氨基阿糖腺苷,其他嘌呤核苷磷酸化酶的氨基酸序列如SEQ ID NO 12、SEQ ID NO 13、SEQ ID NO 14、SEQ ID NO 15、SEQ ID NO 16、SEQ ID NO 17、SEQ ID NO 18、SEQ ID NO19、SEQ ID NO 20、SEQ ID NO 21、SEQ ID NO 22、SEQ ID NO 23、SEQ ID NO 24、SEQ ID NO25、SEQ ID NO 26、SEQ ID NO 27、SEQ ID NO 28、SEQ ID NO 30所示。
表1嘧啶核苷磷酸化酶及其催化反应的底物剩余比例表
从表1所示不同嘧啶磷酸化酶中,筛选耐热性较强、催化阿糖尿苷磷酸化效率较高的酶。当用这些嘧啶磷酸化酶催化反应一所示的阿糖尿苷的磷酸化反应时,底物剩余不一。来源于Parageobacillus thermoglucosidasius、Streptococcus pyogenes和Shewanellaoneidensis的嘧啶磷酸化酶底物剩余较少。其中,Shewanella oneidensis的嘧啶磷酸化酶催化效果更佳,且并无其他文献或专利报道。
将来源于Shewanella oneidensis的嘧啶磷酸化酶,通过酶的理性设计及改造、定向进化的方法获取了对于阿糖尿苷催化活力较高的突变体,突变体序列如SEQ ID NO.31所示。其突变位点为I32A,R89K,M195S,E196V,L200S,该突变体的热稳定性依然较高。在使用该突变体进行反应一所示阿糖尿苷的磷酸化反应时,底物剩余为21.9%,远低于SEQ IDNO.10所示野生型催化的反应的53.5%。
本发明的从土壤中获取的Thermoclostridium属微生物的嘌呤核苷磷酸化酶序列如SEQ ID NO.32所示;Thermoclostridium caenicola的嘌呤核苷磷酸化酶序列如SEQ IDNO.29所示。
表2嘌呤核苷磷酸化酶及其催化反应底物剩余比例表
用表2所示的不同嘌呤核苷磷酸化酶与嘧啶核苷磷酸化酶突变体搭配,以阿糖尿苷和2-氨基腺嘌呤为底物,可获得2-氨基阿糖腺苷,但收率较低。
本发明从土壤培养物中获得了一株耐热菌,其细胞提取物可以与嘧啶磷酸化酶突变体搭配,以较高的产率合成2-氨基阿糖腺苷,以阿糖尿苷计算,收率可达94.2%。将上述微生物的16S rDNA测序后,经鉴定,该微生物属于Thermoclostridium属。将上述微生物培养物的提取物用HPLC-MASS进行蛋白组学测序,并以其同属微生物Thermoclostridiumcaenicola的嘌呤核苷磷酸化酶为模板,从测序获得的多肽中钓取相关肽段,并将序列进行拼接可获得覆盖率达95%的蛋白序列。以Thermoclostridium caenicola的相应位置的氨基酸代替未能测到的5%的氨基酸后获得完整的嘌呤核苷磷酸化酶氨基酸序列。以Thermoclostridium caenicola的嘌呤核苷磷酸化酶与嘧啶核苷磷酸化酶突变体搭配,也可以较高的收率获得2-氨基阿糖腺苷,以阿糖尿苷计算,收率可达90.8%。
本发明采用的技术方案是:含有上述的嘧啶核苷磷酸化酶和嘌呤核苷磷酸化酶的突变体基因的重组载体,以pET系列质粒为出发载体。
进一步的,为了保证二者酶活比例,在pET载体上的顺序为:嘧啶核苷磷酸化酶突变体位于嘌呤核苷磷酸化酶突变体基因的上游,基因间的DNA间隔序列为:TAATAACCGGGCAGGCCATGTCTGCCCGTATTTCGCGTAAGGAAATCCATT。
本发明采用的技术方案是:一种用于生产上述的嘧啶核苷磷酸化酶和嘌呤核苷磷酸化酶的突变体的基因工程菌,所述基因工程菌包含上述的重组载体,宿主细胞为大肠埃希氏菌。
与现有技术相比,本发明所具有的有益效果是:
1.本发明使用原料易得,反应路线短、总收率高、不需异构体分离、不需中间产物分离的2-氨基阿糖腺苷的制备工艺。
2.天然的核苷中的五碳糖是核糖而并非阿拉伯糖,2-氨基腺嘌呤也不是天然的碱基。因此酶在催化2-氨基阿糖腺苷时的催化活力较低,本发明结合酶的理性设计、定向进化以及高通量筛选技术对酶蛋白进行改造,获得了催化活性高、热稳定性好的嘧啶核苷磷酸化酶突变体;
3.发明人从土壤中分离到一株Thermoclostridium属耐热微生物,其细胞提取物与嘧啶核苷磷酸化酶组合,催化阿糖尿苷和2-氨基腺嘌呤生产2-氨基阿糖腺苷时,收率可达94.2%。发明人初步鉴定了该嘌呤核苷磷酸化酶序列,并将其高度同源、来源于Thermoclostridium caenicola的嘌呤核苷磷酸化酶与嘧啶核苷磷酸化酶突变体组合,催化阿糖尿苷和2-氨基腺嘌呤制备2-氨基阿糖腺苷时,收率也可达90.8%。
附图说明
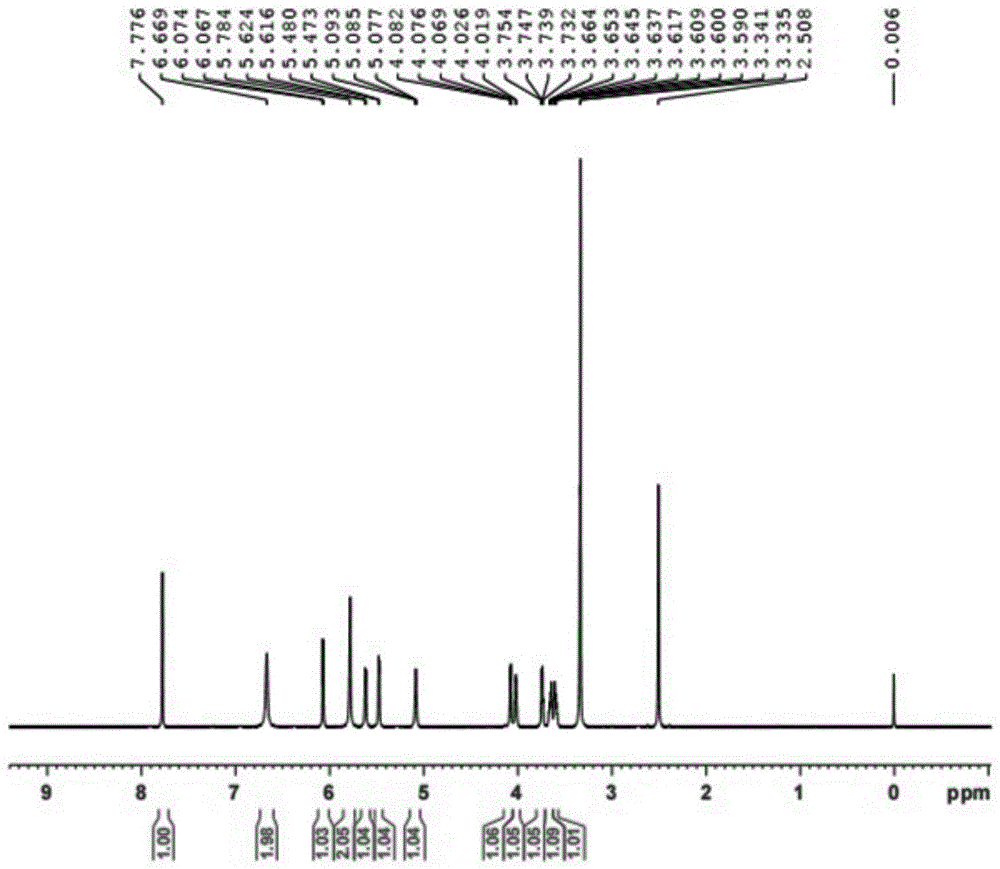
图1为本发明实施例纯化得到的2-氨基阿糖腺苷的H1 NMR图谱(以DMSO为溶剂);
图2为本发明实施例纯化得到的2-氨基阿糖腺苷的HPLC图谱。
具体实施方式
为使本领域技术人员更好的理解本发明的技术方案,下面结合附图和具体实施例对本发明作详细说明。
实施例1:耐热嘧啶核苷磷酸化酶的获得
将表1中所示的嘧啶核苷磷酸化酶基因野生型基因序列进行序列优化,然后由基因合成公司人工合成全基因片段,并将基因插入pET-24a质粒的NdeI和BamHI位点中,将连接后的载体转入大肠杆菌BL21(DE3)中建立嘧啶核苷磷酸化酶基因工程菌。
实施例2:嘌呤核苷磷酸化酶的获得
将表2中所示的嘌呤核苷磷酸化酶基因野生型基因序列进行序列优化,然后由基因合成公司人工合成全基因片段,并将基因插入pET-24a质粒的NdeI和BamHI位点中,将连接后的载体转入大肠杆菌BL21(DE3)中建立嘌呤核苷磷酸化酶基因工程菌。
实施例3:耐热、高效嘌呤核苷磷酸化酶的获得
将以下组分在纯化水中溶解:NaHCO3 2.0g/L,胰蛋白胨2.0g/L,K2HPO4 1.5g/L,葡萄糖1.0g/L,酵母抽提物1.0g/L,NH4Cl 0.9g/L,NaCl 0.9g/L,KH2PO40.75g/L,L-半胱氨酸盐酸盐0.5g/L,MgCl2 6H2O 0.4g/L,HCl 0.0025g/L,FeCl3 6H2O 0.0025g/L,FeCl24H2O 0.0015g/L,刃天青钠盐0.0005g/L,CoCl26H2O 0.00019g/L,MnCl2 4H2O 0.0001g/L,ZnCl2 0.00007g/L,Na2MoO4 2H2O0.000036g/L,NiCl2 6H2O 0.000024g/L,H3BO30.000006g/L,CuCl2 2H2O 0.000002g/L,调节pH为6.8,用灭菌的囊式滤器过滤到灭菌的丝口瓶中,1L丝口瓶中装1L培养基。分别从表层土壤、20cm深土壤及50cm深土壤中取5g土壤,用灭菌后的生理盐水重悬后,在220rpm、30℃摇床中震荡30分钟,取悬浊液5ml接种到丝口瓶中,在50℃、100rpm的摇床中培养7天。
取菌液在12000rpm离心2min,沉淀用pH7.0、100mM磷酸缓冲液重悬到200g/L,而后用超声细胞破碎机破碎,在12000rpm离心10min,收集上清。
实施例4:嘧啶核苷磷酸化酶突变体获得
来源于Shewanella oneidensis的嘧啶核苷磷酸化酶的三维结构目前尚未被揭示。但本发明用SWISS-MODEL对野生型基因序列三维模型构建发现,其与Yersiniapseudotuberculosis来源的尿嘧啶核苷磷酸化酶(PDB ID:4NY1)高度同源。因此,参考该酶的三维结构进行分析,通过分子对接软件进行反应底物与蛋白质的结合模拟,最后通过Pymol分析,选择有可能与底物结合结合相关的氨基酸作为突变氨基酸。
除上述理性设计外,本发明利用易错PCR随机突变的方法,对嘧啶核苷磷酸化酶进行了蛋白质工程改造。一般来说,易错PCR可以通过DNA聚合酶进行目的基因扩增时,调整反应条件来改变扩增过程中的突变频率,如提高镁离子浓度、加入锰离子、改变体系中四种的dNTP浓度或运用低保真度DNA聚合酶等,从而以一定的频率向目的基因中随机引入突变,获得蛋白质分子的随机突变体。
本发明采用较低保真度的Taq聚合酶,同时利用Mn2+替代天然辅助因子Mg2+增加易错概率。
50μL PCR体系如下:
加入灭菌双蒸水至50μL。
其中:嘧啶核苷磷酸化酶模板基因为SEQ ID NO.10的基因插入至pET-24a质粒中构建得到的重组质粒;引物设计,本发明根据重组质粒中目的基因的上下游序列设计。
PCR反应条件为:95℃预变性2.5min;94℃变性15s,53℃退火30s,72℃延伸60s,共35个循环;72℃继续延伸10min,冷却至4℃。
所得PCR扩增产物,连接至pET-24a载体,并转入之大肠杆菌BL21(DE3)中建立嘧啶核苷磷酸化酶基因突变文库。
利用大肠杆菌BL21(DE3)为宿主,pET-24a质粒为载体,表达嘧啶核苷磷酸化酶,以实施例7所述酶活力检测方法高通量筛选高活性突变株。突变后高活性嘧啶核苷磷酸化酶基因进行鉴定。筛选出的高活性嘧啶核苷磷酸化酶突变体基因的氨基酸序列如SEQ ID NO31所示。
实施例5:嘧啶核苷磷酸化酶和嘌呤核苷磷酸化酶的共表达
合成嘧啶核苷磷酸化酶突变体与SEQ ID NO.31或SEQ ID NO.32嘌呤核苷磷酸化酶串联序列,二者居间序列为
TAATAACCGGGCAGGCCATGTCTGCCCGTATTTCGCGTAAGGAAATCCATT,将串联后的DNA连接到pET24a的NdeI和BamHI酶切位点间;或分别合成SEQ ID NO.31嘧啶核苷磷酸化酶突变体和SEQ ID NO.32嘌呤核苷磷酸基因序列,依次连接到pETDuet-1的NcoI和NotI位点、NdeI和XhoI位点;或分别合成SEQ ID NO.31嘧啶核苷磷酸化酶突变体和SEQ ID NO.29嘌呤核苷磷酸基因序列,分别连接到pETDuet-1的NcoI和NotI位点、NdeI和XhoI位点。
实施例6:在摇瓶中小规模生产嘧啶核苷磷酸化酶及嘌呤核苷磷酸化酶
将包含实施例1、2、3、4、5构建重组质粒的大肠杆菌,接种到含卡那霉素(50μg/mL)的50mL LB培养基中(蛋白胨10g/L,酵母抽提物5g/L,NaCl 10g/L,pH7.2)。37℃、210rpm震荡培养16小时。然后按1:100比例转接,于100mL含卡那霉素的LB培养基中,37℃、210rpm震荡培养,定时测量菌液在600nm下的吸光值(OD600),以监测菌体生长密度。当培养物的OD600=0.6~0.8时,加入终浓度0.2mM的异丙基β-D-硫代半乳糖苷(IPTG)来诱导目的酶基因表达,诱导培养过夜(≥16小时)。10000rpm、4℃离心10min,弃上清,细胞沉淀以预冷的100mM磷酸缓冲液(pH7.0)按200g/L重悬后,超声破碎,然后13000rpm、4℃离心30min,收集上清,即粗酶液,储存于-20℃。
实施例7:嘧啶核苷磷酸化酶活力的测定
嘧啶核苷磷酸化酶活力测定体系如下:
100mM磷酸二氢钾-磷酸氢二钾缓冲溶液,包含终浓度为7.33g/L反应一所示底物(阿糖尿苷),350ml/L酶溶液,调节pH 7.2,混匀后放入60℃反应5h,样品以纯水稀释40倍,以实施例10所示的方法检测原料剩余和产品生成。
实施例8:嘌呤核苷磷酸化酶活力的检测
嘌呤核苷磷酸化酶活力测定体系如下:
100mM磷酸二氢钾-磷酸氢二钾缓冲溶液,包含终浓度为7.33g/L反应一所示底物(阿糖尿苷)和终浓度为13g/L的反应二所示底物(2-氨基腺嘌呤),150ml/L嘧啶核苷磷酸化酶溶液,150ml/L嘌呤核苷磷酸化酶溶液,调节pH 7.2,混和后放入60℃反应5h,样品以纯水稀释40倍,以实施例10所示的方法检测原料剩余和产品生成。
实施例9:酶的发酵生产
发酵方案:将实施例5构建的重组大肠杆菌(含突变的嘧啶核苷磷酸化酶基因和嘌呤核苷磷酸化酶基因),单个微生物菌落接种于含卡那霉素50μg/mL(以pET24a为母本的质粒)或氨苄青霉素50μg/mL(以pETDuet1为母本的质粒)的120mL LB培养基中,37℃、220rpm震荡培养过夜(≥10小时),然后在15L发酵罐中发酵:种子液按2%的接种量接入6L发酵培养基,发酵液通过加入氨水维持pH=7.0-7.2,罐温37℃,搅拌转速300-900rpm,过程中控制溶氧30%左右,空气流量1:1~2vvm。培养8小时后加入IPTG(终浓度0.2mmol/L),罐温调整至22℃,继续发酵12-16小时。发酵过程中需加入补料液(葡萄糖200g/L,酵母提取物100g/L,pH7.2)维持培养物的生长。发酵结束后将培养物直接用高压均质机匀浆破碎。破碎后的发酵液,加入终浓度为2g/L的聚乙烯亚胺和150g/L的硅藻土,搅拌30分钟。絮凝沉降结束后,用滤布过滤。过滤后的酶液用超滤膜过滤浓缩后,制备得到粗酶液并于-20℃保存。
实施例10分析方法
照高效液相色谱法(中国药典2020年版四部通则0512)测定。
溶剂:水-甲醇(85:15)。
供试品溶液:取本品适量,加溶剂溶解并定量稀释制成每1ml中约含0.4mg的溶液。
色谱条件:用十八烷基硅烷键合硅胶(4.6×150mm,5μm或效能相当的色谱柱)为填充剂;以水(0.1%磷酸)为流动相A,乙腈为流动相B,进行线性梯度洗脱;流速为每分钟1.0ml;柱温为35℃;检测波长为254nm;进样体积5μl。
表3HPLC检测方法中流动相比例的变化表
测定法:精密量取供试品溶液,注入液相色谱仪,记录色谱图。
采用本发明所述的嘧啶核苷磷酸化酶突变体及嘌呤核苷磷酸化酶合成的2-氨基阿糖腺苷,经纯化后的核磁共振图谱如图1所示,经纯化后的HPLC检测纯度的图谱如图2所示。
以上通过实施例对本发明进行了详细说明,但所述内容仅为本发明的示例性实施例,不能被认为用于限定本发明的实施范围。本发明的保护范围由权利要求书限定。凡利用本发明所述的技术方案,或本领域的技术人员在本发明技术方案的启发下,在本发明的实质和保护范围内,设计出类似的技术方案而达到上述技术效果的,或者对申请范围所作的均等变化与改进等,均应仍归属于本发明的专利涵盖保护范围之内。
- 一种利用L-氨基酸连接酶一步法合成L-肌肽的方法
- 一种酶法合成(S)-2-氨基丁酰胺的方法
- 一种酶法合成(S)-2-氨基丁酰胺的方法
