一种基于基因工程化细胞膜囊泡的脱氧核糖核酸酶递送系统及其制备方法和应用
文献发布时间:2024-04-18 19:58:26
技术领域
本发明属于生物医药技术领域,具体涉及一种基于基因工程化细胞膜囊泡的脱氧核糖核酸酶递送系统及其制备方法和应用。
背景技术
急性呼吸窘迫综合征又称为ARDS,是指由于心源性以外的各种肺内肺外致病因素导致的急性进行性呼吸衰竭,临床表现为呼吸窘迫和顽固型的低氧血症,肺部影像学表现为非均一性的渗出性病变,一般认为该病的早期阶段为急性肺损伤,又称为ALI。
中性粒细胞外陷阱(neutrophil extracellular traps,NETs)是中性粒细胞激活后释放到胞外的网状超微结构,其骨架为细胞外裸露的DNA骨架,其在ALI/ARDS的病理过程中扮演了重要角色,研究表明,中性粒细胞外陷阱会加速ALI/ARDS进程,被认为是潜在的治疗靶点。通过阻断NETs形成或者采用脱氧核糖核酸酶(下文简称DNase)降解NETs,能够治疗ALI/ARDS。
然而,目前缺乏精准高效的DNase递送策略,临床收效甚微。因此,如何实现DNase向肺部炎症环境靶向递送仍是亟待解决的关键问题。
发明内容
本发明的发明目的是提供一种基于基因工程化细胞膜囊泡的DNase递送系统及其制备方法和应用,该DNase递送系统能够将DNase靶向递送至肺部炎症环境,清除中性粒细胞外陷阱。
为实现上述发明目的,本发明的技术方案为:
一种基于基因工程化细胞膜囊泡的DNase递送系统,该DNase递送系统包括基因工程化细胞膜囊泡,该基因工程化细胞膜囊泡的表面过表达有CXCR2受体且接枝有DNase。
本发明在基因工程化细胞膜囊泡的表面过表达CXCR2受体,该CXCR2受体能够与炎症部位高表达的CXCL1、CXCL2、CXCL3、CXCL5、CXCL6、CXCL8等趋化因子结合,从而模拟中性粒细胞的炎症趋化过程使基因工程化细胞膜囊泡靶向炎症环境,则接枝在基因工程化细胞膜囊泡表面的DNase即被特异性地靶向递送到肺部炎症环境中,有效清除肺部炎症环境中出现的中性粒细胞外陷阱的DNA骨架,缓解组织损伤。
本发明的DNase递送系统以天然细胞膜囊泡为基础,利用细胞膜表面自然结构组分,部分模拟细胞生物活性功能,达到提升DNase递送系统内在生物相容性、跨越部分生物屏障、延缓免疫系统清除过程、实现炎症靶向等功能。
本发明的DNase递送系统具有良好的炎症靶向性,优秀的中性粒细胞外陷阱清除能力,生物安全性好,具备良好的临床转化可能性。基于此,本发明还提供了上述的DNase基于基因工程化细胞膜囊泡的DNase递送系统在制备肺炎治疗药物中的应用。
作为优选,在上述的基于基因工程化细胞膜囊泡的DNase递送系统中,DNase在基因工程化细胞膜囊泡表面的接枝率为0.6%-29.5%。
作为优选,在上述的基于基因工程化细胞膜囊泡的DNase递送系统中,所述的基因工程化细胞膜囊泡的直径在50-400nm;更优选为50-200nm;该尺寸有利于调整DNase递送系统在体内的富集、循环、留存特性。
本发明还提供了上述基于基因工程化细胞膜囊泡的DNase递送系统的制备方法,该制备方法包括以下步骤:
(1)制备表面过表达有CXCR2受体的工程细胞;
(2)对步骤(1)获得的工程细胞进行表面叠氮修饰,获得过表达CXCR2且叠氮修饰的工程细胞;
(3)获取步骤(2)中工程细胞的细胞膜,采用PVDF膜挤出法将细胞膜制成基因工程化细胞膜囊泡;
(4)将DNase通过点击化学反应接枝到基因工程化细胞膜囊泡的表面的叠氮基团上,获得所述的基于基因工程化细胞膜囊泡的DNase递送系统。
本发明的制备方法的反应体系温和,条件可控;通过点击化学反应将DNase接枝到基因工程化细胞膜囊泡的表面,不会影响DNase活性以及囊泡表面的CXCR2受体趋化功能。
作为优选,步骤(1)中,所述的工程细胞为HEK293T工程细胞。HEK293T细胞具有较少表面受体,从而具有低免疫原性、易于体外大量扩增、表面受体易于通过基因编辑表达等特点,更适用于应用于本发明中以过表达CXCR2受体和接枝DNase。
作为优选,步骤(2)中,将步骤(1)获得的工程细胞与终浓度为50μmol/L的叠氮修饰甘露糖(Ac
作为优选,步骤(3)包括以下步骤:
1)采用活性酯聚乙二醇环辛炔(下文简称NHS-PEG
2)将DNase-DCBO偶联物与表面过表达有CXCR2受体的基因工程化细胞膜囊泡混合,在4℃条件下摇床震荡孵育,获得所述的DNase递送系统。
作为进一步优选,步骤1)中,先将DNase溶于含1%二甲亚砜的PBS溶液,获得DNase溶液;而后将DNase溶液与NHS-PEG
作为进一步优选,步骤2)中,将DNase-DCBO偶联物与基因工程化细胞膜囊泡以反应蛋白质量比为0.2:1~1:1(即DNase与基因工程化细胞膜囊泡上反应蛋白CNV-N
与现有技术相比,本发明的有益效果体现在:
(1)本发明在基因工程化细胞膜囊泡的表面过表达CXCR2受体,该CXCR2受体能够与炎症部位高表达的CXCL1、CXCL2、CXCL3、CXCL5、CXCL6、CXCL8等趋化因子结合,从而模拟中性粒细胞的炎症趋化过程使基因工程化细胞膜囊泡靶向炎症环境,则接枝在基因工程化细胞膜囊泡表面的DNase即被特异性地靶向递送到肺部炎症环境中,有效清除肺部炎症环境中出现的中性粒细胞外陷阱的DNA骨架,缓解组织损伤;本发明的DNase递送系统具有良好的炎症靶向性,优秀的中性粒细胞外陷阱清除能力,生物安全性好,具备良好的临床转化可能性。
(2)本发明的DNase递送系统以天然细胞膜囊泡为基础,利用细胞膜表面自然结构组分,部分模拟细胞生物活性功能,达到提升DNase递送系统内在生物相容性、跨越部分生物屏障、延缓免疫系统清除过程、实现炎症靶向等功能。
附图说明
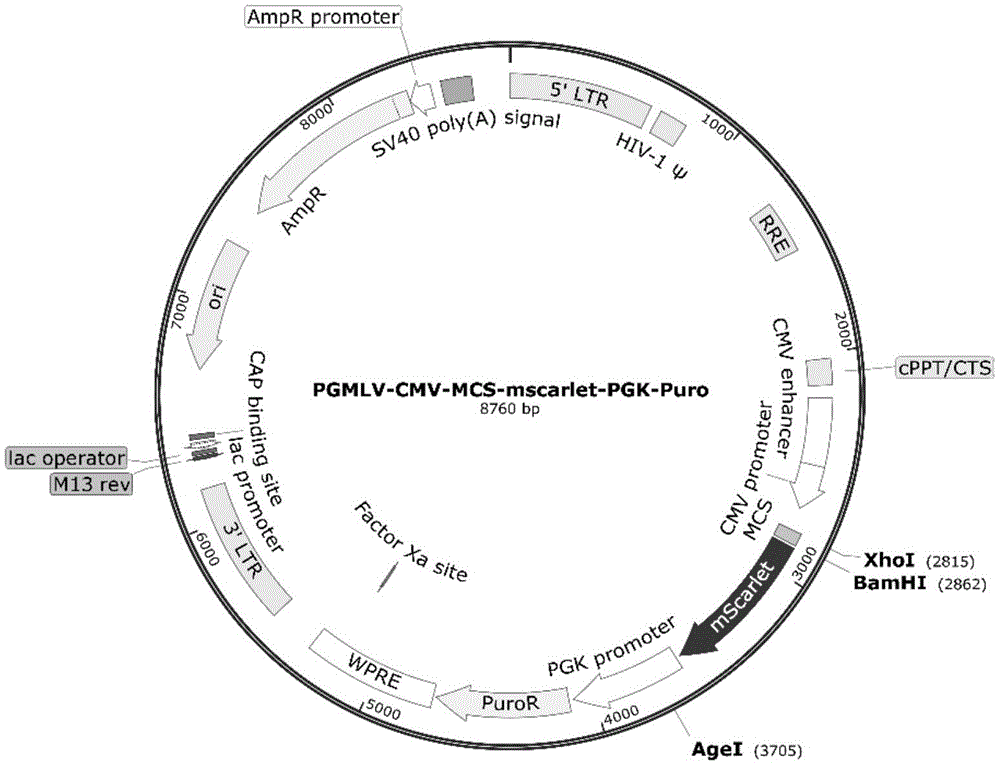
图1为实施例1中构建的慢病毒载体的结构示意图;
图2为实施例1中制备的CXCR2-eGFP过表达HEK293T细胞的荧光共聚焦照片;
Control表示空白对照,下同;
图3为使用Cy5-DBCO探针显示通过Ac
图4为实施例1中制备的DNase I-DCBO偶联物以及对应浓度的DNase I与接枝DBCO基团等摩尔浓度的NHS-PEG
其中,Wavelength(nm)表示波长(纳米);
图5为本发明的基于基因工程化细胞膜囊泡的DNase递送系统的TEM观测照片;
图6为本发明的基于基因工程化细胞膜囊泡的DNase递送系统的水化粒径表征结果;
其中,Size(nm)表示粒径(纳米),Number(%)表示数量(百分比);CNV表示CXCR2过表达的工程细胞囊泡(未接枝DNase I与叠氮修饰),CNV-N
图7为本发明的基于基因工程化细胞膜囊泡的DNase递送系统的电位表征结果;
其中,Zeta potential(mV)表示Zeta电位(毫伏);
图8为在不同投料比下DNase I-DBCO偶联物与1mg CNV-N
其中,Ratio of DNase I toCNV表示DNase I-DBCO偶联物与1mg CNV-N
图9为本发明的基于基因工程化细胞膜囊泡的DNase递送系统上DNase I的酶活性比例检测结果;
其中,Relative DNase I activity表示DNase I的酶活性比例;
图10为本发明基于基因工程化细胞膜囊泡的DNase递送系统对小鼠肺的干湿重量比的影响;
其中,DNV表示无CXCR2过表达但接枝DNase I的细胞膜囊泡,Lung wet/dryweight ratio表示肺的干湿重量比;
图11为本发明基于基因工程化细胞膜囊泡的DNase递送系统对小鼠肺泡内炎症细胞数量的影响;
其中,BALF neutrophil(×10
图12为本发明基于基因工程化细胞膜囊泡的DNase递送系统对小鼠肺内NETs水平的影响;
其中,Relative BALF MPO-DNA level表示肺泡灌洗液中MPO-DNA的相对水平;
图13为本发明基于基因工程化细胞膜囊泡的DNase递送系统对小鼠肺组织损伤的改善作用。
具体实施方式
下面结合附图和具体实施方式对本发明的技术方案作进一步详细说明。
实施例1制备基于基因工程化细胞膜囊泡的DNase递送系统
本实施例一种基于基因工程化细胞膜囊泡的DNase递送系统,其制备方法包括以下步骤:
(1)制备表面过表达有CXCR2受体的工程细胞;
具体地,包括:
1)慢病毒的制备;
1.在10cm细胞培养皿内,应用添加1%青-链霉素双抗、1‰盐酸四环素、10%胎牛血清的DMEM完全培养基培养HEK293T细胞,至细胞密度为70%;
2.应用无血清及抗生素添加的DMEM预处理HEK293T细胞30min后,使用PolyJet试剂盒,按照3.75μg:3.75μg:7.5μg的比例共转染pSPAX2、pMD2G、PGMLV-CMV-MCS-mCXCR2-meGFP-PGK-Puro质粒;添加时,应注意优先制备15μg质粒与125μl无血清及抗生素组分的DMEM培养基混合液,应用1000μl微量移液器枪头吹打12次,制备组分液Ⅰ,再使用7.5μlPolyJet与125μl无血清及抗生素组分的DMEM培养基混合,1000μl微量移液器枪头吹打15次后制备组分液Ⅱ,并将混合组分液Ⅰ加入组分液Ⅱ,采用1000μl微量移液器枪头吹打15次后,在室温条件下静置15min,形成组分液Ⅲ,在步骤1论及的HEK293T细胞培养皿内均匀滴加组分液Ⅲ,摇匀;
3.将步骤2中论及的HEK 293T细胞置于37℃,5%二氧化碳环境下培养24小时,在培养皿内加入12ml包含1%青-链霉素双抗、10%胎牛血清的DMEM完全培养基;
4.将步骤3中论及的HEK 293T细胞培养24小时后,回收培养基液体,在1500转下离心5min,收集上清Ⅰ保存于4℃环境,向HEK 293T细胞内添加10ml包含1%青-链霉素双抗、10%胎牛血清的DMEM完全培养基;
5.将步骤4中论及的HEK 293T细胞培养24小时后,回收培养基液体,在1500转下离心5min,收集上清Ⅱ保存于4℃环境,与上清Ⅰ合并形成慢病毒溶液Ⅰ;
6.将慢病毒溶液Ⅰ在4℃条件下,于Thermo Fisher Scientific超速离心机内,在24000g离心4小时,每25ml慢病毒溶液Ⅰ/管;
7.弃去超速离心后的慢病毒溶液Ⅰ离心管上清液,向离心管内加入1.5ml无血清及抗生素组分的DMEM培养基,将离心管置于冰上震荡,直至病毒沉淀溶解,得到慢病毒溶液Ⅱ(慢病毒载体结构图见图1)。
2)慢病毒制备工程HEK293T细胞;
1.在6cm培养皿中准备生长状态良好的,密度为70%的HEK293T细胞;
2.将300μl步骤1)中获得的慢病毒溶液Ⅱ滴加至包含2.7ml包含1%青-链霉素双抗、10%胎牛血清的DMEM完全培养基内,加入2.0μl的10mg/ml聚凝胺溶液,应用1000μl微量移液器枪头吹打混匀,得到慢病毒溶液Ⅲ;
3.弃去步骤1中论及HEK 293T细胞培养基,加入慢病毒溶液Ⅲ,在37℃,5%二氧化碳环境下培养24小时;
4.弃去步骤3中论及细胞上清液,加入3ml包含1μg嘌呤霉素、1%青-链霉素双抗、1‰盐酸四环素、10%胎牛血清的DMEM完全培养基,每培养24小时后更换新鲜本步骤中论及的DMEM完全培养基,每48-72小时传代,直至细胞性状稳定,得到表达CXCR2-eGFP的HEK293T工程细胞(以下简称C-HEK293T),C-HEK293T的荧光共聚焦照片见图2。
(2)对步骤(1)获得的工程细胞进行表面叠氮修饰,获得过表达CXCR2且叠氮修饰的工程细胞;
具体地,包括:
1.在15cm培养皿内,以包含1μg嘌呤霉素、1%青-链霉素双抗、1‰盐酸四环素、10%胎牛血清的DMEM完全培养基培养扩增C-HEK293T,直至获得10皿密度为70%的C-HEK293T细胞,将C-HEK 293T细胞置于50μM的Ac4ManNAz DMEM培养基内孵育24小时;
2.使用真空泵弃去C-HEK293T细胞培养上清,每皿细胞加入5ml、4℃PBS缓冲液;备用。
图3为使用Cy5-DBCO探针显示Ac4ManNAz孵育,实现细胞膜表面修饰叠氮基的表征。
(3)获取步骤(2)中工程细胞的细胞膜,采用PVDF膜挤出法将细胞膜制成基因工程化细胞膜囊泡;
具体地,包括:
1.使用1000μl微量移液器枪头吹打C-HEK293T细胞,直至细胞从培养皿底脱落,收集细胞悬液至室温50ml离心管,并在培养皿内加入5ml、4℃PBS缓冲液,加入至室温50ml离心管内;
2.将收集于50ml离心管内的C-HEK293T细胞悬液置于1200rpm下离心5min,获得C-HEK293T细胞沉淀,以4℃PBS缓冲液重悬,再次离心,弃去上清,保留沉淀;
3.向50ml离心管内加入30ml提取试剂A(碧云天,P0033),重悬细胞后,加入300μl100mM苯甲基磺酰氟溶液,加入各300μl磷酸酶抑制剂Cocktail(Bimake,B15001,B15002),重悬细胞;
4.将细胞悬液置于冰上静置15min,分装与1.5ml离心管内,每管加入1.0ml;
5.将离心管置于液氮内,直至液体完全转化为固态;
6.将离心管置于45℃金属浴上90秒,再次置于液氮中;
7.重复步骤5、6两步5轮;
8.将离心管在4℃,600g下离心10min,取不包含胶状沉淀物的上清液,收集至新1.5ml离心管内;
9.将离心管置于高速离心机内,4℃,15000rpm离心60min;
10.弃上清,收集沉淀,重悬至1000μl,冰上350w超声10min;
11.应用Avanti脂质挤出器系统,在45℃恒温加热台上,依次应用400μm、200μm、100μm、50μm PVDF膜反复挤出,每个孔径膜挤出6个来回;
12.使用BCA定量法测定基因工程化细胞膜囊泡(CNV-N
(4)将DNase通过点击化学反应接枝到基因工程化细胞膜囊泡表面的叠氮基团上,获得本实施例的基于基因工程化细胞膜囊泡的DNase递送系统;
具体地,包括:
1)采用NHS-PEG
具体包括:
1.使用1%二甲亚砜的PBS溶液溶解DNase I,获得浓度为1mg/ml的DNase I溶液;
2.按照DNase I与NHS-PEG5-DBCO的摩尔比为1:3的浓度混合;
3.在4℃下轻柔搅拌溶液,反应1h;
4.使用截流质量为3kDa的透析袋,在4℃条件下,在PBS溶液中透析1小时,重复换液,直至外部溶液无法使用紫外分光光度计检出308nm处的DBCO基团特征吸收峰;
图4所示的是该DNase I-DCBO偶联物以及对应浓度的DNase I与接枝DBCO基团等摩尔浓度的NHS-PEG5-DBCO吸收峰关系,可以看出,本实施例的DNase I-DCBO偶联物中,DNase I和DCBO基团的摩尔比为1:1。
2)将DNase I-DCBO偶联物与基因工程化细胞膜囊泡混合,静置反应,获得本实施例的基于基因工程化细胞膜囊泡的DNase递送系统;
具体地,包括:将DNase I-DCBO偶联物与CNV-N
该DNase递送系统的TEM观测图见图5(标尺提示为200nm),水化粒径表征结果见图6,电位表征结果见图7。
为测定不同投料比下,DNase I-DBCO偶联物与1mg CNV-N
使用DNase I荧光法酶活定量试剂盒评估等质量的DNase I与接枝在CNV表面上的DNase I(DCNV)酶活性比例,检测结果如图9所示。由图9可见,接枝的DNase I活性约为原始DNase I的89%。
实施例2基于基因工程化细胞膜囊泡的DNase递送系统对ALI/ARDS的治疗效果测试
利用LPS构建ALI/ARDS小鼠模型,将模型小鼠随机分为五组,以66.7μgDNase I/小鼠的剂量分别经尾静脉注射给予DNase I、CXCR2过表达的工程细胞囊泡(未接枝DNase I)(CNV)、无CXCR2过表达但接枝DNase I的细胞膜囊泡(DNV)、基于基因工程化细胞膜囊泡的DNase递送系统(DCNV)、等体积的PBS溶液;另取健康小鼠作为control。
(1)基于基因工程化细胞膜囊泡的DNase递送系统对肺的干湿重量比的影响
给药24小时后,获取各组小鼠的肺组织,在60℃烘箱内烘干48小时,对比烘干前后的肺质量,获取肺的干湿重量比,结果如图10所示。
由图10可见,本发明的基于基因工程化细胞膜囊泡的DNase递送系统有效减少了肺的干湿重比,反映出DCNV减少了肺血管壁、肺泡壁损伤与炎症渗出。
(2)基于基因工程化细胞膜囊泡的DNase递送系统对肺泡内炎症细胞数量的影响
获取各组小鼠的肺泡灌洗液(BALF),对肺泡内炎症细胞计数,结果如图11所示。
由图11可见,本发明的基于基因工程化细胞膜囊泡的DNase递送系统有效减少了肺泡内炎症细胞的富集、渗出。
(3)基于基因工程化细胞膜囊泡的DNase递送系统对肺内NETs水平的影响
获取各组小鼠的肺泡灌洗液(BALF),使用MPO ELISA试剂盒与Picogreen DNA定量试剂盒测定肺泡灌洗液内MPO-DNA含量,以鉴定小鼠肺泡渗出液内NETs水平,检测结果见图12。
由图12可见,本发明的基于基因工程化细胞膜囊泡的DNase递送系统有效降低了ALI/ARDS小鼠肺内的NETs水平。
(4)基于基因工程化细胞膜囊泡的DNase递送系统对肺组织损伤的改善作用
获取各组小鼠的肺组织,制作H&E切片,并进行染色,结果见图13。
由图13可见,本发明的基于基因工程化细胞膜囊泡的DNase递送系统有效减少了小鼠肺组织内的炎性渗出,DCNV组小鼠的肺组织具备较窄的肺泡壁间隔、较少的透明膜形成,表明经该DNase递送系统治疗后小鼠的肺组织损伤得到显著缓解。
- 一种高生物活性细胞膜仿生微囊泡及其制备方法与应用
- 一种基因工程化细胞膜涂层脂质体纳米囊泡及其制备与应用
- 一种基因工程化细胞膜纳米囊泡及其制备与应用
