一种制备工程改造的免疫细胞的方法
文献发布时间:2024-04-18 20:00:50
技术领域
本发明涉及细胞免疫治疗领域,尤其涉及一种制备工程改造的免疫细胞的方法。
背景技术
嵌合抗原受体T细胞(Chimeric antigen receptor T cell,CAR-T)疗法大多数情况下为自体CAR-T细胞疗法,即从病人体内获得T细胞,进行基因改造,再将改造的T细胞输回病人体内,从而激活针对病人体内肿瘤细胞特异性的免疫反应。截止2021年12月份FDA已批准五款CAR-T产品,分别为Kymriah(tisagenlecleucel)、Yescarta(axicabtageneciloleucel)、Tecartus(brexucabtagene autoleucel)、Breyanzi(lisocabtagenemaraleucel)和Abecma(idecabtagene vicleucel,ide-cel),CDE已批准了两款CAR-T产品,分别为益基利仑赛注射液和瑞基仑赛注射液。
自体CAR-T的制备过程包含一些基本的步骤。首先,病人的白细胞(WBC)通过血细胞去除法分离后洗涤获得;然后,T细胞被激活,转导CAR基因,扩增到一定数量后罐装和密封后用于治疗。经过一定质控,患者经过预处理后,将CAR细胞注射到患者体内。尽管在目前的细胞治疗开发过程中,基本的开发方法类似,但在整个生产过程中依然有很多不同的过程。目前上市的七款CAR-T产品均为自体来源T细胞的病毒载体体外基因转导的细胞制备体系,人工操作繁杂,非常耗时耗力,而且难以扩大,失败率高。整个CAR-T制备工艺非常复杂,而相对应的其生产过程的优化却较为缓慢。相对应地,CAR-T的生产制备成本高昂,影响生产成本最大的两个因素是产能利用率和病毒载体,意味着提升生产规模、降低基因转导载体的成本将是降低CAR-T成本的有效方式。
以非病毒载体系统来制备CAR-T细胞治疗产品,在安全性、有效性和成本方面相比较于病毒载体系统都有相应的优势。首先是复发率降低。非病毒系统转染的CAR-T细胞会产生更多的记忆T细胞,可以更大程度的防止癌症的复发。通过非病毒载体系统制备的CAR-T细胞在治疗后,会产生比病毒载体系统制备的CAR-T细胞更多的记忆T细胞,治疗后肿瘤的复发概率更低。二是成本更低。相对于病毒载体系统而言,非病毒载体系统的生产工艺更加简单、容易进行质量控制;同时在存储方面,非病毒载体使用的质粒DNA稳定性更高,存储的要求也比病毒载体系统的RNA病毒更低,有效期更长。在转染的这一环节上,非病毒载体的成本只有病毒载体的1/10。因此,在其他生产条件相同的情况下,非病毒载体系统制作的CAR-T细胞可以节省大量的成本,也意味着在上市之后,患者可以享受到治疗效果更好但是价格更便宜的CAR-T细胞治疗。第三是安全性更高。病毒载体转染系统使用灭活的艾滋病毒进行CAR基因转染,可能会存在病毒重新复制的风险,存在安全隐患,因此FDA建议对接受治疗的患者进行长达15年的跟踪随访以确定安全性,与之相比,非病毒载体则没有这方面的顾虑,安全性从理论上讲更高。
多家生物公司正在开展基于电转方式的非病毒载体CAR-T细胞产品的开发,其工艺路径为从外周血中分离T细胞后进行电转染外源基因物质,随后进行体外刺激并培养,待收获足量细胞后回输给病人。但该方式应用于临床病人样本时会存在制备失败的高风险,在样本制备早期经过电转染后造成的细胞损伤大,难以存活,后期体外扩增能力有限。另外,Maxcyte公司开发的转染mRNA形式的工艺路径,以及Precigen公司开发的快速回输制备工艺路径均存在质控时间长于细胞制备时间,外源基因物质未长期整合至基因组,无法长期发挥有效功能的问题。
发明内容
本发明提供一种制备工程改造的免疫细胞的方法,该方法包括:(1)使用激活剂激活待转入的核酸的免疫细胞,获得激活的免疫细胞,然后(2)再将该核酸电转入该激活的免疫细胞中。
在一个或多个实施方案中,所述激活剂包括选自以下的一种或多种:CD3抗体、CD28抗体、4-1BB抗体、4-1BBL抗原。
在一些实施方案中,所述激活剂选自下组:CD3抗体,CD3抗体和CD28抗体,CD3抗体和4-1BB抗体,和CD3抗体和4-1BBL抗原。
在一些实施方案中,所述激活剂固定在固相载体上。
在一些实施方案中,所述载体是磁珠或容器壁。
在一些实施方案中,所述激活剂为固定在磁珠上的CD3抗体和CD28抗体;优选地,所述激活剂为Miltenyi MACS GMP TransAct CD3/28磁珠和/或CTS Dynabeads CD3/28。
在一个或多个实施方案中,所述激活剂为固定在容器壁(例如玻璃)上的CD3抗体,CD3抗体和CD28抗体,CD3抗体和4-1BB抗体,或CD3抗体和4-1BBL抗原;优选地,所述容器为T75瓶。
在一些实施方案中,所述激活剂的终浓度为1-20μg/mL。
在一个或多个实施方案中,激活剂与免疫细胞的浓度比为1-20μg/mL:2.45-2.8×10
在一些实施方案中,所述Miltenyi MACS GMP TransAct CD3/28磁珠的终浓度为4-8mL/1×10
在一些实施方案中,所述CTS Dynabeads CD3/28磁珠与免疫细胞的数量比为=1:1。
在一些实施方案中,所述激活的温度为27-45℃,优选35-40℃,更优选37.0±1℃。
在一个或多个实施方案中,所述激活的CO
在一个或多个实施方案中,所述激活的培养基为含有或不含5%血清或其替代物的AIM-V培养基。优选地,所述培养基中还含有细胞因子,例如IL-7和/或IL-15。在一个或多个实施方案中,IL-7的终浓度为1-50ng/mL,例如10-30ng/mL,优选25ng/mL;IL-15的终浓度为1-50ng/mL,例如10-30ng/mL,优选25ng/mL。
在一些实施方案中,激活时间为12-84小时,优选24-72小时,更优选24、48或72小时。
在一些实施方案中,电转条件为将包含核酸、细胞和电转液的混合液转移至电转杯中,放入Lonza Nucleofactor 4D或Maxcyte电转仪,选取编号为FI-115或Resting T/Expand T4的程序进行电击。
在一个或多个实施方案中,激活的免疫细胞在电转混合物中的浓度为1×10
在一个或多个实施方案中,所述核酸在电转混合物中的浓度为1-20nmol/L,优选2-10nmol/L,更优选3.09nmol/L。
在一个或多个实施方案中,所述核酸含有多肽编码序列。优选地,所述多肽编码序列是CAR的编码序列。
在一个或多个实施方案中,所述激活的免疫细胞中还转化有表达功能蛋白的核酸,所述转化优选为电转。其中,所述功能蛋白包括但不限于肿瘤抗原的抗体或其抗原结合片段。在一些实施方案中,所述肿瘤抗原优选免疫抑制分子或免疫检查点蛋白,例如PD-1。在一个或多个实施方案中,表达功能分子(例如PD-1抗体)的核酸在电转混合物中的浓度为1-20nmol/L,优选2-10nmol/L,更优选3.72nmol/L。
在一个或多个实施方案中,含有多肽编码序列的核酸为核酸构建体,优选为表达载体。
在一个或多个实施方案中,所述表达载体含有可被转座酶识别的位点,并且所述激活的免疫细胞中还转化有表达转座酶的核酸。所述转化优选为电转。在一个或多个实施方案中,表达转座酶的核酸在电转混合物中的浓度为1-100nmol/L,优选20-60nmol/L,更优选42.29nmol/L。
在一个或多个实施方案中,所述表达载体是非病毒载体,例如为pNB328。
在一个或多个实施方案中,所述免疫细胞是T细胞、NK细胞或NKT细胞;优选地,所述T细胞是CD3+T细胞。
在一个或多个实施方案中,所述方法还包括:(3)培养经电转的免疫细胞。
在一个或多个实施方案中,步骤(3)中的培养温度为27-45℃,优选35-40℃,更优选37.0±1℃。
在一个或多个实施方案中,步骤(3)中的培养的CO
在一个或多个实施方案中,步骤(3)中的培养时间为至少3天,优选至少5天、更优选3-13天。
在一个或多个实施方案中,步骤(3)中的培养的培养基为含有或不含5%血清或其替代物的AIM-V培养基。优选地,所述培养基中还含有细胞因子,例如IL-7和/或IL-15。优选地,IL-7的终浓度为1-25ng/mL,IL-15的终浓度为1-25ng/mL。优选地,所述细胞因子在所述培养进行0-6小时后加入所述培养基。
附图说明
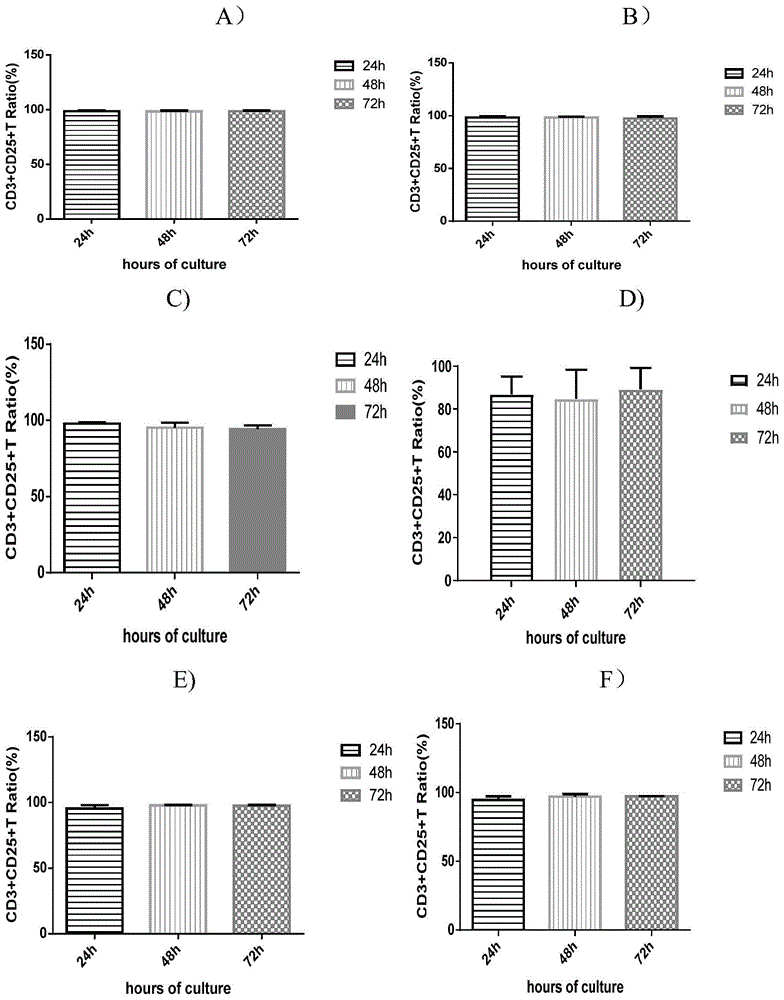
图1是不同激活试剂分别在24h、48h、72h小时内对T细胞的激活效果。A显示了CD3抗体激活分选后T细胞24h、48h、72h后的CD3+CD25+T细胞比例。B显示了CD3抗体/CD28抗体激活分选后T细胞24h、48h、72h后的CD3+CD25+T细胞比例。C显示了CD3抗体/4-1BB抗体激活分选后T细胞24h、48h、2h后的CD3+CD25+T细胞比例。D显示了CD3抗体/4-1BBL抗原激活分选后T细胞24h、48h、72h后的CD3+CD25+T细胞比例。E显示了Miltenyi MACS GMP TransActCD3/28磁珠激活分选后T细胞24h、48h、72h后的CD3+CD25+T细胞比例。F显示了DynabeadsCD3/28磁珠激活分选后T细胞24h、48h、72h后的CD3+CD25+T细胞比例。
图2是CD3抗体激活不同时间的细胞培养结果。A显示了分选的T细胞经CD3抗体激活24h、48h、72h并进行电转后第3、5、7、9、11和13天的细胞活率。B显示了分选的T细胞经CD3抗体激活24h、48h、72h并进行电转后第3、5、7、9、11和13天的CD3+MSLN CAR+T细胞比例。C显示了分选的T细胞经CD3抗体激活24h、48h、72h并进行电转后第3、5、7、9、11和13天的CD3+MSLN CAR+T细胞增殖曲线。
图3是CD3抗体/CD28抗体激活不同时间的细胞培养结果。A显示了分选的T细胞经CD3抗体/CD28抗体激活24h、48h、72h并进行电转后第3、5、7、9、11和13天的细胞活率。B显示了分选的T细胞经CD3抗体/CD28抗体激活24h、48h、72h并进行电转后第3、5、7、9、11和13天的CD3+MSLN CAR+T细胞比例。C显示了分选的T细胞经CD3抗体/CD28抗体激活24h、48h、72h并进行电转后第3、5、7、9、11和13天的CD3+MSLN CAR+T细胞增殖曲线。
图4是CD3抗体/4-1BB抗原激活不同时间的细胞培养结果。A显示了分选的T细胞经CD3抗体/4-1BBL抗原激活24h、48h、72h并进行电转后第3、5、7、9、11和13天的细胞活率。B显示了分选的T细胞经CD3抗体/4-1BBL抗原激活24h、48h、72h并进行电转后第3、5、7、9、11和13天的CD3+MSLN CAR+T细胞比例。C显示了分选的T细胞经CD3抗体/4-1BBL抗原激活24h、48h、72h并进行电转后第3、5、7、9、11和13天的CD3+MSLN CAR+T细胞增殖曲线。
图5是CD3抗体/4-1BBL抗体激活不同时间的细胞培养结果。A显示了分选的T细胞经CD3抗体/4-1BB抗体激活24h、48h、72h并进行电转后第3、5、7、9、11和13天的细胞活率。B显示了分选的T细胞经CD3抗体/4-1BB抗体激活24h、48h、72h并进行电转后第3、5、7、9、11和13天的CD3+MSLN CAR+T细胞比例。C显示了分选的T细胞经CD3抗体/4-1BB抗体激活24h、48h、72h并进行电转后第3、5、7、9、11和13天的CD3+MSLN CAR+T细胞增殖曲线。
图6是Miltenyi MACS GMP TransAct CD3/28磁珠激活不同时间的细胞培养结果。A显示了分选的T细胞经Miltenyi MACS GMP TransAct CD3/28磁珠激活24h、48h、72h并进行电转后第3、5、7、9、11和13天的细胞活率。B显示了分选的T细胞经Miltenyi MACS GMPTransAct CD3/28磁珠激活24h、48h、72h并进行电转后第3、5、7、9、11和13天的CD3+MSLNCAR+T细胞比例。C显示了分选的T细胞经Miltenyi MACS GMP TransAct CD3/28磁珠激活24h、48h、72h并进行电转后第3、5、7、9、11和13天的CD3+MSLN CAR+T细胞增殖曲线。
图7是Dynabeads CD3/28磁珠激活不同时间的细胞培养结果。A显示了分选的T细胞经Dynabeads CD3/28磁珠激活24h、48h、72h并进行电转后第3、5、7、9、11和13天的细胞活率。B显示了分选的T细胞经Dynabeads CD3/28磁珠激活24h、48h、72h并进行电转后第3、5、7、9、11和13天的CD3+MSLN CAR+T细胞比例。C显示了分选的T细胞经Dynabeads CD3/28磁珠激活24h、48h、72h并进行电转后第3、5、7、9、11和13天的CD3+MSLN CAR+T细胞增殖曲线。
具体实施方式
应理解,在本发明范围中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成优选的技术方案。
本发明所要解决的技术问题是针对目前病毒载体转化细胞(例如免疫细胞)制备带来的工艺操作复杂,成本高昂等问题。同时,先电转后激活的非病毒载体转化细胞制备的方式造成细胞损伤大,难以存活,后期体外扩增能力有限。此外,转染mRNA形式的工艺路径,和电转染DNA后快速回输制备工艺路径均存在质控时间长于细胞制备时间,外源基因物质未长期整合至基因组,无法长期发挥有效功能的问题。
为此,本发明提供一种新的工程改造的免疫细胞的制备方法,包括步骤:(1)先使用激活剂激活待转入的核酸的免疫细胞,获得激活的免疫细胞,然后(2)再将该含有核酸电转入该激活的免疫细胞中。所述方法还包括步骤:(3)培养经电转的免疫细胞。本发明发现,采用本发明的方法获得的工程改造的免疫细胞,其体外扩增能力优异,具有较高的细胞活率,且此方法极大地简化了工程改造的免疫细胞制备流程,并提高了制备工艺的稳定性,降低了生产制备成本。
本文中,免疫细胞包括但不限于T细胞、NK细胞和NKT细胞。在示例性实施方案中,使用T细胞。
本文中,在将多肽编码序列导入免疫细胞之前使用“激活剂”将免疫细胞活化,有助于缓解细胞制备中的细胞损伤,提高细胞活力和存活比例。理论上,可使用本领域已知的任何可用于免疫细胞活化的试剂。在免疫细胞是T细胞(特别是CD3+T细胞)的示例性实施方案中,所述激活剂包括选自以下的一种或多种:CD3抗体、CD28抗体、4-1BB抗体、4-1BBL抗原。
在示例性实施方式中,CD3抗体具有SEQ ID NO:1所示的序列,CD28抗体具有SEQID NO:2所示的序列,4-1BB抗体具有SEQ ID NO:3所示的序列,4-1BBL抗原具有SEQ ID NO:4所示的序列。
激活的过程包括在激活剂和细胞接触的条件下孵育免疫细胞。在孵育混合物中,激活剂终浓度、免疫细胞的浓度以及二者的比例不受限制。例如,激活剂可以包被在固相载体上,包被液的终浓度可为1-20μg/ml,例如1、5、10、15或20μg/ml。激活剂与免疫细胞的浓度比可为1-20μg/ml:2.45-2.8×10
激活孵育所需的培养基可以是任何适合免疫细胞(例如T细胞)生长的商用或自制培养基。在一个或多个实施方案中,使用含有或不含5%血清或其替代物的AIM-V培养基进行激活孵育。优选地,所述培养基中还含有细胞因子,例如IL-7和/或IL-15;优选地,IL-7的终浓度为1-50ng/mL,IL-15的终浓度为1-50ng/mL。
所述激活剂可以溶质的形式存在于孵育混合物中,或者其可固定在固相载体上。可用于固定激活剂(例如抗体)的固相载体本领域周知,例如磁珠或容器壁。在一些实施方案中,所述激活剂为固定在磁珠上的CD3抗体和CD28抗体;优选地,所述激活剂为MiltenyiMACS GMP TransAct CD3/28磁珠和/或CTS Dynabeads CD3/28。在一些实施方案中,所述激活剂为固定在容器壁上的CD3抗体,CD3抗体和CD28抗体,CD3抗体和4-1BB抗体,或CD3抗体和4-1BBL抗原;优选地,所述容器为T75瓶。
发明人发现,24-72小时的激活时间均可以显著提升转化核酸获得的T细胞的扩增能力和活力。本领域技术人员容易知晓,使用小于24或大于72小时之外的激活时间也应可以获得相似或相应的细胞(例如T细胞)活力提升。在具体实施方案中,使用容器包被的CD3抗体激活分选的T细胞24-72小时后电转,优选激活48小时;使用容器包被的CD3抗体和CD28抗体激活分选的T细胞24-72小时后电转,优选激活48小时;使用容器包被的CD3抗体和4-1BBL抗原激活分选的T细胞24-72小时后电转,优选激活48小时;使用容器包被的CD3抗体和4-1BB抗体激活分选的T细胞24-72小时后电转;使用包被CD3抗体和CD28抗体的MiltenyiMACS GMP TransAct CD3/28磁珠激活分选的T细胞24-72小时后电转,优选激活72小时;使用包被CD3抗体和CD28抗体的Dynabeads CD3/28磁珠激活分选的T细胞24-72小时后电转,优选激活48-72小时。在一个或多个实施方案中,Miltenyi MACS GMP TransAct CD3/28磁珠的终浓度为4mL/1×10
激活前,免疫细胞经过分选。本领域知晓通常用于分选免疫细胞特别是T细胞的方法,例如抗体分选或流式细胞术。在一个或多个实施方案中,所述T细胞是CD3+T细胞。
本文中,核酸转化优选电转。通常,将电转混合物在电转装置中电击。示例性地,所述电转混合物包含:核酸、如本文所述方法激活的免疫细胞和电转液。在具体实施例中,电转装置采用为Lonza Nucleofactor 4D或Maxcyte电转仪(LONZA设备的电转液为V4XP-3024;Maxcyte设备的电转液为Gibco Opti-MEM
本发明方法适合任何大小的核酸,包括至少200bp、至少500bp、至少1000bp、至少2000bp或至少4000bp的核酸,例如4000-8000bp的核酸。本发明方法适合同时转化一种、两种或多种不同大小的核酸。
本文中,向免疫细胞中转化的核酸可以含有多肽编码序列。示例性的多肽包括CAR和功能蛋白。在示例性实施方案中,所述CAR是靶向MSLN的CAR。含有多肽编码序列的核酸在电转混合物中的浓度为1-20nmol/L,更优选为2-10nmol/L,例如3.09nmol/L。
含有多肽编码序列的核酸包括核酸构建体,优选为表达载体。当所述核酸是表达载体时,所述多肽用于在细胞中表达。本文中,用于表达多肽(例如CAR)的载体可以是非病毒载体或病毒载体。
含有多肽(例如CAR)编码序列的核酸优选为非病毒表达载体。这样的表达载体不受限制,任何可在T细胞中引导外源编码序列表达的载体均可用于本发明,例如基于转座系统的载体。在一个或多个实施方案中,载体可为商用质粒,商用质粒可以通过商购购买现成质粒,也可以通过委托合成(例如CDMO),例如:可以购买金斯瑞现有质粒。质粒用量可为20-500μg/ml,例如30-400μg/ml、40-300μg/ml、50-250μg/ml、60-180μg/ml。
基于转座系统的载体通常具有可被转座酶识别的位点,通常是反向重复序列(ITR)。在转座酶的作用下,转座子之间的片段会被切割和整合到基因组或DNA序列的特定位置。转座酶的编码序列可与多肽(例如CAR)编码序列位于相同核酸,从而转入T细胞。或者,所述激活的T细胞中还转化有表达转座酶的核酸(例如表达载体或mRNA)。
基于转座系统的载体包括:改造的或未改造的Sleeping Beauty转座子系统载体或PiggyBac转座子系统载体,优选地为改造的PiggyBac转座子系统载体。在示例性实施方案中,含有CAR的编码序列的核酸和含有转座酶编码序列的核酸是CN105154473A中公开的pNB328转座子系统载体,该专利申请的全部内容通过引用纳入本文。载体及其制备方法参照CN105154473A中公开的pNB328-EGFP载体。
本文所述CAR不受限制,可以是具有胞外结构域、跨膜结构域和胞内结构域的任何CAR,所述胞外结构域识别并结合抗原内,胞内结构域用于传导信号或刺激下游分子。在示例性实施方案中,CAR是靶向MSLN的CAR包含胞外抗MSLN抗体、铰链区、跨膜区、胞内区(包括信号转导结构域和/或共刺激结构域)。所述抗MSLN抗体的示例性序列如SEQ ID NO:5所示。所述激活的T细胞中还可具有其他感兴趣的功能蛋白,例如PD-1抗体。这样的T细胞转化有表达所述蛋白的核酸,例如表达载体pNB328。所述核酸可以与所述含有CAR的编码序列的核酸一起转入或分别转入。所述转化优选为电转。在示例性实施方案中,CAR如CN202111681582.0中所述,本文将其全部内容以引用的方式纳入本文。
电转后的免疫细胞通常需要扩大培养。该培养可使用本领域已知的适合免疫细胞生长的任何条件和培养基。示例性地,本发明电转后的T细胞在含有或不含5%血清或其替代物的AIM-V培养基中于37℃,5%CO
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
实施例1
1、根据所需电转的细胞量用激活试剂包被T75瓶(每瓶1.0
2、配制培养基(AIM-V+5%SR),放置培养箱预热。
3、分选完成后取含1.05×10
4、将所有激活后的细胞合并混匀后,取样计数并送检CD3+CD25+细胞比例。
上述激活剂中,CD3抗体(ACRO公司,货号为CDD-H5224)序列如SEQ ID NO:1所示;CD28抗体(ACRO公司生产,货号为CD8-H82F2)序列如SEQ ID NO:2所示;4-1BB抗体的序列如SEQ ID NO:3所示;4-1BBL(ACRO公司生产,货号为41B-H5256)的序列如SEQ ID NO:4所示。
图1的A-F结果显示,CD3抗体,CD3抗体/CD28抗体,CD3抗体/4-1BB抗体,CD3抗体/4-1BBL抗原,Miltenyi MACS GMP TransAct CD3/28磁珠,Dynabeads CD3/28磁珠在激活分选后T细胞24h、48h、72h后的CD3+CD25+T细胞比例在80%-100%之间,激活效果良好。
实施例2
取实施例1中CD3抗体激活的T细胞,每管1×10
图2的A-C的结果显示:1)随着培养时间的延长,CD3抗体激活各组CD3+MSLN CAR+T阳性率下降,培养至第7天时阳性率稳定;2)3例样本数据显示至第13天时,48h组的阳性率(23.6%、19.5%、25.3%)较其它组有优势,其中48h组显著高于24h组(P=0.0128);3)培养至第13天时,48h组显著高于72h组(P=0.0042)。
实施例3
取实施例1中CD3抗体/CD28抗体激活的T细胞,每管1×10
结果如图3的A-C所示:1)随着培养时间的延长,CD3抗体/CD28抗体激活各组CD3+MSLN CAR+T阳性率下降,培养至第7天时阳性率稳定;2)3例样本数据显示至13天时,48h组阳性率(16.4%、14.0%、18.3%)显著高于24h组(P=0.0079)和72h组(P=0.0397);3)培养至第13天时,48h组显著高于72h组(P=0.0366)。
实施例4
取实施例1中CD3抗体/4-1BBL抗原激活的T细胞,每管1×10
结果如图4,A-C所示:1)随着培养时间的延长,CD3抗体/4-1BBL激活各组CD3+MSLNCAR+T阳性率下降,培养至第7天时阳性率稳定;2)3例样本数据显示至13天时,48h组阳性率(18.7%、11.9%、22.2%);3)培养至day13,48h组阳性细胞总量显著高于24h组(P=0.0216)。
实施例5
取实施例1中CD3抗体/4-1BB抗体激活的T细胞,每管1×10
结果如图5,A-C所示:1)随着培养时间的延长,CD3抗体/4-1BB抗体激活阳性率下降,培养至第7天时阳性率稳定;2)培养至第13天时,CD3抗体/4-1BB抗体激活各组阳性率无显著性差异(5%~20%);3)培养至第13天时,CD3抗体/4-1BB抗体激活组间无显著性差异。
实施例6
取实施例1中Miltenyi MACS GMP TransAct CD3/28磁珠激活的T细胞,每管1×10
结果如图6,A-C所示:1)随着培养时间的延长,Miltenyi MACS GMP TransActCD3/28磁珠阳性率下降。2)培养至第13天,48h组阳性率显著高于24h组(P=0.0479),72h组显著高于24h组(P=0.0003)。2例样本数据显示至第13天,48h组的阳性率(36.9%、24.3%)较其他组有优势,1例样本数据显示至第13天,72h组阳性率(34.2%)较其他组有优势,3例样本数据不一致。3)培养至第13天,72h组阳性细胞总量均显著高于24h组(P=0.0447)和48h组(P=0.0057)。
实施例7
取实施例1中Dynabeads CD3/28磁珠激活的T细胞,每管1×10
结果如图7,A-C所示:1)随着培养时间的延长,Dynabeads CD3/28磁珠激活阳性率下降,培养至第7天阳性率稳定;2)培养至第13天,48h组阳性率显著高于24h组(P=0.0304);2例样本数据显示至第13天,48h阳性率(36.4%、26.5%)较其他组有优势,1例样本数据显示第13天,2h阳性率(42.0%)较其他组有优势,3例样本数据不一致;3)培养至第13天,各组间无显著性差异。
本发明序列
n=Ψor p,pseudouridine
