一种羧基磁珠偶联蛋白的试剂盒及其制备方法
文献发布时间:2024-04-18 20:00:50
技术领域
本发明属于生物技术领域,具体涉及一种羧基磁珠偶联蛋白的试剂盒及其制备方法。
背景技术
磁微粒化学发光免疫分析是将磁性分离技术、化学反光技术、免疫分析技术相结合起来的一种新兴分析方法。将免疫检测反应所需的抗体或抗原等蛋白偶联至磁珠表面,需要以磁性微粒作为反应发生的载体,其凭借独特的三维表面和较高的比表面积,可以保证磁微粒表面固定足够的蛋白并且充分保持蛋白(抗体/抗原)活性,实现对目标分子的有效捕获,因此获得更高的检测灵敏度。磁微粒的超顺磁性在磁场下可以实现多次磁分离操作,有利于提高仪器检测的全自动化程度。因此,磁微粒化学发光检测技术凭借其自身优势,目前已被广泛应用于生物医学的检测领域,磁微粒化学发光检测技术中很关键的一个环节就是如何高效的实现磁微粒对蛋白的偶联。
用于化学发光的磁珠粒径基本在1-3μm左右,对抗体等蛋白的偶联中常用的磁珠为羧基磁珠。羧基磁珠表面分布有羧基(-COOH)官能团,羧基基团在被EDC(1-乙基-(3-二甲基氨基丙基)碳酰二亚胺,1-(3-Dimethylaminopropyl)-3-ethylcarbodiimidehydrochloride,EDC)活化后,形成活性O-酰基异脲中间体,该中间体容易被反应溶液中蛋白质的伯氨基团亲核取代形成酰胺键,从而实现磁珠与蛋白的共价偶联。现有技术中对羧基磁珠的偶联方法也是通过EDC活化偶联的方式。专利申请CN103323603A公开了一种在磁珠表面共价偶联蛋白质的方法,包括如下步骤:(1)将磁珠与活化剂共孵育,得到活化后的磁珠;(2)将所述活化后的磁珠与蛋白质共孵育,得到偶联有所述蛋白质的磁珠;(3)将所述偶联有所述蛋白质的磁珠用封闭液进行处理,封闭表面的活性位点;(4)将步骤(3)得到的磁珠边进行振荡边过筛,收集过筛后的磁珠。此方法蛋白偶联效率高、重复性好、具有通用性、不影响偶联在磁珠上的蛋白质的生物学活性,但是需要对磁珠进行额外的过筛处理。
在磁珠与蛋白的偶联过程中,会用到MES(2-(N-Morpholino)ethanesulfonicacid,4-Morpholineethanesulfonic acid,2-(N-吗啡啉)乙磺酸)缓冲液,因其不含有伯氨基团,不会干扰磁珠与蛋白的偶联过程,因此作为羧基磁珠偶联蛋白的常用缓冲液。在羧基磁珠偶联蛋白的方法中常见的分为一步法和两步法。一步法偶联过程中的活化剂有可能对所偶联的目标蛋白活性造成不利影响,两步法的偶联规避了活化剂对蛋白的直接影响,通过使用NHS(N-Hydroxy succinimide,N-羟基琥珀酰亚胺)或者sulfo-NHS(N-Hydroxysulfosuccinimide sodium salt,N-羟基硫代琥珀酰亚胺)稳定了活化中间体提高了偶联效率。专利申请CN114137227A公开了一种血清淀粉样蛋白A抗体与磁珠的偶联方法及试剂盒,采用浓度为5mmol/L的2-(N-吗啡啉)乙磺酸作为缓冲液,调整缓冲液的pH为6.1-6.4;利用该缓冲液重悬、活化磁珠,并与血清淀粉样蛋白A抗体进行偶联、封闭制得R1,即完成血清淀粉样蛋白A抗体与磁珠的偶联,该方法中使用的活化剂是EDC-NHS混合液,提高了血清淀粉样蛋白A抗体氨基与羧基磁珠的偶联的效率,但是忽视了对偶联过程中蛋白投料的精细把控,使用过量的蛋白进行偶联,这样不仅造成蛋白的浪费,增加了成本,也使得偶联效率降低。同时,过量的蛋白进行偶联反应,会存在一定程度的蛋白是通过疏水作用等非成键方式结合到磁珠表面,随着后续储存时间的延长,吸附结合的蛋白会逐渐脱落,造成在发光检测反应中出现信号值逐渐降低的趋势,严重影响了免疫磁珠制备过程中的批次稳定性。
所以,现有技术中缺少一种能够避免磁珠活化过程中活化剂对蛋白的变形影响,且投入蛋白量较少、节约蛋白使用量、降低偶联成本以及提高蛋白偶联效率、维持磁珠及蛋白的良好性能的磁珠偶联蛋白的方法。
发明内容
本发明针对现有技术存在的问题,提供了一种羧基磁珠偶联蛋白的试剂盒及制备方法,从磁珠表面积对蛋白的吸附量方面入手合理调整的蛋白投料比例,节约了蛋白原料,降低偶联的成本;采用独特的双封闭处理方法,既降低了磁珠在化学发光中的非特异性吸附,又能够使磁珠不发生团聚,保持单分散的良好状态。
为实现上述目的,本发明采用的技术方案如下:
本发明提供了一种羧基磁珠偶联蛋白的方法,通过将羧基磁珠进行清洗、活化以及二次清洗处理后,与蛋白混匀进行孵育偶联,之后双封闭处理,保存;
所述的蛋白与羧基磁珠的质量比为4-6:100;所述的双封闭方法为,先使用化学封闭,再使用生物封闭。
进一步优选地,所述的蛋白与磁珠的质量比为1:20。
优选地,所述清洗的溶液为磁珠反应缓冲液;所述活化的溶液为活化缓冲液。
优选地,所述磁珠反应缓冲液为MEST溶液;其中,所述的磁珠反应缓冲液的pH为5-5.5,浓度为25-200mmol/L。
进一步优选地,所述的磁珠反应缓冲液的pH为5;浓度为50mmol/L。
优选地,所述活化缓冲液包括磁珠反应缓冲液和活化剂;活化缓冲液需要现配现用。
优选地,所述的活化剂为EDC与NHS的混合液。
优选地,所述活化时间为20分钟。
优选地,所述EDC与sulfo-NHS的质量比为1:1-2。
进一步优选地,所述EDC与sulfo-NHS的质量比1:2。
优选地,所述的活化方法包括:使用磁珠反应缓冲液配制两种活化剂(EDC和sulfo-NHS)作为活化缓冲液,将活化剂加入磁珠中进行涡旋混匀,室温25℃旋转孵育20分钟。
优选地,所述化学封闭的溶液为乙醇胺;所述生物封闭的溶液为含有1%BSA的TBS缓冲液。
进一步优选地,所述的乙醇胺浓度为200mmol/L,pH为7.4;所述的TBS缓冲液包括1%BSA和50mM TBS,pH为7.4。
根据上述的方法,具体包括以下步骤:
S1、清洗:将磁珠超声处理后,使用磁珠反应缓冲液清洗;
S2、活化:将活化缓冲液加入清洗后的磁珠中,混匀,室温孵育;
S3、二次清洗:使用磁珠反应缓冲液二次清洗活化后的磁珠;
S4、制备偶联蛋白:使用磁珠反应缓冲液配制蛋白溶液;
S5、偶联:将配制的蛋白溶液加入二次清洗后的磁珠中,混匀,室温孵育;
S6、双封闭:偶联结束后,先使用乙醇胺进行化学封闭,再使用含有1%BSA的TBS缓冲液进行生物封闭;
S7、保存:封闭结束后,使用TBST缓冲液清洗磁珠,将磁珠保存于磁珠保存液中。
优选地,步骤S1中所述的清洗为2-3次。
进一步优选地,步骤S1中所述的清洗的方法包括:先用超声短暂处理后,再用MEST缓冲液清洗。
优选地,步骤S2中所述的活化缓冲液中的活化剂与磁珠的质量比为2-3:1。
进一步优选地的,步骤S2中所述活化缓冲液中的活化剂与磁珠的质量比为3:1。
优选地,步骤S2中所述的孵育时间为10-20min。
进一步优选地,所述的孵育时间为20min。
优选地,步骤S5中所述的孵育时间为1-3h。
进一步优选地,所述的孵育时间为2h。
优选地,所述的保存液包括0.1% BSA、0.1% Proclin300和50mM TBS。
进一步优选地,所述的保存液的pH为7.4。
本发明还提供了一种免疫磁珠,由上述方法制备成。
本发明还提供了一种试剂盒,包括上述免疫磁珠。
本发明中所涉及的名词中英文释义:
磁珠、磁微粒:magnetic particle,一般指含有磁性的聚合物颗粒
NaCl:Sodium chloride,氯化钠
MES:2-(N-Morpholino)ethanesulfonic acid,4-Morpholineethanesulfonicacid,2-吗啉乙磺酸
COOH:carboxyl group,羧基
EDC:1-(3-Dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,1-(3-二甲基氨基丙基)-3-乙基碳二亚胺
NHS:N-Hydroxy succinimide,N-羟基琥珀酰亚胺
Sulfo-NHS:N-Hydroxysulfosuccinimide sodium salt,N-羟基硫代琥珀酰亚胺
pH:hydrogen ion concentration,氢离子浓度指数,用来指示溶液的酸碱度
mM:mmol/L,毫摩尔每升,物质的量浓度单位
BSA:Bovine serum albumin,牛血清白蛋白
BCA:the bicinchoninic acid assay,指测定蛋白浓度的一种实验方法,BCA测浓度指使用BCA试剂盒对蛋白进行浓度测定
PBS:phosphate buffered saline(PBS),磷酸盐缓冲液
TBS:tris buffered saline,三乙醇胺缓冲液
TBST:TBS+Tween 20,指添加了Tween 20表面活性剂的清洗缓冲液,用TBST表示
Proclin 300:液体生物防腐剂
IgG:immunoglobulin G,免疫球蛋白G。
相对于现有技术,本发明具有以下有益效果:
1.使用改良后的偶联工艺,先进行磁珠的活化处理,经过清洗环节后再投入所需偶联的蛋白,可以消除残留的活化剂所造成的蛋白自身的过度交联,保持蛋白的活性;
2.偶联过程中蛋白投料的精细把控,在提高蛋白偶联效率(90%以上)的前提下,节约了蛋白的使用量,降低了偶联的成本。
3.使用双封闭环节且先使用化学封闭再使用生物封闭,可以降低磁珠后续在化学发光应用中的非特异性吸附,还可以有效保持磁珠的单分散状态,不发生团聚现象,维持磁珠及蛋白的良好性能。并且不需要对磁珠进行额外的分选过筛处理。
附图说明
图1为EDC和sulfo-NHS双活化剂对羧基磁珠活化的反应路线图。
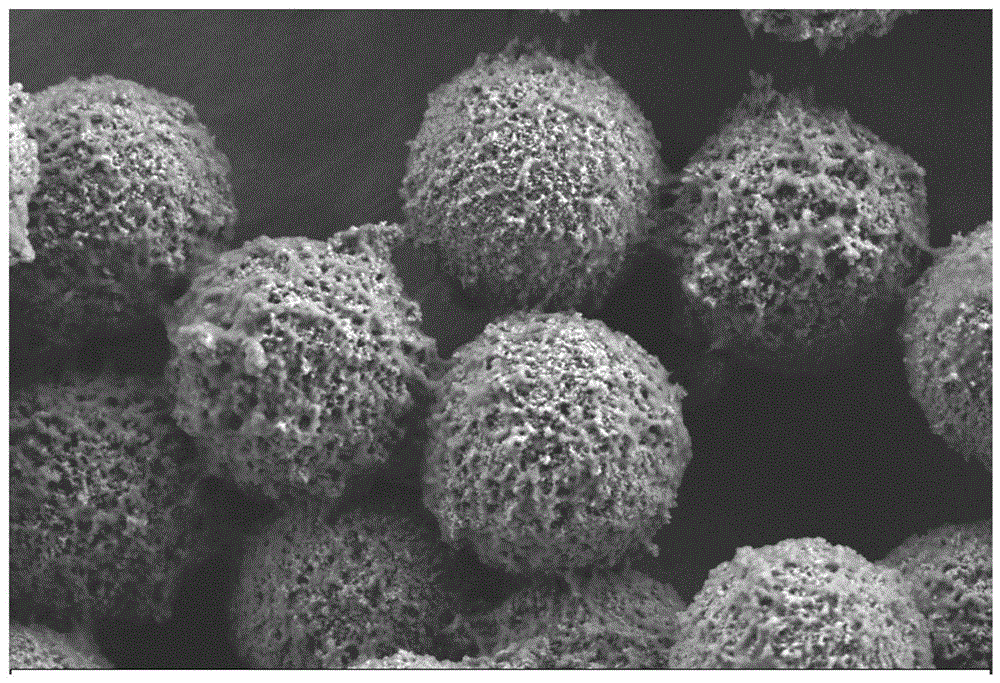
图2为实施例1中双封闭后的磁珠在1μm分辨率下的电镜状态图。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。
本发明用到的蛋白为抗体蛋白鼠抗人IgG抗体购买厂家为科跃仲恺,货号为HG11N003。
本发明用到的磁珠(2.8μm羧基磁珠)购买厂家博岳生物和货号M2800C。
本发明用到的EDC购自阿拉丁试剂,货号为E106172-500g;Sulfo-NHS购自E106172-500g,货号PG82072。
实施例1
1、配制pH为5.0,浓度为50mM的MEST缓冲液(在MES缓冲液中添加体积分数为0.05% Tween 20)。
2、磁珠清洗:取用10mg磁珠混合均匀后,使用pH为5.0、浓度为50mM的MEST缓冲液清洗3次,最后使用MEST缓冲液调整磁珠浓度为10mg/mL。
3、磁珠活化:使用MEST缓冲液配制活化缓冲液(其中活化剂EDC和sulfo-NHS的质量比为1:2),活化缓冲液需要现配现用。将磁珠置于磁力架上磁吸富集磁珠,分别去除磁珠中的上清MEST缓冲液,迅速加入配制的1mL活化缓冲液,以保持磁珠反应浓度为10mg/mL,活化剂总质量与磁珠的质量比为3:1。于涡旋混匀仪上涡旋混匀磁珠,置于旋转混匀仪于室温25℃下孵育20分钟。
4、蛋白制备:使用MEST缓冲液配制蛋白溶液,配置浓度为0.5mg/mL的蛋白溶液,体积为1.5mL,取1mL用于与磁珠偶联,剩余蛋白用于偶联效率测试使用。
5、磁珠清洗:活化结束后,将磁珠置于磁力架上磁吸去除上清,使用MEST缓冲液重悬磁珠,再次磁吸去除上清液。重复清洗磁珠3次。
6、蛋白偶联:最后一遍磁珠清洗结束后,去除洗液,将配制好的蛋白溶液加入磁珠中,加入的蛋白溶液体积1mL,理论投入量为0.5mg,涡旋混匀磁珠,置于旋转混匀仪于室温25℃下孵育2小时。
7、化学封闭:蛋白偶联结束后,磁吸富集磁珠,保留上清用于偶联效率测试。向磁珠混合液中加入终浓度为200mM的乙醇胺,继续涡旋混匀磁珠,置于旋转混匀仪于室温25℃下孵育1小时。
8、生物封闭:磁吸富集磁珠去除上清,向磁珠中加入使用TBS缓冲液配制的含有1%BSA的封闭液,涡旋混匀磁珠,置于旋转混匀仪于室温25℃下孵育1小时。
9、磁珠保存:封闭结束后,磁吸富集磁珠去除上清,使用TBST清洗磁珠3次,用含有0.1%BSA的TBST保存液调整所需的磁珠浓度,置于4℃冰箱保存备用。
10、计算偶联效率:使用BCA蛋白检测试剂盒,测试偶联前后的蛋白溶液的浓度,计算偶联前后的蛋白变化量。
蛋白偶联效率=实际偶联量/(实际偶联量+实际剩余量)×100%。
得到的具体数据如表1所示:
表1实施例1偶联结果
磁珠对蛋白的单层吸附量可以根据以下经验公式大致推算:
S=(6/ρD)(C)
S=达到表面饱和所需的代表蛋白量(mg蛋白/g微球);
C=给定蛋白质的微球表面容量,其大小取决于待偶联蛋白质的大小和分子量(mg蛋白质/聚合物表面),对于IgG抗体(150kD),C=2.5mg/m
6/ρD=给定直径的微球的表面积/质量(ρ=微球密度,聚苯乙烯为1.05g/cm
D=微球的直径,单位为微米。
本发明中所使用的羧基磁珠直径约为2.8μm,经计算磁珠的理论蛋白结合量约为5μg/mg磁珠,所以10mg磁珠的蛋白理论结合量约为50μg,但是实际操作中,一般以10倍饱和量的投入量如进行偶联反应,所以取用10mg的磁珠投入0.5mg左右的蛋白获得的偶联效率最高,这与实际实验中的数据基本相符合。
实施例2
1、配制pH为5.5,浓度为25mM的MEST缓冲液。
2、磁珠清洗:取用10mg磁珠混合均匀后,使用MEST缓冲液清洗3次,最后使用MEST缓冲液调整磁珠浓度为10mg/mL。
3、磁珠活化:使用MEST缓冲液配制活化缓冲液(其中活化剂EDC和sulfo-NHS的质量比为1:1),活化缓冲液需要现配现用。将磁珠置于磁力架上磁吸富集磁珠,分别去除磁珠中的上清MEST缓冲液,迅速加入配制1mL的活化缓冲液,以保持磁珠反应浓度为10mg/mL,活化剂总质量与磁珠的质量比为2:1。于涡旋混匀仪上涡旋混匀磁珠,置于旋转混匀仪于室温25℃下孵育15分钟。
4、蛋白制备:使用MEST缓冲液配制蛋白溶液,配置浓度为0.4mg/mL的蛋白溶液,体积为1.5mL,取1mL用于与磁珠偶联,剩余蛋白用于偶联效率测试使用。
5、磁珠清洗:活化结束后,将磁珠置于磁力架上磁吸去除上清,使用MEST缓冲液重悬磁珠,再次磁吸去除上清液。重复清洗磁珠3次。
6、蛋白偶联:最后一遍磁珠清洗结束后,去除洗液,将配制好的蛋白溶液加入磁珠中,加入的蛋白溶液体积1mL,理论投入量为0.4mg,涡旋混匀磁珠,置于旋转混匀仪于室温25℃下孵育3小时。
7、化学封闭:蛋白偶联结束后,磁吸富集磁珠,保留上清用于偶联效率测试。向磁珠混合液中加入终浓度为200mM的乙醇胺,继续涡旋混匀磁珠,置于旋转混匀仪于室温25℃下孵育1小时。
8、生物封闭:磁吸富集磁珠去除上清,向磁珠中加入使用TBS缓冲液配制的含有1%BSA的封闭液,涡旋混匀磁珠,置于旋转混匀仪于室温25℃下孵育1小时。
9、磁珠保存:封闭结束后,磁吸富集磁珠去除上清,使用TBST清洗磁珠3次,用含有0.1%BSA的TBST保存液调整所需的磁珠浓度,置于4℃冰箱保存备用。
10、计算偶联效率:使用BCA蛋白检测试剂盒,测试偶联前后的蛋白溶液的浓度,计算偶联前后的蛋白变化量。
得到的具体数据如表2所示:
表2实施例2偶联结果
实施例3
1、配制pH为5.2,浓度为200mM的MEST缓冲液。
2、磁珠清洗:取用10mg磁珠混合均匀后,使用MEST缓冲液清洗3次,最后使用MEST缓冲液调整磁珠浓度为10mg/mL。
3、磁珠活化:使用MEST缓冲液配制活化缓冲液(其中活化剂EDC和sulfo-NHS的质量比为1:1.5),活化缓冲液需要现配现用。将磁珠置于磁力架上磁吸富集磁珠,分别去除磁珠中的上清MEST缓冲液,迅速加入配制的1mL活化缓冲液,以保持磁珠反应浓度为10mg/mL,活化剂总质量与磁珠的质量比为2.5:1。于涡旋混匀仪上涡旋混匀磁珠,置于旋转混匀仪于室温25℃下孵育10分钟。
4、蛋白制备:使用MEST缓冲液配制蛋白溶液,配置浓度为0.6mg/mL的蛋白溶液,体积为1.5mL,取1mL用于与磁珠偶联,剩余蛋白用于偶联效率测试使用。
5、磁珠清洗:活化结束后,将磁珠置于磁力架上磁吸去除上清,使用MEST缓冲液重悬磁珠,再次磁吸去除上清液。重复清洗磁珠3次。
6、蛋白偶联:最后一遍磁珠清洗结束后,去除洗液,将配制好的蛋白溶液加入磁珠中,加入的蛋白溶液体积1mL,理论投入量为0.6mg,涡旋混匀磁珠,置于旋转混匀仪于室温25℃下孵育1小时。
7、化学封闭:蛋白偶联结束后,磁吸富集磁珠,保留上清用于偶联效率测试。向磁珠混合液中加入终浓度为200mM的乙醇胺,继续涡旋混匀磁珠,置于旋转混匀仪于室温25℃下孵育1小时。
8、生物封闭:磁吸富集磁珠去除上清,向磁珠中加入使用TBS缓冲液配制的含有1%BSA的封闭液,涡旋混匀磁珠,置于旋转混匀仪于室温25℃下孵育1小时。
9、磁珠保存:封闭结束后,磁吸富集磁珠去除上清,使用TBST清洗磁珠3次,用含有0.1%BSA的TBST保存液调整所需的磁珠浓度,置于4℃冰箱保存备用。
10、计算偶联效率:使用BCA蛋白检测试剂盒,测试偶联前后的蛋白溶液的浓度,计算偶联前后的蛋白变化量。
得到的具体数据如表3所示。
表3实施例3偶联结果
对比例1
与实施例1相比,仅将步骤4和步骤6中偶联的蛋白投入量分别调整为0.1mg、0.3mg、0.8mg、1mg、1.5mg和2mg,其余步骤不变。
得到的具体数据如表4所示:
表4对比例1偶联结果
对比例2
与实施例1相比,区别仅在于:步骤3中活化剂总质量与磁珠的质量比为4:1,其余步骤不变。
得到的具体数据如表5所示:
表5对比例2偶联结果
对比例3
与实施例1相比,区别仅在于:使用MES缓冲液替换实施例1中的MEST缓冲液,其余步骤不变。
得到的具体数据如表6所示:
表6对比例3偶联结果
根据表6结果可知,MES缓冲液会使得磁珠清洗与富集过程中以及磁珠偶联蛋白的过程中出现一定程度的磁珠团聚,而导致其与蛋白偶联效率出现一定程度的降低。
对比例4
与实施例1相比,仅将步骤1中的MEST缓冲液中添加终浓度为150mM的NaCl,其他步骤不变。
得到的具体数据如表7所示:
表7对比例4偶联结果
对比例5
与实施例1相比,仅将步骤1中的MEST缓冲液中的pH调整为6和6.8,其他步骤不变。
得到的具体数据如表8所示:
表8对比例5偶联结果
最后应当说明的是,以上内容仅用以说明本发明的技术方案,而非对本发明保护范围的限制,本领域的普通技术人员对本发明的技术方案进行的简单修改或者等同替换,均不脱离本发明技术方案的实质和范围。
- 一种高能量密度的人造石墨负极材料及其制备方法
- 一种高能量密度锂离子电池的制备方法
- 一种高压实和高能量密度的三元正极材料的制备方法
- 一种低镍高能量密度O3型钠离子电池正极材料及其制备方法
