黄连解毒丸在干预实热上火证候中的应用及检测方法
文献发布时间:2024-04-18 20:00:50
技术领域
本发明涉及一种黄连解毒丸,特别是一种黄连解毒丸在干预实热上火证候中的应用。
背景技术
“实热上火”是中医一种典型且高发的证候,常见症状包括咽喉肿痛、口舌生疮、红肿热痛、便秘等,它是一种亚健康状态,严重时可能引发其他疾病。例如,实热可能导致结直肠癌患者整体生存率较低。“实热上火”证候是逐渐形成和发展的,主要表现为致病程度上的层层累积及致病范围上的逐渐结聚;对“实热上火”证候病因的理解有着悠久的历史。然而,证候信息的多样性和复杂性使得研究难度增大。从课题组前期的研究可以看出,“实热上火”证候与炎症、氧化应激、能量代谢和脂质代谢紊乱密切相关,但具体机制尚不清楚,需要进一步探索。
《黄连解毒丸》(HLJDW)是中国首个获批用于“实热上火”证候的新药,具有良好的临床疗效。初步的小样本临床研究已经确定了一些与炎症和免疫相关的潜在生物标志物(琥珀酸、4-HNE等)。然而,这些生物标志物与证候之间的相关性和潜在机制仍不清楚。因此,亟需通过现代科学语言来解释中医特色的“清热泻火”理论治疗“实热上火”证候。
发明内容
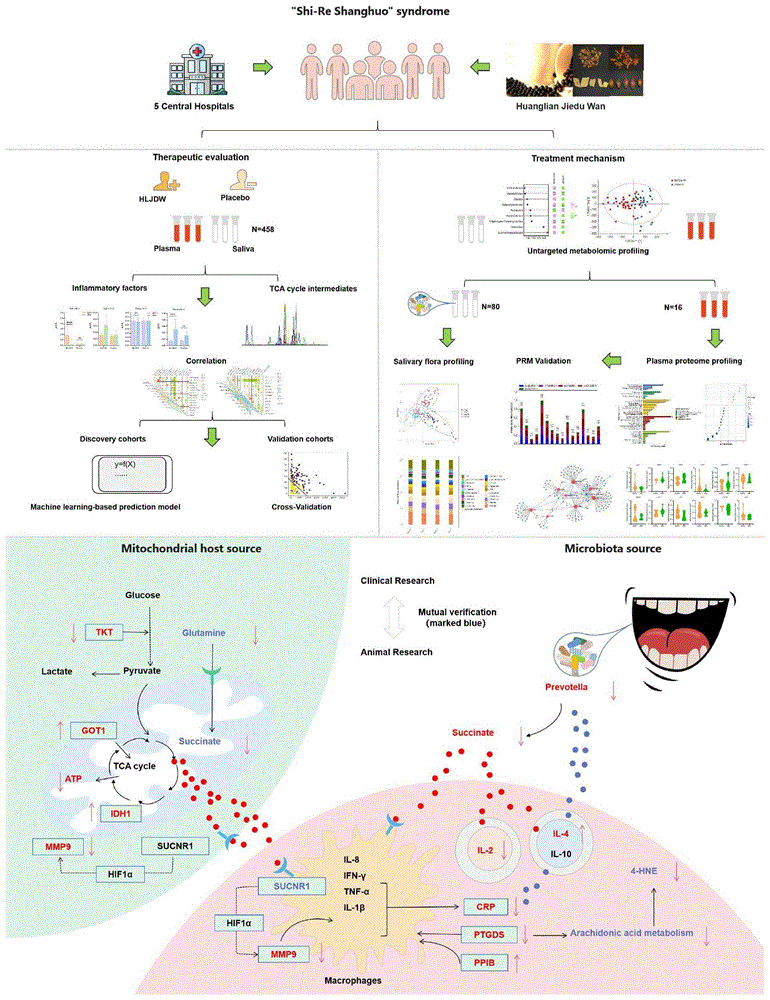
本发明的目的在于,提供一种黄连解毒丸在干预实热上火证候中的应用。本发明从宿主和微生物途径探索黄连解毒丸治疗“实热上火”证候的临床生物标志物及潜在机制,为解释中医特色的“清热泻火”理论治疗“实热上火”证候奠定了科学基础。
本发明的技术方案:黄连解毒丸在干预实热上火证候中的应用,黄连解毒丸通过宿主途径三羧酸循环以及通过微生物途径产生的琥珀酸干预实热上火证候,调节炎症和免疫之间的平衡;黄连解毒丸通过HIF1α/MMP9途径调节下游花生四烯酸代谢。
前述的黄连解毒丸在干预实热上火证候中的应用中,黄连解毒丸通过谷氨酰胺代谢作为回补途径产生的琥珀酸干预实热上火证候。
前述的黄连解毒丸在干预实热上火证候中的应用中,黄连解毒丸干预的实热上火证候中的生物标志物为唾液中IL-2、IL-10、琥珀酸、谷氨酰胺、色氨酸和普雷沃氏菌;以及,血浆中IL-2、IL-4、4-HNE和花生四烯酸。
前述的黄连解毒丸在干预实热上火证候中的应用中,黄连解毒丸包括黄连、黄芩、黄柏和栀子。
前述的黄连解毒丸在干预实热上火证候中的应用中,黄连、黄芩、黄柏和栀子之间的质量配比为3:2:2:3。
黄连解毒丸在治疗由实热上火证候引起的牙龈炎,急性咽炎,复发性口腔溃疡和便秘中的用途。
一种黄连解毒丸治疗实热上火证候效果的检测方法,通过MSD电化学发光法,酶联免疫吸附试验和多组学检测技术进行检测。
前述的一种黄连解毒丸在治疗实热上火证候中效果的检测方法中,多组学检测技术包括非靶向和靶向代谢组学,唾液菌群,蛋白质组学,平行反应监测技术,分子对接和表面等离子体共振技术。
与现有技术相比,本发明通过一项随机、双盲、多中心、安慰剂对照的Ⅱ期临床试验,采用非靶向和靶向代谢组学、唾液微生物组、蛋白质组学和平行反应监测等整合分析技术对黄连解毒丸治疗“实热上火”证候的机制进行研究。相关性分析结果表明,HLJDW可以通过宿主途径三羧酸循环(谷氨酰胺代谢作为回补途径)和微生物途径产生的琥珀酸干预“实热上火”证候,从而调节炎症和免疫之间的平衡,进一步通过HIF1α/MMP9途径,调节下游花生四烯酸代谢,特别是脂质过氧化产物4-HNE。最后,通过建立“实热上火”证候引起的复发性口腔溃疡动物模型,并使用HLJDW进行干预,检测临床结果中发现的潜在途径HIF1α/MMP9中的关键指标(琥珀酸、SUCNR1、谷氨酰胺、4-HNE、花生四烯酸代谢),发现结果与临床一致。
本发明通过现代科学语言从宿主和微生物途径探索黄连解毒丸治疗“实热上火”证候的临床生物标志物及潜在机制,为解释中医特色的“清热泻火”理论治疗“实热上火”证候奠定了科学基础。
附图说明
图1(1)-(3)是HLJDW与安慰剂对“实热上火”患者炎症和三羧酸循环中间产物的影响图;
图1(1)中,A表示唾液中炎症因子和三羧酸循环中间产物在干预前后的变化图;Before:对照组;After:干预组;*p<0.05,**p<0.01,***p<0.001,****p<0.0001。图1(2)中,B表示血浆中炎症因子和三羧酸循环中间产物在干预前后的变化;C表示唾液和血浆中炎症因子的动态网络热图;D表示唾液和血浆中三羧酸循环中间产物的动态网络热图;E表示唾液中炎症因子和三羧酸循环中间产物的动态网络热图;F表示血浆中炎症因子和三羧酸循环中间产物的动态网络热图。在右侧热图中,水平和垂直轴表示测定的唾液/血浆中的炎症因子/三羧酸循环中间产物,热图中的色块表示正相关或负相关系数,色块的大小表示相关系数的绝对值。左侧是另一个环境中与炎症因子/三羧酸循环中间产物相关的血浆/唾液数据,通过线连接。线的粗细表示相关性的强度,颜色表示相关性的显著程度。图1(3)中,G表示炎症因子/三羧酸循环中间产物的逻辑回归分类图;紫色代表给药前,黄色代表给药后。
图2是HLJDW对“实热上火”患者唾液和血浆中差异代谢产物的调节示意图;
图2中,(A,I)表示正离子模式下唾液和血浆中的PCA评分图;(B,J)表示正离子模式下唾液和血浆中的OPLS-DA评分图;(C,K)表示唾液和血浆中正离子模式下OPLS-DA的置换检验图;(D,L)表示负离子模式下唾液和血浆中的PCA评分图;(E,M)表示负离子模式下唾液和血浆中的OPLS-DA评分图;(F,N)表示唾液和血浆中负离子模式下OPLS-DA的置换测试图;(G,O)表示唾液和血浆中差异代谢产物的点-棒热图,水平和垂直轴表示vip值和差异代谢产物;(H,P)表示KEGG分析中唾液和血浆中的代谢通路图;Before-H:“实热上火”组;After-H:HLJDW干预组。
图3是临床试验药物干预“实热上火”患者的唾液菌群分析图;
图3中,(A)表示OTU分析的Venn图;(B)表示PLS-DA评分图;Before-H:HLJDW对照组;After-H:HLJDW干预组;Before-P:安慰剂对照组;After-P:安慰剂干预组;(C,D)表示各组主要菌种在门和属水平上的比例;(E)表示HLJDW组和安慰剂组唾液微生物的差异分析;Before:对照组;After:干预组;*p<0.05,**p<0.01,***p<0.001,****p<0.0001。
图4(1)和图4(2)是“实热上火”患者服用HLJDW后的血浆蛋白质组学分析图;
图4(1)中,(A)表示肽长度分布图;(B)表示从血浆样本中鉴定的蛋白质和肽段数量;(C)表示HLJDW组和“实热上火”组之间差异蛋白热图;(D)表示GO二级分类图;(E)表示KEGG通路分类图;(F)表示COG/KOG功能分类图;(G)表示GO分类的富集分析图;图4(2)中,(H,I)表示Reactome和KEGG通路的富集分析图;(J)表示蛋白相互作用网络图;(K,L)表示代谢产物和差异蛋白网络分析图;(M)表示琥珀酸和差异蛋白网络分析图;(N)表示PRM验证的12个差异蛋白表达图谱。
图5是HLJDW通过宿主和微生物途径干预“实热上火”证候的过程图。
图6是HLJDW代表性成分与SUCNR1的分子对接和SPR验证结果。(A)SUCNR1与HLJDW代表性成分的分子对接图。(B)黄芩苷、小檗碱和京尼平苷与SUCNR的亲和/动力学拟合分析结果。
图7是HLJDW干预“实热上火”大鼠模型视图;
图7中,(A)表示动物模型构建过程;(B)表示给药后大鼠体重和口腔黏膜厚度的变化图;(C)大鼠口腔黏膜的组织病理学切片;(D)表示血浆中琥珀酸、谷氨酰胺、SUCNR1、4-HNE等关键指标的测定图;(E)表示给药后花生四烯酸途径代谢产物的变化图;Con.空白对照组;Mod.模型组;L-H.低剂量HLJDW组;M-H.中剂量HLJDW组;H-H.高剂量HLJDW组;Pos.阳性药组.模型组与空白对照组相比:#p<0.05,##p<0.01,###p<0.001,####p<0.0001;模型组与各治疗组比较:**p<0.05,**p<0.01,***p<0.001,****p<0.0001。
具体实施方式
下面结合附图和实施例对本发明作进一步的说明,但并不作为对本发明限制的依据。
实施例。HLJDW是中国首个获得临床研究的证候类中药新药,源于《肘后备急方》黄连解毒汤,已应用1600多年。它由黄连、黄芩、黄柏和栀子按比例3:2:2:3组成。本研究团队对其进行了化学成分和质量控制研究,动物体内外代谢机制探讨以及“实热上火”证候的药代动力学-药效学相关性研究,阐明了其在体内的活性成分、作用过程和效果。此外,它对源自“实热”的牙龈炎和阿尔茨海默病有良好的治疗效果,其干预机制与炎症和免疫紧密相关。此外,我们的初步临床研究发现,HLJDW治疗“实热上火”证候与三磷酸腺苷(ATP)和三羧酸循环(TCA)有关。尽管研究取得一些进展,但仍缺乏科学结果来支持HLJDW在临床角度上治疗“实热上火”的机制。
近年来,中医证候的科学内涵与代谢产物、免疫炎症、微生物组和蛋白质等现代生物分子机制密切相关。代谢组学是一种强大的技术,可以提供生物途径或突变的微小信息,从而揭示疾病进展的机制并发现诊断生物标志物。人体微生物组与宿主之间的稳态对于减少炎症和维持健康的宿主组织至关重要。口腔微生物组与许多口腔系统性疾病(如龋齿、牙龈炎、牙周炎)密切相关。蛋白质组学作为新型精准医学预防措施的关键工具日益重要。系统生物学和生物信息学分析技术的快速发展为探索HLJDW治疗“实热上火”证候的机制提供了便利条件,这可为临床诊断和干预提供新的思路和目标。
在我们的研究中,我们应用整合技术探索并发现HLJDW治疗“实热上火”证候的临床生物标志物。评估了229名受试者在用药前后的血浆和唾液样本的疗效。首先,采用高敏多因子电化学发光法对HLJDW的抗炎疗效进行评估,并确定了与“实热上火”证候密切相关的10种炎症因子。此外,采用基于液相色谱-串联质谱技术的定量分析方法来确定三羧酸循环中间代谢产物。然后,建立逻辑回归模型来预测HLJDW对“实热上火”证候的干预效果,并进行简单和双重交叉验证。随后,选择40名证候显著改善的患者研究其干预机制。采用非靶向代谢组学方法发现药物在体内的小分子代谢产物。此外,利用唾液微生物组的16S rDNA基因测序寻找与代谢产物和炎症因子相关的微生物。最后,应用血浆蛋白质组学发现和验证可能将这些变量联系在一起的差异蛋白。基于上述发现的关键临床生物标志物和靶点,建立了炎症因子、代谢产物、微生物组成和靶蛋白的综合分析,以阐明HLJDW治疗“实热上火”证候的关键环节。最后,利用临床结果作为基础,本研究利用“实热上火”证候复发性口腔溃疡(ROU)大鼠模型对潜在通路中的关键上下游成分进行测定,实现了临床和动物的双向验证。
1、材料和方法
1.1、研究人群
天津中医药大学第二附属医院是临床研究的负责单位,本院伦理委员会在临床试验前审核批准了研究方案和知情同意(批准号:2019-037-02),其他临床试验研究单位在试验前也分别进行了伦理批准或伦理记录。本研究收集从2020年6月到2021年3月天津中医药大学第二附属医院,黑龙江中医药大学第二附属医院,辽宁中医药大学附属医院,成都中医大学附属医院,湖南中医药大学第一附属医院门诊病例。根据证候纳入和排除标准结合西医诊断口腔溃疡、牙龈炎和急性咽炎临床表现,纳入240例,其中HLJDW试验组120例,安慰剂组120例,1(0.42%)例患者没有完成试验,和239(99.58%)例完成。10例未收集生物样本。因此,本研究共收集了229名受试者。
材料为:Mix-3000震荡混匀器购于杭州米欧仪器有限公司;Mikro 220R台式高速冷冻离心机购于Hettich公司;人ATP合酶Elisa试剂盒(Cat:OM626460);人ACTH Elisa试剂盒(Cat:OM527142);人4-HNE Elisa试剂盒(Cat:OM521593)购于Omnimabs(加利福尼亚州,美国)。所有操作均按照制造商的建议进行。
试药及服用方法
黄连解毒丸及其模拟剂(安慰剂):规格:2.5g/袋。由贵州百灵企业集团制药股份有限公司生产提供。试验组口服黄连解毒丸,安慰剂组口服黄连解毒丸模拟剂,两组服用方法均为1次2袋,1日2次。每例受试者用药期至少3天,用药至“实热火毒证评价量表”中列出的主要症状消失或满5天,以先到达的时间为准。
疗效判断方法
中医证候积分
(1)痊愈:症状消失或基本消失,证候总积分减少≥95%;
(2)显效:症状明显改善,证候总积分减少≥70%,<95%;
(3)有效:症状好转,证候总积分减少≥30%,<70%;
(4)无效:症状无改善或有加重,证候总积分减少<30%。
依据实热火毒证评价量表,计算证候总积分,疗效用疗效指数进行评价。疗效指数=(治疗前证候积分一治疗后证候积分)/治疗前证候积分×100%。
中医单项症状积分
分析两组治疗前后中医单项症状积分变化,具体症状为:面红目赤、红肿热痛、咽喉肿痛、口鼻气热、口舌生疮、小便黄赤、大便燥结,及红舌、黄苔、燥苔。
血浆标本的采集、保存、运输、检测
采集受试者静脉血约5mL置肝素锂采血管中,采用离心机3000r/min,4℃离心15min,取上清置冻存管中,超低温冰箱(-80℃)保存,干冰冷链运输至中国中医科学院中药研究所后进行分装处理,-80℃保存;ATP、4-HNE和ACTH指标的检测均严格按照试剂盒厂家说明书进行。
临床疗效结果
此次实热火毒证证候以七个主要中医症状的轻重程度为评价标准,主要中医症状为面红目赤,红肿热痛,咽喉肿痛,口鼻气热,口舌生疮,小便黄赤,大便燥结,以此作为中医证候评价量表的主要内容。根据SAS 9.4统计软件分析系统生成的受试者随机治疗分配,用药周期均为5天,观察治疗前后实热火毒证患者中医证候、中医单项症状积分的变化情况初步探索黄连解毒丸治疗实热火毒证的疗效。实热火毒证的患者症状表现中,有一个特别有代表性的主要症状。主要疗效指标设置为主要症状的改善,评价主要症状的消失率,更好保证评价的准确性。同时设置次要疗效指标证候评价量表,进行结合判断。依据数据显示主要症状消失率黄连解毒丸组69.17%,安慰剂组50.83%;主要症状消失时间黄连解毒丸组为5.00(4.00,5.00)天,安慰剂组为6.00(5.00)天;用药后主要症状评分降低值黄连解毒丸组1.38(0.71)分,安慰剂组0.93(0.95)分;用药后中医症候评分降低值黄连解毒丸组6.09(2.88)分,安慰剂组4.50(3.80)分;用药后黄苔评分降低值黄连解毒丸组0.48(0.70)分,安慰剂组0.33(0.64)分等。根据研究结果可知,黄连解毒丸组的主要症状消失率、主要症状评分降低值、中医证候评分的降低值以及黄苔评分降低值高于安慰剂组;主要症状消失时间黄连解毒丸组较安慰剂组短。本研究已在2021年9月10日进行了揭盲。
2.2、仪器
Ultimate 3000超高效液相色谱仪(包括自动进样器、柱温恒温器、在线真空脱气器、低压四元梯度泵、PDA检测器)、带有电喷雾离子源(ESI)的LTQOrbitrap velos pro质谱仪、Heraeus Multifuge XIR高速离心机和NanoDrop 2000分光光度计均由美国ThermoFisher公司购买。KQ-250B超声波清洗器由昆山超声仪器有限公司购买。XA105-1/10万电子天平由MettlerToledo公司获得。
JA503-DuaIRange 1/10万电子天平由上海Sunny Hengping仪器有限公司购买。IKA/Eka MS 3数字涡旋仪由德国IKA公司获得。UHPLC-QqQ-MS/MS系统由ExionLC-20AC高效液相色谱系统(Shimadzu,Japan)和配备EIS源的Sciex 6500+QqQ质谱仪组成(AB Sciex,USA)。MSD高灵敏度多因子电化学发光分析仪由美国Meso Scale Discovery公司获得。ABI9700PCR仪由Applied Biosystems,Inc.,USA获得。Caliper LabChip GX Touch HT由PerkinElmer,Inc.,USA购买。Agilent 2100生物分析仪由美国AgilentTechnologies,Inc.购买。ABI StepOnePlus实时PCR系统由Applied Biosystems,Inc.,USA购买。Miseq PE300由Illumina,Inc.,USA获得。
MSD电化学发光法:Meso Scale Discovery QuickPlex SQ 120超敏多因子电化学发光分析仪;
酶联免疫吸附试验(Elisa):Bio Tek酶标仪;
非靶向代谢组学:Ultimate 3000超高效液相色谱仪LTQOrbitrap Velos Pro质谱仪;
靶向代谢组学:Exion LC-20AC高效液相色谱仪AB SCIEX Triple Quad 6500+质谱仪;
唾液菌群:Illumina Miseq;
蛋白质组学:EASY-nLC 1200超高效液相系统Orbitrap Exploris
平行反应监测(PRM)技术:EASY-nLC 1000超高效液相系统Q ExactiveTM Plus质谱仪;
分子对接:SimBioSys公司的分子对接软件AutoDock Vina(Vina);
表面等离子体共振(SPR)技术:SPR仪器(Biacore T200 GE Healthcare)。
琥珀酸、顺式乌头酸、L-谷氨酸、L-谷氨酰胺、甘氨酸、L-丝氨酸、富马酸、柠檬酸、L-丙氨酸和α-酮戊二酸由上海诗丹德技术服务有限公司提供的。D(+)-无水葡萄糖和丙酮酸来自上海源叶生物技术有限公司。L-乳酸由CATO公司(美国)购买。一磷酸腺苷(AMP)由广州硕谱生物技术有限公司提供。苹果酸由国家食品药品监督管理局购买。色氨酸由J&K科技有限公司(北京)获得。甲醇、甲酸、水和乙腈由赛默飞科技中国)有限公司购买。碘乙酰胺、尿素和DL-二硫苏糖醇由Sigma-Aldrich提供。胰蛋白酶由Promega提供。Agencourt AMPureXP由贝克曼库尔特公司(美国)提供。NEB NextUltra IIDNALibraryPrep Kit由新英格兰生物实验室(美国)提供。E.Z.N.A.DNAKit由Omega生物技术公司(USA)购买。所有其他化学品和溶剂均为分析级。
2.3、MSD化学发光技术测定炎症因子
选择多因子试剂盒检测白细胞介素-2(IL-2)、IL-1β、IL-4、IL-8、IL-10、IL-6、IL-12p70、IL-13、干扰素-γ(IFN-γ)和肿瘤坏死因子-α(TNF-α)。血浆/唾液样本以3000rpm离心15min,取上清液稀释2倍。然后向标准品中加入1mL标准稀释液,充分振荡作为最高浓度点,放置于室温15-20min,母液依次稀释2倍,形成七个标准品溶液。吸取检测抗体60ul,并用抗体稀释液补足3ml体积。清洗MSD板3次,每次150ul的清洗液。每孔加入50ul的样本和标准品,并用封口膜封上,室温振荡2h。清洗MSD板3次,每次150ul的清洗液。每孔加入配置好的25ul检测抗体,并用封口膜封上,室温振荡2h。清洗MSD板3次,每次150ul的清洗液。每孔加入150ul配置好的读板液,上机检测。
2.4、LC-MS/MS定量血浆/唾液中的TCA循环中间代谢物本研究采用液相色谱-串联质谱技术,在给药前后检测血浆/唾液中的TCA循环中间代谢物(富马酸、顺式乌头酸、柠檬酸、乳酸、苹果酸、琥珀酸、α-酮戊二酸、色氨酸、甘氨酸、丝氨酸、谷氨酰胺、谷氨酸、丙氨酸、一磷酸腺苷、葡萄糖、丙酮酸)。将100μL血浆/唾液加入0.5mL离心管中后加入200μL乙腈,进行3min的涡旋混匀。12,000rpm,4℃离心15分钟后,取上清液,在37℃水浴中用氮气吹干。用水复溶并涡旋混匀3min,离心(12,000rpm,4℃)15min。最后,将上清液转移至液相瓶中储存。色谱柱:Waters,Atlantis
表1梯度洗脱程序
表2.各代谢物在使用多反应监测模式下的质谱参数
2.5.逻辑回归算法和模型
本研究选择在疗效评估中显示显著差异的指标作为特征。一系列选定的特征被递归地列为子集,并在每个子集上训练逻辑回归模型。使用简单交叉验证的准确性和K折交叉验证的平均准确性来全面评估每个模型的性能。确定显著影响模型预测结果的特征组合,并选择最佳特征组合。
2.6.基于唾液/血浆样品的非靶向代谢组学分析使用LC-MS/MS
将冷冻在-80℃的样品取出并在冰上融化。将50μL唾液样品转移到含有100μL乙腈的0.5mL离心管中。然后,经过60秒的涡旋混合,离心(12,000rpm,4℃,5min)后,将100μL上清转移到带有250μL内衬管的进样瓶中。流动相A为乙腈,流动相B为含0.1%甲酸-水。流速为0.3mL/min,进样量为10μL。然后使用以下梯度条件洗脱样品:0-2min,5-55%min;2-10min,55-95%A;10-15min,95%A;15-15.5min,95-5%A;平衡时间为4.5min,5%A。色谱柱:ACQUITYUHPLC HSS T3(2.1mm×100mm,1.8μm),柱温35℃。
使用UHPLC-LTQ-Orbitrap MS仪器,ESI源参数设置如下:正离子和负离子扫描模式,正离子模式下的毛细管温度为350℃,毛细管电压为35V,喷雾电压为3.5kV,氮气帘幕气体流速为40arb,辅助气体流速为10arb;负离子模式下的毛细管电压和喷雾电压分别为-35V和-3.5kV,氮气帘幕气体和辅助气体流速分别为35arb和10arb。此外,分辨率和扫描范围(m/z)分别为30,000和50-1,500。使用Xcalibur、Metworks和Mass Frontier 7.0软件进行数据采集和分析。
对于血浆样品制备,将50μL血浆样品的转移到含有150μL乙腈的0.5mL离心管中。其余的样品制备步骤与唾液相同。对于血浆样本的分离,流动相A为乙腈,流动相B为含0.1%甲酸-水。流速为0.3mL/min,进样量为5μL。然后使用以下梯度条件洗脱样品:2-15%A;3-5min,15-60%A;5-18min,60-98%A;18-21min,98%A;21-21.5min,98-2%A;
平衡时间为3.5min,使用2%A。其他所需条件与唾液非靶向代谢组学操作相一致。
2.7.口腔菌群
使用E.Z.N.A.DNAKit(Omega Bio-tek,Inc.,USA)试剂盒提取样本的基因组DNA,使用Nanodrop 2000(ThermoFisher Scientific,Inc.,USA)检测DNA质量和浓度,DNA样本储存在-20℃以备后续实验使用。使用通用引物338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)扩增细菌16Sr RNA基因的V3-V4区。在引物上游和下游引物的5’末端各添加8bp的barcode序列,以区分不同的样本。最后合成带有barcode序列的通用引物在ABI 9700PCR仪(AppliedBiosystems,Inc.,USA)上进行扩增。使用1%琼脂糖凝胶电泳检测扩增目的条带大小,170V30 min。PCR产物使用AgencourtAMPureXP(BeckmanCoulter,Inc.,USA)核酸纯化试剂盒进行自动化纯化。PCR产物使用NEB Next UltraIIDNALibrary Prep Kit(New EnglandBiolabs,Inc.,USA)建库试剂盒进行文库构建。最后,构建完成的文库使用AgencourtAMPure XP(Beckman Coulter,Inc.,USA)核酸纯化试剂盒进行纯化。使用Nanodrop2000(ThermoFisher Scientific,Inc.,USA)粗检文库浓度,使用Agilent 2100Bioanalyzer(Agilent Technologies,Inc.,USA)检测文库片段大小,使用ABI StepOnePlus Real-Time PCR System(Applied Biosystems,Inc.,USA)精确定量文库浓度。最后文库在Illumina Miseq/Novaseq 6000(Illumina,Inc.,USA)平台测序,测序策略为PE300。
2.8.血浆蛋白质组学
采用4D无标记定量蛋白质组学技术,检测和筛选出HLJDW干预“实热上火”证候的差异表达蛋白质。然后通过生物信息学分析相关功能和涉及的信号通路。样品从-80℃取出,4℃,12000g离心10分钟,上清液转移至新的离心管,使用高丰度蛋白去除试剂盒Pierce
2.9.蛋白质组学的PRM验证
样品处理方法同2.8项下。肽段用液相色谱流动相A相溶解后使用EASY-nLC 1000超高效液相系统进行分离。流动相A为含0.1%甲酸和2%乙腈的水溶液;流动相B为含0.1%甲酸和90%乙腈的水溶液。液相梯度设置:0-40min,6-20%B;40.0-52.0min,20%~30%B;52.0-56.0min,30%~80%B;56.0-60.0min,80%B,流速维持在500nl/min。肽段经由超高效液相系统分离后被注入NSI离子源中进行电离然后进Q Exactive
2.10.分子对接研究
从Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov/)获取HLJDW所含化合物的结构式(MOL2格式)。从PDB数据库(https://www.rcsb.org/)获取关键靶点SUCNR1的X射线晶体结构。通过去除水和有机物,并添加氢原子来处理蛋白质靶点。使用AutoDockVina软件对蛋白质靶点和HLJDW的主要活性成分进行分子对接。通过目标和成分的最优构象的结合能来评估关键靶点,并将最优构象导入PyMOL软件进行结果的可视化检查。
2.11.琥珀酸受体1表达纯化
构建pET23b载体,将SUCNR1基因插入NdeI/XhoI酶切位点;标签为N-terminal10xHis-tagged,融合蛋白分子量40.2kDa,用Progema试剂盒操作抽提得到质粒备用。得到的质粒可以直接用于体外转录翻译系统。混合大肠杆菌抽提物、进料缓冲、氨基酸、T7 RNA聚合酶和质粒等,将混合好的反应液加入透析盒中,再将透析盒浸入补料缓冲中,30℃过夜透析。取反应液,4℃,12000rpm离心10min。分离上清和沉淀,SDS-PAGE检测。沉淀用1%LMPG溶解沉淀,离心取得上清进行与2ml镍柱材料(Qiagen,NTAAgarose)过夜孵育(4℃),上重力柱纯化。依次用去垢剂+咪唑进行洗脱柱子。收集蛋白洗脱液,超滤。收集蛋白洗脱液,在PBS,0.05%Brij78,pH7.4,60mM imidazole和PBS,0.05%Brij78,pH7.4,500mMimidazole洗脱后均得到目的蛋白,进行蛋白浓缩送质控。通过SDS-PAGE考马斯亮蓝染色、BCA法检测蛋白纯度,使用Bandscan软件分评估纯度,纯度85%,蛋白加6%海藻糖进行冻干保存。
2.12.SPR验证
更换新的CM5芯片,running Buffer更换为PBS。先用50mM NaOH 400μl与0.05%SDS 4μl混合液清洗新的CM5芯片2次,再用50mM NaOH 400μl清洗CM5芯片一次,流速30μl/min。将等体积的EDC(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐;0.4M水溶液)和NHS(N-羟基琥珀酰亚胺;0.1M水溶液)两个试剂混合后5μl/min流速进样20min活化芯片Fc3和Fc4通道。将SUCNR1蛋白用pH4.0的10mM醋酸钠稀释至终浓度为25μg/mL后。Fc4通道以10μl/min流速进样10min,预计蛋白偶联量可达到约为8470.6RU;Fc3通道作为对照。偶联结束后,将Fc3和Fc4通道用乙醇胺溶液以5μl/min封闭芯片10min。用DMSO将所有小分子稀释到20mM。用不含DMSO的1.05×PBST缓冲液稀释20mM小分子化合物母液稀释20倍,得到1mM含5%DMSO的1×PBST的小分子。再用配好的含5%DMSO的running buffer(含5%DMSO的1×PBST)将小分子化合物按照设计的最高浓度开始,向下2倍稀释10个浓度梯度(每个各200μl),增加一个0浓度。选择LMWkinetics模式设置程序进样,检测温度默认25℃。流速为30μl/min;Contacttime为60s;Dissociation time为60s;再生用10mMNaOH为30s。
2.13.抗原乳化剂的制备
随机选择15只健康SPF级SD大鼠,使用20%乌拉坦麻醉后,通过颈椎处死,收集头部,用剪刀沿口腔颊部剖开。用镊子分离黏膜,剥离后用灭菌滤纸吸取水分。然后将黏膜剪碎,称重,并在液氮下研磨。加入10倍的磷酸盐缓冲溶液(0.1mol/L,pH 7.4),在1200rpm下均质化20min。将匀浆转移到无菌离心管中,并超声处理20min。在4℃,8000rpm离心15min,收集含有口腔黏膜匀浆的上清液,并分装到EP管中。冷冻在-80℃下储存。在使用前,将组织匀浆在室温下解冻,并与相等体积的弗氏佐剂混合,充分乳化形成抗原乳化剂。
2.14.构建"实热上火"证候诱导的ROU大鼠模型
共选择60只大鼠,其中10只为空白对照组。剩余的50只大鼠在脊柱两侧皮下注射上述抗原乳化剂。每只大鼠注射两个点,每个点注射0.1mL。注射每周一次,共进行8周。在用免疫学方法诱导大鼠模型的第7周,同时饲喂高脂饲料(每50kg包括5kg猪油、2.5kg蛋黄粉、0.5kg胆固醇、0.1kg胆汁酸、7.5kg糖和34.4kg基础饲料)。它们每隔一天灌胃辣椒油1mL/100g,连续14天之后,50只模型大鼠被随机分为五组:高、中、低剂量的HLJDW组、阳性药物组和模型组。根据上述剂量,治疗组每天连续给予一周。
2.15.动物实验药物的制备
该HLJDW配方由黄连900g、黄芩600g、黄柏600g和栀子900g组成。上述四味药材饮片浸泡于水中1小时,煎煮两次,过滤,将滤液合并,浓缩,减压干燥后粉碎成粉,出膏率为28.9%。根据临床剂量计算每只大鼠的剂量,成人(70kg)每日剂量为10g,相当于30g草药。使用人鼠体表面积转换法,大鼠的等效剂量是人的6.3倍,即大鼠的每日剂量为780.30mg/kg。这个剂量被用作中剂量组。低剂量组为中剂量组的一半,高剂量组为中剂量组的两倍。选择的阳性药物是左旋咪唑,剂量按照说明书等效为15.75mg/kg。
2.16.大鼠血浆中AA代谢产物的测量
精密称定适量20-HETE-d6、PGE2-d5和AA-d8标准物质制备内标溶液,浓度分别为500ng/mL、500ng/mL和5μg/mL。使用我们研究团队建立的方法,测定大鼠血清中5-HETE、8-HETE、11-HETE、12-HETE、15-HETE、5(6)-EET、11(12)-EET、14(15)-EET、9-HODE、13-HODE、LA和AA的含量。
2.17.统计量
对于非靶向代谢组学,所获得的数据使用progensyssQI软件进行处理,输入原始数据,对齐和选择峰并归一化,生成保留时间(tR)和m/z数据对的峰值强度。这些特征在人human metabolome database中被确定。将预处理数据导入SIMCA 14.1软件(Umectrics)进行多变量分析。无监督分离采用主成分分析(PCA),使用Parteo标准化来区分所有变量之间样本的差异。采用正交偏最小二乘鉴别分析(OPLS-DA)对数据进行进一步处理,以根据(VIP)值(阈值>1)和t检验(P<0.05)中的变量重要性来识别潜在的生物标志物。
组间差异采用GraphPadPrism8.01版本进行t检验。所有数据均以平均值(SD/SEM)表示。GO富集显著性分析采用Fisher精确检验,KEGG数据库进行途径富集分析。所有数据P<值为0.05被认为具有显著性。通过MetaboAnalyst中KEGG代谢网络分析差异表达的潜在代谢物的之间的关联。在Cytoscape 3.7.1中对蛋白质代谢物进行网络分析。使用OmicShare数据分析工具(https://www.omicshare.com/tools)进行动态关联分析的热图。STRINGdatabase数据库用于蛋白质-蛋白质相互作用网络。
3、结果
3.1、HLJDW治疗"实热上火"证候的疗效评价
以中医证候量表对HLJDW治疗“实热上火”证候的临床疗效进行评估。收集了229名受试者在服用药物前后的唾液和血浆样本。将分配到HLJDW组和安慰剂组的“实热上火”证候患者的人口统计学和基线特征经过统计发现,这些特征之间没有显著差异,表明对后续疗效研究没有显著影响。
3.1.1、HLJDW对唾液样本中炎症因子的影响
为了验证HLJDW干预“实热上火”证候后炎症的变化,本研究测定了唾液中的10种炎症因子,同时也包括了安慰剂组的评估结果(图1(1)A所示)。与安慰剂组相比,HLJDW主要通过调节唾液中的IL-2和IL-10作用于“实热上火”证候。文献表明,清胃散是经典中药方剂之一,被广泛用于治疗胃热证,能够显著降低IL-2的水平。IL-10是一种抑炎和在哺乳动物中产生的晚期细胞因子,黄连解毒汤(HLJDD)干预后可以明显增加。Th2型细胞因子IL-10在唾液样本中显示出较强的相关性,并有助于调节Th1/Th2平衡。它在口腔溃疡所致的成纤维细胞活性、数量和胶原沉积中起到重要的免疫调节作用,在本研究中口腔溃疡也是“实热上火”证候的疾病载体,我们的研究结果与上述文献一致。
3.1.2、HLJDW对唾液样本中TCA循环中间产物的影响
基于之前的结果,在HLJDW干预前后检测了TCA循环中间代谢物(图1(1)A)。与安慰剂组相比,HLJDW主要通过调节唾液中的琥珀酸、谷氨酰胺和色氨酸来干预“实热上火”证候。琥珀酸脱氢酶催化琥珀酸在TCA循环中氧化为富马酸,“上火”状态下琥珀酸脱氢酶呈上升趋势。加速的TCA循环和增强的线粒体生物合成是“实热上火”的表现。作为TCA循环的中心代谢物,琥珀酸可以特异性激活SUCNR1(琥珀酸受体1,也称为GPR91),谷氨酰胺的存在会导致呼吸速率提升和SUCNR1表达升高。谷氨酰胺在M1型巨噬细胞的氧化和还原TCA循环中均被分解代谢,从而产生包括琥珀酸在内的信号分子。缺乏谷氨酰胺和色氨酸等必需氨基酸也会削弱免疫细胞功能。因此,除了琥珀酸宿主途径外,本研究假设HLJDW可能使用谷氨酰胺作为回补途径,抑制琥珀酸信号传导,并发挥抗炎作用。
3.1.3.HLJDW对血浆样本中的炎症和TCA循环中间产物的影响
与唾液研究方法一致,本研究同样检测了血浆中的炎症因子和TCA循环中间产物(图1(2)B)。与安慰剂组相比,HLJDW主要通过调节血浆中的IL-2和IL-4来发挥作用。IL-4被认为是驱动Th2免疫应答的关键因素。HLJDW可以显著改善“实热上火”证候引起的血浆中IL-4紊乱,这个结果在本研究中得到证实。Th1细胞在疾病发展中起着重要作用,它们产生IL-2、IFN-γ等,这些因子正向反馈促进Th1细胞进一步分化。已有报道显示,包括慢性疲劳综合征在内的严重多因素疾病患者血清中的IL-2显著增高。血清IL-2的增加可能是一种补偿蛋白激酶磷酸化损失的途径。基于这些发现,本研究推测HLJDW通过IL-2和IL-4介导Th1和Th2免疫应答。根据TCA循环中间产物的测定结果,血浆和唾液中代谢物的表达具有一定的相关性。
3.1.4.唾液和血浆中的炎症因子与TCA循环中间产物的相关性
结合临床疗效评估结果,将炎症因子和TCA循环中间产物作为主要疗效指标进行相关性分析,并以动态网络相关图的形式呈现(图1(2)C-F),可以看出HLJDW可能使用琥珀酸作为关键节点来调节唾液和血浆中的能量代谢和炎症免疫应答。
3.1.5.逻辑回归模型预测HLJDW对"实热上火"证候的干预效果
基于疗效评估结果,本研究选择了在与安慰剂组相比显著改善的炎症因子和TCA循环代谢物作为特征,因此选择了IL-2、IL-4、琥珀酸和谷氨酰胺。在数据预处理后,将一定比例的数据用于模型训练,剩余的数据用于测试和评估性能。通过简单交叉验证得到的最佳排列组合是唾液IL-2、唾液IL-4、唾液琥珀酸、唾液谷氨酰胺、血浆IL-4、血浆琥珀酸、血浆谷氨酰胺,模型准确率达到85.71%。进一步使用2倍交叉验证验证结果,结果高度一致。总体而言,在HLJDW治疗“实热上火”证候获得的这些差异指标具有代表性,并显示了干预证候状态的是多个临床生物标志物的结合作用,而不是单一指标的变化。血浆和唾液环境中关键指标之间的逻辑回归分类图显示了它们的相互组合,促进了“实热上火”证候用药前后的区分,表明这些临床生物标志物在HLJDW治疗中起着重要作用。
3.2.HLJDW对"实热上火"证候的干预机制
3.2.1.HLJDW对"实热上火"证候患者唾液中的差异代谢物的调节
采用非靶向代谢组学鉴定差异代谢物,进一步使用PCA和OPLS-DA获得更多信息。图2(A-F)显示了HLJDW组和“实热上火”组在正负离子模式下的PCA、OPLS-DA得分图和OPLS-DA置换检验图(200次)。OPLS-DA用于放大组间差异,并有助于鉴定分离差异代谢物。结果显示在“实热上火”组和HLJDW组中鉴定出9种差异代谢物(图2G),其中,戊糖苷、l-2-羟基戊二酸、L-谷氨酸、瓜氨酸、辛酰基葡萄糖醛酸、苯乳酸(PLA)、天冬氨酸-赖氨酸、5-羟基癸-7-烯二酰肉碱在HLJDW干预后显著降低,而泛酸显著增加。谷氨酸调节趋势与疗效评估中的结果一致。PLA是脑皮层脂质氧化损伤、苯丙酮尿症和酒精性肝病的主要代谢生物标志物。D-泛酸是生产辅酶A的中间体。辅酶A是许多代谢过程中必需的且普遍存在的辅助因子,它还是重要的α-羟基脂肪酸,是一系列生物活性化合物的手性前体,包括D-泛酸。这些指标的生物学意义与HLJDW的作用机制相呼应。PLA显著激活NF-κB信号通路,触发NF-κB的核易位,介导细胞迁移和侵袭,并调控E6/E7和MMP9的表达。将鉴定出的9种差异代谢物导入MetaboAnalyst软件进行代谢通路分析,结果表明HLJDW主要影响精氨酸生物合成、氮代谢、D-谷氨酰胺和D-谷氨酸代谢等通路(图2H,表1)。谷氨酰胺代谢通路,也与疗效评价相一致。
表1.唾液差异代谢物的代谢通路结果
3.2.2.HLJDW调节血浆中的差异代谢物
采用非靶向代谢组学鉴定血浆中的差异代谢物,图2(I-N)显示了HLJDW组和“实热上火”组之间的PCA、OPLS-DA得分图和OPLS-DA置换检验(200次)。两组相比,共鉴定出11种差异代谢物(图2O),其中,植物鞘氨醇、鞘氨醇、lysoPG(16:0/0:0)在HLJDW干预后显著降低,而PC(20:2(11Z,14Z)/14:0)、胆固醇乙酸酯、lysoPE(0:0/18:2(9Z,12Z))、lysoPE(18:1(9Z)/0:0)、L-阿拉伯糖醇、磷酸乙酯和苏糖酸显著增加。与唾液非靶向处理过程相同,将鉴定出的11种差异代谢物导入代谢通路分析软件中,发现HLJDW主要影响鞘脂代谢和亚油酸代谢(图2P,表2)。鞘脂类(SLs)是一类参与细胞过程的生物活性脂质家族,它直接与效应蛋白相互作用和调节,或作为膜的生物物理性质的调节器。亚油酸是花生四烯酸(20:4n-6)的前体,进而可导致炎症性前列腺素升高。这与HLJDW干预“实热上火”证候炎症和免疫平衡相一致。
表2.血浆差异代谢物的代谢通路结果
3.2.3.临床试验患者的唾液菌群分析
本研究使用OTU Venn图分析了各组之间的OTU数量和物种重叠情况(图3A)。与对照组相比,药物组的唾液菌群物种丰富度增加。采用偏最小二乘判别分析(PLS-DA)检测细菌丰度的整体差异(图3B)。HLJDW组与安慰剂组显著不同,表明HLJDW能够促进唾液微生物丰度和结构的恢复,从而在治疗“实热上火”证候方面发挥作用。
在门分类水平上的物种分析结果如图3c所示,其中厚壁菌门和拟杆菌门所占比例最大。唾液微生物门水平的前五个相对丰度比例依次是厚壁菌门、拟杆菌门、变形菌门、隐蔽菌门和梭杆菌门。与对照组不同的是,HLJDW组中拟杆菌门的丰度显著降低(P<0.01),而厚壁菌门显著增加(P<0.01)。然而,这两个优势物种在安慰剂组中均没有统计学意义(P>0.05)。此外,属水平的分析结果(图3D)显示,普雷沃氏菌属的比例远高于其他属。HLJDW组中普雷沃氏菌的相对丰度明显下降,而安慰剂组中有所增加。
根据不同分类水平,对相对丰度排名前20位的唾液微生物进行了分析,主要包括目、科、属和种的信息(图3E)。文献报道,梭杆菌、普雷沃氏菌、放线菌均含有致病性和潜在致病性,在口腔鳞状细胞癌患者的肿瘤组织中度较高。普雷沃氏菌科将糖发酵成有机酸,如琥珀酸、丙酸和醋酸盐。钠转位模块将琥珀酸的产生与膜电位的形成联系起来。在人类微生物群中,普雷沃氏菌在身体的所有部位都很丰富,是健康和疾病之间平衡的关键角色。琥珀酸可以由宿主细胞对炎症刺激的反应以及微生物群落的干扰产生。在严重牙周炎患者中观察到琥珀酸水平升高可能是由宿主细胞和细菌共同增加产生的。普雷沃氏菌与受影响个体中的琥珀酸水平高度相关,已知它能产生琥珀酸。
从上述结果可知,HLJDW通过减少有害菌群和恢复有益菌群来改善口腔微生物群的紊乱。通过唾液菌群分析发现了能够产生琥珀酸的普雷沃氏菌,这证明了HLJDW对“实热上火”证候的微生物途径的调节。本研究结果表明,琥珀酸除了宿主途径外,还可以由口腔微生物途径产生,从而介导炎症免疫平衡。
3.2.4.血浆蛋白质组学发现研究
为研究控制炎症因子和代谢物的关键蛋白,我们选择了8对HLJDW治疗前后的样本进行血浆蛋白质组学研究。大部分肽段分布在7-20个氨基酸上(图4(1)A),这符合酶消化和质谱碎裂的一般规律。质谱鉴定的肽段长度分布满足质量控制要求。共鉴定了11337个肽段和1376个蛋白(图4(1)B)。HLJDW组与“实热上火”证候患者的血浆蛋白质图谱具有显著差异,主要表现在62个差异蛋白中36个显著上调,26个显著下调(图4(1)C)。
GO二级分类分析显示,差异表达的蛋白质主要参与免疫效应过程和免疫反应(图4D)。KEGG通路分类分析显示,差异表达的蛋白质主要参与免疫系统,在生物系统中排名第一(图4(1)E)。COG/KOG功能分类分析显示,这些蛋白质主要集中在碳水化合物运输和代谢以及翻译后修饰、蛋白质转运和伴侣作用(图4(1)F)。GO生物过程分类的富集分析发现,差异表达的蛋白质对巨噬细胞趋化和迁移具有负调控作用(图4(1)G)。Reactome分析显示,差异表达的蛋白质主要富集在先天免疫系统和免疫系统中(图4(2)H)。KEGG通路分析显示,差异表达的蛋白质主要参与Fcγ受体介导的吞噬作用和花生四烯酸代谢(图4(2)I)。HLJDW干预“实热上火”证候显著下调的信号通路包括花生四烯酸代谢、非洲锥虫病、疟疾和过氧化物酶体;显著上调的信号通路包括半乳糖代谢、酪氨酸代谢。
3.2.5.差异表达蛋白的验证和网络分析
我们选择了15个差异表达的蛋白进行平行反应监测(PRM)靶向蛋白质组学验证。其中4个上调的蛋白质包括肽基脯氨酰异构酶B(PPIB)、异柠檬酸脱氢酶[NADP]细胞质型(IDH1)、纤溶酶原激活物抑制剂1(SERPINE1)、细胞质型天冬氨酸氨基转移酶(GOT1),8个下调的蛋白质包括转酮醇酶(TKT)、C-反应蛋白(CRP)、基质金属蛋白酶9(MMP9)、脂多糖结合蛋白(LBP)、钙粘附蛋白5(CDH5)、前列腺素-H2 D-异构酶(PTGDS)、血红蛋白亚单位β(HBB)、血红蛋白亚单位α(HBA1),与HLJDW干预“实热上火”证候血浆蛋白质组学发现研究结果一致(图4(2)N)。
根据GO二级分类分析(图4(1)D),IDH1、CRP、MMP9、LBP和HBB都参与免疫效应过程和免疫反应。此外,SERPINE1和CDH5根据KEGG通路分类被纳入免疫系统(图4(1)E)。文献报道称,HBB可能刺激先天免疫RNA病毒模式识别并抑制活性氧。MMP的过表达和激活可引起结肠黏膜损伤和炎症,网络药理分析显示,HLJDD调节包括MMP9在内的靶基因与溃疡性结肠炎和肺炎相关,与HLJDW干预“实热上火”证候治疗趋势相同。从COG/KOG功能分类图(图4(1)F)可以看出,MMP9和PPIB被分配为翻译后修饰、蛋白质转换、伴侣蛋白。TKT被归类为碳水化合物运输和代谢,而GOT1则属于氨基酸运输和代谢。HBB,IDH1和HBA1一起参与能量的产生和转换。SERPINE1和LBP都参与防御机制。SERPINE1作为一个新的潜在效应分子和治疗靶点,在外周中性粒细胞浸润中起到关键作用,可能有助于减少缺血再灌注引起的神经损伤。LBP是LPS暴露的生物标志物,能间接反映革兰阴性菌的存在。LBP已在骨肉瘤细胞和肿瘤相关巨噬细胞中检测到。下调LBP可以改善脂肪合成引起的肝脂积累。血浆靶向蛋白质组学的结果与文献报道一致。
图4(1)J中的网络分析显示,MMP9在所有验证的蛋白质中起着重要的节点作用。从图4K可以看出,AA是连接差异蛋白质的关键代谢产物,这与通路富集分析的结果一致。此外,图4(1)L还发现4-HNE是一个关键代谢产物,这与我们对4-HNE作为治疗评估的关键代谢产物的研究结果一致。AA可以增加脂质过氧化,而4-HNE是脂质过氧化过程中的代表性醛类产物。从图4(1)M可以看出,琥珀酸与靶蛋白质之间存在密切关系。基于这些结果,研究推测HLJDW可能通过调节这些关键蛋白靶点来治疗“实热上火”证候,从而调动防御机制,触发关键开关琥珀酸介导免疫反应,进而影响下游代谢物。
3.2.6.相关性分析和相关性验证分析
宿主-微生物相互作用是免疫系统发育的基础。将这些结果之间的内部关系综合起来,如图5所示,可以推测琥珀酸是HLJDW治疗“实热上火”证候的核心。琥珀酸通过宿主和微生物两个途径产生。HLJDW可以减少宿主途径及普雷沃氏菌产生的琥珀酸,随后通过细胞外抑制SUCNR1的激活。通过HIF1α/MMP9通路介导巨噬细胞极化,影响炎症和免疫的平衡,进而调节AA代谢,特别是脂质过氧化产物4-HNE的水平。为了验证琥珀酸是否激活SUCNR1并调节免疫平衡,我们采用分子对接技术初步研究HLJDW与SUCNR1之间的亲和力。本研究根据HLJDW的定性和定量分析以及相关文献筛选出了40种活性成分。使用SimBioSys的AutoDockVina评估它们与SUCNR1的结合能力。结合能均小于-6.3kJ/mol(图6),表明它们是潜在的SUCNR1靶点的药理成分,HLIDW与SUCNR1的亲和力较好。
基于课题组研究基础,HLJDW主要包含生物碱、黄酮和环烯醚萜三类成分[10,23]。为了进一步验证分子对接结果的准确性,我们使用SPR技术测定了SUCNR1和HLJDW中三个含量较高的代表性活性组分的亲和力。因此,我们选择小檗碱、黄芩苷和京尼平苷作为细胞外验证分子模型,与SUCNR1蛋白进行分子相互作用实验。本研究将SUCNR1固定在芯片中,小檗碱、黄芩苷和京尼平苷溶液分别通过芯片检测结合能。结果如图6B所示。小檗碱和SUCNR1的KD值为233.9μM。黄芩苷和SUCNR1的KD值为268.9μM。黄芩苷和小檗碱对SUCNR1蛋白具有较高的结合亲和力,且其浓度梯度变化趋势显著,表明其具有特异性结合。京尼平苷与SUCNR1蛋白的结合量较低,可能是与其结构类型有关。
3.2.7.HLJDW对“实热上火”证候ROU大鼠模型的干预
为了验证临床结果,本研究构建了“实热上火”证候ROU大鼠模型,实验方案如图所示(图7A)。结果显示空白对照组毛发有光泽,性情温顺,食欲良好,尿便正常,反应灵活,体重并逐渐增加。模型组毛发粗糙,性情暴躁,反应迟钝,食物和水摄入减少。从折线图(图7B)可以看出,对照组的体重增长趋势逐渐高于其他组。药物干预始于第63天,低剂量组和中剂量组的体重趋势与对照组一致。然而,模型组在药物干预第3天时出现波动和下降。与对照组的口腔黏膜厚度相比,模型组显著增加;与模型组相比,药物组显著降低口腔黏膜增厚,证明了HLJDW的显著治疗效果。大鼠口腔黏膜组织病理学切片如图7C所示,正常组动物口腔上皮排列规则,角化层完整。模型组动物口腔上皮轻度增生,角化层轻度脱落,复层柱状上皮轻度肿胀、变性、坏死、脱落,真皮层可见轻微炎症细胞浸润,部分上皮较正常对照组有明显差异。这些符合机体处于正常和疾病之间的亚健康状态表现。阳性药组和高剂量组动物口腔上皮排列规则,角化层轻微脱落,复层柱状上皮轻微肿胀,较模型组明显减轻。中剂量组动物口腔上皮排列较规则,角化层轻微缺失,复层柱状上皮轻度肿胀、变性,较模型组有轻微改善作用。
本研究测定了临床实践中发现的潜在通路指标如琥珀酸、谷氨酰胺、SUCNR1、4-HNE以及下游与HIF1α/MMP9通路相关的不饱和脂肪酸和过氧化脂质(图7D-E),动物模型研究得到的结果与临床试验的趋势一致。动物机制研究验证了HLJDW可以调节与“实热上火”证相关的AA代谢(AA、LA、5-HETE、8-HETE、11-HETE、12-HETE、15-HETE等),特别是脂质过氧化产物4-HNE的水平。
4、讨论
在这项研究中,以“实热上火”为模式证候,采用HLJDW作为干预处方进行临床试验。“实热上火”以头部和面部皮肤和黏膜损伤为主要表现,尤其是口腔黏膜。口腔黏膜表面上皮处于持续的失去和再生状态,黏膜的稳定性取决于严格的稳态平衡。口腔中“唾液”是一种高动态的液体,具有揭示病理过程的潜力。大多数离子和代谢物通过特定通道进入唾液。唾液的成分可以反映身体的全身状况,根据我们研究的证候类型,使用唾液具有明显的优势。它为药物干预研究提供了一种有价值的替代方法,至少适用于某些类型的疾病。此外,唾液的收集和存储方法简单、无创、相对便宜,而且对患者和医务人员所面临的风险都较低。这些特征有利于研究婴儿、儿童和成人的龋病生物标志物。因此,除了血浆样本外,还包括了唾液研究。
采用随机、双盲、安慰剂对照的多中心Ⅱ期临床设计招募符合证候条件的受试者。共纳入240例,随机分为安慰剂组和HLJDW组。有1例(0.42%)未完成试验,239例(99.58%)完成了试验,10例未收集生物样本。因此,对229名“实热上火”证候参与者的血浆和唾液样本进行了疗效评估,并随机分为115名HLJDW组和114名安慰剂组。使用中医证候量表评估了HLJDW治疗“实热上火”证候的临床疗效。结果显示,HLJDW组主要症状消失率为69.17%,安慰剂组为50.83%。此外,HLJDW可以显著改善“实热上火”证候患者血浆中的ATP和4-HNE。在先前的临床试验中,该证候与炎症和能量代谢密切相关。因此,对关键炎症因子和TCA循环中间产物进行了验证。通过综合分析,唾液和血浆的疗效结果表明,HLJDW可以显著改善IL-2、IL-4、琥珀酸和谷氨酰胺,并且趋势与先前的结果一致。为了进一步验证这些差异性生物标志物,构建了逻辑回归模型,发现这几个指标的协同作用在评估结果中起着关键作用。
对每个细胞因子的功能和在其识别的下游传播的信号通路的了解几乎总是基于对单个细胞因子的反应。免疫通常以促炎细胞因子增加和抗炎细胞因子减少为特征。谷氨酰胺来源的氮通过己糖胺生物合成途径(HBP)使蛋白质糖基化,IL-4和IFN-γ的产生受到谷氨酰胺分解和HBP的差异调控。IL-2是一种重要的稳态细胞因子,在免疫原性和耐受性免疫调节中具有治疗应用。在急性应激期间,某些唾液炎症细胞因子增加。复发性口腔溃疡性口炎中IL-2和IFN-γ较高。促炎细胞因子可以激活细胞谷氨酰胺摄取,导致琥珀酸增加。线粒体代谢重编程可以通过炎症刺激激活巨噬细胞诱导,从而支持促炎细胞因子的产生。代谢重编程的特征是通过IDH下调α-酮戊二酸形成和谷氨酰胺来源的琥珀酸积累。本研究在蛋白质组学中发现并验证了IDH差异蛋白。抗炎细胞因子如IL-10和IL-4可以通过限制巨噬细胞产生促炎细胞因子来提供补偿性保护作用。IL-4在抑制软骨细胞炎症途径方面具有有效性。琥珀酸作为一种重要的代谢产物具有促炎作用,其积累通常与菌群失调和炎症相关。巨噬细胞对琥珀酸的摄取增加已知可以增强炎症。研究已经证实TLR4信号在介导琥珀酸在巨噬细胞中的促炎作用中起着不可或缺的作用。根据疗效评估结果,我们推测HLJDW以琥珀酸作为临床生物标志物的核心显著改善“实热上火”证候的免疫炎症和能量代谢紊乱。
琥珀酸是三羧酸循环中的核心中间代谢产物,被认为是免疫系统中的一种危险信号。SUCNR1是琥珀酸信号的受体,属于G蛋白偶联受体家族的成员,作为自分泌的脂解调节因子。琥珀酸在炎症区域积累,并通过SUCNR1信号通路调节免疫功能。它与牙周组织炎症水平呈正相关,升高的琥珀酸水平激活SUCNR1促进牙周炎的发生。缺乏SUCNR1或其活性减弱可以显著降低牙周炎的易感性,表明SUCNR1可能是对抗口腔疾病的一个有前景的靶点。生理浓度的细胞外琥珀酸通过SUCNR1激活的Gq信号通路有效调节免疫功能基因的转录,使M2型巨噬细胞极化超过M1型。巨噬细胞通过SUCNR1消耗细胞外琥珀酸,从而上调内源性缺氧诱导因子1α(HIF1α)依赖的通路,最终增强IL-1β的产生。HIF1α是多种病理过程的关键,包括氧化应激、基质金属蛋白酶的释放和炎症反应。MMP9是HIF1α的下游蛋白,被认为是与线粒体相关的基因。抑制其表达显著改善了线粒体形态、代谢和氧化应激。在乳腺癌患者的肿瘤组织中,MMP9与HIF1α同时上调。由易感因素诱导的HIF1α可以导致MMP9的过度表达。SUCNR1的激活促进巨噬细胞的抗炎表型,并增强对包括IL-4在内的2型细胞因子的响应。在我们的研究中,MMP9明显受到抑制,并经过验证。根据文献报道和我们的发现,我们推测HLJDW可能通过抑制琥珀酸与受体蛋白SUCNR1的结合来下调HIF1α,从而影响MMP9以发挥促炎反应的作用。
为了研究HLJDW对“实热上火”证候的作用机制,选择了40名证候显著改善的患者,并基于血浆和唾液进行生物样本研究。首先进行了非靶向代谢组学研究。差异代谢物经过通路富集后发现,HLJDW治疗“实热上火”证候主要影响精氨酸生物合成、D-谷氨酰胺和D-谷氨酸代谢、鞘脂代谢和LA代谢,这些生物过程与免疫炎症和能量代谢密切相关。精氨酸增加了琥珀酸脱氢酶和苹果酸脱氢酶的活性,同时降低了乳酸脱氢酶的活性。鞘脂是一类特殊的脂质,对血浆膜的组成至关重要,它们在促炎反应中起着关键作用。炎症过程与炎症介质的产生有关,包括AA和LA衍生物。因此,结合疗效结果,推测HLJDW以琥珀酸用作突破口干预“实热上火”证候。
研究发现,T细胞亚群与共生细菌的比例和微生物的易位密切相关,主要分泌细胞因子IL-4和IL-10。它们可以参与多种免疫疾病的临床症状改善。抗炎饮食似乎与有益微生物的丰度增加有关,特定的口腔和肠道微生物组成与炎性标志物,包括IL-4、IL-10、高敏C反应蛋白(hs-CRP)等相关。口腔微生物群是人体中最稳定的生态系统之一,同时由于口腔中可用的生境的多样性而具有高度多样性。口腔唾液微生物失衡已与多种系统性疾病的发病机制相关联,并且这些物种已被证明是有用的生物标志物。因此,对唾液微生物进行16SrDNA基因测序,结果显示,普雷沃氏菌在属水平最为丰富,其丰度在HLJDW组中显著降低,而在安慰剂组中升高。
口腔普雷沃氏菌被认为是从早期开始存在于口腔黏膜和牙菌斑中的厌氧共生菌。它是一种重要的琥珀酸产生细菌。普雷沃氏菌参与口腔炎症过程,并与炎症细胞因子和氧化应激高度相关,在牙周的异常生物膜中经常发现。普雷沃氏菌含有一个膜结合的电子传递复合物,它可以将富马酸还原为琥珀酸。抑制普雷沃氏菌富马酸还原酶基因表达可导致琥珀酸积累。在促炎巨噬细胞中,对琥珀酸的摄取显著增加,由Na+依赖的琥珀酸转运体控制。我们的研究结果表明,除了宿主来源外,琥珀酸还可以由口腔微生物产生,从而介导炎症免疫的发展。这些结果也得到了文献的证实。
为了深入研究调控炎症因子和代谢物的蛋白,本课题进行了血浆蛋白质组学发现和验证研究。通过差异蛋白分类,主要集中在免疫系统中,表现在免疫效应过程和免疫反应。HLJDW显著下调的通路是花生四烯酸代谢和过氧化物酶体,涉及琥珀酸和炎症免疫的串扰,呼应了先前的非靶向结果,表明受影响的下游小分子可能集中在花生四烯酸代谢上。花生四烯酸是最丰富的脂肪酸,也是巨噬细胞中促炎性前列腺素的主要前体。花生四烯酸代谢在决定M2型巨噬细胞表型方面发挥着关键作用[85]。它可以增加脂质过氧化、4-HNE生成、细胞凋亡等。HLJDW显著降低4-HNE水平的结论也得到了证实。与花生四烯酸代谢相关的PTGDS在发现和验证中表现显著,它可能涉及适应性免疫反应、白细胞迁移,以及细胞粘附分子和趋化因子信号的调节。此外,PTGDS与B细胞、CD4+T细胞和巨噬细胞的免疫浸润状态呈正相关。因此,HLJDW的治疗可能通过介导琥珀酸通路上与免疫相关的蛋白PTGDS影响花生四烯酸代谢,从而调节4-HNE的脂质过氧化。
另外还有几种蛋白质在整体机制研究中起到了关键连接作用,如GOT1、TKT、PPIB和CRP。GOT1和线粒体柠檬酸合酶的下调是线粒体三羧酸循环受损的特征。通过GOT1将天冬氨酸转化为草酰乙酸可以维持胰腺导管腺癌细胞的氧化还原状态和增殖活性。抑制GOT1可以抑制线粒体代谢并促进分解代谢状态。TKT是戊糖磷酸途径非氧化阶段的代谢酶。TKT的丧失可以增加基因组稳定性,通过加速核苷酸合成来抑制坏死和炎症。缺乏TKT或添加α-酮戊二酸可以增强肿瘤抑制因子琥珀酸脱氢酶和富马酸水合酶,降低琥珀酸和富马酸的代谢产物,并进一步稳定HIF羟化酶2并降低HIF1α。此外,研究表明PPIB可以触发巨噬细胞中的炎症小体激活和和焦亡。差异蛋白中还包括一个急性期蛋白CRP,其主要由肝脏产生和分泌,作为对T细胞和巨噬细胞释放的炎症成分的反应。健康患者血浆CRP明显低于年龄相关证候患者,CRP浓度的增加与生存率的降低相关。CRP浓度的增加与生存率降低、身体功能下降和认知能力下降相关。结合以上文献可知,血浆蛋白质组学发现和验证研究得到的差异蛋白在维持线粒体环境和免疫平衡方面起着重要作用。
总的来说,结合这些结果之间的内在关系,可以推测琥珀酸是HLJDW干预“实热上火”证候的核心。HLJDW可以降低“实热上火”证候患者体内通过宿主和微生物途径产生的琥珀酸,从而抑制细胞外SUCNR1的激活。该过程通过HIF1α/MMP9途径介导巨噬细胞极化,影响炎症和免疫的平衡,进而调节AA代谢,特别是脂质过氧化产物4-HNE的水平。结合分子对接和SPR实验结果,SUCNR1与小檗碱、黄芩苷的相互作用具有良好的亲和力和特异性结合。同时,这些成分可作为HLJDW治疗“实热上火”证候的有效物质基础。此外,我们构建了“实热上火”ROU大鼠模型(“实热上火”证候的三种疾病载体之一),HLJDW对其治疗效果显著,通过测定临床试验中发现的HIF1α/MMP9途径中的关键指标(琥珀酸、谷氨酰胺、SUCNR1、4-HNE以及下游AA代谢相关的不饱和脂肪酸和过氧化脂质),结果与临床发现一致,实现了临床和动物研究之间的双向验证。我们的研究结果说明了机体的能量代谢和免疫功能是导致“实热上火”的重要因素。文献也表明“上火”可以影响免疫力,增加疾病易感性[7,93]。另一方面,通过整合临床多组学研究和动物样本验证,我们发现“实热上火”可引起下游花生四烯酸相关氧化脂质代谢的变化,特别是4-HNE。这与文献中氧化脂质在体内积累是“实热上火”[94]的原因之一的观点一致。
在这项研究中,我们发现黄连解毒丸(HLJDW)通过线粒体宿主和微生物途径改善了“实热上火”证候。根据炎症因子、代谢产物、微生物组成和靶标蛋白的显著变化,提示琥珀酸是介导免疫平衡的重要信号。它可能在这个过程中扮演调节开关或生物标志物的角色,为“清热泻火”理论在治疗“实热上火”证候提供新思路。琥珀酸通过HIF1α/MMP9通路介导的免疫平衡的分子机制有待从III期临床研究和细胞水平上进一步研究。
- 一种钢筋弯弧装置、钢筋焊接装置及弯弧方法
- 一种高节能性全液压式型钢弯弧机
- 一种高节能性全液压式型钢弯弧机
