一种磁珠法提取真菌mRNA的试剂盒及应用
文献发布时间:2024-04-18 20:01:55
技术领域
本发明涉及真菌mRNA提取技术领域,更具体地说是涉及一种磁珠法提取真菌mRNA的试剂盒及应用。
背景技术
mRNA(信使核糖核酸)作为蛋白质生物合成的直接模板,研究热度一直较高;mRNA只占细胞总RNA的2%~5%,具有代谢活跃,半衰期短,容易分解等特点,使得mRNA的提取以及保存难度很大;因此,mRNA研究的前期提取工作显得尤为重要。
真菌mRNA的提取方法有很多,但这些方法都需要先提取总RNA,然后进一步纯化得到mRNA,以其中的mRNA作为模板,使其反转录成cDNA进行PCR扩增来达到基因表达水平的检测,在临床诊断中具有重要意义。然而mRNA仅占总RNA的1%~5%,加之总RNA中成分复杂、干扰因素多,导致扩增效率降低,降低了PCR、RT-PCR的检测灵敏度,难以满足微量核酸样品的分析。因此,高质量mRNA的获取是下游实验过程成功进行的关键;这就需要对常规方法进行改进,期望获得高质量高浓度的真菌mRNA。
因此,如何提供一种以磁珠法提取真菌mRNA的试剂盒,并将其应用于真菌mRNA的提取中是本领域技术人员亟需解决的问题。
发明内容
有鉴于此,本发明结合纳米磁珠与核酸探针的特点,通过破壁酶液对真菌进行破壁,再利用裂解液对破壁细胞进行裂解,最后用制备的生物素核酸探针跟真菌mRNA polyA特异性结合,快速获得真菌mRNA;缩短了提取步骤,能降低mRNA在提取过程中发生的降解问题,具有快捷、特异性强、缩短提取步骤等优点,可为后续实验提供高质量模板。
为了实现上述目的,本发明采用如下技术方案:
一种磁珠法提取真菌mRNA的试剂盒,包括:破壁酶液、溶液A、溶液B、溶液C、溶液D、溶液E、溶液F;
所述破壁酶液按照体积比包括蜗牛酶70%和溶菌酶30%;
所述溶液A由pH=7.5、浓度为182mg/ml的山梨醇缓冲液和0.1MPBS缓冲液组成;所述溶液B包含1.5M异硫氰酸胍、1M柠檬酸钠溶液、2%SDS、1.5M醋酸钠溶液、15%苯酚和0.2%巯基乙醇;
所述溶液C为异丙醇;
所述溶液D包括链霉亲和素、生物素化核酸探针和羧基磁珠30mg/mL;生物素化核酸探针为Oligo(dT)5'端连接生物素,序列为Biotin-TTTTTTTTTTTTTTTTTTTT;
所述溶液E为乙醇溶液;
所述溶液F为TE Buffer。
作为与上述技术方案相同的发明构思,本发明还请求保护所述的提取真菌mRNA的试剂盒在提取真菌mRNA中的应用。
作为与上述技术方案相同的发明构思,本发明还请求保护一种磁珠法提取真菌mRNA的方法,包括以下步骤:
(1)取菌液1.5mL,4℃5000rpm离心2min取沉淀。加入500μL溶液A,加入1mL破壁酶液,充分混匀5~10min,5000rpm离心5min弃上清收集沉淀;
(2)向步骤(1)所得沉淀加入1mL溶液B,激烈振荡30s,室温静置10min;12000rpm离心10min;吸取上清转移至另一离心管中;
(3)向上清中加入300μL溶液C,20μL溶液D,上下颠倒离心管充分混匀后,静置5min,磁分离;
(4)缓慢沿管壁加入1mL溶液E清洗沉淀,轻轻上下颠倒洗涤离心管壁,磁分离,此步骤重复2次;
(5)弃去溶液E,室温干燥沉淀5~10min,加入40μL溶液F洗脱,磁分离取上清冷冻保存;
(6)反转录,取出产物-20℃保存。
优选地,反转录体系如下:
反转录程序为45℃24min、94℃5min、94℃30s、61℃30s,72℃1kbp/min,35个循环;72℃延伸10min。
经由上述的技术方案可知,与现有技术相比,本发明用破壁酶在山梨醇缓冲液下充分破解真菌,再由连接了生物素核酸探针的链霉亲和素磁珠悬浮液特异性结合真菌mRNA。该试剂盒可以快速、特异的提取真菌mRNA,防止真菌mRNA在提取过程中降解,获得高质量真菌mRNA,具体效果为:
(1)本发明利用改进的酶法破壁代替传统的液氮法机械破壁,通过制备的生物素化核酸探针和链霉亲和素连接的羧基磁珠相结合的提取方法,裂解真菌细胞壁时只需加入破壁酶液无需加液氮冷冻研磨,简化了操作方法,降低了真菌mRNA在提取过程中的损耗;
(2)本发明能直接提取纯化真菌mRNA,相比于传统提取方法先提取真菌总RNA后二次纯化得到mRNA,缩短了提取步骤,大大提高了真菌mRNA提取效率和质量;
(3)本试剂盒提取的mRNA纯度较高,蛋白质和盐类含量少。该提取方法基于生物素化核酸探针-链霉亲和素磁珠特异性结合mRNA,通过磁吸附弃去杂质,避免蛋白质、盐类吸附到磁珠,OD
(4)基于改进的酶法破壁和制备的特异性生物素化核酸探针-链霉亲和素磁珠核酸富集技术建立了一种真菌mRNA提取的新方法,该方法快速、简便、特异性强,可用于实际样品中真菌mRNA提取以及复杂样品中真菌mRNA提取;
(5)本发明有利于推进真菌mRNA提取自动化的实现;
(6)试剂盒操作简单,省去很多离心等中间步骤,能高效特异性提取真菌mRNA;
(7)本试剂盒很大限度减少了有机溶剂的使用,降低了对人体和环境的危害;试剂盒包括一种专有的酶混合物,可以裂解较难破壁的真菌。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
图1附图为制备的羧基磁珠TEM扫描图;
图2附图为制备的链霉亲和素磁珠连接生物素化核酸探针TEM扫描图;跟图1相比,图2表面有一层膜,是连接了生物素化核酸探针的结果;
图3附图为提取的mRNA扩增产物凝胶电泳图;图中泳道1为生工生物公司DL2000Marker,图中泳道2、3分别为酵母菌、黑曲霉mRNA扩增产物;
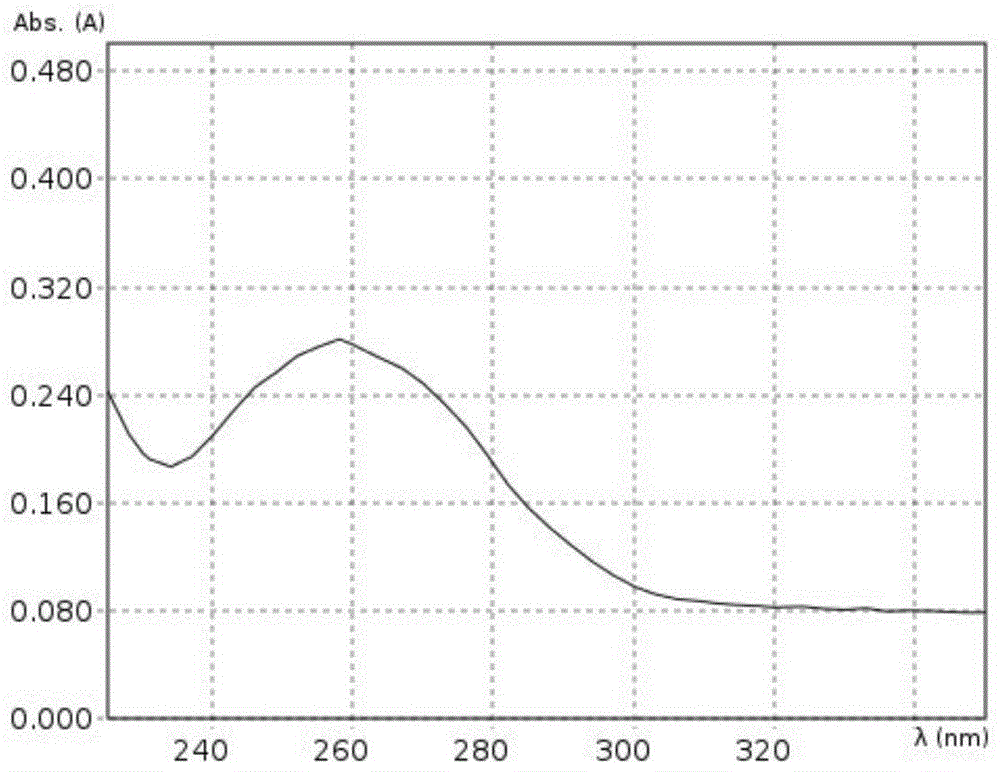
图4附图为本试剂盒提取的酵母菌mRNA产物紫外光谱图;
图5附图为本试剂盒提取的黑曲霉mRNA产物紫外光谱图;
图6附图为液氮法机械破壁提取的真菌mRNA产物紫外光谱图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1制备链霉亲和素磁珠连接生物素化核酸探针
1)取30mg/mL羧基磁珠100μl置于离心管中(包含磁珠3mg),磁力架进行分离,用500μl灭菌水清洗两次;用2-吗啉乙磺酸(MES)活化缓冲液清洗两次,磁力架分离弃上清;羧基磁珠粒径0.2μm。基于专利号105097161A制备,TEM扫描图如图1所示;
2)加入800μl活化剂1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC),室温混匀状态反应1.5h,用MES活化缓冲液洗涤羧基磁珠3次,磁力架分离,弃上清;MES溶液,终浓度为50mM;EDC溶液,终浓度为50mg/mL;
3)加入250μl(10mg/mL)链霉亲和素(购自生工生物公司);振荡反应1.5h,静置0.5h,上述溶液磁力架分离;
4)加入500μl的缓冲液A清洗,震荡反应,磁力架分离,弃上清,取500μl缓冲液A悬浮磁珠;其中,缓冲液A由终浓度为7.5mM Tris-HCl、0.75mM E DTA和1.5M NaCl组成,pH=7.5;1M Tris-HCl(pH8.0):称取Tris碱6.06g,加DEPC水40mL溶解混匀,滴加浓HCl约调pH至8.0,定容至50mL;0.5M E DTA(pH8.0):准确称取EDTA 9.306g,加DEPC水40mL,搅拌均匀,用N aOH颗粒调pH至8.0,定容至50mL;
5)加入200μl生物素化核酸探针,室温放置,轻轻旋转混合30min,磁分离,弃上清,用0.1%DEPC水清洗3次,得到生物素化核酸探针-链霉亲和素磁珠备用,链霉亲和素磁珠连接生物素化核酸探针TEM扫描图如图2所示。
实施例2
一种磁珠法提取真菌mRNA的试剂盒,包括:破壁酶液、溶液A、溶液B、溶液C、溶液D、溶液E、溶液F;
所述破壁酶液按照体积比包括蜗牛酶70%和溶菌酶30%;
所述溶液A由pH=7.5、浓度为182mg/ml的山梨醇缓冲液和0.1M PBS缓冲液组成;所述溶液B包含1.5M异硫氰酸胍、1M柠檬酸钠溶液、2%SDS、1.5M醋酸钠溶液、15%苯酚和0.2%巯基乙醇;
所述溶液C为异丙醇;
所述溶液D包括链霉亲和素、生物素化核酸探针和羧基磁珠30mg/mL;生物素化核酸探针为Oligo(dT)5'端连接生物素,序列为Biotin-TTTTTTTT TTTTTTTTTTTT;
所述溶液E为乙醇溶液;
所述溶液F为TE Buffer。
各组分的制备方法为:
DEPC处理的水(RNase-free ddH
破壁酶液:称取21mg蜗牛酶和9mg溶菌酶溶于1mL RNase-free ddH
PBS:配制0.1M PH=7.4的PBS缓冲液,分别称取NaCl 8.5g,Na
山梨醇缓冲液:称取18.2g山梨醇溶于100ml 0.1M PBS。
75%的乙醇:取75mL乙醇加RNase-free ddH
2-吗啉乙磺酸溶液(MES):配制0.05M pH=6的MES250ml,称取2.666g MES溶于RNase-free ddH
EDC:取0.2g EDC溶于RNase-free ddH
TE Buffer:量取5mL的1M Tris-HCl Buffer PH=8.0,1mL的0.5M EDTA PH=8.0向烧杯中加入约400ml RNase-free ddH
实施例3使用磁珠法提取真菌mRNA试剂盒提取酵母菌mRNA
(1)取液体培养48h酵母菌菌液1.5mL,4℃5000rpm离心2min取沉淀。加入500μl溶液A,加入1mL破壁酶液,充分混匀5-10min,5000rpm离心5min弃上清收集沉淀;
(2)沉淀加入1mL溶液B,激烈振荡30s,室温静置10min;12000g 4℃离心10min;从离心机上小心取出离心管,吸取上清转移至另一干净的离心管中,切忌吸出白色的中间层;
(3)向上清中加入300μl溶液C,20μl溶液D,上下颠倒离心管充分混匀后,静置5min,磁分离;
(4)缓慢沿管壁加入1mL溶液E清洗沉淀,轻轻上下颠倒洗涤离心管壁,磁分离,此步骤重复2次;
(5)弃去溶液E,室温干燥沉淀5~10min,加入40μL溶液F洗脱,磁分离取上清冷冻保存;
(6)反转录使用生工一步法RT-PCR扩增试剂盒(AMV),具体反应条件反应体系如下:取10×One Step Buffer 5μl,正向引物2μl,反向引物2μl,AMV RT 0.5μl,RNaseinhibitor 0.5μl,Taq DNA polymerase 0.5μl,模板2μl加入PCR管中,最后加RNase freeddH
引物序列为:
J-tps1-F:5’-AAGATTCACGAGAAGCAAC-3’,如SEQ ID NO.1所示;
J-tps1-R:5’-AATCACAACTCAAAACACC-3’,如SEQ ID NO.2所示;
(7)琼脂糖凝胶电泳检测:分别取2μl PCR产物进行1.5%琼脂糖凝胶电泳进行检测。
实施例4使用磁珠法提取真菌mRNA试剂盒提取黑曲霉mRNA
(1)取液体培养48h黑曲霉菌液1.5mL,4℃5000rpm离心2min取沉淀。加入500μl溶液A山梨醇缓冲液,加入1ml破壁酶液,充分混匀30℃处理30min,5000rpm离心5min弃上清收集沉淀;
(2)沉淀加入1mL溶液B,激烈振荡30s,室温静置10min;12000g 4℃离心15min;从离心机上小心取出离心管,吸取上清转移至另一干净的离心管中,切忌吸出白色的中间层;
(3)向上清中加入300μl溶液C,20μl生物素化核酸探针-链霉亲和素磁珠,上下颠倒离心管充分混匀后,静置10min,磁分离;
(4)缓慢沿管壁加入1mL 75%的溶液E清洗沉淀,轻轻上下颠倒洗涤离心管壁,磁分离,此步骤重复2次。
(5)弃去溶液E,室温干燥沉淀5~10min,加入40μl溶液F洗脱,磁分离取上清-20℃保存;
(6)反转录使用生工一步法RT-PCR扩增试剂盒(AMV),具体反应条件反应体系如下:取10×One Step Buffer 5μl,正向引物2μl,反向引物2μl,A MV RT 0.5μl,RNaseinhibitor 0.5μl,Taq DNA polymerase 0.5μl,模板2μl加入PCR管中,最后加RNase freeddH
扩增引物为:
H-bgl1-F:5’-TGGAGGAACGGCGATAAT-3’,如SEQ ID NO.3所示;
H-bgl1-R:5’-GGCTCGGTGACCAAGTAG-3’,如SEQ ID NO.4所示;
(7)琼脂糖凝胶电泳检测:分别取2μl PCR产物进行1.5%琼脂糖凝胶电泳进行检测。
图3为实施例3和实施例4的方法提取的真菌mRNA反转录扩增产物电泳检测图。其中,泳道1为生工生物公司DL2000Marker,图中泳道2、3分别为酵母菌、黑曲霉mRNA扩增产物;
实施例5本试剂盒酶法破壁和传统液氮法机械破壁提取真菌mRNA浓度、纯度对比。
用实施例3方法提取酵母菌mRNA试剂盒提取酵母菌mRNA(J3、J4样品)。
用实施例4方法提取黑曲霉mRNA试剂盒提取酵母菌mRNA(H3、H4样品)。
紫外光谱图如图4、图5和图6所示。
用液氮法机械破壁提取酵母菌mRNA(J1、J2样品)
(1)取液体培养48h酵母菌菌液1.5mL,4℃5000rpm离心2min取沉淀。多次加入液氮充分研磨成粉状,使真菌破壁;
(2)沉淀加入1mL溶液B,激烈振荡30s,室温静置10min;12000g 4℃离心10min;从离心机上小心取出离心管,吸取上清转移至另一干净的离心管中,切忌吸出白色的中间层;
(3)向上清中加入300μl溶液C,20μl溶液D,上下颠倒离心管充分混匀后,静置5min,磁分离;
(4)缓慢沿管壁加入1mL溶液E清洗沉淀,轻轻上下颠倒洗涤离心管壁,磁分离,此步骤重复2次。
(5)弃去溶液E,室温干燥沉淀5~10min,加入40μl溶液F洗脱,磁分离取上清检测样品浓度、OD值。
溶液B中异硫氰酸胍浓度为1.5mol/L、柠檬酸钠溶液浓度为1mol/L、十二烷基肌氨酸钠溶液(SDS)浓度为2%、醋酸钠溶液浓度为1.5mol/L、苯酚浓度为15%、巯基乙醇浓度为0.2%;溶液C为异丙醇;溶液D中生物素化核酸探针-链霉亲和素磁珠;溶液E为75%的乙醇溶液;溶液F为TE Buffer;
用液氮法机械破壁提取黑曲霉mRNA(H1、H2样品)
(1)取液体培养48h酵母菌菌液1.5mL,4℃5000rpm离心2min取沉淀。多次加入液氮充分研磨成粉状,使真菌破壁。
(2)沉淀加入1mL溶液B,激烈振荡30s,室温静置10min;12000g 4℃离心10分钟;从离心机上小心取出离心管,吸取上清转移至另一干净的离心管中,切忌吸出白色的中间层;
(3)向上清中加入300μl溶液C,20μl溶液D,上下颠倒离心管充分混匀后,静置5分钟,磁分离;
(4)缓慢沿管壁加入1mL溶液E清洗沉淀,轻轻上下颠倒洗涤离心管壁,磁分离,此步骤重复2次;
(5)弃去溶液E,室温干燥沉淀5~10min,加入40μl溶液F洗脱,磁分离取上清检测样品浓度、OD值。
溶液B中异硫氰酸胍浓度为1.5mol/L、柠檬酸钠溶液浓度为1mol/L、十二烷基肌氨酸钠溶液(SDS)浓度为2%、醋酸钠溶液浓度为1.5mol/L、苯酚浓度为15%、巯基乙醇浓度为0.2%;溶液C为异丙醇;溶液D中生物素化核酸探针-链霉亲和素磁珠;溶液E为75%的乙醇溶液;溶液F为TE Buffer;
浓度、OD值检测:使用德国Eppendorf核酸蛋白检测仪(Biophotometer)对样品进行浓度、OD值检测(见表1)。
检测结果显示本试剂盒酶法破壁提取的真菌mRNA产物浓度较高且纯度良好。
表1
本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
