通过活化细胞修复组织
文献发布时间:2023-06-19 11:21:00
背景技术
组织再生为有机体提供重要的能力,以在衰老、创伤、自身免疫疾病和恶性肿瘤等中更新受损组织并保持正常的器官功能。组织修复是复杂的多参数过程。其涉及在受损部位初始分泌促炎性细胞因子和趋化因子,然后将各种间充质和造血细胞募集至受损组织,以保护其免受破坏性炎症过程的侵害。该过程导致抗炎性级联反应,其最终恢复器官的完整性并使受损组织再生。因此,在组织损伤和修复的背景下,细胞疗法研究的主要兴趣集中在使用具有独特的抗炎性和再生性质的不同细胞类型,以增强天然组织对损伤和初始急性促炎性级联反应的修复。在这些细胞中是间充质干细胞(MSC)和巨噬细胞。
存在于各种间充质组织中,MSC通过分泌诸如IL-1RA、PGE2、TSG6和TGFβ的因子获得强的抗炎性质,从而诱导免疫抑制活性。此外,我们和其他人先前已显示MSC具体位于肿瘤或受损的组织部位,并减少炎症以及改善血管形成和组织修复。另外,先前已显示在胰腺癌中,化学疗法活化的MSC通过活化CXCL10-CXCR3轴来富集并保留癌症干细胞(CSC)生态位,并增强对细胞毒性剂的抗性,从而导致肿瘤生长和侵袭性增强。还已知巨噬细胞对组织稳态和伤口愈合具有关键作用。作为高度可塑性细胞,巨噬细胞在表型上从促炎性状态转变为抗炎性“修复”状态,分泌IL-10,转化生长因子β(TGFβ)、胰岛素样生长因子-1(IGF1)和VEGF,抑制T细胞并促进组织修复。此外,巨噬细胞通过诱导血管发生和淋巴管发生来增强组织再生和肿瘤生长。综上,这些能力使巨噬细胞和MSC成为基于细胞的疗法的最佳目标。
然而,尽管某些细胞类型具有修复受损组织的治疗潜力,但是细胞疗法仍不是分配的第一线治疗方法。其主要原因之一是缺乏细胞的特异性和活性,因此延迟并最小化组织再生和伤口愈合。具体地,当前方法应用各种生长因子和细胞因子来活化效应细胞,如TNFα和IFNγ。这些因子已显示活化基质细胞,从而有助于肿瘤生长抑制和组织修复。在其它情况下,细胞活化需要昂贵的遗传修饰,这也可以增加效应细胞的毒性和免疫相容性,并且这种方法的效率相对低。此处,我们提议了用于不同细胞的特异性活化以诱导组织再生和修复的新型、简单和具有成本效益的方法。
发明内容
在本发明的一些实施方式中,提供了活化组合物,其包含被化学治疗剂活化的用于细胞疗法的任何细胞类型。
在本发明的一些实施方式中,提供了活化组合物,其包含被化学治疗剂活化的用于细胞疗法的任何细胞类型,其中由具体化学治疗剂活化的用于细胞疗法的细胞类型与条件培养基分离,并且其中条件培养基用作疗法。
在本发明的一些实施方式中,提供了活化组合物,其包含被化学治疗剂活化的间充质干细胞和/或巨噬细胞或可用于细胞疗法的任何其它细胞类型,其中被特定化学治疗剂活化的间充质干细胞和/或巨噬细胞和/或可用于细胞疗法的细胞类型与条件培养基分离,并且其中条件培养基用作疗法。
在本发明的一些实施方式中,提供了用于产生活化细胞的方法,该活化细胞可以是用于组织修复的细胞疗法中使用的任何细胞类型,所述方法包括:通过用化学治疗剂培养用于细胞疗法的任何细胞类型活化用于细胞疗法的细胞类型。
在本发明的一些实施方式中,提供了用于生产用于组织修复的活化的间充质干细胞和/或活化的巨噬细胞的方法,所述方法包括:通过用化学治疗剂培养间充质干细胞和/或巨噬细胞来活化间充质干细胞和/或巨噬细胞。
在本发明的一些实施方式中,提供了用于在哺乳动物中促进组织再生或器官修复或用于减轻炎症的方法,该方法包括:
(a)获得被化学治疗剂活化的用于细胞疗法的任何细胞类型的活化组合物;和
(b)将活化组合物给予需要组织再生、器官修复或减轻炎症的哺乳动物。
在本发明的一些实施方式中,提供了用于在哺乳动物中促进组织再生或器官修复或用于减轻炎症的方法,该方法包括:
(a)获得被化学治疗剂活化的间充质干细胞和/或巨噬细胞的活化组合物;和
(b)将活化组合物给予需要组织再生、器官修复或减轻炎症的哺乳动物。
在本发明的一些实施方式中,提供了在哺乳动物中引发血管发生的方法,该方法包括:
(a)获得被化学治疗剂活化的用于细胞疗法的任何细胞类型的活化组合物;和
(b)将活化组合物给予需要组织再生或器官修复的哺乳动物,其中血管发生增强组织再生或器官修复。
在本发明的一些实施方式中,提供了在哺乳动物中引发血管发生的方法,该方法包括:
(a)获得被化学治疗剂活化的人间充质干细胞和/或巨噬细胞的活化组合物;和
(b)将活化组合物给予需要组织再生或器官修复的哺乳动物,其中血管发生增强组织再生或器官修复。
在本发明的一些实施方式中,提供了活化组合物,其包含被抗癌药物活化的间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞(other tissuesresident cells)。
在一些实施方式中,抗癌药物可以是化学治疗剂。
在本发明的一些实施方式中,提供了活化组合物,其包含来自由抗癌药物活化的间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞的条件培养基。
在本发明的一些实施方式中,提供了产生用于组织修复或用于治疗与组织损伤相关的疾病的活化的间充质干细胞和/或活化的巨噬细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞组合物的方法,所述方法包括:通过用抗癌药物培养间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞来活化间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织驻留细胞,以及任选地从活化的间充质干细胞和/或活化的巨噬细胞和/或T细胞和/或成纤维细胞分离条件培养基,活化的间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞或其上清液被用于组织修复或用于治疗与组织损伤相关的疾病。在本发明的一些实施方式中,用抗癌剂培养或培育细胞的步骤持续约10分钟至约72小时。
在本发明的一些实施方式中,条件培养基从至少105-107个活化细胞收集。
在本发明的一些实施方式中,提供了用于在哺乳动物中促进受损器官的组织再生或器官修复和/或用于减轻炎症的方法,该方法包括:将本发明的活化组合物给予需要组织再生、器官修复或减轻炎症的哺乳动物。
在本发明的一些实施方式中,提供了在哺乳动物中引发血管发生和/或诱导免疫抑制的方法,该方法包括:将本发明的活化组合物给予需要组织再生或器官修复的哺乳动物,其中血管发生增强受损器官的组织再生或器官修复。
在本发明的一些实施方式中,提供了使受损器官中的组织再生的方法,包括以下步骤:将本发明的活化组合物直接或通过外周给药施用于受损器官。
在本发明的一些实施方式中,受损器官是胰腺、乳房、卵巢、肺、心脏、肾、肺、GI道、肠、皮肤、肝或脑。
在本发明的一些实施方式中,抗癌药物是选自以下的化学治疗剂:吉西他滨、帕利他西(紫杉醇,paclitaxel)、帕利他西与阿那白滞素(anakinra)的组合、阿那白滞素、顺铂、5-FU、达卡巴嗪、替莫唑胺及其任何组合,或者其中抗癌药物是抗体、分子靶向药物,如硼替佐米(bortezomib)、放射、和免疫治疗剂,包括免疫检查点抑制剂(immune checkpointinhibitors)。在本发明的一些实施方式中,其中如果:
受损器官是胰腺,则化学治疗剂是吉西他滨;
受损器官是乳房、卵巢或肺,则化学治疗剂是帕利他西;
受损器官是心脏,则化学治疗剂是帕利他西和阿那白滞素的组合;
受损器官是肾或肺,则化学治疗剂是顺铂;
受损器官是GI道或肠,则化学治疗剂是5-FU;
受损器官是皮肤,则化学治疗剂是达卡巴嗪;
受损器官是脑,则化学治疗剂是替莫唑胺;和
受损器官是肝,则化学治疗剂是吉西他滨。
在本发明的一些实施方式中,提供了在有需要的对象中治疗或预防与组织损伤相关的疾病的方法,包括以下步骤:将活化组合物直接施用于变性器官或通过外周给药而施用于有需要的对象。
在本发明的一些实施方式中,如果疾病或障碍是肺纤维化,则抗癌药物是帕利他西、顺铂或吉西他滨;如果疾病或障碍是肝纤维化,则抗癌药物是吉西他滨。
在本发明的一些实施方式中,提供了治愈伤口的方法,包括将本发明的活化组合物施用于伤口的步骤。
在本发明的一些实施方式中,抗癌药物是帕利他西。
在本发明的一些实施方式中,细胞与抗癌药物一起培育约10分钟至约72小时。
附图说明
本文仅通过实例,参考附图描述了本发明。现具体参考详细附图,强调的是,仅通过实例显示细节,并且仅为了本发明的优选实施方式的示例性讨论的目的,并以提供被认为是对本发明的原理和概念方面最有用和最容易理解的描述的目的而呈现。在这方面,没有试图比基本理解本发明所必需更详细地显示本发明的结构细节,结合附图进行的描述对于本领域技术人员而言显而易见的是可以如何实践本发明的若干形式。
在附图中:
图1(A、B和C):图1A是显示吉西他滨促进MSC归巢至肿瘤并诱导干细胞群富集的照片
将8至10周龄SCID小鼠皮下植入PANC1细胞(n=5只小鼠/组)。当肿瘤达到500mm3时,用吉西他滨(500mg/kg)或媒介物对照(vehicle control)处理小鼠。图1A:72小时后,收获肿瘤,并使用识别MSC的抗CD105(黄色)和αSMA(绿色)和识别CSC的抗CD133(红色)的抗体对肿瘤切片进行免疫染色。细胞核用DAPI(蓝色)染色。红色箭头表示CSC,而白色箭头表示MSC。比例尺:100μm。图1B:右侧是显示测量和绘制的MSC与CSC之间的距离的图(n>15场/组),图1B左侧是显示通过流式细胞术定量的肿瘤单个细胞悬浮液中MSC的百分比图。图1C:显示通过流式细胞术评估的培养物中TIC的百分比的图:将PANC1细胞培养在无血清培养基(对照)或补充有衍生自对照MSC的培养物的条件培养基的无血清培养基(MSC)、吉西他滨培养的MSC(MSC-GEM)或吉西他滨-和抗-CXCL10-处理的MSC(MSC-GEM+抗-hCXCL10)中。3天后,通过流式细胞术评估培养物中TIC的百分比。
图2(A和B)显示了吉西他滨-活化的MSC的条件培养基诱导内皮细胞募集并促进免疫抑制
将含有10%由吉西他滨活化的MSC或未处理的MSC产生的条件培养基(CM)的基质胶塞(Matrigel plugs)皮下注射至8至10周龄BALB/c小鼠的腹侧。10天后,移除胶塞并染色,以进行组织学分析和流式细胞术评估。图2A显示了含有来自对照(左侧)或吉西他滨活化的MSC(右侧)的CM的基质胶塞的苏木精&伊红染色。图2B呈现了作为单个细胞悬浮液处理的基质胶塞针对不同细胞类型进行免疫染色,并如图所示通过流式细胞术进行分析。
图3(A、B或C)是显示化学疗法活化的MSC抑制T细胞活化的图
在不存在(基线)或存在未处理的MSC或化学疗法活化的MSC的CM的情况下,用CD3+/CD28+T细胞活化珠培养从8-10周幼龄BALB/c小鼠分离的脾细胞。24小时后,收获脾细胞,并通过流式细胞术评估活化的细胞毒性T细胞(CD8+(图3A)、CD8+/CD25+(图3B)或CD8+/CD107a+(图3C)的百分比。NC-阴性对照(在不存在活化珠的情况下培养脾细胞)、GEM-吉西他滨、PTX-帕利他西、CIS-顺铂。
图4(A、B、C和D)显示化学疗法活化的MSC诱导伤口愈合
使用博伊登盒测定法(Boyden chamber assay)评估PANC1(2x105个细胞)的迁移性质。如图4A中的图所示,在获自暴露于若干类型的化学治疗药物的MSC的CM的存在下测试细胞。如图4B和4C所示,当在存在来自对照或化学疗法活化的MSC的CM下培养时,使用刮擦伤口测定(scratch wound assay)分析PANC1细胞的运动性质。图4D中的照片中显示在注射有化学疗法活化的MSC或其对照的小鼠中体内评估伤口愈合性质。简而言之,在8至10周龄BALB/c小鼠的背部进行小的切口。第二天,用对照MSC或吉西他滨培养的MSC的条件培养基对伤口进行外部处理。每隔1天进行疗法,直至实验结束。每隔1天追踪愈合过程,持续2周,直至达到伤口完全闭合。
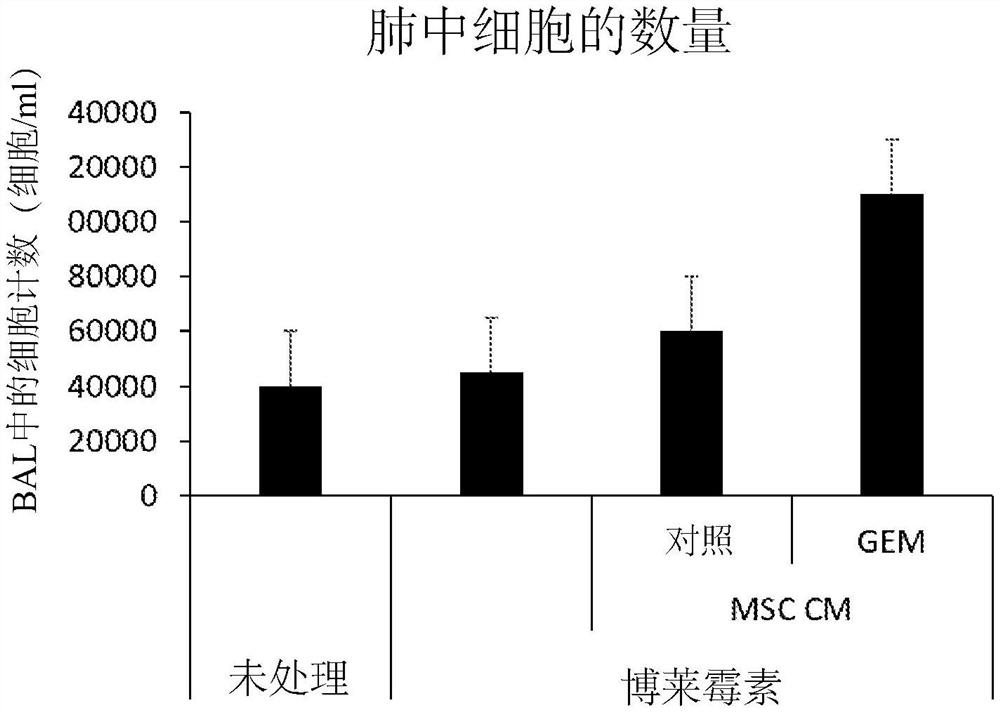
图5是显示由肺纤维化诱导的小鼠的细胞归巢至肺的图
将10周龄Balb/c小鼠气管内施用0.04单位的博莱霉素(Baxter Oncology GmbH,Germany)或用媒介物对照处理。1周后,不对小鼠进行处理,或气管内(IT)给予对照MSC或化学疗法活化的MSC的CM。每隔1天进行处理,持续1周。在给予博莱霉素后14天,进行支气管肺泡灌洗(BAL)并对细胞进行计数。显示来自BAL的细胞数。
图6(A、B、C和D)是显示化学疗法活化的干细胞抑制肺组织炎症的图。
如图5所示,针对不同表面标志物对细胞进行免疫染色,以评估免疫细胞谱系及其功能,如炎症或抗炎状态。然后通过流式细胞术分析细胞,并测试每个样品中细胞的百分比。如图6A-D所示,促炎性细胞的百分比减少,而抗炎性细胞的百分比增加,因此证明组织再生过程。
图7(A和B)是显示化学疗法活化的间充质干细胞降低肺纤维化的照片。
将10周龄Balb/c小鼠气管内(IT)给予0.04单位的博莱霉素(Baxter OncologyGmbH,Germany)或用媒介物对照处理。1周后,不对小鼠进行处理,或者IT给予对照MSC或化学疗法活化的MSC的条件培养基(CM)。每隔1天进行处理,持续1周。在给予博莱霉素后14天,收获肺,随后用PFA固定。将石蜡包埋的肺组织切片,并用苏木精和伊红(H&E)溶液(图7A)或Sirius Red染色,以评估胶原蛋白含量(图7B)。结果证明,在博莱霉素处理的小鼠(对照或MSC对照给予的小鼠)的肺中,广泛的炎症过程随后胶原蛋白沉积增加(由白色箭头表示),而在给予化学疗法活化的MSC的CM的小鼠的纤维化肺中,炎症完全消除,并且胶原蛋白沉积减少。
图8是显示化学疗法活化的间充质干细胞疗法不诱导毒性(由总体重测量)的图。
将8至10周龄的雌性C57Bl/6小鼠腹膜内给予DNM(5mg/kg)或用媒介物对照处理。在处理开始后2周,不对小鼠进行处理,或注射对照MSC或化学疗法活化的MSC的条件培养基或其外泌体级分(exosomes fraction)。每隔1天进行疗法,持续2周时间。每隔1天监测小鼠体重,以反映疗法的严重毒性作用。
图9(A、B和C)是显示化学疗法活化的MSC疗法在肝纤维化模型中恢复肝生理的图。
将8至10周龄的雌性C57Bl/6小鼠腹膜内给予DNM(5mg/kg)或用媒介物对照处理。治疗开始后2周,不对小鼠进行处理,或注射对照MSC或化学疗法活化的MSC的条件培养基或其外泌体级分。每隔1天进行疗法,持续2周时间。在终点处,从处理和对照小鼠抽血以评估肝生理功能。白蛋白(图9A)、丙氨酸氨基转移酶(ALT,图9B)和天冬氨酸氨基转移酶(AST,图9C)的水平表明,给予ac条件培养基或外泌体的化学疗法活化的MSC疗法改善纤维化肝的肝生理参数。
图10(A、B、C和D)是显示化学疗法活化的间充质干细胞抑制肝部炎症的图。
针对不同表面标志物对来自用DNM处理以产生纤维化肝病的肝的单个细胞悬浮液进行免疫染色,以评估成纤维细胞和免疫细胞谱系。然后通过流式细胞术分析细胞,并测试每个样品中细胞的百分比。活化的MSC疗法抑制促炎性细胞(T辅助细胞、细胞毒性T细胞(图10A)、NK细胞、B细胞(图10B)、MDSC、巨噬细胞(图10C)、成纤维细胞和枯否细胞(Kupffercell)(图10D)和刺激的抗炎性群体,包括枯否细胞和骨髓衍生的抑制细胞(myeloid-derived suppressor cells)(MDSC)的百分比,因此表明我们的疗法促进肝的组织再生增加。
图11(A、B、C和D)显示化学疗法活化的间充质干细胞降低肝纤维化。
将8至10周龄的雌性C57Bl/6小鼠腹膜内给予DNM(5mg/kg)或用媒介物对照处理。处理开始后2周,不对小鼠进行处理,或注射对照MSC或化学疗法活化的MSC的条件培养基或其外泌体级分。每隔1天进行疗法,持续2周时间。在开始DNM处理后4周,处死小鼠,收获肝,并处理以用于纤维化评估。与其它组相比时,经化学疗法活化的MSC的CM处理的小鼠中可溶性胶原蛋白水平显著下降,表明肝纤维化降低(图11A)。同时,将石蜡包埋的肝组织切片并用苏木精和伊红(H&E)溶液(图11B)或Sirius Red染色,以评估胶原蛋白含量(图11C和图11D)。结果表明,在DNM处理的小鼠的肝中胶原蛋白沉积增加(由白色箭头表示),而在给予化学疗法活化的MSC的CM或其产生的外泌体的小鼠的纤维化肝中,胶原蛋白沉积显著降低至未处理的对照的水平。
具体实施方式
令人惊讶地,发现抗癌剂,如例如化学治疗剂在体内和体外均能高度有效活化间充质干细胞(MSC)、巨噬细胞、成纤维细胞和T细胞,其中发现活化的MSC、巨噬细胞、成纤维细胞和T细胞或其条件培养基有效地使组织再生。更令人惊讶地,发现特定的化学治疗剂在某些组织中和对于具体的临床应用具有明显的作用。因此,本发明提供了通过特定的抗癌剂(如化学治疗剂)具体活化各种细胞的方法。活化细胞可以用于诱导组织再生、修复具体器官以及治疗各种状况,包括肺或肝纤维化。本发明进一步提供了通过用由抗癌剂(如化学治疗药物)活化的间充质干细胞和/或巨噬细胞和/或成纤维细胞和/或可用于细胞疗法的任何其它细胞类型的活化产物局部处理生理或受损组织或器官进行组织修复(包括伤口愈合和纤维化愈合)的方法。进一步提供了用由抗癌剂(如化学治疗剂)具体活化的间充质干细胞和/或巨噬细胞和/或成纤维细胞和/或T细胞或可用于细胞疗法的任何其它细胞类型的CM治疗伤口的方法。
在本发明的一些实施方式中,提供了在有需要的对象中治疗或预防与组织损伤相关的疾病的方法,该方法包括:
使活化的间充质干细胞(MSC)和/或上述任何其它活化的细胞接触和/或使活化的MSC和/或任何其它活化的细胞的条件培养基与有需要的对象中经历组织损伤的组织接触,其中MSC是自体或同种异体的未转染的MSC。
如本文所用,“预防(preventing)”或“预防(prevention)”或“抑制(inhibit)”或“抑制(inhibition)”可互换地指代降低罹患疾病或障碍(可能为与组织损伤相关的疾病)的风险的可能性(例如,当对象尚未经历或未显示疾病的所有症状或症状较轻时,该疾病的爆发将被延迟或抑制)。用于识别此类患者的生物学或生理学参数是医师公知的,并且取决于疾病或障碍。
术语对象的“治疗(treatment)”或“治疗(treating)”包括将可用于本发明的活化的MSC和/或其它细胞的分泌细胞产物应用于或给予对象(或将本发明的化合物应用于或给予对象的细胞或组织),以稳定、治愈(curing)、愈合(healing)、减少、缓解、改变、治疗(remedying)、降低恶化、减轻、改善或影响疾病或状况、疾病或状况的症状、或疾病或状况的风险(或易感性)。术语“治疗”指代成功治疗或减轻损伤、病理或状况的任何指标,包括任何客观或主观参数,如削减;缓解;降低恶化率;减轻疾病的严重性;稳定,减少症状或使患者更耐受损伤、病理或状况;减慢变性或下降的速率;使变性的终点减少衰弱;或改善对象的身心健康。在一些实施方式中,术语“治疗”可以包括在需要另外的治疗之前延长对象的预期寿命和/或延迟。
术语“组织损伤”在本文中指代病理状况,包括胞外基质(ECM)或具体组织内的细胞(包括烧伤、凋亡细胞或坏死细胞)的结构变化。这种受损组织可能由于免疫或自身免疫活性、内力或外力、炎症过程、外伤等。
在本发明的一些实施方式中,提供了用于治疗或预防与组织损伤相关的疾病的方法。与组织损伤相关的疾病是以下疾病、状况或障碍中的一种或多种:
骨性关节炎、缺血性坏死或严重的退行性关节病(severe degenerative jointdisease);
中风或退行性脑病,选自痴呆、肌萎缩性侧索硬化(ALS)、阿尔茨海默氏病、帕金森氏病、杭廷顿氏舞蹈病、皮克氏病、克-雅二氏病、及其组合;
肌营养不良,如例如,杜兴氏肌营养不良(DMD)、贝克尔肌营养不良(BMD)、埃-德二氏肌营养不良、兰-代二氏肌营养不良、面肩肱肌营养不良(FSH)、假肥大性肌营养不良(Limb-Girdle muscular dystrophies)、von Graefe-Fuchs肌营养不良、眼咽肌营养不良(OPMD)、肌强直性营养不良(斯太纳特氏病)和先天性肌营养不良;
纤维化肝病或肝退行性疾病、肝炎性状况、硬变(cirrhosis);
纤维化肺病、慢性阻塞性肺病;
自身免疫性疾病,如狼疮、1型糖尿病、牛皮癣、皮肤湿疹;
骨性关节炎——关节炎的最常见形式——是特征在于关节软骨的退行性过程缓慢,与边缘骨赘形成相关的软骨下骨和低度炎症的疾病。认为骨性关节炎以其慢性形式影响15%的人群。其中,四分之一严重残疾。大多数骨性关节炎没有已知的病因,被称为原发性骨性关节炎。当骨性关节炎的病因已知时,这种状况被称为继发性骨性关节炎。继发性骨性关节炎由另一种疾病或状况引起。可能导致继发性骨性关节炎的状况包括关节结构反复受伤或手术、出生时关节异常(先天性异常)、痛风、糖尿病和其它激素紊乱。其它形式的关节炎是全身性疾病,如类风湿性关节炎和全身性红斑狼疮(SLE);
骨性关节炎主要涉及臀部、膝盖、脊柱和指间关节。在严重的骨性关节炎中,软骨垫(cartilage cushion)的完全丧失引起骨之间的摩擦,从而导致静止时的疼痛或运动受限的疼痛。骨性关节炎的特征在于软骨在数年内缓慢降解;
视网膜退行性障碍、雷弗素姆病、史-伦-奥三氏综合征、晶状角膜营养不良(Schnyder crystalline corneal dystrophy)、脉网膜小疣、与年龄相关的黄斑变性和糖尿病性视网膜病;
一些其它实例:阿尔茨海默氏病(AD)、肌萎缩性侧索硬化(ALS,葛雷克氏病(LouGehrig's Disease))、夏-马-图三氏病(CMT)、慢性外伤性脑病、囊性纤维化、一些细胞色素C氧化酶缺乏症(通常是退行性利氏(Leigh)综合征的病因)、埃-丹二氏综合征、进行性骨化性纤维发育不良、弗里德赖希氏共济失调、额颞痴呆(Frontotemporal dementia)(FTD)、心血管疾病(例如动脉粥样硬化,如冠状动脉疾病、主动脉狭窄等)、杭廷顿氏舞蹈病、婴儿神经轴索营养不良、圆锥形角膜(KC)、球形角膜、脑白质病变、黄斑变性(AMD)、马方氏综合征(MFS)、一些线粒体肌病、线粒体DNA缺陷综合征(Mitochondrial DNA depletionsyndrome)、多发性硬化(MS)、多系统萎缩(Multiple system atrophy)、肌营养不良(MD)、神经元蜡样脂褐质沉积症、尼-皮二氏病、骨性关节炎、骨质疏松、帕金森氏病、肺动脉高压、朊粒病(prion diseases)(克-雅二氏病、致死性家族性失眠(fatal familial insomnia)等)、进行性核上麻痹、色素性视网膜炎(RP)、类风湿性关节炎、山德霍夫病、脊髓性肌萎缩(SMA,运动神经元病)、亚急性硬化性全脑炎、泰-萨二氏病、血管痴呆(本身可能不是神经退行性的,但通常与其它形式的退行性痴呆一起出现);
其它实例是烧伤、骨头破裂、伤口、糖尿病伤口,如在1型糖尿病中;
进一步的实例是自身免疫疾病,如例如,风湿性关节炎、牛皮癣、结节病、乳糜泻、1型糖尿病、格雷夫斯氏病、炎症性肠病、多发性硬化、牛皮癣、类风湿性关节炎和全身性红斑狼疮;
“活化的细胞”或“活化的间充质干细胞”或“活化的巨噬细胞”或“活化的成纤维细胞”等在本文指代先前使用标准无血清培养基用抗癌剂培养至少10、20、30、40、50分钟或1小时、2、3、4、5、6、7、8、9、10、12、14、16、18、20、22、24、48或72小时或更长时间的细胞、间充质干细胞或巨噬细胞或其它细胞。应注意,应在细胞经历凋亡和/或死亡之前终止培育。这些活化的细胞或由此产生的条件培养基可以用于本文所述的方法中。此类抗癌剂的实例是吉西他滨(Gemacitabine)、帕利他西(紫杉醇,paclitaxel)、帕利他西和阿那白滞素(Anakinra)、顺铂、5-FU、达卡巴嗪、替莫唑胺靶向药物(例如硼替佐米)、辐射、抗血管发生药物和免疫检查点抑制抗体。术语“活化组合物”包括通过抗癌疗法或其条件培养基或两者活化的细胞。条件培养基可以被稀释、浓缩或冻干。活化的细胞是以下中的任一种:可用于组织修复的活化的间充质干细胞和/或活化的巨噬细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织驻留细胞或任何其它活化的细胞。
本发明的活化的MSC或任何其它活化的细胞的数量、或由此产生的条件培养基、给药剂型和给药方案以及在局部给药的情况下的位置取决于疾病或障碍的类型、受损组织或器官的位置以及疾病的严重性。在大多数情况下,但不是排他性地,条件培养基从每1ml至少105-106个细胞中产生。在一些实施方式中,治疗是每次治疗使用至少1-10×106个细胞。
应注意,在本发明的一些实施方式中,条件培养基可以通过例如以1100,000g离心来浓缩以获得外泌体和其它产物。在一些情况下,可以将条件培养基冻干,以将其保持为干燥产物,例如以后用于重构。注意,在本发明的治疗方法中,术语“条件培养基(conditionedmedium)”或“条件培养基(conditioned media)”或“CM”还指代分泌组(secretome)、干燥产物、上清液以及未接触的条件培养基。
例如,对于治疗患者椎间盘变性(disc degeneration)的方法,该方法包括:将活化的间充质干细胞(MSC)或活化的MSC的条件培养基直接注射至患者的腰椎间盘近侧的腰相关肌肉中,其中MSC是自体或同种异体的未转染的MSC;其中腰相关肌肉选自腰大肌、多裂肌、横突棘肌和骶棘肌。治疗剂量方案为1-10次(times),细胞活化后细胞的数量为1×106个细胞。在一些情况下,根据治愈过程监测,可以将上述指定的活化细胞条件培养基以100μl的体积注射1-10次或更多次。
化学疗法活化的MSC富集干细胞
MSC由于其高的增殖潜力和分化为主要间充质组织的能力而是组织再生和细胞疗法的主要候选者之一。此外,已显示MSC通过在暴露于铂系细胞毒性剂之后分泌两种具体的脂肪酸而促进实体瘤中化学疗法的全身性抗性。这些脂肪酸间接保护结肠和肺癌细胞免受化学疗法的细胞毒性作用。然而,MSC与组织驻留干细胞的相互作用尚不清楚,尤其是在化学疗法之后。为此,如在实施例中所见,通过将PANC1细胞注射至8至10周龄SCID小鼠的胁腹(胁,flank)来分析、生成皮下胰腺肿瘤。当肿瘤达到某些尺寸时,用吉西他滨处理小鼠,3天后取出小鼠并处死。在吉西他滨疗法之后,对MSC和癌症干细胞(CSC)的肿瘤进行免疫染色,证明了具有增加的耐药能力和增加的致肿瘤性的罕见肿瘤细胞群。具体而言,与未处理的对照相比,MSC归巢至肿瘤,并紧邻CSC定位(图1A)。另外,图1B证明化学疗法诱导MSC大量募集至胰腺肿瘤,这与MSC对受损组织部位的浸润相似。此外,为了研究MSC是否有助于CSC再繁殖(repopulation),施用未处理的MSC或吉西他滨培养的MSC的条件培养基(CM),并通过流式细胞术使用表型表征评估CSC富集。与未处理的MSC的作用相比,用化学疗法活化MSC导致CSC显著富集。吉西他滨-活化的MSC的分泌组分析表明,相对于未处理的MSC,在化学疗法处理之后,在条件培养基中,影响组织重塑和/或再生的CXCL10等多个其它因素高度升高,如表2所示。显示CXCL10通过与CXCR3受体结合并连续诱导STAT3信号传导来促进CSC富集。用抗CXCL10抗体中和CXCL10消除了化学疗法活化的MSC对CSC的富集作用(图1C)。
化学疗法活化的MSC促进免疫抑制并诱导血管发生
MSC以其归巢至受损部位并促进组织再生的能力而被知晓。此外,MSC分泌整个环境的细胞因此和趋化因子,包括TGFβ、IL-6、PGE2、IDO、LIF,以调节各种造血细胞类型(其调节组织结构)的募集。进行基质胶塞测定法以测试这些能力。为此,将含有由未处理或吉西他滨培养的MSC生成的条件培养基(CM)的基质胶塞植入Balb/c小鼠的胁腹。10天后,取出胶塞并制备为单个细胞悬浮液。通过流式细胞术对来自胶塞的细胞进行表型分析,以识别募集至胶塞的细胞。显示来自吉西他滨处理的MSC的CM诱导内皮细胞的募集,表明吉西他滨疗法之后血管发生潜力增加。另外,与含有对照MSC的CM的胶塞相比时,在具有来自吉西他滨-活化的MSC的CM的基质胶塞中,大多数免疫群体,包括巨噬细胞、NK细胞、T细胞和B细胞的定殖显著减少(图2A-B)。为进一步阐明化学疗法暴露的MSC的免疫调节作用,通过向从幼稚(naive)Balb/c小鼠提取的脾细胞施用幼稚或化学疗法活化的MSC的CM来进行T细胞活化测定。结果,化学疗法活化的MSC显著减少CD8 T细胞的总量,并抑制细胞毒性T细胞的活化(图3)。总体而言,结果提供了另外的支持:在肿瘤中,与受损组织相似,MSC获得通过增加血管发生和诱导免疫抑制促进的强大再生能力,以增加总体组织修复。
化学疗法活化的MSC增加有效组织修复
基于化学疗法活化的MSC的增强的促血管发生和免疫抑制性质,测试MSC愈合伤口的能力。为此,如材料和方法中所述,通过进行改良博伊登盒测定法来测试MSC对其它细胞的迁移性质的影响。这样做,在孔的上盒(上室,upper chamber)中培养PANC1,而在下盒(下室,lower chamber)中装载化学疗法活化的MSC的CM或未处理的MSC的CM。24小时后,将迁移至盒下侧的细胞固定,随后用结晶紫染色。发现与对照组相比,吉西他滨-活化的MSC的CM显著增加PANC1细胞的迁移性质。有趣的是,由暴露于其它细胞毒性剂(如帕利他西和顺铂)的MSC生成的CM不影响细胞的迁移能力(图4A)。另外,进行刮擦伤口测定法,以进一步证明化学疗法活化的MSC的再生潜力。用吉西他滨培养的MSC的CM处理的细胞比未处理的对照细胞或暴露于未处理的MSC的CM的细胞更快地封闭间隙(图4B和4C)。与迁移测定结果并行,用来自暴露于PTX或顺铂的MSC的CM处理的细胞的伤口闭合时间与对照组相似。
接下来,在体内测试化学疗法活化的MSC的伤口愈合性质。为此目的,在SCID小鼠的背部进行0.5cm切口。24小时后,用对照MSC或预暴露于10nM吉西他滨的MSC的条件培养基外部处理伤口。对照小鼠不进行处理。监测伤口愈合,直至伤口完全闭合。结果显示,与对照组相比,用吉西他滨-活化的MSC处理的小鼠的伤口愈合最快(图4D)。综上所述,我们的结果证明,化学疗法培养的MSC极大地诱导MSC再生和伤口愈合特征,因此有助于损伤修复。
在本发明的实施方式中,显示了化学治疗剂可以用于活化可用于需要细胞再生的各种适应症的细胞,如巨噬细胞和/或MSC、和/或T细胞和/或成纤维细胞。下表1中显示了一些实例。在一些实施方式中,例如在细胞再生中反映的具体化学治疗剂的治疗效果对某些器官具有特异性,如表1所示例。
在本发明的实施方式中,提供了下文定义的活化组合物。根据本发明的一些实施方式,活化组合物包含由抗癌剂(如化学治疗剂)活化的间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞。在其它实施方式中,活化组合物包含制剂的上清液或条件培养基,该制剂包括由具体的抗癌剂(如化学治疗剂)活化和例如使用这种活化细胞的分泌组通过离心分离的间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞。术语“分泌组”指代蛋白质、代谢产物、酶、脂质、糖分子和胞外囊泡,如由细胞分泌到胞外空间中的外泌体。
“胞外囊泡”、“外泌体”是从含有可以在细胞之间转移的蛋白质、RNA、DNA和其它生物材料的细胞冒泡(blubbing)或分泌小囊泡。这些囊泡已显示在生理和病理条件下起作用。
在本发明的一些实施方式中,提供了活化组合物,其包含被化学治疗剂活化的间充质干细胞和/或巨噬细胞,其中被化学治疗剂活化的间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞与条件培养基分离,并且其中条件培养基用作疗法。
在本发明的一些实施方式中,提供了产生用于组织修复的活化的间充质干细胞和/或活化的巨噬细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞的方法,包括:通过用合适的化学治疗剂培养间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞来活化间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞。
在本发明的一些实施方式中,提供了用于在哺乳动物中促进组织再生、器官修复或用于减轻炎症的方法,该方法包括:
(a)获得被化学治疗剂活化的间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞的活化组合物;和
(b)将活化组合物给予需要组织再生、器官修复或减轻炎症的哺乳动物。
在本发明的一些实施方式中,提供了在哺乳动物中引发血管发生的方法,该方法包括:
(a)获得被化学治疗剂活化的人间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞的活化组合物;和
(b)将活化组合物给予需要组织再生或器官修复的哺乳动物,其中血管发生增强组织再生或器官修复。
在本发明的实施方式中,提供了在受损器官中使组织再生的方法,包括以下步骤:使巨噬细胞和/或间充质干细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞与化学治疗剂接触,以提供活化的巨噬细胞和/或活化的间充质干细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞,并将活化的细胞施用于受损器官。
在本发明的一些实施方式中,受损器官是胰、乳房、卵巢、肺、心脏、肾、肺、GI道、肠、皮肤、肝或脑。在一些实施方式中,化学治疗剂是吉西他滨、帕利他西、帕利他西与阿那白滞素的组合、阿那白滞素、顺铂、5-FU、达卡巴嗪或替莫唑胺、或其任何组合。
在本发明的一些实施方式中,如果受损器官是胰,则用于细胞活化的化学治疗剂是吉西他滨。
在本发明的一些实施方式中,如果受损器官是乳房、卵巢或肺,则用于细胞活化的化学治疗剂是帕利他西。
在本发明的一些实施方式中,如果受损器官是心脏,则可以用于细胞活化的化学治疗剂是帕利他西和阿那白滞素的组合或单独的阿那白滞素。
在本发明的一些实施方式中,如果受损器官是肾、卵巢或肺,则用于细胞活化的化学治疗剂是顺铂。
在本发明的一些实施方式中,如果受损器官是GI道,例如肠,则用于细胞活化的化学治疗剂是5-FU。
在本发明的一些实施方式中,如果受损器官是皮肤,则用于活化的化学治疗剂是达卡巴嗪。
在本发明的一些实施方式中,如果受损器官是脑,则用于活化的化学治疗剂是替莫唑胺。
在本发明的一些实施方式中,提供了治疗胰腺炎的方法,包括以下步骤:使间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞和/或用于细胞疗法的任何其它细胞类型与化学治疗剂接触,以提供活化的间充质干细胞、巨噬细胞和/或T细胞和/或成纤维细胞和/或脂肪组织衍生的细胞和/或其它组织驻留细胞和/或用于细胞疗法的任何其它细胞类型,并将活化的间充质干细胞、巨噬细胞和/或T细胞和/或成纤维细胞和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞和/或活化的用于细胞疗法的细胞类型通过直接注射或通过外周给药施用于胰。在一些实施方式中,化学治疗剂是吉西他滨。在一些实施方式中,活化组合物包含被化学治疗剂活化的间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞和/或可用于细胞疗法的任何其它细胞类型,其中由具体化学治疗剂活化的间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞和/或用于细胞疗法的其它细胞类型与上清液分离,并且其中上清液用作可以用于上述治疗方法中的疗法。
在本发明的一些实施方式中,提供了治疗乳房、肺或卵巢损伤的方法,包括以下步骤:使巨噬细胞或间充质干细胞和/或T细胞和/或成纤维细胞和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞或用于细胞疗法的任何其它细胞类型与化学治疗剂接触,以提供活化的巨噬细胞和/或活化的间充质干细胞、和/或T细胞和/或成纤维细胞和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞和/或用于细胞疗法的其它活化的细胞类型,并将活化的巨噬细胞和/或活化的间充质干细胞和/或T细胞和/或成纤维细胞和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞或用于细胞疗法的活化的细胞类型施用于乳房、肺或卵巢。在一些实施方式中,化学治疗剂是帕利他西。
在一些实施方式中,活化组合物包含被化学治疗剂活化的间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞和/或可用于细胞疗法的任何其它细胞类型,其中由具体化学治疗剂活化的间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞和/或用于细胞疗法的其它细胞类型与上清液分离,其中上清液用作可以用于上述治疗方法中的疗法。
在本发明的一些实施方式中,提供了治疗心肌梗塞(MI)或心力衰竭的方法,包括以下步骤:使巨噬细胞或间充质干细胞和/或用于细胞疗法的任何其它细胞类型与化学治疗剂接触,以提供活化的巨噬细胞或活化的间充质干细胞和/或T细胞和/或成纤维细胞和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞和/或用于细胞疗法的活化的细胞类型,并将活化的巨噬细胞或活化的间充质干细胞或用于细胞疗法的活化的细胞类型施用于心脏。在一些实施方式中,化学治疗剂是帕利他西和阿那白滞素的组合或单独的阿那白滞素。在一些实施方式中,活化组合物包含被化学治疗剂活化的间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织驻留细胞和/或可用于细胞疗法的任何其它细胞类型,其中由具体化学治疗剂活化的间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞和/或用于细胞疗法的细胞类型与上清液分离,并且其中上清液用作可以用于上述治疗方法中的疗法。
在本发明的一些实施方式中,提供了治疗肾损伤或肾病的方法,包括步骤:使巨噬细胞或间充质干细胞或用于细胞疗法的任何其它细胞类型与化学治疗剂接触,以提供活化的巨噬细胞或活化的间充质干细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞和/或用于细胞疗法的活化的细胞类型,并将活化的巨噬细胞或活化的间充质干细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞和/或用于细胞疗法的活化的细胞类型施用于肾。在一些实施方式中,化学治疗剂是顺铂。
在一些实施方式中,活化组合物包含被化学治疗剂活化的间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞和/或可用于细胞疗法的任何其它细胞类型,其中由具体化学治疗剂活化的间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞和/或和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞或用于细胞疗法的细胞类型与上清液分离,并且其中上清液用作可以用于上述治疗方法中的疗法。
在本发明的一些实施方式中,提供了治疗炎症性肠病(IBD),如克罗恩病或溃疡性结肠炎的方法,包括以下步骤:使巨噬细胞和/或间充质干细胞和/或T细胞和/或成纤维细胞和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞和/或用于细胞疗法的任何其它细胞类型与化学治疗剂接触,以提供活化的巨噬细胞和/或活化的间充质干细胞、和/或T细胞和/或成纤维细胞和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞和/或用于细胞疗法的活化的细胞类型,并将活化的巨噬细胞或活化的间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞或用于细胞疗法的活化的细胞类型施用于GI道或肠。在一些实施方式中,化学治疗剂是5-FU。
在一些实施方式中,活化组合物包含被化学治疗剂活化的间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞和/或可用于细胞疗法的任何其它细胞类型,其中被具体化学治疗剂活化的间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞和/或用于细胞疗法的细胞类型与上清液分离,并且其中上清液用作可以用于上述治疗方法中的疗法。
在本发明的一些实施方式中,提供了治疗皮肤伤口,如烧伤、糖尿病病灶等的方法,包括以下步骤:使巨噬细胞和/或间充质干细胞和/或T细胞和/或成纤维细胞和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞和/或用于细胞疗法的任何其它细胞类型与化学治疗剂接触,以提供活化的巨噬细胞或活化的间充质细胞和/或T细胞和/或成纤维细胞和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞和/或用于细胞疗法的活化的细胞类型,并将活化的巨噬细胞和/或T细胞和/或成纤维细胞和/或活化的间充质干细胞和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞或用于细胞疗法的活化的细胞类型施用于伤口可以被修复的位置的皮肤。在一些实施方式中,化学治疗剂是达卡巴嗪。在一些实施方式中,活化化合物包含被化学治疗剂活化的间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞和/或可用于细胞疗法的任何其它细胞类型,其中被具体化学治疗剂活化的间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞和/或用于细胞疗法的细胞类型与上清液分离,并且其中上清液用作可以用于上述治疗方法中的疗法。
在本发明的一些实施方式中,提供了治疗神经退行性疾病,如ALS、帕金森氏病、阿尔茨海默氏病等的方法,包括以下步骤:使巨噬细胞和/或间充质干细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞和/或用于细胞疗法的任何其它细胞类型与化学治疗剂接触,以提供活化的巨噬细胞和/或活化的间充质干细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞或用于细胞疗法的其它细胞类型,并将活化的巨噬细胞和/或T细胞和/或成纤维细胞和/或活化的间充质干细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞和/或用于细胞疗法的其它活化的细胞类型施用于脑中的受损区域。在一些实施方式中,化学治疗剂是替莫唑胺。
在一些实施方式中,活化组合物包含被化学治疗剂活化的间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞和/或可用于细胞疗法的任何其它细胞类型,其中被具体化学治疗剂活化的间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞和/或用于细胞疗法的细胞类型与上清液分离,并且其中上清液用作可以用于上述治疗方法中的疗法。
在本发明的一些实施方式中,提供了治疗衰老相关状况的方法,包括以下步骤:使巨噬细胞和/或间充质干细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞或用于细胞疗法的任何其它细胞类型与化学治疗剂接触,以提供活化的巨噬细胞和/或活化的间充质干细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞或用于细胞疗法的活化的其它细胞类型,并将活化的巨噬细胞和/或活化的间充质干细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞或用于细胞疗法的活化的细胞类型施用于脑中的受损区域。在一些实施方式中,化学治疗剂是替莫唑胺。
在一些实施方式中,活化组合物包含被化学治疗剂活化的间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞和/或可用于细胞疗法的任何其它细胞类型,其中被具体化学治疗剂活化的间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞和/或用于细胞疗法的细胞类型与条件培养基分离,其中条件培养基用作可以用于上述治疗方法中的疗法。
在本发明的一些实施方式中,提供了治疗自身免疫相关状况的方法,包括以下步骤:使巨噬细胞和/或间充质干细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞或用于细胞疗法的任何其它细胞类型与化学治疗剂接触,以提供活化的巨噬细胞和/或活化的间充质干细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞或用于细胞疗法的活化的其它细胞类型,并将活化的巨噬细胞和/或活化的间充质干细胞和/或T细胞和/或成纤维细胞和/或神经组织细胞(如星形胶质细胞和神经胶质细胞)和/或脂肪组织衍生的细胞和/或其它组织的驻留细胞或用于细胞疗法的活化的细胞类型施用于脑中的受损区域。在一些实施方式中,化学治疗剂是甲氨蝶呤。
表1:可以用于活化用于各种适应症的细胞的不同化学疗法。
表2:用吉西他滨化学疗法活化的间充质干细胞的分泌组(MSC的条件培养基中的蛋白质表达表示为幼稚和吉西他滨-活化的MSC之间的增加倍数)
在一些实施方式中,提供了用于制备用于治疗受损组织的药物的方法,包括以下步骤:
分析来自被抗癌药物活化的间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞和/或神经细胞和/或脂肪细胞的条件培养基的分泌组;
制备包括在分泌组中确定的两种或更多种活性成分的组合的组合物;
评估组合物的效率。
在一些实施方式中,两种或更多种活性成分之间的比与在分泌组中确定的比大约相同。
方法可以用于个体水平,即,由不同抗癌剂活化的不同细胞将导致不同的活性成分和/或其间的不同比率。因此,可以为每个人制备个体组合物。
因此,可以通过使用来自被抗癌药物活化的间充质干细胞和/或巨噬细胞和/或T细胞和/或成纤维细胞和/或神经细胞和/或脂肪细胞的条件培养基,或通过确定其分泌组中的成分,确定其间的比率并制备这种组合物用作药物来治疗与组织损伤相关的疾病或障碍或状况。
实施例
材料和方法
细胞培养
人胰腺腺癌细胞系(PANC1)购自美国模式培养物集存库(American Type CultureCollection)(ATCC),并培养在DME培养基(DMEM)中。在原始母液中解冻后,在1%青霉素-链霉素、1%丙酮酸钠和1%L-谷氨酰胺的存在下,在37℃于5%CO2环境中,用10%FCS补充培养基持续不超过6个月。
为了分析CSC富集,将PANC1细胞培养在无血清培养基(对照)、衍生自未处理或化学疗法培养的MSC的CM中,或在无血清培养基中与未处理或化学疗法培养的MSC以10:1的比共培养。在一些组中,无血清培养基补充有抗hCXCL10(1μg/ml,R&D系统)。3天后,如下所述使用免疫表型分析评估培养物的CSC富集。
生成化学疗法培养的(educated)MSC或MSC衍生的条件培养基
人骨髓MSC(LONZA,瑞士)培养在补充有10%FBS、1%L-谷氨酰胺、1%丙酮酸钠和1%链霉素的极限必需培养基-α(αMEM)中。每3天更换培养基,并将细胞保持培养上至7代。
在一些情况下,使用分离自健康患者的骨髓抽吸物的人MSC,并培养在补充有10%FBS、1%L-谷氨酰胺、1%丙酮酸钠和1%链霉素的极限必需培养基-α(αMEM)的培养皿中。基于其对塑性培养皿的粘附能力进行MSC的纯化。每3天更换培养基,直至造血细胞被冲掉,留下粘附的MSC均质培养物。扩增获得的MSC并传代,同时上至7代的细胞用于实验。
在一些情况下,从骨髓抽吸物分离小鼠MSC,并培养在补充有10%FBS、1%L-谷氨酰胺、1%丙酮酸钠和1%链霉素的极限必需培养基-α(αMEM)的培养皿中。基于其对塑性培养皿的粘附能力进行MSC的纯化。每3天更换培养基,直至造血细胞被冲洗掉,留下粘附的MSC均质培养物。扩增获得的小鼠MSC并传代,同时直至上至10代的细胞用于实验。
为生成化学疗法培养的MSC,将培养的MSC暴露于帕利他西(100nM)、吉西他滨(10nM)、顺铂(10μM)或媒介物对照24小时。为生成MSC衍生的CM,将化学疗法培养的MSC(如上所述)以1×105个细胞/ml的浓度重接种在无血清培养基中。72小时后,收集CM。
动物模型、治疗和实时成像
动物的使用和实验方案已被Technion的动物护理和使用委员会批准(AnimalCare and Use Committee)。将人PANC1(5×106个细胞)皮下注射至8至10周龄CB.17雌性SCID小鼠(Harlan,Israel)的胁腹。利用公式宽2×长×0.5通过游标卡尺定期评估肿瘤大小。用500mg/kg吉西他滨(Eli Lilly Ltd.)或媒介物对照处理小鼠。
对于体内伤口愈合测定,在8至10周龄BALB/c小鼠的背部进行小(0.5cm)切口。在手术当天,用未处理或吉西他滨-活化的MSC的条件培养基对小鼠进行外部处理或不对其进行处理。每天监测伤口大小,并用游标卡尺进行评估。在手术之前将小鼠随机分组。
基质胶塞测定
将含有未处理MSC或预暴露于吉西他滨、帕利他西或顺铂的MSC的沉淀条件培养基的基质胶(0.5ml)皮下注射至BALB/c雌性小鼠(8-10周龄)(n=5只小鼠/组)的每个胁腹。10天后移除胶塞,随后如前所述在单个细胞悬浮液后制备用于组织学评估或流式细胞仪分析(13)。用抗体混合物对细胞悬浮液进行免疫染色,以检测由其以下表面标志物定义的细胞类型:EC:CD31+/VEGFR2+/CD45-;MDSC:Gr-1+/CD11b+/CD45+;M1巨噬细胞:F4/80+、CD11b+、CD11c+、CD206-;M2巨噬细胞:F4/80+、CD11b+、CD11c+、CD206+;NK细胞NKp46+、CD45+;B细胞CD45R(B220)+、CD45+;和T细胞CD3ε+、CD45+。所有单克隆抗体均购自Biolegend,BDBiosciences,R&D系统,和Macs Militenyi Biotec,并根据制造商的说明使用。购买了与以下荧光染料缀合的单克隆抗体:Gr-1-异硫氰酸荧光素(FITC)、VEGFR2-红色藻胆素(PE)、CD11b-多甲藻素-叶绿素蛋白(PerCP)、CD31-FITC和CD45-APC-Cy7、F4/80-PE、CD11c-APC-Cy7、CD206-BV421、NKp46-APC、CD45R(B220)-BV605、CD3ε-太平洋蓝(CD3ε-Pacific blue)。必要时,在红细胞裂解后,通过CyAn ADP流式细胞仪和Summit v4.3软件(BeckmanCoulter)分析细胞悬浮液。进行每个样品至少100,000个细胞的获取。当在未处理的对照动物的EC、MDSC、巨噬细胞、B细胞或T细胞计数门控(T cell enumeration gates)中收集足够数量的事件(通常50–150)时,分析被认为是提供有效信息(informative)。确定染色细胞的百分比,并将其与适当的阴性对照进行比较。阳性染色被定义为大于非特异性背景染色,并使用7-氨基放线菌素D(7AAD)区分凋亡细胞和死细胞与活细胞。
评估MSC对细胞毒性T细胞活性的影响
根据制造商的说明,使用小鼠T细胞活化试剂盒(Miltenyi Biotec,Germany)评估细胞毒性T细胞活性。简而言之,在存在或不存在幼稚MSC或用不同化学治疗剂(吉西他滨10nM、帕利他西100nM、或顺铂10μM)预暴露的MSC的条件培养基的情况下,在存在或不存在抗小鼠CD3ε和CD28生物素化磁珠(106个磁珠/样品)的情况下,将来自幼稚BALB/c小鼠的脾细胞(107)在37℃下培养24小时。珠模拟抗原呈递细胞并活化静止的T细胞。随后,将细胞在室温下以470×g离心5min。将细胞沉淀重悬于PBS中,并通过流式细胞术定量总CD8+T细胞和活化的T细胞(CD8+/CD25+或CD8+/CD107a+)的水平。
刮擦伤口测定
使用培养在补充有10%FCS的DMEM的96孔平板透明板(Thermo FisherScientific,Waltham,MA)中的PANC1细胞进行体外刮擦测定。在测定细胞之前,将其在无血清DMEM中饥饿16小时。在进行刮擦之前,用未处理的MSC或暴露于帕利他西(100nM)、吉西他滨(10nM)、顺铂(10μM)的MSC的CM温育细胞。使用IncuCyte ZOOM HD/2CLR系统按×100物镜捕获细胞迁移的延时图像,并通过IncuCyte ZOOM 2016B软件(Essenbioscience,AnnArbor,MI)进行分析。
改良博伊登盒(博伊登室,Boyden chamber)测定
使用先前描述的方案,在纤连蛋白包被的博伊登盒中评估未处理MSC或暴露于帕利他西、吉西他滨、顺铂的MSC的CM对PANC1细胞培养物的迁移性质的影响(14、15)。简而言之,将血清饥饿的细胞(在0.2ml无血清DMEM培养基中的2×105个细胞)添加至用50μl纤连蛋白(10μg/ml)包被的盒的上隔室中。下隔室中填充有来自上述未处理或用不同化学治疗剂预处理的MSC的CM。24小时后,迁移至底部过滤器的细胞用结晶紫染色,并在倒置显微镜(Leica DMIL LED)下以每×100物镜进行计数。所有实验进行3次。
免疫染色
将肿瘤或基质胶包埋入O.C.T.(Sakura,Japan)中,然后在-80℃下冷冻。使用Leica CM 1950切片机(Leica,Germany)制备组织切片(10μm厚)。将切片在冷丙酮中固定15分钟。用抗人prominin-1(CD133,1:250,Macs MiltenyiBiotec)的PE-缀合抗体对CSC进行染色。为识别MSC,用抗内皮糖蛋白的FITC-缀合抗体(CD105)和抗CD44的APC-缀合抗体(1:200,BD Biosciences)对切片进行染色。使用Leica Application suite版本3.4.0软件或LSM 700Zeis共聚焦显微镜(Zeiss,Germany),通过附接至倒置显微镜(Leica CTR6000)的相机对肿瘤切片进行分析。用DAPI(Electron Microscopy Sciences,PA,USA)对细胞核进行染色。
细胞因子阵列
根据制造商的说明,将来自吉西他滨培养的MSC或对照MSC的CM应用于蛋白质组分析仪人XL细胞因子阵列(proteome profiler human XL cytokine array)(ARY022B,R&D系统,MN)。通过光密度测定分析定量阵列中相应于每个因子的信号。计算由吉西他滨培养的MSC与未处理的MSC分泌的各种因子的表达水平之间的比。
统计分析
数据表示为平均值±标准偏差(SD)。差异的统计学显著性通过单因素方差进行评估,然后使用GraphPad Prism 5软件(La Jolla,CA)进行Tukey临时统计检验(Tukey adhoc statistical test)。当仅比较两组时,在一些实验中使用Student t检验。将所有组之间的差异彼此之间进行比较,并认为p值在0.05以下时具有显著性。
结果
化学疗法活化的MSC富集干细胞
MSC由于其高的增殖潜力和分化为主要间充质组织的能力而是组织再生和细胞疗法的主要候选者之一。此外,已显示MSC通过在暴露于铂系细胞毒性剂之后分泌两种具体脂肪酸来促进实体瘤中对于化学治疗的全身耐药性。这些脂肪酸间接保护结肠和肺癌细胞免受化学疗法的细胞毒性作用。然而,MSC与组织驻留干细胞的相互作用尚不清楚,尤其是在化学疗法之后。为此,我们分析了皮下胰腺肿瘤,该胰腺肿瘤通过向8至10周龄SCID小鼠的胁腹注射5×106个PANC1细胞而生成。当肿瘤达到500mm3时,用500mg/kg吉西他滨处理小鼠,3天后取出小鼠并处死。在吉西他滨疗法之后,显示了针对MSC和CSC的肿瘤免疫染色。具体而言,当与未处理的对照相比时,MSC归巢至肿瘤并紧邻CSC(图1A)。另外,图1B显示化学疗法诱导MSC向胰腺肿瘤大量募集,这与MSC向受损组织部位的浸润相似,如先前所示。此外,为研究MSC是否有助于CSC再繁殖,我们应用了未处理的MSC或吉西他滨培养的MSC的CM,并如材料和方法中所述,通过流式细胞术使用表型表征评估CSC富集。我们显示当与未处理的MSC的作用相比,化学疗法活化MSC导致CSC显著富集。吉西他滨-活化的MSC的分泌组分析显示,相对于未处理的MSC,在化学疗法处理之后CXCL10分泌高度升高,如表1所示。我们显示CXCL10通过与CXCR3受体结合并连续诱导STAT3信号传导来促进CSC富集。用抗CXCL10抗体中和CXCL10,抵消了化学疗法活化的MSC对CSC的富集作用(图1C)。这些结果发表在1月的Cancer Research(6)中。总之,我们的结果表明在化学疗法活化之后,MSC有助于组织驻留CSC。
化学疗法活化的MSC促进免疫抑制并诱导血管发生
MSC以其归巢至受伤部位并促进组织再生的能力而被知晓。此外,MSC分泌整个环境的细胞因子和趋化因子,包括TGFβ、IL-6、PGE2、IDO、LIF,以调节各种调节组织结构的造血细胞类型的募集。为了在我们的实验条件下测试这些能力,进行基质胶塞测定。为此,将含有由未处理的MSC或吉西他滨培养的MSC产生的CM的基质胶塞植入8至10周龄Balb/c小鼠的胁腹。10天后,移除胶塞并制备为单个细胞悬浮液。通过流式细胞术对来自胶塞的细胞进行表型分析,以鉴定募集至胶塞的细胞。我们发现来自吉西他滨处理的MSC的CM诱导内皮细胞的募集,表明在吉西他滨疗法之后血管发生的潜力增加。另外,当与含有对照MSC的CM的胶塞相比时,在具有来自吉西他滨-活化的MSC的CM的基质胶塞中,大多数免疫种群体(包括巨噬细胞、NK细胞、T细胞和B细胞)的定殖显著减少(图2A-B)。为进一步阐明化学疗法暴露的MSC的免疫调节作用,通过对从幼稚Balb/c小鼠提取的脾细胞施用幼稚或化学疗法活化的MSC的CM来进行T细胞活化。结果,化学疗法活化的MSC显著减少CD8 T细胞的总量,并抑制细胞毒性T细胞的活化(图3)。总之,该结果提供了另外的支持:在肿瘤中,与受损组织相似,MSC获得强大的再生能力,其通过增加血管发生和诱导免疫抑制来,从而提高整体组织修复。
化学疗法活化的MSC增加有效组织修复
基于化学疗法活化的MSC的增强的促血管发生和免疫抑制性质,评估了MSC治愈伤口的能力。为此,如材料和方法中所述,通过进行改良博伊登盒测定测试MSC对其它细胞的迁移性质的影响。这样做,在孔的上盒中培养PANC1(2×106个细胞),而下盒中装载有化学疗法活化的MSC的CM或未处理的MSC的CM。24小时后,将迁移至盒下侧的细胞固定,随后用结晶紫进行染色。发现与对照组相比,吉西他滨-活化的MSC的CM显著增加PANC1细胞的迁移性质。有趣的是,由暴露于其它细胞毒性剂(如帕利他西和顺铂)的MSC产生的CM不影响细胞的迁移能力(图4A)。另外,进行刮擦伤口测定,以进一步证明化学疗法活化的MSC的再生潜力。用吉西他滨培养的MSC的CM处理的细胞比未处理的对照细胞或暴露于未处理的MSC的CM的细胞更快地封闭间隙(图4B-C)。与迁移测定结果并行,用暴露于PTX或顺铂的MSC的CM处理的细胞的伤口闭合时间与对照组相似。
接下来,在体内测试化学疗法活化的MSC的伤口愈合性质。为此目的,在BALB/c小鼠的背部进行0.5cm切口。24小时后,用未处理的MSC或预暴露于10nM吉西他滨的MSC的条件培养基对小鼠进行外部处理。对照小鼠不进行处理。监测伤口愈合,直至伤口完全闭合。结果显示,与对照组相比,用吉西他滨-活化的MSC处理的小鼠伤口愈合最快(图4D)。综上,我们的结果表明,化学疗法培养的MSC极大地诱导MSC再生和伤口愈合特性,因此有助于损伤修复。
实施例2
化学疗法活化的MSC用于治疗肺纤维化
支气管肺泡灌洗
所有动物研究和动物实验方案均被Technion的动物护理和使用委员会批准。通过气管内(IT)给予单个剂量的博莱霉素来建立小鼠肺纤维化模型,如Van Hoecke,L.,etal.,Bronchoalveolar Lavage of Murine Lungs to Analyze Inflammatory CellInfiltration.J Vis Exp,2017(123)和Cox,T.R.,et al.,LOX-mediated collagencrosslinking is responsible for fibrosis-enhanced metastasis.Cancer Res,2013.73(6):p.1721-32中所示。
简而言之,将0.04单位的博莱霉素气管内(IT)给予10周龄雌性BALB/c小鼠,或用媒介物对照处理。1周后,不对小鼠进行处理,或者IT给予对照MSC或化学疗法活化的MSC的条件培养基。每隔1天进行这种处理(70μl的活化的MSC的条件培养基,如上文方法部分中所述),持续1周时间。在给予博莱霉素后14天,通过用补充有100uM乙二胺四乙酸(EDTA,均来自Biological industries ltd,Israel)的Hank’s平衡盐溶液(HBSS)洗涤肺来进行支气管肺泡灌洗(BAL),并使用流式细胞术分析肺部炎性细胞浸润。然后,收获肺、固定并处理以用于组织学。
使用流式细胞术评估支气管肺泡灌洗(BAL)中的炎性细胞类型
为评估BAL程序后的各种免疫细胞类型,从博莱霉素处理的小鼠或对照小鼠的支气管肺泡灌洗液提取细胞。然后对细胞进行免疫染色,并分析以定义各种先天性和适应性免疫细胞群体,包括T细胞(CD4+和CD8+)、B细胞(B220)、巨噬细胞(CD11b+F4/80+、CD11c±、CD206±)、NK细胞(NKp46)和骨髓衍生的抑制细胞(MDSC、CD11b+、Ly6G±、Ly6C±)。所有单克隆抗体均购自BioLegend(San Diego,CA,USA),并根据制造商的说明使用。使用LSRFortessa流量分析系统(LSR Fortessa flow analyzing system)(BD Biosciences,SanJose,CA,USA)进行样品采集,然后使用FlowJo X软件(FlowJo,LLC,Ashland,OR,USA)进行分析。
组织学
在终点收获来自对照或处理小鼠的肺,随后用PFA固定。对石蜡包埋的肺组织进行切片,并用苏木精和伊红(H&E)溶液染色。为评估代表纤维化的胶原蛋白含量,用SiriusRed溶液(以红色标记)对肺切片进行染色。
结果
当功能性组织被粗糙的结缔组织大量替代而导致生理功能受损时,组织损伤通常导致疤痕组织和纤维化的发展。具体而言,肺纤维化(PF)是间质性肺部疾病,其病因在大多数情况下是未知的。肺损伤、炎性过程、肺部疾病、暴露于辐射和化学物质可能诱发PF,并且其死亡率上升。在实验动物情况下,博莱霉素是用于诱导肺纤维化模型的广泛使用的试剂。因此,实施了博莱霉素诱导的纤维化模型以评估提出的基于干细胞的疗法预防和治愈纤维化的功效。具体而言,对BAL样品中细胞数量的评估表明,如上文方法部分中所述,当与对照组相比时,在博莱霉素处理的肺中给予化学疗法活化的MSC的条件培养基(CM)增强细胞募集并归巢至肺中(图5)。具体而言,与所以其它组相比,用化学疗法活化的MSC的CM处理的肺纤维化诱导的小鼠导致CD45阳性细胞增加。这些细胞由增加百分比的抗炎性巨噬细胞和骨髓衍生的抑制细胞(其两者代表组织再生和生长)以及降低百分比的促炎性巨噬细胞、T细胞、B细胞和NK细胞(其全部代表抑制组织再生的组织炎症)组成(图6)。
用化学疗法活化的MSC的CM处理的博莱霉素处理的小鼠或对照小鼠的组织学分析支持BAL样品的流式细胞术数据。具体而言,来自博莱霉素处理的小鼠或经博莱霉素和非活化对照MSC的CM处理的小鼠的肺中观察到广泛的炎症(由白色箭头表示)。相反,用化学疗法活化的MSC处理的肺表现最低的炎症水平,与未处理的对照组的肺相似(图7A)。此外,来自对照博莱霉素处理的小鼠或用非活化的MSC的CM处理的小鼠的肺的Sirius red染色显示胶原蛋白沉积增加(用白色箭头表示),表明当与对照未处理的肺或来自用化学疗法活化的MSC处理的小鼠的纤维化肺相比时,支气管周增厚(图7B)。
总体而言,这些结果表明,在用化学疗法活化的MSC的CM处理的小鼠中,肺中的炎性过程被抑制,因此,组织纤维化也被抑制,因此,肺组织纤维化的量减少。
实施例3
化学疗法活化的MSC用于治疗肝纤维化
肝细胞癌、硬变和其它肝脏病理仍是死亡的主要原因之一。在大多数情况下,酗酒、非健康饮食、病毒感染和复发性炎症导致疤痕组织扩散和广泛肝纤维化的发展,从而加剧并促进肝衰竭。发生这种情况的原因是功能性肝组织被纤维化尖峰(fibrotic spikes)取代,该纤维化尖峰破坏有效的血液供应,诱发胆道狭窄并导致肝功能受损。然而,尚未开发出有效的药物来治疗和逆转与肝纤维化有关的损伤。因此,需要有效的治疗策略来保持肝组织结构和功能并防止纤维化组织形成。
当前实例中描述的方法通过诱导肝组织再生和预防包括肝纤维化的肝病(其可以进一步发展为肝硬变和肝癌)提出了基于活化细胞的疗法的另外的应用。
方法
生成化学疗法活化的MSC或MSC衍生的条件培养基或活化的MSC衍生的外泌体
从骨髓抽吸物中分离小鼠MSC,并培养在补充有10%FBS、1%L-谷氨酰胺、1%丙酮酸钠和1%链霉素的极限必需培养基α(αMEM)的培养皿中。基于MSC对塑性培养皿的粘附能力进行MSC的纯化。每3天更换一次培养基,直至造血细胞被冲洗掉,留下粘附的MSC均质培养物。将获得的小鼠MSC扩增并传代,同时上至10代的细胞用于实验。
为生成化学疗法培养的MSC,将培养的MSC暴露于吉西他滨(0-10nM)、或媒介物对照24小时。为生成MSC衍生的CM,将化学疗法培养的MSC(如上所述)以1×105个细胞/ml的浓度重新接种在无血清培养基中。72小时后,收集CM。
为了从活化的MSC中提取外泌体级分,将化学疗法活化的MSC的CM在4℃下以20,000g离心1小时,以分离微粒和凋亡小体。因此,将获得的上清液在4℃下以110,000g超速离心2小时。将沉淀重悬于PBS中,等分并储存于-80℃。
诱导小鼠肝纤维化模型
所有动物研究和动物实验方案均已获得Technion的动物保护和使用委员会批准。通过连续3天腹膜内(IP)给予连续注射二甲基亚硝胺(DNM)持续4周来建立小鼠肝纤维化模型,如先前在Chooi,K.F.,et al.,The Dimethylnitrosamine or N-Nitrosodimetilamine(DNM or NDMA)Induced Liver Fibrosis Model in the Rat.J Vis Exp,2016(112)以及Cox,T.R.,et al.,LOX-mediated collagen crosslinking is responsible forfibrosis-enhanced metastasis.Cancer Res,2013.73(6):p.1721-32中所述。简而言之,将8至10周龄雌性C57/Bl小鼠IP给予DNM(5mg/kg;Sigma Aldrich,Israel)或用媒介物对照处理。在处理开始后2周,不对小鼠进行处理或将小鼠注射对照MSC或化学疗法活化的-MSC的条件培养基或由化学疗法活化的MSC生成的外泌体。每隔1天给予疗法,持续2周。当处死小鼠时,取出肝并处理,以进行组织学分析和评估纤维化等级。同时,对单个肝叶进行单细胞悬浮液处理,并通过流式细胞术分析炎性细胞和成纤维细胞的亚群。处理另外的肝叶以评估可溶性胶原蛋白含量。
基于肝生理学评估肝纤维化
为测试DNM诱导的肝纤维化小鼠的肝的生理功能,不对小鼠进行处理或腹膜内(IP,每隔1天,持续2周时间)注射化学疗法活化的MSC或对照MSC的条件培养基或化学疗法活化的MSC衍生的外泌体。在终点处从处理和对照小鼠抽取血液,并评估肝功能参数,如总蛋白、白蛋白、胆红素和特异的肝酶,包括碱性磷酸酶(ALP)、丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)的水平。
使用流式细胞术评估定殖肝的细胞类型
为了评估浸润肝的各种细胞类型,从DNM处理的小鼠或对照小鼠的肝提取细胞。然后对细胞进行免疫染色并进行分析,以定义肝成纤维细胞(CD90+)以及各种先天性和适应性免疫细胞群体,包括T细胞(CD4+和CD8+)、B细胞(B220+)、巨噬细胞(CD11b+F4/80+、CD11c±、CD206±)、NK细胞(NKp46+)、和骨髓衍生的抑制细胞(MDSC;CD11b+、Ly6G±、Ly6C±)。所有单克隆抗体均购自BioLegend(San Diego,CA,USA),并根据制造商的说明使用。使用LSRFortessa流量分析系统(BD Biosciences,San Jose,CA,USA)进行样品采集,然后使用FlowJo X软件(FlowJo,LLC,Ashland,OR,USA)进行分析。
组织学
为评估基于活化细胞的疗法对肝纤维化进展、其组织组成和结构的影响,从对照和处理小鼠收获肝,并用4%多聚甲醛(PFA)溶液固定。对石蜡包埋的肝组织切片,并用苏木精和伊红(H&E)染色。为评估肝中胶原蛋白聚集的表达并评估DNM处理或未处理小鼠的纤维化程度,使用SircolTM可溶性胶原蛋白测定(Biocolor,UK)评估可溶性胶原蛋白水平的量。另外,用Sirius Red对肝切片进行染色并分析胶原蛋白沉积。
结果
研究响应于化学疗法活化的MSC的肝功能
当功能性组织被粗糙的结缔组织大量替代而导致生理功能受损时,组织损伤通常导致疤痕组织和纤维化的发展。具体而言,肝纤维化是肝病理的关键阶段,其在大多数情况下发展为肝硬变和癌症。尽管若干因素可促进肝的纤维化,如病毒感染(HCV)、饮食、饮酒量增加和遗传畸变,但肝中纤维化组织发展的确切病因尚不清楚。在实验动物情况下,DNM(也称为NDMA)以及其它化学物质是用于诱导肝纤维化模型的广泛使用的试剂。因此,我们实施了DNM诱导的纤维化模型以评估我们所提出的基于活化细胞的疗法用于预防和治愈肝纤维化的功效。具体而言,通过连续每周注射DNM,诱导8至10周龄BALB/c小鼠患有肝纤维化。2周后,用对照MSC或化学疗法活化的MSC的条件培养基或化学疗法活化的MSC生成的外泌体对小鼠进行IP处理(每隔1天,持续2周时间)。作为对照,用PBS注射小鼠。值得注意的是,DNM注射或用MSC的CM或其外泌体的疗法均不导致严重的毒性,如通过动物体重测量的。所有实验亚组的体重保持正常,与未处理小鼠的体重相似(图8)。在终点,针对DNM处理的小鼠对照或注射化学疗法活化的MSC的CM的小鼠的肝的生理功能分析血液。如所期望的,在DNM处理的小鼠中肝功能受损,如白蛋白水平降低以及ALT和AST酶的水平升高所证明。然而,用吉西他滨-活化的MSC的条件培养基或其外泌体级分处理的小鼠显示肝功能显著改善。即,用化学疗法活化的MSC的CM处理的小鼠表现出增加的白蛋白水平和降低的肝酶水平,这与对照未处理的幼稚小鼠的参数相似(图9A-C)。此外,DNM诱导的肝纤维化降低肝驻留的枯否(Kupffer)细胞的水平,并促进成纤维细胞和免疫细胞(包括T细胞、B细胞、NK细胞、髓样细胞和巨噬细胞)向肝的流入增加。总而言之,这些细胞的水平升高表示肝部炎症增加,这减弱组织再生并促进纤维化。然而,用活化的MSC的CM或其外泌体级分处理降低肝中炎性细胞的百分比,并增加免疫抑制性骨髓衍生的抑制细胞,从而促进组织再生(图10A-D)。
为评估用化学疗法活化的MSC的CM处理的小鼠或对照小鼠的肝中的纤维化等级和胶原蛋白沉积,我们评估了处理的肝中的可溶性胶原蛋白水平。当与用DNM处理的对照组相比时,用活化的MSC的CM处理导致可溶性胶原蛋白显著降低(图11A)。肝的组织学分析支持处理的肝的上述数据。具体而言,H&E和Sirius红染色证明中央管(central canals)周围以及DNM处理的肝的入口区域的广泛纤维化(由白色箭头表示)。相反,用吉西他滨-活化的MSC的条件培养基处理的小鼠的肝组织学类似于未处理的健康(幼稚)对照小鼠的肝的组织学,表明纤维化组织完全再生。如所期望的,以我们的外泌体疗法处理导致类似的肝纤维化减少,而对照MSC的CM未显示DNM处理小鼠的肝纤维化的任何显著改善(图11B-D)。
总体而言,这些结果表明,在用吉西他滨-活化的MSC的CM处理的小鼠中,肝部炎症被抑制,这改善了组织再生并因此预防和减少肝纤维化,并恢复健康的肝功能。
尽管已结合本发明的具体实施方式描述了本发明,但是显然,对于本领域技术人员而言,多种替代、修改和变化将是显而易见的。因此,旨在涵盖落入所附权利要求书的精神和广泛范围内的所有这种替代、修改和改变。
本说明中提及的所有出版物、专利和专利申请在本文中以其整体通过引用并入说明书中,其程度与通过引用具体地和单独地指示将每个出版物、专利或专利申请并入本文相同。另外,在本申请中对任何参考文献的引用或标识不应被解释为承认该参考文献可用作本发明的现有技术。就使用本部分标题而言,其不应被解释为必然地限制。
- 通过活化细胞修复组织
- 口腔软组织细胞修复促进剂、口腔护理组合物及应用
