用于检测耳道假丝酵母菌的组合物和方法
文献发布时间:2023-06-19 11:55:48
技术领域
本公开涉及分子诊断领域,并且更具体地涉及耳道假丝酵母菌的检测。
背景技术
耳道假丝酵母菌(Candida auris,C.auris,CA)是一种新兴的真菌,对全球健康构成严重威胁。尽管耳道假丝酵母菌最早是在2009年于日本鉴定的,但关于假丝酵母菌株收集物的回顾性调查发现已知最早的耳道假丝酵母菌株追溯到1996年于韩国出现。尽管耳道假丝酵母菌到2009年才被认可,但它快速出现并且已经在包括美国在内的超过20个国家中有所报告。几个国家的医疗机构已经报告,耳道假丝酵母菌已经在住院患者中引起严重疾病。在一些患者中,这种酵母菌可以进入血流并扩散到全身,引起严重的侵袭性感染。
耳道假丝酵母菌引起人们的关注主要有以下几个原因:1)它通常具有多重耐药性,这意味着它对于通常用于治疗假丝酵母菌感染的多种抗真菌药物具有耐药性;2)它难以用标准的实验室方法鉴定,并且在没有特定技术的实验室中可能会被错误地鉴定。错误鉴定可能会导致管理不当,以及3)它已经在医疗机构中引起疫情。出于这一原因,重要的是要在住院患者中快速鉴定耳道假丝酵母菌,以便医疗机构能够采取特殊的预防措施来阻止其传播。
大约54%的耳道假丝酵母菌病例是从血液中鉴定的;其余46%的病例是在其他身体部位鉴定的,包括但不限于尿液、伤口、痰液和胆汁。一些临床实验室通常无法确定来自非无菌部位的分离株的菌种,因为在这些部位上假丝酵母菌的存在可能代表了定植而非感染,并且不需要处理。然而,即使从非无菌的身体部位鉴定出耳道假丝酵母菌也很重要,因为在任何身体部位存在耳道假丝酵母菌都可以代表更广泛的定植,存在传播风险,并且需要采取控制感染的预防措施。
像其他假丝酵母菌感染一样,耳道假丝酵母菌感染通常通过血液或其他体液的培养物来诊断。然而,与其他更常见类型的假丝酵母菌相比,很难从培养物中鉴定出耳道假丝酵母菌。例如,它可以与其他类型的酵母菌,尤其是希木龙假丝酵母菌(Candidahaemulonii)混淆。需要特殊的实验室测试以鉴定耳道假丝酵母菌。
有限的数据提示,耳道假丝酵母菌感染的危险因素通常与其他类型假丝酵母菌感染的危险因素相似。这些危险因素包括近期进行的手术、糖尿病、广谱抗生素和抗真菌药的使用。
长期在医疗机构住院的患者、具有进入体内的管线(诸如呼吸管、饲管和中心静脉导管)的患者或以前曾接受过抗生素或抗真菌药物的患者看来具有最高的感染耳道假丝酵母菌的风险。从早产儿到老年人,所有年龄段的患者中都发现了感染。需要进一步的研究,以了解更多有关耳道假丝酵母菌感染的风险因素的信息。
培养物中耳道假丝酵母菌菌落的外观和颜色可能有助于菌种鉴定,但不能用作耳道假丝酵母菌的唯一鉴定方法,因为如果不使用其他方法,就不能将耳道假丝酵母菌与其他更常见的假丝酵母菌种区分开。基于基质辅助激光解吸/电离飞行时间(MALDI-TOF)的诊断设备可以将耳道假丝酵母菌与其他假丝酵母菌种区分开来,但并非MALDI-TOF设备中包含的所有参考数据库都可以用于检测。因此,在本领域中需要一种更好且完整的方法来特异性地检测耳道假丝酵母菌。
发明内容
本公开中的某些实施例涉及用于快速检测生物学或非生物学样品中存在或不存在耳道假丝酵母菌(CA)的方法,例如,通过实时聚合酶链式反应在单个试管中进行CA多重检测的方法。实施例包括检测CA的方法,其包括执行至少一个循环步骤,该循环步骤可以包括扩增步骤和杂交步骤。此外,实施例包括设计用于在单管中检测CA的引物、探针和试剂盒。该检测方法设计为靶向耳道假丝酵母菌基因组中的特定基因,所述特定基因有可能区别于与其最相似的希木龙假丝酵母菌和酿酒酵母。
提供了一种用于检测样品中的耳道假丝酵母菌(CA)的方法,该方法包括执行扩增步骤,包括使样品与一组设计为靶向特异性CA基因的寡核苷酸引物接触,如果样品中存在CA,则产生扩增产物;执行杂交步骤,包括使扩增产物与一种或多种可检测的针对靶标CA基因的寡核苷酸探针接触;和检测存在或不存在扩增产物,其中存在扩增产物指示样品中存在CA,并且其中不存在扩增产物指示样品中不存在CA;其中靶标CA基因为5.8s/ITS2rRNA基因。
在一方面,提供了检测样品中耳道假丝酵母菌(CA)的方法,该方法包括执行扩增步骤,其包括使样品与一组CA 5.8s/ITS2 rRNA基因引物接触,如果样品中存在CA核酸,则产生扩增产物;执行杂交步骤,其包括使扩增产物与一种或多种可检测的5.8s/ITS2 rRNA基因探针接触;和检测存在或不存在扩增产物,其中存在扩增产物指示样品中存在CA,并且其中不存在扩增产物指示样品中不存在CA;其中该组CA 5.8s/ITS2 rRNA基因引物包含:第一寡核苷酸引物,其包含选自由SEQ ID NO:1至SEQ ID NO:3组成的组的第一核酸序列,或其补体,以及第二寡核苷酸引物,其包含选自由SEQ ID NO:5至SEQ ID NO:6及SEQ ID NO:8组成的组的第二核酸序列,或其补体;并且其中一种或多种可检测的CA 5.8s/ITS2 rRNA基因寡核苷酸探针包含选自由SEQ ID NO:9至SEQ ID NO:11组成的组的第三核酸序列,或其补体。
在一些实施例中,杂交步骤包括使扩增产物与可检测的CA 5.8s/ITS2rRNA基因探针接触,所述探针用供体荧光部分和相应的受体部分标记;并且检测步骤包括检测存在或不存在探针的供体荧光部分与受体部分之间的荧光共振能量转移(FRET),其中存在或不存在荧光指示样品中存在或不存在CA。在一些实施例中,重复扩增和杂交步骤。在此,重复次数取决于例如样品的性质。如果样品是核酸的复杂混合物,则将需要更多扩增和杂交步骤以扩增足以检测的靶标序列。在一些实施例中,扩增和杂交步骤重复至少约20次,但可以重复多达25、30、40、50、60或甚至100次。此外,可以在每个扩增和杂交步骤期间或之后,在每个其他扩增和杂交步骤期间或之后,在特定扩增和杂交步骤期间或之后,或在特定扩增和杂交步骤期间或之后,检测扩增产物的存在或不存在,其中,如果存在的话,期望有足够的扩增产物用于检测。在一些实施例中,扩增步骤采用具有5′至3′核酸酶活性的聚合酶。在一些实施例中,供体荧光部分和相应的受体部分在探针上处于彼此不超过8个至20个核苷酸的范围内。在一些实施例中,受体部分是猝灭剂。在一些实施例中,寡核苷酸包含选自以下项的核苷酸序列或由其组成:SEQ ID NO:1至SEQ ID NO:3、SEQ ID NO:5至SEQ ID NO:6、SEQ ID NO:8、SEQ ID NO:9至SEQ ID NO:11,或其补体,具有100个或更少的核苷酸、50个或更少的核苷酸、40个或更少的核苷酸或30个或更少的核苷酸。在一些实施例中,第一CA5.8s/ITS2 rRNA基因引物、第二CA 5.8s/ITS2 rRNA基因引物和可检测的CA 5.8s/ITS2rRNA探针具有40个或更少的核苷酸(例如,35个或更少的核苷酸、30个或更少的核苷酸等)。在一些实施例中,第一寡核苷酸引物包含SEQ ID NO:2的核酸序列或由其组成,第二寡核苷酸引物包含SEQ ID NO:5的核酸序列或由其组成,并且寡核苷酸探针包含SEQ ID NO:10的核酸序列或由其组成。在某些实施例中,第一寡核苷酸、第二寡核苷酸和第三寡核苷酸中的任一个具有40个或更少的核苷酸。在一些实施例中,第一寡核苷酸、第二寡核苷酸和第三寡核苷酸中的至少一者包含至少一个经修饰核苷酸。
在另一个实施例中,本公开提供了寡核苷酸,其包括与SEQ ID NO:1至SEQ ID NO:3、SEQ ID NO:5至SEQ ID NO:6、SEQ ID NO:8、SEQ IDNO:9至SEQ ID NO:11中的一者具有至少70%的序列同一性(例如,至少75%、80%、85%、90%或95%等)的核酸,或其补体,该寡核苷酸具有100个或更少的核苷酸。通常,在这些实施例中,这些寡核苷酸可以是引物核酸、探针核酸等。在一些实施例中,寡核苷酸包含至少一个经修饰核苷酸,例如,以相对于未修饰核苷酸改变核酸杂交稳定性。任选地,寡核苷酸包含至少一种标记和/或至少一种猝灭剂部分。在一些实施例中,寡核苷酸包括至少一个经保守修饰的变体。特定核酸序列的“经保守修饰的变异”或简称为“保守变体”是指编码相同或基本相同的氨基酸序列,或在核酸不编码氨基酸序列的情况下基本相同的序列。本领域人员将会认识到,在改变造成氨基酸缺失、氨基酸添加或氨基酸替换为化学上相似氨基酸的情况下,使得被编码序列中的单个氨基酸或低百分比的氨基酸(通常低于5%,更通常低于4%、2%或1%)改变、添加或缺失的个体取代、缺失或添加是“经保守修饰的变体”。在一些实施例中,第一靶标CA基因引物、第二靶标CA基因引物和可检测的靶标CA基因探针中的至少一者包含至少一个经修饰核苷酸。
在一些实施例中,扩增(扩增步骤)可以采用具有5′至3′核酸酶活性的聚合酶。因此,沿着探针的长度,供体荧光部分和受体部分(例如,猝灭剂)可以处于彼此不超过5个至20个核苷酸(例如,8个或10个)的范围内。在另一方面,可检测的探针包括允许二级结构形成的核酸序列。这种二级结构的形成通常导致第一荧光部分和第二荧光部分之间的空间接近。根据该方法,探针上的第二荧光部分可以是猝灭剂。
本公开提供了检测来自个体的生物学样品中存在或不存在CA的方法。此类方法通常包括执行至少一个循环步骤,该循环步骤包括扩增步骤和染料结合步骤。通常,扩增步骤包括使样品与设计为靶向特定CA基因的多对引物接触,如果样品中存在靶标CA基因核酸分子,则产生一种或多种靶标CA基因扩增产物,并且染料结合步骤包括使靶标CA基因扩增产物与双链DNA结合染料接触。在一个实施例中,靶标CA基因是CA 5.8s/ITS2 rRNA基因。此类方法还包括检测存在或不存在双链DNA结合染料与扩增产物的结合,其中存在结合指示样品中存在CA,而不存在结合指示样品中不存在CA。代表性的双链DNA结合染料是溴化乙锭。另外,此类方法还可包括确定靶标CA基因扩增产物与双链DNA结合染料之间的解链温度,其中解链温度确认存在或不存在CA。
在又一方面,提供了一种用于检测CA 5.8s/ITS2 rRNA基因的试剂盒。该试剂盒可包括一组或多组对于CA 5.8s/ITS2 rRNA基因的扩增为特异性的引物和一种或多种对于CA5.8s/ITS2 rRNA基因扩增产物的检测为特异性的可检测的探针。
特别地,上文公开的结合根据本发明的方法的寡核苷酸引物和探针适合被包括在根据本发明的试剂盒中。再次,提供了一种用于检测耳道假丝酵母菌(CA)的5.8s/ITS2rRNA基因的试剂盒,该试剂盒包含:第一寡核苷酸引物,其包含选自由SEQ ID NO:1至SEQID NO:3所组成的组的第一核酸序列,或其补体;第二寡核苷酸引物,其包含选自由SEQ IDNO:5至SEQ ID NO:6和SEQ ID NO:8所组成的组的第二核酸序列,或其补体;以及经荧光可检测地标记的寡核苷酸探针,其包含选自由SEQ ID NO:9至SEQ ID NO:11所组成的组的第三核酸序列,或其补体,所述经可检测地标记的探针构造成与通过第一寡核苷酸引物和第二寡核苷酸引物生成的扩增子杂交。在一方面,该试剂盒可以包括已经用供体部分和相应的受体部分(例如,另一荧光部分或黑暗猝灭剂)标记的探针,或者可以包括用于标记探针的荧光部分。该试剂盒还可以包含三磷酸核苷、核酸聚合酶和该核酸聚合酶发挥功能所必需的缓冲剂中的至少一者。该试剂盒还可以包括包装插页以及使用引物、探针和荧光基团检测样品中存在或不存在CA的使用说明书。在一些实施例中,第三经可检测地标记的寡核苷酸探针包含供体荧光部分和相应的受体部分。在一些实施例中,受体部分是猝灭剂。在一些实施例中,第一寡核苷酸引物包含SEQ ID NO:2的核酸序列或由其组成,第二寡核苷酸引物包含SEQ ID NO:5的核酸序列或由其组成,并且寡核苷酸探针包含SEQ ID NO:10的核酸序列或由其组成。在某些实施例中,第一寡核苷酸、第二寡核苷酸和第三寡核苷酸中的任一个具有40个或更少的核苷酸。在一些实施例中,第一寡核苷酸、第二寡核苷酸和第三寡核苷酸中的至少一者包含至少一个经修饰核苷酸。在一些实施例中,第一寡核苷酸、第二寡核苷酸和第三寡核苷酸具有40个或更少的核苷酸。
在另一方面,提供了包含如上所公开的用于扩增靶标CA基因的一组寡核苷酸引物的组合物。在一些实施例中,该组CA 5.8s/ITS2 rRNA基因引物包含:第一引物,其包含选自由SEQ ID NO:1至SEQ ID NO:3所组成的组的第一寡核苷酸序列或其补体或由其组成;和第二引物,其包含选自由SEQ ID NO:5至SEQ ID NO:6和SEQ ID NO:8所组成的组的第二寡核苷酸序列或其补体或由其组成。在某些实施例中,该组合物进一步包含一种或多种可检测的CA 5.8s/ITS2 rRNA基因探针,所述探针包含选自由SEQ ID NO:9至SEQ ID NO:11所组成的组的第三寡核苷酸序列或其补体或由其组成。
除非另外定义,否则本文中使用的所有技术和科学术语所具有的含义与本发明所属领域普通技术人员通常理解的含义相同。尽管在本主题的实践或测试中,可使用与本文所述的那些方法和材料类似或等同的方法和材料,但下文描述了合适的方法和材料。此外,材料、方法和实例仅是说明性的,而不旨在限制。本文提及的所有出版物、专利申请、专利和其他参考文献通过引用以其全文合并于本文。如有冲突,以本说明书(包括定义)为准。
本发明的一个或多个实施例的细节在附图和下面的说明书中阐述。根据附图和具体实施方式以及权利要求,本发明的其他特征、目的和优点将是显而易见的。
附图说明
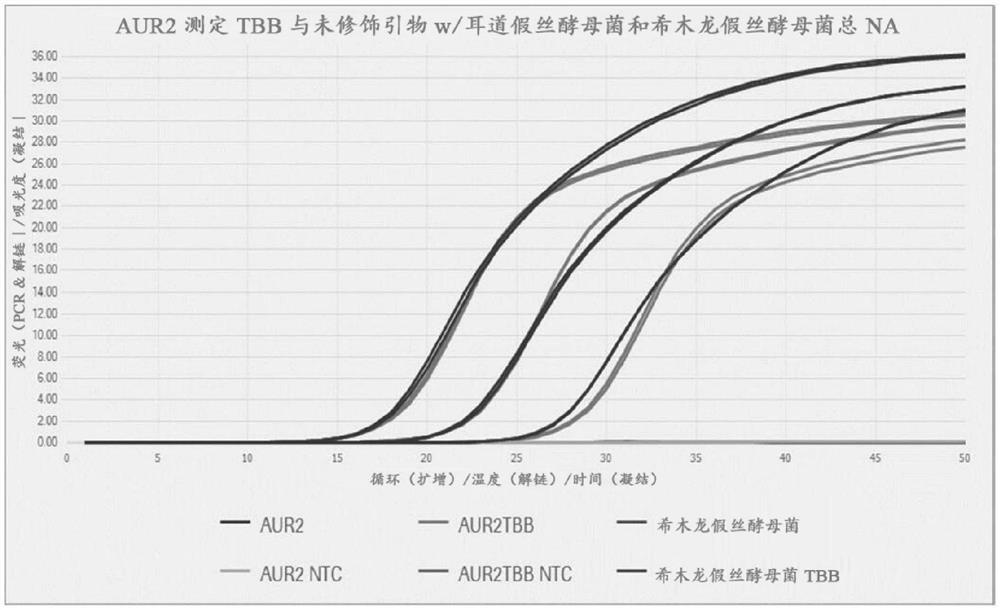
图1显示,在AUR2测定(参见表V)中,从CA 5.8s/ITS2 rRNA引物(SEQ ID NO:2和SEQ ID NO:5)和探针(SEQ ID NO:10)生成的实时PCR实验的PCR生长曲线,该实验在存在浓度为100,000、10,000和1,000基因组等效物浓度每PCR反应(ge/PCR)的基因组耳道假丝酵母菌DNA模板的情况下以及在存在100,000ge/PCR的基因组希木龙假丝酵母菌模板或无模板DNA(NTC)的情况下进行。TBB是指在3′末端用叔丁基-苄基部分修饰的引物。
具体实施方式
通过核酸扩增诊断CA感染提供了一种快速而准确地检测真菌感染的方法。本文描述了用于检测样品中的CA的实时测定法。提供了用于检测CA的引物和探针,以及包含此类引物和探针的制品或试剂盒。与其他方法相比,用于CA检测的实时PCR的灵敏度提高,并且实时PCR的改进特征(包括样品容纳量和扩增产物的实时检测)使该技术可用于在临床实验室进行CA感染的常规诊断。
本公开包括寡核苷酸引物和荧光标记的水解探针,所述探针与CA基因组的特定基因座杂交,以便使用
所公开的方法可以包括执行至少一个循环步骤,所述循环步骤包括使用一对或多对引物来扩增来自样品的核酸分子基因靶标的一个或多个部分。如本文所用,“引物”是指寡核苷酸引物,其在合适的条件下特异性退火到CA中的靶标基因并由此开始DNA合成,产生各自的扩增产物。每个讨论的引物均退火到各自的靶标核酸分子内的靶标或与靶标核酸分子相邻的靶标,使得每个扩增产物的至少一部分含有对应于靶标的核酸序列。在样品中存在一种或多种靶标CA基因核酸的前提下,产生了一种或多种扩增产物,因此存在一种或多种靶标CA基因扩增产物指示样品中存在CA。扩增产物应包含与靶标CA基因的一种或多种可检测的探针互补的核酸序列。如本文所用,“探针”是指特异性退火到编码靶标CA基因的核酸序列的寡核苷酸探针。每个循环步骤包括扩增步骤、杂交步骤和检测步骤,其中,使样品与一种或多种可检测的探针接触以检测样品中存在或不存在CA。
如本文所用,术语“扩增”是指合成与模板核酸分子的一条链或两条链互补的核酸分子的过程。扩增核酸分子通常包括使模板核酸变性,在低于引物解链温度的温度下将引物退火到模板核酸,以及自引物进行酶促延长以产生扩增产物。扩增通常需要存在三磷酸脱氧核糖核苷、DNA聚合酶(例如,
如本文所用,术语“引物”是本领域技术人员已知的,是指寡聚化合物,主要指寡核苷酸,但也指经修饰的寡核苷酸,该经修饰的寡核苷酸能够通过模板依赖性DNA聚合酶“引发”DNA合成,即,例如,寡核苷酸的3′末端提供了游离的3′-OH基团,其他“核苷酸”可以通过模板依赖性DNA聚合酶附接至该基团,从而建立3′至5′磷酸二酯键,以及,由此而使用三磷酸脱氧核苷并且由此而释放焦磷酸酯。因此,可能除了预期功能外,“引物”、“寡核苷酸”或“探针”之间没有根本区别。
术语“杂交”是指一种或多种探针退火到扩增产物。杂交条件通常包括低于探针解链温度但避免探针的非特异性杂交的温度。
术语“5′至3′核酸酶活性”是指通常与核酸链合成相关的核酸聚合酶的活性,由此从核酸链的5′末端去除核苷酸。
术语“热稳定的聚合酶”是指处于热稳定的聚合酶,即,该酶催化与模板互补的引物延伸产物的形成,并且在双链模板核酸有效变性所需的时间内经受升高的温度时不会不可逆地变性。通常,合成在每个引物的3′末端处起始,并且沿着模板链以5′至3′方向前进。已经从黄栖热菌(Thermus flavus)、红栖热菌(T.ruber)、嗜热栖热菌(T.thermophilus)、水生栖热菌(T.aquaticus)、乳色栖热菌(T.lacteus)、红色栖热菌(T.rubens)、嗜热脂肪芽孢杆菌(Bacillus stearothermophilus)和甲烷嗜热菌(Methanothermus fervidus)中分离出热稳定的聚合酶。然而,非热稳定的聚合酶也可用于PCR测定中,条件是补充该酶。
术语“其补体”是指与给定核酸长度相同且精确互补的核酸。
当针对核酸而使用时,术语“延伸”或“延长”是指何时将额外的核苷酸(或其他类似分子)并入核酸中。例如,核酸可任选地通过核苷酸并入生物催化剂(例如通常在核酸3′末端添加核苷酸的聚合酶)进行延伸。
术语“相同”或“百分比同一性”是指在两个或更多核酸序列或子序列的背景下,当对最大对应性比较和对准(例如,使用本领域技术人员可获得的序列比较算法或通过目测来测量)时,两个或更多序列是相同的或具有特定百分比的相同核苷酸。适用于确定序列同一性和序列相似性的示例性算法是BLAST程序,它们在以下中有所描述:例如,Altschul等人(1990)“本地序列基本搜索工具”(Basic local alignment search tool)《分子生物学杂志》(J.Mol.Biol)215:403-410、Gish等人(1993)“通过数据库相似性搜索鉴定蛋白质编码区”(Identification of protein coding regions by database similarity search)《自然遗传学》(Nature Genet)3:266-272、Madden等人(1996)“网络BLAST服务器的应用”(Applications of network BLAST server)《酶学方法》(Meth.Enzymol.)266:131-141、Altschul等人(1997)“Gapped BLAST和PSI-BLAST:新一代的蛋白质数据库搜索程序”(Gapped BLAST and PSI-BLAST:a new generation of protein database searchprograms)《核酸研究》(Nucleic AcidsRes.)25:3389-3402以及Zhang等人(1997)“PowerBLAST:一种新型用于交互式或自动序列分析和注释的网络BLAST应用程序”(PowerBLAST:A new network BLAST application for interactive or automatedsequence analysis and annotation)《基因组研究》(Genome Res.)7:649-656,上述文献各自以引用方式并入本文。
在寡核苷酸的语境中,“经修饰核苷酸”是指其中寡核苷酸序列的至少一个核苷酸被向寡核苷酸提供所需特性的不同核苷酸替代的改变。可以在本文所述寡核苷酸中被取代的示例性经修饰核苷酸包括,例如,C5-甲基-dC、C5-乙基-dC、C5-甲基-dU、C5-乙基-dU、2,6-二氨基嘌呤、C5-丙炔基-dC、C5-丙炔基-dU、C7-丙炔基-dA、C7-丙炔基-dG、C5-炔丙基氨基-dC、C5-炔丙基氨基-dU、C7-炔丙基氨基-dA、C7-炔丙基氨基-dG、7-脱氮-2-脱氧黄苷、吡唑并嘧啶类似物、假-dU、硝基吡咯、硝基吲哚、2′-0-甲基核糖-U、2′-0-甲基核糖-C、N4-乙基-dC、N6-甲基-dA等。可以在寡核苷酸中被取代的许多其他经修饰核苷酸是本文中所指的,或者在本领域中是已知的。在某些实施例中,相对于相应的未修饰寡核苷酸的解链温度,经修饰核苷酸取代改变了寡核苷酸的解链温度(Tm)。为了进一步说明,在一些实施例中,某些经修饰核苷酸取代可以减少非特异性核酸扩增(例如,最小化引物二聚体形成等),增加预期的靶标扩增子的产率等。这些类型的核酸修饰的示例在例如美国专利号6,001,611中描述,其通过引用并入本文。
检测CA
本公开提供了通过扩增例如CA 5.8s/ITS2 rRNA基因核酸序列的一部分来检测CA的方法。该基因的核酸序列可公开获得(例如,GenBank登录号AB375772)。具体地,本公开的实施例提供了用于扩增和检测特定CA核酸分子靶标的引物和探针。
为了检测CA,提供了用于扩增CA 5.8s/ITS2 rRNA基因的引物和探针。除本文举例说明的核酸外的核酸也可用于检测样品中的CA。例如,本领域技术人员可以使用常规方法评估功能性变体的特异性和/或敏感性。代表性的功能变体可以包括,例如,本文公开的靶标CA基因核酸中的一个或多个缺失、插入和/或取代。
更具体地,寡核苷酸的实施例各自包括具有选自SEQ ID NO:1至SEQ ID NO:12的序列的核酸、其基本上相同的变体(其中该变体与SEQ ID NO:1至SEQ ID NO:12中的一者具有至少例如80%、90%或95%的序列同一性)或SEQ ID NO:1至SEQ ID NO:12和变体的补体。
表I:5.8s/ITS2 rRNA引物
表II:5.8s/ITS2 rRNA探针
在一个实施例中,使用上述引物组和探针以提供对怀疑含有CA的生物学样品中的CA的检测。引物组和探针可以包含对于CA 5.8s/ITS2 rRNA基因的核酸序列为特异性的引物和探针或由其组成,所述核酸序列包含SEQ ID NO:1至SEQ ID NO:12的核酸序列或由其组成。在另一个实施例中,用于CA 5.8s/ITS2 rRNA基因的引物和探针包含SEQ ID NO:1至SEQ ID NO:12的任何引物和探针的功能活性变体或由其组成。
SEQ ID NO:1至SEQ ID NO:12的任何引物和/或探针的功能活性变体可以通过使用所公开的方法中的引物和/或探针来鉴定。SEQ ID NO:1至SEQ ID NO:12中任一者的引物和/或探针的功能活性变体,属于与SEQ ID NO:1至SEQ ID NO:12各序列相比在所述方法或试剂盒中提供相似或更高特异性和敏感性的引物和/或探针。
该变体可以例如与SEQ ID NO:1至SEQ ID NO:12的序列相差一个或多个核苷酸添加、缺失或取代,诸如位于SEQ ID NO:1至SEQ ID NO:12各序列的5′末端和/或3′末端的一个或多个核苷酸添加、缺失或取代。如上所述,可以对引物(和/或探针)进行化学修饰,即,引物和/或探针可以包含经修饰核苷酸或非核苷酸化合物。探针(或引物)则是经修饰寡核苷酸。“经修饰核苷酸”(或“核苷酸类似物”)与天然“核苷酸”的不同之处在于一些修饰,但仍由碱基或碱基样化合物、呋喃戊糖基(pentofuranosyl)糖或呋喃戊糖基糖样化合物、磷酸根部分或磷酸根样部分或其组合组成。例如,“标记”可以附接至“核苷酸”的碱基部分,由此获得“经修饰核苷酸”。“核苷酸”中的天然碱基也可以被例如7-脱氮嘌呤代替,由此也获得“经修饰核苷酸”。术语“经修饰核苷酸”或“核苷酸类似物”在本申请中可互换使用。“经修饰核苷”(或“核苷类似物”)与天然核苷的区别在于,以关于上述“经修饰核苷酸”(或“核苷酸类似物”)概述的方式进行了一些修饰。
可以使用例如计算机程序诸如OLIGO(Molecular Biology Insights Inc.,Cascade,Colo.)来设计包括经修饰寡核苷酸和寡核苷酸类似物的寡核苷酸,所述寡核苷酸扩增编码靶标CA 5.8s/ITS2 rRNA基因的核酸分子。当设计待用作扩增引物的寡核苷酸时的重要特征包括但不限于,适宜大小的扩增产物以促进检测(例如,通过电泳)、一对引物成员的相近的解链温度、以及每个引物的长度(即,引物需要足够长从而以序列特异性进行退火并且启动合成,但不能太长以至于在寡核苷酸合成过程中降低保真度)。通常,寡核苷酸引物的长度为8个至50个核苷酸(例如,长度为8个、10个、12个、14个、16个、18个、20个、22个、24个、26个、28个、30个、32个、34个、36个、38个、40个、42个、44个、46个、48个或50个核苷酸)。在一些实施例中,寡核苷酸引物的长度为40个或更少的核苷酸。
除了一组引物之外,该方法可以使用一个或多个探针以便检测存在或不存在CA。术语“探针”是指合成或生物产生的核酸(DNA或RNA),其通过设计或选择而包含特定的核苷酸序列,使它们能够在定义的预定严格性下特异性地(即优先)与“靶标核酸”杂交,在当前情况下,与靶标CA基因核酸杂交。“探针”可以被称为“检测探针”,意指其检测靶标核酸。
在一些实施例中,可以用至少一种荧光标记物标记所述CA 5.8s/ITS2 rRNA基因探针。在一个实施例中,可以用供体荧光部分(例如,荧光染料)和相应的受体部分(例如,猝灭剂)标记CA 5.8s/ITS2 rRNA基因探针。在一个实施例中,探针包含荧光部分或由其组成,并且核酸序列包含SEQ ID NO:9至SEQ ID NO:12或由其组成。
可以以类似于设计引物的方式设计用作探针的寡核苷酸。实施例可以使用单个探针或一对探针来检测扩增产物。取决于实施例,探针用途可以包含至少一种标记和/或至少一种猝灭剂部分。与引物一样,探针通常具有相似的解链温度,并且每个探针的长度必须足以发生序列特异性杂交,但不能太长以至于在合成过程中降低保真度。寡核苷酸探针的长度通常为15个至40个(例如,16个、18个、20个、21个、22个、23个、24个或25个)核苷酸。
构建体可以包括各自包含CA 5.8s/ITS2 rRNA基因引物和探针核酸分子中的一者的载体。构建体可以用作例如对照模板核酸分子。适合使用的载体是可商购的和/或通过本领域常规的重组核酸技术方法产生的。可以通过例如化学合成、从CA直接克隆或通过PCR扩增获得CA 5.8s/ITS2 rRNA基因核酸分子。
除CA 5.8s/ITS2 rRNA基因核酸分子(例如,包含SEQ ID NO:1至SEQ ID NO:12中的一个或多个序列的核酸分子)外,适用于该方法的构建体通常还包括编码用于选择所需构建体和/或转化体的可选标志物(例如,抗生素抗性基因)的序列以及复制起点。载体系统的选择通常取决于几个因素,包括但不限于宿主细胞的选择、复制效率、选择性、诱导性和恢复的难易程度。
含有靶标CA基因核酸分子的构建体可以在宿主细胞中繁殖。如本文所用,术语宿主细胞意为包括原核生物和真核生物,诸如酵母细胞、植物细胞和动物细胞。原核宿主可以包括大肠杆菌(E.coli)、鼠伤寒沙门氏菌(Salmonella typhimurium)、粘质沙雷氏菌(Serratia marcescens)和枯草芽孢杆菌(Bacillus subtilis)。真核宿主包括酵母诸如酿酒酵母(S.cerevisiae)、裂殖酵母(S.pombe)、毕赤酵母(Pichia pastoris)、哺乳动物细胞诸如COS细胞或中国仓鼠卵巢(CHO)细胞、昆虫细胞和植物细胞诸如拟南芥(Arabidopsisthaliana)和普通烟草(Nicotiana tabacum)。可以使用本领域普通技术人员通常已知的任何技术将构建体引入宿主细胞。例如,磷酸钙沉淀、电穿孔、热休克、脂质转染、显微注射和病毒介导的核酸转移是将核酸引入宿主细胞的常用方法。另外,裸DNA可以直接递送至细胞(参见,例如,美国专利号5,580,859和5,589,466)。
聚合酶链式反应(PCR)
专利号为4,683,202、4,683,195、4,800,159和4,965,188的美国专利公开了常规PCR技术。PCR通常采用两个寡核苷酸引物,其与所选核酸模板(例如,DNA或RNA)结合。在一些实施例中有用的引物包括寡核苷酸,其能够充当所述靶标CA基因核酸序列(例如,SEQ IDNO:1至SEQ ID NO:7)内核酸合成的起始点。引物可以通过常规方法从限制性消化物中纯化,或它可以合成产生。为了扩增中的最大效率,引物优选是单链的,但引物可以是双链的。首先将双链引物变性(即处理)以分离链。使双链核酸变性的一种方法是通过加热。
如果模板核酸是双链的,则必须在它可以用作PCR中的模板前分离两条链。链分离可以通过任何合适的变性方法完成,包括物理、化学或酶促方式。分离核酸链的一种方法涉及加热核酸直至它多数变性(例如,大于50%、60%、70%、80%、90%或95%变性)。用于使模板核酸变性必需的加热条件将取决于例如缓冲液盐浓度以及变性核酸的长度和核苷酸组成,但通常范围在约90℃至约105℃,持续取决于反应特征(诸如温度和核酸长度)的一段时间。变性通常进行约30秒至4分钟(例如,1分钟至2分30秒,或1.5分钟)。
如果双链模板核酸通过加热变性,则允许反应混合物冷却至促进每个引物退火到其在所述靶标CA基因核酸分子上的靶标序列的温度。退火温度通常为约35℃至约65℃(例如,约40℃至约60℃;约45℃至约50℃)。退火时间可以是约10秒至约1分钟(例如,约20秒至约50秒;约30秒至约40秒)。然后将反应混合物调整至聚合酶的活性得到促进或最佳化的温度,即足以使延伸从退火引物发生,以生成与模板核酸互补的产物的温度。温度应足以从退火至核酸模板的每个引物合成延伸产物,但不应如此高,以使延伸产物变性脱离其互补模板(例如用于延伸的温度通常范围为约40℃至约80℃(例如约50℃至约70℃;约60℃))。延伸时间可以是约10秒至约5分钟(例如,约30秒至约4分钟;约1分钟至约3分钟;约1分钟30秒至约2分钟)。
PCR测定可采用核酸,诸如RNA或DNA(cDNA)。模板核酸不需要纯化;它可以是复杂混合物(例如人类细胞中所含的核酸)的一小部分。核酸分子可以通过常规技术(诸如《诊断分子微生物学:原理和应用》(Diagnostic Molecular Microbiology:Principles andApplications)(Persing等人(编),1993,American Society for Microbiology,Washington D.C.)中描述的技术)从生物学样品中提取。核酸可从多种来源获得,诸如质粒或天然来源(包括细菌、酵母、原生动物病毒、细胞器或高级生物诸如植物或动物)。
在诱导引物延伸的反应条件下,将寡核苷酸引物与PCR试剂合并。例如,扩链反应通常包括50mM KCl、10mM Tris-HCl(pH 8.3)、15mM MgCl
新合成的链形成双链分子,可用于反应的后续步骤。链分离、退火和延长步骤可以根据需要重复多次,以产生所需数量的对应于靶标核酸分子的扩增产物。反应中的限制因素是反应中存在的引物、热稳定酶和核苷三磷酸的量。循环步骤(即,变性、退火和延伸)优选重复至少一次。对于在检测中的用途,循环步骤数目将取决于例如样品的性质。如果样品是核酸的复杂混合物,则将需要更多循环步骤以扩增足以检测的靶标序列。通常,循环步骤重复至少约20次,但可以重复多达40、60或甚至100次。
荧光共振能量转移(FRET)
FRET技术(例如,参见专利号为4,996,143、5,565,322、5,849,489和6,162,603的美国专利)基于以下概念:当供体荧光部分和相应的受体荧光部分彼此位于一定距离内时,可以在两个荧光部分之间发生能量转移,并且该能量转移可以可视化或以其他方式检测和/或定量。当供体被具有合适波长的光辐射激发时,供体通常将能量转移至受体。受体通常以具有不同的波长的光辐射的形式重新发射转移的能量。在某些系统中,非荧光能量可以通过包括基本上非荧光供体部分的生物分子而在供体部分和受体部分之间转移(参见,例如,美国专利号7,741,467)。
在一个实例中,寡核苷酸探针可包含供体荧光部分和相应的猝灭剂,其可以是或不是荧光的,并且以光以外的形式耗散被转移的能量。当探针完整时,能量转移通常发生在供体部分和受体部分之间,使得来自供体荧光部分的荧光发射被受体部分猝灭。在聚合酶链式反应的延伸步骤期间,结合至扩增产物的探针由例如Taq聚合酶的5′至3′核酸酶活性切割,使得供体荧光部分的荧光发射不再被猝灭。用于该目的的示例性探针在例如专利号为5,210,015、5,994,056和6,171,785的美国专利中有所描述。常用的供体-受体对包括FAM-TAMRA对。常用的猝灭剂是DABCYL和TAMRA。常用的黑暗猝灭剂包括BlackHoleQuenchers
在另一个实例中,各自包含荧光部分的两个寡核苷酸探针可以在特定位置与扩增产物杂交,所述特定位置由寡核苷酸探针与靶标核酸序列的互补性决定。当寡核苷酸探针在合适的位置与扩增产物核酸杂交时,产生FRET信号。杂交温度可以在约35℃至约65℃的范围内,持续约10秒至约1分钟。
可以使用例如光子计数落射荧光显微镜系统(包含适当的二向色镜和用于监控特定范围内的荧光发射的滤光器)、光子计数光电倍增器系统或荧光计进行荧光分析。可以使用氩离子激光器、高强度汞(Hg)弧光灯、光纤光源或其他经过适当滤光以在所需范围内激发的高强度光源来进行能量转移的激发或荧光团的直接检测。
如本文所用,对于供体部分和相应的受体部分,“对应”是指具有与供体荧光部分的发射光谱重叠的吸收光谱的受体荧光部分或黑暗猝灭剂。受体荧光部分的发射光谱的最大波长应比供体荧光部分的激发光谱的最大波长至少大100nm。因此,可以在它们之间产生有效的非辐射能量转移。
通常选择荧光供体部分和相应的受体部分用于(a)高效的Forster能量转移;(b)大的最终Stokes位移(>100nm);(c)尽可能进入可见光谱红色部分(>600nm)的发射位移;(d)发射位移至比通过在供体激发波长激发而产生的Raman水荧光发射更大的波长。例如,可以选择供体荧光部分,其具有在激光线(例如,氦-镉442nm或氩488nm)附近的最大激发、高消光系数、高量子产率,并且其荧光发射与响应的受体荧光部分的激发光谱具有良好的重叠性。可以选择相应的受体荧光部分,其具有高消光系数、高量子产率,其激发与供体荧光部分的发射有良好的重叠性,并且具有在可见光谱红色部分(>600nm)中的发射。
可以与FRET技术中的各种受体荧光部分一起使用的代表性供体荧光部分包括荧光素、荧光素黄、B-藻红蛋白、9-吖啶异硫氰酸酯、荧光素黄VS、4-乙酰胺基-4′-异硫氰酸根合二苯乙烯-2,2′-二磺酸、7-二乙基氨基-3-(4′-异硫氰酸根合苯基)-4-甲基香豆素、1-吡丁酸琥珀酰亚胺酯和4-乙酰胺基-4′-异硫氰酸根合二苯乙烯-2,2′-二磺酸衍生物。取决于所使用的供体荧光部分,代表性的受体荧光部分包括LC Red 640、LC Red 705、Cy5、Cy5.5、丽丝胺罗丹明B磺酰氯、四甲基罗丹明异硫氰酸酯、罗丹明x异硫氰酸酯、赤藓红异硫氰酸酯、荧光素,二亚乙三胺五乙酸盐或镧系元素(例如,铕或铽)离子的其他螯合物。供体荧光部分和受体荧光部分可以例如从Molecular Probes(Junction City,Oreg.)或SigmaChemical Co.(St.Louis,Mo.)获得。
可以经由连接臂将供体荧光部分和受体荧光部分附接至适当的探针寡核苷酸。每个连接臂的长度很重要,因为连接臂将影响供体荧光部分和受体荧光部分之间的距离。连接臂的长度可以是从核苷酸碱基到荧光部分的距离,以埃
受体荧光部分,诸如LC Red 640,可以与含有氨基连接基(例如,可从ABI(FosterCity,Calif.)或Glen Research(Sterling,VA)获得的C6-氨基亚磷酰胺)的寡核苷酸组合在一起,以产生例如经LC Red 640标记的寡核苷酸。将供体荧光部分诸如荧光素偶联至寡核苷酸的常用连接基包括硫脲连接基(FITC衍生的,例如,来自Glen Research或ChemGene(Ashland,Mass.)的荧光素-CPG)、酰胺连接基(荧光素-NHS-酯衍生的,诸如来自BioGenex(San Ramon,Calif.)的CX-荧光素-CPG)或需要在寡核苷酸合成后偶联荧光素-NHS-酯的3′-氨基-CPG。
检测CA
本公开提供了用于检测生物学样品或非生物学样品中存在或不存在CA的方法。提供的方法避免了样品污染、假阴性和假阳性的问题。该方法包括执行至少一个循环步骤以及一个FRET检测步骤,所述循环步骤包括使用一对或多对引物从样品扩增靶标核酸分子的一部分。优选在热循环仪中执行多个循环步骤。可以使用引物和探针执行该方法以检测CA的存在,并且对靶标CA基因的检测指示样品中存在CA。
如本文所述,可以使用利用FRET技术的优点的经标记杂交探针来检测扩增产物。一种FRET格式利用
也可以使用与FRET缀合的分子信标来使用实时PCR方法检测扩增产物的存在。分子信标技术使用被第一荧光部分和第二荧光部分标记的杂交探针。第二荧光部分通常是猝灭剂,且荧光标记一般位于探针的每个末端处。分子信标技术使用具有允许二级结构形成(例如,发夹)的序列的探针寡核苷酸。作为在探针内的二级结构形成的结果,当探针在溶液中时,两个荧光部分空间接近。在与靶标核酸(即扩增产物)杂交以后,探针的二级结构被破坏,并且荧光部分变得彼此分离,从而使得在用合适波长的光激发后,可以检测第一荧光部分的发射。
FRET技术的另一种常见格式利用两种杂交探针。每种探针可以经不同的荧光部分标记,并且通常设计为在靶标DNA分子(例如,扩增产物)中彼此紧邻地杂交。通过
通常,存在FRET指示样品中存在CA,而不存在FRET指示样品中不存在CA。然而,样本采集不充分、运输延误、运输条件不当或使用某些采集拭子(藻酸钙或铝制杆)都是可能影响测试结果成功和/或准确性的条件。使用本文公开的方法,在例如45个循环步骤内检测到FRET指示CA感染。
可用于实施该方法的代表性生物学样品包括但不限于呼吸道标本、粪便标本、血液标本、皮肤拭子、鼻拭子、伤口拭子、血液培养物、皮肤和软组织感染。生物学样品的收集和储存方法是本领域技术人员已知的。可以处理生物学样品(例如,通过本领域已知的核酸提取方法和/或试剂盒)以释放CA核酸,或者在一些情况下,可以使生物学样品与PCR反应组分和适当的寡核苷酸直接接触。
解链曲线分析是一个附加步骤,可以包含在循环特征中。解链曲线分析基于以下事实:DNA在称为解链温度(Tm)的特征温度下解链,该温度定义为一半DNA双链体分离成单链的温度。DNA的解链温度主要取决于其核苷酸组成。因此,富含G核苷酸和C核苷酸的DNA分子的Tm高于具有丰富的A核苷酸和T核苷酸的DNA。通过检测信号丢失的温度,可以确定探针的解链温度。类似地,通过检测信号产生的温度,可以确定探针的退火温度。来自扩增产物的探针的解链温度可以确认样品中存在或不存在CA。
在每次热循环仪运行中,对照样品也可以循环。阳性对照样品可以使用例如对照引物和对照探针扩增靶标核酸对照模板(不同于所描述的靶标基因的扩增产物)。阳性对照样品也可以扩增例如含有靶标核酸分子的质粒构建体。可以使用与检测目标靶标所使用者相同的引物和探针,在内部(例如,在样品内)或在与患者样品并排的单独样品中扩增此类质粒对照。此类对照是扩增、杂交和/或FRET反应成功或失败的指示物。每次热循环仪运行还可以包含一个阴性对照,例如,它缺少靶标模板DNA。阴性对照可以衡量污染。这确保系统和试剂不会产生错误的阳性信号。因此,对照反应可以容易地确定,例如,引物以序列特异性退火并引发延长的能力,以及探针以序列特异性杂交并发生FRET的能力。
在实施例中,该方法包括避免污染的步骤。例如,在专利号为5,035,996、5,683,896和5,945,313的美国专利中描述了酶促方法,该方法利用尿嘧啶-DNA糖基化酶来减少或消除一次热循环仪运行与下一次热循环仪运行之间的污染。
结合FRET技术的常规PCR方法可用于实施这些方法。在一个实施例中,使用
作为FRET的替代品,可使用双链DNA结合染料诸如荧光DNA结合染料(例如,
应当理解,本公开的实施例不受一种或多种市售仪器的配置的限制。
制品/试剂盒
本公开的实施例进一步提供了用于检测CA的制品、组合物或试剂盒。制品可以包括用于检测靶标CA基因的引物和探针,以及合适的包装材料。组合物可以包括用于扩增靶标CA基因的引物。在某些实施例中,组合物还可以包含用于检测靶标CA基因的探针。用于检测CA的代表性引物和探针能够与靶标核酸分子杂交。另外,试剂盒还可以包括适当包装的试剂和DNA固定、杂交和检测所需的材料,诸如固体支持物、缓冲液,酶和DNA标准品。本文公开了设计引物和探针的方法,并且提供了扩增和杂交至靶标核酸分子的引物和探针的代表性实例。
制品还可以包括一个或多个用于标记探针的荧光部分,替代性地,试剂盒随附的探针可以是经标记的。例如,制品可以包括用于标记探针的供体荧光部分和/或受体荧光部分。上面提供了合适的FRET供体荧光部分和相应的受体荧光部分的示例。
制品还可以包含包装插页或包装标签,上面带有使用引物和探针检测样品中的CA的使用说明书。制品和组合物可以额外包括用于实施本文公开的方法的试剂(例如,缓冲液、聚合酶、辅因子或防止污染的药剂)。此类试剂对于本文所述的市售仪器之一可能是特异性的。
在以下实例中将进一步描述本公开的实施例,其不限制权利要求中描述的本发明的范围。
实例
提供以下实例、表和附图以帮助理解主题,其真正范围在所附权利要求中阐明。应当理解的是,在不脱离本发明精神的前提下,可以对阐明的程序进行修改。
选择CA的靶标是对公共序列数据库进行全面检索以及对CA靶标进行文献检索的结果,这些CA靶标可能区别于与其最相似的希木龙假丝酵母菌和酿酒酵母。在设计阶段的靶标选择过程中分析了来自公共序列数据库的多个靶标,但所有靶标显示与希木龙假丝酵母菌和酿酒酵母的交叉反应性。公共数据库中的序列由于来自多拷贝靶标的“大量”序列数据而变得复杂。所选寡核苷酸的BLAST分析指示,唯一显著的交叉反应性将是与希木龙假丝酵母菌的交叉反应性。
使用
表III PCR扩增试剂
下表显示了用于PCR扩增反应的典型温度曲线:
表IV PCR温度曲线
预PCR程序包括初始变性和在55℃、60℃和65℃孵育以用于RNA模板的逆转录。在三个温度下孵育将以下有益效果组合:在较低温度下也会转录轻微不匹配的靶标序列(诸如生物体的遗传变异),而在较高温度下,RNA二级结构的形成受到抑制,从而导致更有效的转录。PCR循环分为两次测量,其中两次测量均采用一步设置(将退火和延伸组合)。在55℃进行的前5个循环通过预扩增轻微不匹配的靶标序列而增加了包容性,而在第二次测量的45个循环中,通过使用58℃的退火/延伸温度提供了更高的特异性。
使用上述条件执行CA 5.8s/ITS2 rRNA基因的扩增和检测。使用几种选定的寡核苷酸引物和探针进行实验的结果作为针对扩增反应的Ct值(阈循环)显示于下,所述引物和探针是针对以100,000、10,000和1,000基因组等效物每PCR反应(ge/PCR)的浓度存在的基因组CA DNA以及均以100,000基因组等效物每PCR反应(ge/PCR)的浓度存在的基因组耳道假丝酵母菌(CA)和希木龙假丝酵母菌(CH)的。
表V CA 5.8s/ITS2 rRNA基因的扩增和检测
表现出对于CA的最佳敏感性和对于CH的最佳排他性的测定法是AUR1、AUR2和AUR5,而AUR4和AUR 6测定法显示出对于CH的交叉反应性。AUR2测定法(即,正向引物SEQ IDNO:2,反向引物SEQ ID NO:5,以及探针SEQ ID NO:10)在以100,000、10,000和1,000ge/PCR的浓度存在的基因组CA DNA中以及以100,000ge/PCR的浓度存在的基因组CH DNA中进一步测试,并且该实验的PCR生长曲线显示在图1中。在未修饰的引物(AUR2)的生长曲线和在3′末端用叔丁基-苄基部分修饰的引物(AUR2TBB)的生长曲线之间未观察到差异。使用修饰或未修饰的引物(希木龙假丝酵母菌/希木龙假丝酵母菌TBB)和无模板对照(AUR2 NTC/AUR2TBB NTC)均未检测到CH模板的信号。
尽管出于清楚和理解的目的已经详细描述了前述发明,但是通过阅读本公开内容,本领域技术人员将清楚,在不脱离本发明的真实范围的情况下,可以进行形式和细节上的各种改变。例如,可以以各种组合使用上述所有技术和装置。本申请中引用的所有出版物、专利、专利申请和/或其他档案通过引用而在此以其整体并入以用于全部目的,引用程度如同每一个体出版物、专利、专利申请和/或其他档案被独立地指示为通过引用并入以用于全部目的。
非正式序列表
SEQ ID NO 1:CAUR001正向引物 TGAGCGTGATGTCTTCTCAC
SEQ ID NO 2:CAUR003正向引物 GAGCGTGATGTCTTCTCACC
SEQ ID NO 3:CAUR005正向引物 ACTGATTTGGATTTTAAAACTAACCCAA
SEQ ID NO 4 CAUR007正向引物 AACTAACCCAACGTTAAGTTCAAC
SEQ ID NO 5:CAUR002反向引物 CCTGATTTGAGGCGACAACAA
SEQ ID NO 6:CAUR004反向引物 CGTCTGCAAGTCATACTACGTA
SEQ ID NO 7:CAUR006反向引物 CGATGATTCACGTCTGCAAGTC
SEQ ID NO 8:CAUR008反向引物 CAACGCCACCGCGAA
SEQ ID NO 9:CAUR101HQ6探针 CTTCGCGGTGGCGTTGCATTCACA
SEQ ID NO 10:CAUR103HQ6探针 TTCGCGGTGGCGTTGCATTCACA
SEQ ID NO 11:CAUR105HQ10探针 ACAACGGATCTCTTGGTTCTCGCATCGATG
SEQ ID NO 12:CAUR107HQ8探针 CTCGCATCGATGAAGAACGCAGCGAAA
- 用于检测耳道假丝酵母菌的组合物和方法
- 一种用于检测近平滑假丝酵母菌的LAMP引物组合物及其LAMP检测试剂盒和使用方法
