用于治疗骨关节炎的制剂
文献发布时间:2023-06-19 11:57:35
技术领域
本发明一般涉及通过改变关节骨形状变化来治疗骨关节炎的方法,关节骨形状变化是骨关节炎的发生和发展的病理基础。
背景技术
骨关节炎
骨关节炎是最常见的关节疾病,也是所有慢性疾病中分布最广的疾病之一。在美国,骨关节炎(OA)是仅次于心脏病的导致50岁以上男性工作障碍的第二大原因。在全球范围内,骨关节炎是导致残疾的第六大原因(Woolf 2003)。
大约80%的OA患者需要膝部治疗。在有症状个体的膝关节内,最常见的影像学表现是关节(透明)软骨丢失和邻近骨重塑,通常在关节边缘形成骨赘。胫股关节和髌股关节腔通常都受到退行性改变的影响。髌股关节炎是由于髌骨和滑车沟软骨丢失所致,在膝关节骨性关节炎患者中很常见,常伴有其他关节腔软骨丢失(Davies 2002)。
疼痛是膝OA患者的常见症状。疼痛通常用醋氨酚或非甾体抗炎药(NSAID)治疗。然而,继2005年非甾体抗炎药处方标签的最初盒装警告和警告和注意事项部分之后,FDA在2015年加强了现有的标签警告,即非阿司匹林非甾体抗炎药,包括其非处方产品,会增加心脏病发作或中风的几率(https://www.fda.gov/drugs/drug-safety-and-availability/fda-drug-safety-communication-fda-strengthens-warning-non-aspirin-nonsteroidal-anti-inflammatory)。使用皮质类固醇或透明质酸产品的关节内治疗也被用来减轻疼痛。皮质类固醇注射与进一步的膝关节软骨退变有关(McAlindon 2017),限制了临床医生使用这种治疗方式的意愿。美国骨科医师学会/美国骨科医师协会不推荐皮质类固醇注射治疗膝OA。
将透明质酸或“黏性补给”产品被注入膝关节,每周一次(2cc),持续3周,或单次给予更大剂量(6cc;Chevalier 2010)。注射的透明质酸产品在关节间隙内停留时间短,约为数小时到数天。虽然一些患者的关节疼痛减轻可能持续数周至数月(Cohen 1998),但多项临床试验未能证明具有临床意义的治疗效果。美国矫形外科医师学会和美国矫形外科医师协会表示,“我们不建议对有症状的膝骨关节炎患者使用透明质酸”。(《AAOS膝骨关节炎治疗循证指南》(AAOS Treatment of Osteoarthritis of the Knee Evidence-BasedGuideline)第2版,2013年5月18日)。(http://www.aaos.org//cc_files/aaosorg/research/guidelines/treatmentofbsteoarthritisofthekneeguideline)
关节软骨退变及治疗现状
众所周知,骨关节炎涉及关节软骨的进行性退变。膝关节、髋关节和肘关节软骨退变通常随着年龄的增长缓慢进展。关节损伤后或在剧烈体力劳动或运动对关节造成慢性或过度压力的情况下,关节退变可能会加速(Sandmark 2000,Felson 1991)。
关节软骨使关节平滑、几乎无摩擦地运动。它缓冲周期荷载并抵消关节上的剪切力。关节软骨包含非胶原蛋白,水,蛋白质多糖,如聚糖蛋白聚糖,和胶原的细胞外基质中包埋的软骨细胞。蛋白质多糖是亲水性分子,能使软骨表层水化。这增加了关节软骨缓冲生物力学应力的能力。关节软骨在生物学上是独特的,任何人工工程材料或损伤或微骨折手术后形成的纤维软骨(“瘢痕”软骨)都无法比拟。
不幸的是,关节软骨不能自然再生,无论是在创伤后,还是在老化的慢性“磨损”情形中(Buckwalter 2002)。
迄今为止,针对患有膝OA的患者,只批准了手术方法和治疗症状(疼痛)管护。外科手术中,软骨下骨的微骨折和磨损被用来诱导纤维软骨(瘢痕软骨)的形成。然而,纤维软骨的结构强度和稳定性比正常关节软骨差得多,退变更快。用于膝关节软骨修复的其他侵入性外科手术包括钻入软骨下骨并植入取自患者身体非负重部位或尸体的软骨细胞(软骨细胞)或其祖细胞的填塞(自体骨软骨移植/同种异体骨移植,OATS手术)。需要进行两次手术,手术后大约6周内患者无法完全负重。治疗失败是常见的,因为是需要额外的手术来处理并发症。
自体软骨细胞植入术(ACI)也需要两种手术方法,在关节镜下从膝关节采集健康软骨并在培养基中生长。然后将培养的软骨细胞植入体内。需要开膝手术。病人的软骨被切割(清创)到骨,骨膜或生物工程皮瓣被缝合或粘合到位。然后将培养的细胞注入皮瓣。在对150多名ACI患者的
膝OA患者的最终选择是关节置换手术,这是一种侵入性和昂贵的选择,有可能导致严重的病态并发症。单膝全膝关节置换(TKR)费用为35000-70000美元,其中不包括术后康复(至少6周)和生产力损失的费用。假肢关节的预期寿命有限,通常必须在15-20年后更换;因此TKR通常保留为老年患者施用。然而,接受TKR治疗的患者的平均年龄一直在下降。2000年为68岁,2014年降至65.9岁(美国骨科医师学会,2018年)。2014年,TKR手术超过68万例,预计2030年,美国将有约128万例TKR手术(不包括翻修手术)(美国骨科医师学会2018:https://aaos-annualmeeting-presskit.org/2018/research-news/sloan_tjr/)。
疾病改变性骨关节炎药物(DMOAD)
鉴于目前可用的治疗方法的局限性和潜在的并发症,人们已经做出巨大的努力来开发通过促进关节软骨形成或减少软骨退变来减缓膝关节退变的治疗方法。
例如,一些研究小组试图开发基质金属蛋白酶抑制剂,据信基质金属蛋白酶是软骨退变的原因(Krsezki 2007)。其他人试图抑制一氧化氮,据信其会加速软骨破坏(Helliole Graverand 2013)。虽然在对设对照的临床试验中已经测试了许多被认为可以抑制膝OA的软骨退变的药物,但到目前为止,还没有一种药物能够成功地减缓或阻滞软骨的丢失。
软骨再生的研究代表了膝OA的另一种治疗方法。已经测试了多种生长因子在软骨再生中的功效,包括TGFβ(转化生长因子β)家族分子,如骨形状发生蛋白-7(BMP-7)。迄今为止,所有研究的生长因子在临床试验中均未显示有效性(Guermazi,2017)。虽然成纤维细胞生长因子-18(FGF-18,又名斯非福明(Sprifermin))显示膝OA对象的胫股关节软骨厚度有轻微但具有统计学意义的增加,但与安慰剂相比,主动治疗未能显示对象膝关节功能或疼痛的改善(Hochberg2017,Hochberg2018)。
正在开发的能够再生关节软骨或延缓其退变的药物被认为是潜在的疾病改变性骨关节炎药物(DMOAD)。
TPX-100是SEQ ID NO:1的肽,在山羊软骨损伤模型中证明了具有关节软骨形成活性,并且是候选的DMOAD(美国专利号7888462和8426558)。在一项随机、双盲、安慰剂对照试验中,对双侧膝OA患者测试了SEQ ID NO:1肽。与安慰剂治疗的膝相比,TPX-100治疗的膝在膝关节功能以及其他临床转归方面表现出具有统计学意义和临床意义的改善(McGuire2017)。在TPX-100治疗的膝关节中,膝关节功能的改善是强劲的,并且持续至为期一年的研究结束时。通过MRI测量,膝关节功能改善与12个月时胫股软骨厚度增加或稳定相关(McGuire2018)。
骨关节炎病理学中软骨结构问题
关节软骨退变被认为是膝OA的主要病理机制。然而,临床观察让一些研究人员质疑关节其他部位的变化是否会导致软骨退变。
例如,随着关节软骨的严重丧失,下面的骨暴露出来。可以合理预期这种“骨对骨”关节炎与严重疼痛相关联,鉴于疼痛纤维对骨的密集神经支配。然而,尽管影像学显示软骨完全丧失,膝OA对象没有或几乎没有疼痛是少见的。另一方面,许多OA患者在关节软骨几乎没有可测量的退变时就会经历剧烈的疼痛和功能受限。
临床症状和软骨厚度变化之间的差异已在候选DMOAD FGF-18(又名斯非福明)的研究中得到证实,这是一种假定的软骨细胞生长因子。在500多名膝OA患者的临床试验中,四个FGF-18剂量组与安慰剂组进行了比较。对象每周接受三次关节内注射FGF-18或安慰剂(即第0天、第7天和第14天)。在第6个月、第12个月和第18个月重复一系列的活性药物或安慰剂注射。MRI测量胫股关节软骨厚度的时间间隔变化,临床转归由西安大略省和麦克马斯特大学骨关节炎结果评分(WOMAC)度量,WOMAC是经验证的患者报告的转归度量。24个月时,与安慰剂组相比,FGF-18治疗组的胫股软骨厚度呈剂量依赖性增加。与安慰剂暴露组相比,两个最高剂量组的软骨厚度差异达到统计学意义。然而,与安慰剂相比,任何治疗组的临床益处均无差异(Hochberg 2017)。在36个月时,与安慰剂治疗组相比,FGF-18治疗组也未能显示出临床益处(Hochberg 2018)。
美国食品药品监督管理局于1999年首次发布了膝OA的DMOAD的发展指南草案,其中关节间隙宽度的增加或通过X射线测量的关节间隙变窄的延迟代表了药物批准的潜在可接受终点。然而,该指南草案于2018年8月被取代,FDA在该指南中得出结论,无论是X射线还是其他成像都不能被推荐作为DMOAD开发中疗效的替代标志物。最新的指南很简短,并指出:
“……开发这类产品仍存在一些问题,包括疾病的多因素和复杂病因、结构变化与体征/症状/功能之间公认的不一致、缺乏疾病进展的标准定义,以及相应地,缺乏可靠评估产品改变OA疾病进展能力的终点。”(FDA2018)
综上所述,目前普遍认为软骨厚度变化与临床转归之间的关系并不明显。具体来说,软骨厚度的变化可能不足以解释患者所经历的OA疾病;软骨厚度的增加也不能被认为会改变OA的临床转归,除非它们与患者益处之间存在有说服力的联系。
软骨下(关节周围)骨在膝骨关节炎中的病理作用
正在研究关节软骨下的骨骼以阐明它们在OA发病和进展中的作用。
用于治疗骨质疏松症的治疗剂如雷奈酸锶(Reginster 2013)、降钙素(Karsdal2015)和唑仑膦酸盐(Laslett 2012)已被临床测试为OA的潜在治疗方法。这些药物促进新骨形成或抑制骨吸收。它们在稳定或加强软骨下骨方面的功效尚未在临床上得到证实,而且显著的副作用已经抑制了人们对这些药物的热情。例如,雷奈酸锶被发现会增加心肌梗死的风险,从而欧洲药品管理局限制了它的使用。
最近提出的OA进展的标志物是测量关节周围骨形状的三维变化。在对美国国立卫生研究院骨关节炎倡议(OAI)数据库中大量对象的比较中,具有射线OA的膝证实,与正常对照组相比,所有OA对象的膝关节周围骨面积随着时间的推移而增加。骨面积的变化比软骨厚度的变化或关节间隙宽度的减少更能预测OA症状进展和关节失能(Bowes 2015)。
来自OAI的对象关节周围骨形状变化的3D分析揭示了OA进展相关的一致的、单向的模式。股骨、胫骨和髌骨即使在没有明显软骨丢失的情况下也会出现骨形变平。关节周围骨的三维形状变化可以使用定义在骨骼表面的多个锚定点(“主成分”)进行测量。在MRI图像上测量这些锚定点的位置随时间的偏移,并使用主动外观建模(AAM)进行算法分析。随着OA的进展,骨形状,特别是股骨周围表面的骨形状,在对象中以可预测的方式发生变化,而不考虑年龄、性别和体重指数等人口统计学差异。在来自OAI数据库的非OA关节(定义为Kellgren-Lawrence(KL)评分为0,按X射线标准反映无OA的那些)中,4年内关节周围骨形状变化的速率明显慢于按KL标准评估的OA关节。骨形状变化标准化为“B分”,表示骨形状变化程度(与未受OA影响的膝关节周围形状变化范围的标准差)(Neogi,2013;Hunter 2016)。
与骨髓病变的半定量分析相比,3D关节周围骨形状的变化能更好地预测膝OA疼痛进展(Dube 2018)。
在接受骨质疏松治疗的OAI数据库对象中,使用骨面积测量和3D形状变化评估评估双膦酸盐治疗对膝OA的影响。与非双膦酸盐使用者相比,双膦酸盐使用者的胫骨内侧骨面积增加在统计学上显著减少;然而,随着时间的推移,各组之间的三维骨形状变化没有差异。没有关于膝OA症状(如功能或疼痛)差异的分析报告(Haj-Mirzaian,2018)。
有流行病学报告称,高骨量或高骨密度与膝OA或关节置换的风险增加有关(Nevitt 2010,Hardcastle 2013)。结合以上双膦酸盐数据,骨量增加或增强并不一定能改善或降低OA的风险。
TPX-100肽
TPX-100是一种合成肽,由23个氨基酸组成,氨基酸序列为TDLQERGDNDISPFSGDGQPFKD(SEQ ID NO:1),来源于人基质细胞外磷酸糖蛋白(MEPE)。
TPX-100原料药分别以醋酸盐和钠盐的形式生产,两种情况下的最终配方均为具有C端酰胺化的冻干粉。临床研究中使用的TPX-100注射液(药品)是在注射用水中配制的。
TPX-100已被证明可促进牙本质、骨和软骨的组织适当再生,而无任何软组织钙化或骨化。TPX-100可通过皮下或关节内注射等常规方法给药。
在非临床安全性和有效性研究中,首次对TPX-100的骨形成活性进行了测试。TPX-100肽被鉴定为人类MEPE的“骨形成活性部位”,表明培养的新生小鼠颅盖骨增厚(Hayashibara 2004)。随后,皮下注射给予的TPX-100证明在广泛使用的大鼠长骨骨折模型(又名Einhorn模型)中加速骨折愈合(Lazarov 2004)。此外,作为TPX-100肽早期研究的一部分,在大鼠牙齿缺损模型中也发现它能促进牙本质的形成(Six 2007)。在这些体内骨形成和牙本质形成研究中,TPX-100具有良好的耐受性。TPX-100肽的安全性在多项GLP毒理学研究和健康志愿者的1期临床研究中得到进一步证实。
基于这些安全性以及骨和牙本质形成的数据,TPX-100分别在两个2期研究中针对牙槽骨和牙本质形成活性进行了测试。TPX-100在两项研究中都具有良好的耐受性。其中一项测试牙科活性的研究表明,在人类磨牙的缺损中给予的TPX-100可修复性形成牙本质(Lazarov 2006)。另一项测试牙槽骨形成的研究没有显示药物组和安慰剂暴露组之间的差异。
值得注意的是,在这些研究TPX-100对骨和/或牙本质疗效的非临床和临床研究中,既没有数据也没有观察到TPX-100影响这些硬组织的形状或其他形态特征。TPX-100仅通过增加这些硬组织来修复扁平和薄的骨或牙本质,在啮齿类动物模型中,愈合位于长骨中心区域的实验性骨折。
随后在山羊模型上用标准化的大软骨缺损证实了TPX-100的软骨再生特性。在活动山羊的全厚度软骨缺损模型中,与载剂对照组的软骨再生相比,术后6个月时,每周4次关节内(IA)注射TPX-100(125mg和250mg)的方案与具有统计学意义的组织学证实的透明软骨再生相关。这种药物在这些自由负重、活动的动物身上安全且耐受性良好(美国专利号7888462和8426558)。
对轻度至重度双侧膝关节骨性关节炎患者进行了TPX-100的随机、双盲、安慰剂对照临床研究。预计TPX-100将改善膝OA影响的关键膝关节功能。
在这项临床研究中,通过每周一次关节内(IA)注射给予测试制品4次,连续3周(第0、7、14和21天)。在本研究中,TPX-100是安全的,耐受性良好。
TPX-100治疗的(指数)膝关节在日常生活活动(“ADL”)和运动休闲活动(“运动休闲”)中表现出具有临床意义和统计学意义的膝关节功能改善,如膝关节损伤和骨关节炎转归评分(KOOS)所测,在膝关节相关的生活质量(“膝关节相关的QOL”)和上下楼梯的疼痛方面也有临床意义和统计学意义的改善。此外,西安大略大学和麦克马斯特大学骨关节炎评分(WOMAC)测量的“功能”和“总”评分显示,有利于指标膝(Index knee)的显著改善。TPX-100治疗的膝关节在6个月或12个月,或两者都有改善。在从基线检查到6个月或12个月的软骨总厚度变化方面,指标膝关节和对照膝关节在MRI上没有可测量的差异。然而,在TPX-100治疗的“反应者”膝盖(有临床意义的功能改善的那些)中,胫股(TF)软骨厚度从基线到12个月显著增加(McGuire 2018)。
如上所述,TPX-100源于人MEPE。已知MEPE的几种其他直系同源物,因此,TPX-100的直系同源物也是已知的。TPX-100直系同源物的示例如下:
TDLQERGDNDMSPFSGDGQPFKD(猕猴)(SEQ ID No.2)
PDLQERGDNDISPFSGDGQPFKD(犬)(SEQ ID No.3)
PDLQGRGDNDLSPFSGDGPPFKD(牛)(SEQ ID NO.4)
PDLLVRGDNDVPPFSGDGQHFMH(大鼠/小鼠)(SEQ ID No.5)
大鼠/小鼠直系同源物的氨基酸序列与人类直系同源物的同源性最低(15/23相同,65%同源)。由于已知大鼠直系同源物可促进人成骨间充质干细胞掺入氚-胸腺嘧啶核苷(美国专利号7888462和8426558),因此应合理假设这些直系同源物及其类似物具有与TPX-100相同的生物学功能。这些肽含有一个共同的氨基酸序列DLXXRGDNDXXPFSGDGXXF(SEQ ID NO:6),其中X可以是任何氨基酸。
发明概述
提出了一种治疗骨关节炎(OA)的新方法。该方法包括能够延迟、阻滞或逆转与疾病发生和进展相关的三维(3D)关节周围骨形状的病理性变化的任何治疗干预。这标志着对病理性关节周围骨形状变化的治疗干预首次被证实,并显示与膝OA的许多致残症状的显著改善显著相关。
本发明的一个方面是通过向患者(其可能是诊断为患骨关节炎的人)给予(可通过局部注射给予)治疗有效量的SEQ ID NO:1的肽制剂来改变三维(3D)关节周围骨形状的病理性变化的方法。
本发明的另一方面是通过延迟、阻滞或逆转关节周围骨形状变化来治疗OA,其中该方法包括通过基于MRI的关节三维形状分析来诊断受影响关节的关节周围骨形状,向患者给予包含治疗有效量的SEQ ID NO:1的肽的制剂,并在一段时间(例如6个月、12个月、24个月等)后测量关节周围骨形状变化,以确定与药物治疗前相比骨形状是否显著改变。
可以使用通过替代成像技术进行的骨形状分析,例如,使用通过计算机断层扫描、超声或其他成像方式获得的关节图像。
MRI通常用于诊断骨关节炎的特征,如关节软骨变薄或半月板病变。治疗前后的骨形状可以使用软骨评价获得的图像序列分析。结合骨形状和软骨分析可以提高评估治疗干预效果的敏感性。
所述肽被配制成可注射制剂,所述可注射制剂可以包括水或盐水,并且可以通过关节内或皮下途径局部注射到膝关节中。已知SEQ ID NO:1肽的几种直系同源物和类似物显示出与SEQ ID NO:1的肽相似的活性。这些肽中的任何一种可通过将其配制成包括注射用水、生理盐水等的可注射制剂来使用。
在本发明的一个方面中,实施所述方法时仅给予所述注射一次、仅两次、三次、四次、五次等。所述剂量可每日递送、每三天递送、每周递送、每十天递送、每月递送、每隔一个月递送、每季度递送、每半年递送、每年递送一次,或者以其不同的组合递送。
在本发明的一个方面中,该方法包括使用诸如KOOS和/或WOMAC量表之类的工具对患者的膝关节功能和/或疼痛进行后续评估。评估也可以基于其他适当的患者报告转归(PRO)和临床评估进行。
在本发明的一个方面中,所述剂量可在50mg到500mg,或100mg到400mg,或200mg的范围内,其中所有毫克剂量均±20%,±10%,±5%。
在本发明的一个方面中,首先基于如本文所述的纳入和排除标准来评估患者。
在本发明的一个方面中,通过改变(modify)不可避免的与年龄相关的关节周围骨形状变化(change)来延迟、阻滞或逆转关节老化。
本发明的一个方面包括采用化合物的方法和/或化合物的用途,以影响患者关节软骨下骨的形状变化,患者可以是任何动物,但包括人类和犬科动物,该方法或用途包括在患者关节局部注射治疗有效量的可注射运载体中的制剂,该制剂包括SEQ ID NO:1、2、3、4、5和6中任一个的肽序列。注射可以是关节内的,并且可以根据需要重复注射(PRN)或在两周、三周、四周或更长时间内每周重复注射,并且注射包括50-400mg±20%范围内的量的肽,继续治疗以影响患者关节软骨下骨的形状变化,从而影响骨形状变化,其中形状变化可能在诊断为骨关节炎的患者中。
本发明的一个方面包括如上所述的方法和/或用途,其中基于包括患者的大小、重量、性别和状况在内的多个因素来调整剂量。此外,给药量根据患者的种类(如人或犬)以及所治疗的特定关节而定。较大的病人和较大的关节需要较大的剂量,较小的病人和较小的关节需要较小的剂量。本发明的基本概念不受特定给药范围的限制,因为本领域技术人员将理解给药量取决于如上所述的因素以及要考虑的其他因素而变化。上述特定给药量是普通成人膝盖的优选剂量范围。本领域技术人员可从剂量推断以提供其它关节和/或动物的其它剂量范围。
本发明的一个方面包括如上所述的方法和/或用途,其中所述序列是SEQ ID NO:1的序列并且所述患者是人或狗。注射可能是关节内的,骨形状的改变可能是由于骨关节炎或老化。
本发明的另一方面包括如上所述的方法和/或用途,其中剂量和/或进一步治疗至少部分地通过在治疗之前和/或期间获得图像和比较图像来确定,以确定由于注射引起的对于骨形状的影响,其中,可以使用主动外观模型(AAM)软件来进行测量和重新测量。
附图说明
结合附图,通过以下详述更好地理解本发明。需要强调,按照惯例,附图的各个特征不成比例。相反,各种特征的尺寸被任意放大或者缩小以清楚显示。附图部分包括如下的附图:
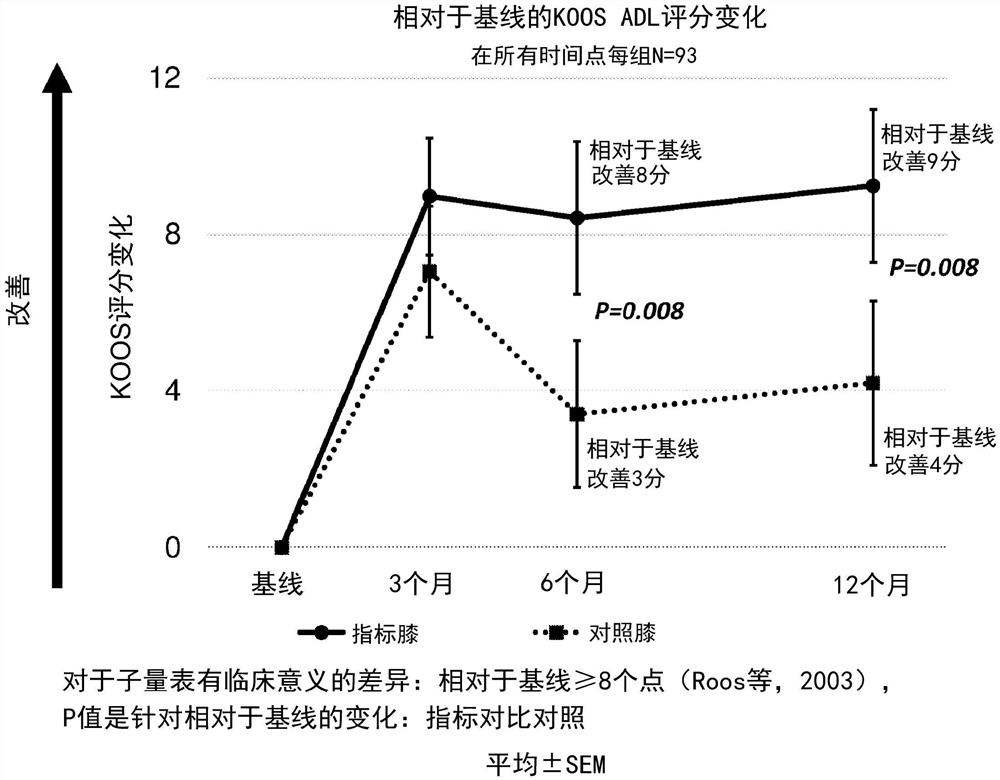
图1是显示实际临床研究结果的图表,其中使用膝关节损伤和骨关节炎转归评分(“KOOS ADL”)的日常生活活动量表测量从基线到12个月的膝关节功能变化。
图2是显示实际临床研究结果的图表,其中使用KOOS的运动和休闲活动子量表(“KOOS运动和休闲”)测量从基线到12个月的膝关节功能变化。
图3是显示实际临床研究结果的图表,其中从基线到12个月的变化是使用KOOS膝关节相关生活质量子量表(“KOOS膝关节相关QOL”)测量的。
图4显示KOOS疼痛子量表的问题和评分系统。
图5是显示实际临床研究结果的图表,其中从基线到12个月的变化是通过使用专门针对“上下楼梯疼痛”的KOOS疼痛子量表的成分来测量的。
图6是显示实际临床研究结果的图表,其中从基线到12个月的变化是通过使用专门针对膝关节疼痛频率的KOOS疼痛子量表的成分来测量的。
图7含有显示实际临床研究结果的图表,其中显示了膝关节四个区域中OA与非OA膝关节周围骨面积变化率的差异。
图8是显示实际临床研究结果的图表,其中显示了从基线到12个月期间股骨内侧关节周围骨面积的变化。
图9显示了指标(TPX-100治疗)和对照(安慰剂暴露)膝的三个区域中关节周围骨面积变化率的差异。
图10是显示实际临床研究结果的图表,其中显示了从基线到12个月期间股骨骨形状评分的变化。
图11是显示实际临床研究结果的图表,其中显示了从基线到12个月疼痛频率的变化,比较了对于使用SEQ ID NO:1的肽的主动治疗的反应者与无反应者。
图12是显示实际临床研究结果的图表,其中显示了从基线到12个月的髌骨的三维骨形状变化与对于使用SEQ ID NO:1的肽的主动治疗的反应者(对比无反应者)的疼痛频率相关。
图13是显示实际临床研究结果的图表,其中显示了从基线到12个月的股骨三维骨形状。
图14是显示实际临床研究结果的图表,其中显示了从基线到12个月疼痛频率的变化,比较了对于使用SEQ ID NO:1的肽的主动治疗的反应者与无反应者。
图15是显示实际临床研究结果的图表,其中显示了从基线到12个月的髌骨的三维骨形状变化与对于使用SEQ ID NO:1的肽的主动治疗的反应者(对比无反应者)的疼痛频率相关。
发明的具体实施方式
在描述本发明组合物和方法之前,应理解,本发明不限于所述的具体实施方式,因为它们当然可能变化。还应理解,本文所用术语的目的仅是描述具体实施方式,不用来构成限制,因为本发明的范围仅受所附权利要求书的限制。
提供数值范围时,也应视作具体公开了该范围的上限和下限之间以下限单位十分之一为间隔的各中间数值,除非上下文另有明确说明。本发明还包括设定范围内任何设定数值或中间数值和该设定范围内任何其它设定数值或中间数值之间的较小范围。取决于设定范围内任何明确排除的限值,所述范围可独立地包含或排除这些较小范围的上下限,本发明也包括这些较小范围不包含限值、包含任一或两个限值的各范围。设定范围包含一个或两个限值时,本发明也包括排除所述限值之一个或两个的范围。
除非另有说明,本文所用的所有科技术语与本发明所属领域普通技术人员所理解的通常含义相同。虽然也可采用与本文所述类似或等同的任何方法和材料实施或测试本发明,但在此描述一些潜在和优选的方法和材料。本文提及的所有出版物均通过引用纳入本文,以公开和描述与所引用出版物相关的方法和/或材料。应理解,出现抵触时,用本发明公开内容代替任何本文所纳出版物的公开内容。
必须注意到,本文和所附权利要求书所用的单数形式“一个”、“一种”和“所述”包括复数含义,除非上下文另有明确说明。因此,例如,提到“一次注射”包括多次这样的注射,提到“所述测量”包括本领域技术人员已知的一种或多种测量及其等同物,等等。
提供本文讨论的出版物仅针对其在本申请提交日之前的公开。本文中所有内容均不应解释为承认本发明不能凭借在先发明而先于这些出版物。此外,所提供的出版日期可能与实际公开日期不同,这可能需要单独确认。
骨关节炎病理生理学中的软骨结构
如上文背景部分所述,长期以来对骨关节炎(OA)发病机制的解释是关节(关节)软骨退变,这被认为会导致受影响关节的功能障碍和疼痛。多个候选的DMOAD已经在临床试验中进行了测试以靶向对于关节软骨结构的改变。然而,很少有人在人体临床试验中实际证明了任何软骨结构改变。即使在临床研究中观察到少量软骨增加,与安慰剂相比,也没有观察到相应的患者益处,如膝关节功能或疼痛改善。
迄今为止,表明膝OA患者软骨厚度增加/稳定与具有统计学意义的临床改善之间存在关联的仅有的公开的临床数据是对SEQ ID NO:1的肽进行的随机安慰剂对照研究的结果(McGuire 2018)。
对于骨关节炎膝的临床益处和软骨增厚的功效
已知SEQ ID NO:1的肽(又名TPX-100)促进新软骨形成(参见美国专利号7888462和8426558)。
对于这种活性,在2期随机双盲安慰剂对照临床试验中,针对轻度至重度膝骨关节炎(OA)患者的软骨损伤情况,对SEQ ID NO:1肽的临床安全性和功效进行了测试。参见实施例。
该肽的预期临床益处是改善膝关节功能。如果肽能修复受损的软骨,维持活的软骨,和/或使软骨对老化的磨损更有弹性,那么可以预期更好的关节功能。
在治疗后6个月和12个月的时间点,通过KOOS ADL和WOMAC功能子量表测量的膝关节功能表明,与安慰剂治疗的膝(“对照膝”)相比,使用SEQ ID NO:1的肽治疗的膝(“指标膝”)的改善在临床上有意义且具有统计学意义(p=0.008)。见图1。
与对照膝相比,指标膝在KOOS的运动和休闲以及膝关节相关QOL子量表方面也显示出有临床意义和统计学意义的改善。见图2和3。
尽管12个月时,指标膝的KOOS疼痛子量表与对照膝相比仅表现出统计学上的改善趋势(p<0.09),但指标膝的疼痛频率和上下楼梯疼痛与对照膝相比有统计学意义的改善(p<0.05)。见图5和6。
关于临床研究的主要终点,即6个月时髌骨软骨厚度的变化,指标膝和对照膝之间没有统计学意义的差异。与基线相比,只有16%的髌骨软骨显示出任何变化,这限制了该测量的实际样本量。尽管如此,TPX-100所显示的强大的临床益处可合理归因于SEQ ID NO:1的肽带来的软骨修复、形成和/或稳定。
在事后分析中,在12个月时,通过KOOS ADL和WOMAC功能测量,观察到指标膝的胫股关节软骨厚度的积极变化与膝关节功能改善之间存在关联,而对照膝则没有(McGuire2018)。在迄今为止对DMOAD候选药物的众多临床研究中,这是第一次证明软骨积极改变与显著超过安慰剂组的临床益处相关。
本报告发表后,进行了进一步的分析。这些分析证实,治疗后12个月时,指标膝的胫股关节(TF)软骨厚度增加/稳定和膝关节功能改善显著相关,而对照(安慰剂暴露)膝则不相关。参见表1。
表1:治疗后6个月和12个月指标膝胫股关节软骨增厚/稳定与膝关节功能改善之间的相关性
根据这些结果,已经证实SEQ ID NO:1的肽改善膝OA患者的临床益处并增加/稳定TF软骨厚度。
由于与在以中重度膝OA为主的患者群体中使用SEQ ID NO:1的肽治疗相关的多种临床益处的有力发现,除了软骨形成/稳定之外的其他生物活性可能有助于该肽的疗效。
关节周围骨面积及形状分析
为了解决这个问题,我们测量并比较了指标膝和对照膝关节周围骨表面积和三维(3D)骨形状。
研究表明,在正常老化过程中,关节周围骨形状发生了可预测的改变,骨形状变化的加速与膝OA的发生和发展密切相关。关节周围骨形状变化的模式是发展OA的所有膝共同的。关节周围骨形状变平并且变不规则,骨表面积增大。这种骨形状变化早于发展OA的患者中可检测到的影像学改变标年(Reichenbach 2008)。
三维骨形状变化可以使用主动外观建模(AAM)量化。AAM支持使用对象表面上的多个锚定点(“主成分”)对对象的三维形状和外观进行编码。这些主成分在计算上描述了物体的特定三维形状。Neogi等(Neogi 2013)详细描述了使用AAM来表示股骨、胫骨和髌骨形状。
采用该方法,比较了国家卫生研究所骨关节炎倡议(OAI)招募的对象OA和非OA膝关节周围骨面积和骨形状变化。如Bowes等(Bowes 2015)和Hunter等(Hunter 2016)详细描述的,在四年的时间里比较了OA和非OA膝之间股骨、胫骨、髌骨和滑车股骨(与髌骨相连的股骨前亚区;这一区域也被称为髌股骨(PF))的骨面积百分比变化和骨形状得分变化的差异。所有区域的骨面积,无论OA状况,均显示出较基线增加。所有区域的骨形状评分也较基线有所增加。根据自然病程,变化是单向的和不可逆的。
OA膝各区域的骨面积增加率明显高于非OA膝。见图7。OA膝的关节周围骨在一年期间的测量结果显示,与非OA膝相比,OA膝的骨面积在统计学上显著增加(Bowes2015)。OA膝关节周围骨的骨形状评分增加速度也明显快于非OA膝。
TPX-100的临床试验结果,在研究期开始时(第0、7、14和21天)仅给药四次测试制品,此后不进行任何强化治疗,经iMorphics的AAM分析(www.imorphics.com)表明,与对照膝相比,指标(TPX-100治疗)膝关节周围三维骨形状和骨面积的变化速率较慢。测量软骨厚度所用的每个膝的MRI图像用于测量股骨外侧和内侧、滑车股骨外侧和内侧、胫骨外侧和内侧以及髌骨外侧和内侧的关节周围骨表面积。还利用相同的MRI图像测量股骨、滑车股骨、胫骨和髌骨的骨形状评分。
比较了来自目前的临床研究的指标膝和对照膝之间所有八个区域的关节周围骨面积变化。
来自临床研究的对照膝(安慰剂治疗的膝)显示,所有区域的关节周围骨面积都持续增加,与OAI自然史数据库中的OA膝相似。
6个月时,与对照膝相比,指标膝内侧股骨关节周围骨面积增加较少,有统计学意义的趋势(p=0.08)。图8显示给予测试制品后,分别在指标膝和对照膝中持续6个月和12个月的股骨内侧骨面积变化。
图9分别显示指标膝关节周围骨与对照膝关节周围骨的股骨外侧、髌骨外侧和髌骨内侧的骨面积变化。尽管这些比较并未显示治疗组之间的统计显著性差异,但值得注意的是,在前6个月内,所有区域的指标膝的骨面积变化几乎为零。
当比较三维骨形状变化时,与对照膝相比,指标膝的形状变化在统计学上显著减少。这种差异在6个月和12个月时都是显著的(分别p=0.005和0.007)。值得注意的是,前6个月指标膝的平均骨形状变化率为0.03,这与OAI数据库中非OA对象的平均骨形状变化率非常相似。见图10。
根据对参与OAI的人群的分析,随着年龄的增长,所有膝的骨面积都在不断增加,3D形状也在不断变化。这些变化在膝OA中加速。在OA中,减缓、阻滞或逆转这些骨变化将是具有疾病改变性的。
如前所述,与安慰剂治疗的膝相比,使用SEQ ID NO:1的肽治疗轻度至重度OA膝降低股骨中3D骨形状和骨面积变化率。这表明OA的进展被SEQ ID NO:1的肽延迟、阻滞或在某些情况下甚至逆转。在本研究中,SEQ ID NO:1的肽仅用于一个系列(第0、7、14和21天,4次)。如果周期性地重复给予SEQ ID NO:1的肽,例如,每几个月、每一年或两年等,则病理性3D骨形状和骨面积变化应在较长时间内减少或正常化。
这些数据还表明,用SEQ ID NO:1的肽治疗延迟、阻滞甚至逆转关节周围骨面积的增加,从而可延迟、阻滞或逆转OA进展,延迟或消除与自然老化相关的关节失能。
值得注意的是,使用SEQ ID NO:1的肽治疗后,病理性骨面积增加和关节周围骨3D形状变化的改变在相对短的时间内发生,即治疗后6个月和12个月。
令人惊讶的是,SEQ ID NO:1的肽在如此短的时间内减少了关节周围的病理性骨形状变化,尽管样本量相对较小,但治疗差异仍然是稳健的和有统计学意义的。
因为通过KOOS ADL、KOOS运动和休闲以及KOOS膝相关QOL来测量膝的临床益处在6个月、12个月或两者时对指标膝有利具有临床意义和统计学意义;并且与对照膝相比,通过关节周围骨结构变化测量的OA进展在指标膝中被延迟、阻滞或逆转,因此认为SEQ ID NO:1的肽通过改变关节周围骨结构变化来改变OA的病理生理学。
为了阐明SEQ ID NO:1的肽改善关节周围骨形状对临床益处的可能影响,采用皮尔森和斯皮尔曼统计分析方法进行相关分析。
在所有膝关节区域中,股骨是最大的关节周围骨。股骨结构的改变被认为在膝OA的病理生理和进展中具有重要影响。在给药后6个月内,SEQ ID NO:1的肽显著减少股骨的病理性3D骨形状变化(图10)。皮尔森和斯皮尔曼分析均表明,在使用SEQ ID NO:1的肽治疗的膝(指标膝)中,病理性股骨3D骨形状变化的减少与胫股(TF)软骨增厚/稳定之间存在相关性,在12个月时具有稳健的统计学意义。参见表2。整个TF软骨以及外侧和内侧TF和股骨髁软骨的软骨增厚/稳定与股骨3D骨形状变化的减少显著相关。6个月时,在整个TF区域、内侧TF区域和股骨髁中观察到显著相关的趋势。这些结果表明,SEQ ID NO:1的肽带来的病理性3D股骨骨形状变化的显著减少表现得相对较早(在前6个月),并且SEQ ID NO:1的肽诱导TF软骨增厚/稳定。12个月时,股骨病理性骨形状变化的减少与TF软骨的增加/稳定高度显著相关。
表2。治疗后6个月和12个月股骨病理性三维骨形状变化减少与胫股关节软骨增厚/稳定之间的相关性
对双侧胫股关节OA对象进行相同的分析(排除单独的髌股关节OA膝后),尽管样本量有限,在12个月时,在整个TF区域、内侧TF区域和股骨髁中,病理性股骨3D骨形状变化的减少与胫股(TF)软骨增厚/稳定之间存在统计学显著相关。参见表3。
在这些分析的任一项中,这些相关性仅在指标膝中发现,而在对照膝中未发现。
表3。双侧胫股关节OA对象治疗后6个月和12个月时股骨病理性三维骨形状变化减少与胫股关节软骨增厚/稳定之间的相关性
SEQ ID NO:1的肽减少髌骨病理性三维骨形状变化。12个月时,皮尔森和斯皮尔曼分析均显示,在使用SEQ ID NO:1的肽治疗的膝(指标膝)中,病理性髌骨3D骨形状变化的减少与疼痛频率之间显著相关。参见表4。在12个月的随访期内,对治疗的反应者的疼痛频率显著降低。见图11。在反应者组中,基线疼痛频率得分为3,表示“每日”疼痛。12个月时,评分提高了约1.5分,表明他们的疼痛频率降低到“半周”。在这项研究中,参与者的止痛药使用减少了62.5%。
此外,疼痛频率反应者组的髌骨三维骨形状变化在12个月内基本保持为零,而无反应者组则持续增加。从基线到12个月的髌骨三维骨形状变化显示两组间差异有高度统计学意义。见图12。
这些综合结果表明,SEQ ID NO:1的肽减少或可能逆转髌骨的病理性三维骨形状变化,从而显著减少膝关节疼痛频率和镇痛药的使用。
表4。指标膝治疗后12个月时髌骨病理性三维骨形状变化与疼痛频率降低之间的相关性
髌骨病理性三维骨形状变化减少与疼痛频率的改善之间的相关性在指标膝中得到证实,而在对照膝中没有。
髌骨的病理性三维骨形状变化没有被表征,股骨的也没有。尽管膝关节疼痛的严重程度与髌骨病理的严重程度最为一致(Joseph 2016),但本发明首次明确提出髌骨3D骨形状变化是OA膝关节疼痛的病理生理机制。在特定疼痛治疗的常规临床设置中,患者可以确定疼痛是否在治疗后短期内减轻。在这种通过延迟、阻滞或逆转病理性三维骨形状变化的疾病改变疗法中,疼痛减轻是由于对骨产生了结构性作用而发生的,根据目前的临床数据,这似乎需要几个月的时间。因此,监测这种治疗后的骨形状变化,为患者和护理人员提供有关预后的有用信息,例如患者目前的膝疼痛是否可以减轻或防止恶化和/或重复治疗是否可以进一步获益。通过减少病理性髌骨形状变化来治疗和预防膝关节疼痛是本发明最重要的组成部分之一。
综上所述,在膝OA患者中给予SEQ ID NO:1的肽可显著减缓甚至逆转多个膝关节腔的病理性关节周围3D骨形状变化,从而产生预期的临床益处,包括改善功能和减少膝关节疼痛的频率。在同一时程中,SEQ ID NO:1的肽对关节周围骨和软骨结构都有积极影响;因此,膝关节的两个组分中的病理性变化可以通过包含作为单一药物成分的SEQ ID NO:1的肽的治疗组合物来治疗。根据给药方案的不同,SEQ ID NO:1的肽不仅治疗OA,而且延缓、阻滞或逆转关节老化的病理性变化,表明该肽可以预防性地用于预防或延缓OA的发生。由于OA的基本机制对许多关节是共同的,因此SEQ ID NO:1的肽的治疗或预防性用途不限于膝关节OA,而是可以包括髋关节、踝关节、肘关节、肩关节、颈关节、脊柱、腕关节和指关节。此外,这种方法还可用于修复、重建或稳定受其他关节炎(如类风湿关节炎)影响的关节,在这些关节炎的疾病特异性原因(如自身免疫和炎症)已得到处理之后。
治疗骨关节炎的新方法
在上述总结的临床研究成果的基础上,建立了治疗骨关节炎(OA)的新方法。
该方法包括可延迟、阻滞或逆转病理性关节周围骨形状变化从而治疗OA的任何治疗干预。虽然OA患者参与OAI的自然史研究数据支持膝OA发生和进展的关节周围骨形状变化的病理学性质,但是本文所描述的临床研究结果首次证明这种与OA相关的自然不可逆的关节周围骨形状变化可以被延迟、阻滞甚至逆转。最重要的是,关节周围骨形状变化的延迟、阻滞或逆转与临床上有意义的患者益处相关,包括受影响关节的功能和疼痛。本发明在对照人体临床试验中证实,减缓病理性关节周围骨形状变化是可能的,并与膝OA的严重症状的改善相关。
该方法的一个重要组成部分包括向患有OA的患者注射治疗有效量的SEQ ID NO:1的肽的制剂,从而降低受影响关节的骨面积和骨形状变化速率。与非关节炎关节相比,骨关节炎关节周围骨显示出更快的骨面积增加和三维形状变化,因此降低这些变化的速率意味着延缓、阻滞甚至逆转OA的进展。这些关节周围骨结构的改变在可测量的软骨丢失之前就开始了,并在疾病的整个进展过程中持续,这种新的方法可以用于从发病到严重疾病的OA整个范围。
除了SEQ ID NO:1的肽外,其衍生自人类以外的其他物种(包括但不限于灵长类动物、犬、牛和鼠)的直系同源肽预期对人类和其他物种的关节周围骨结构变化具有类似的活性,因此在本发明的范围内。示例为SEQ ID NO:2-5的肽。
SEQ ID NO:1的肽的类似肽及其直系同源物,其被认为具有与SEQ ID NO:1的肽相似的生物活性,包括那些共享如SEQ ID NO:6所示的共同氨基酸序列的肽,也在本发明的范围内。
此外,由于已知膝在老化过程中经历关节周围骨面积增加和3D骨形状变化,因此该方法通过降低病理性关节周围骨面积和形状变化的速率,包括预防、延迟或阻滞否则增加OA风险的不可避免的过程。
该新方法特别适用于膝OA,正如实施例中所证明。
本发明的一个重要组成部分是通过延迟、阻滞或逆转髌骨中的三维骨形状变化来降低膝OA中膝关节疼痛频率的新方法。
含有SEQ ID NO:1的肽的药物组合物,其通过延迟、阻滞或逆转关节周围骨的病理结构变化来治疗OA,在本发明的范围内。
虽然本发明是基于膝OA患者的临床试验数据,但也适用于髋关节、踝关节、肘关节、肩关节、颈关节、脊柱、腕关节、手指等其他关节的OA,因为这些其他关节的关节周围骨结构也会发生类似的病变。
由于关节周围骨在许多关节疾病和紊乱中经常受损,并且由于SEQ ID NO:1的肽能够延迟、阻滞或逆转病理性关节周围骨结构变化,因此这种新方法可用于治疗OA以外的关节疾病,包括但不限于,类风湿性关节炎和外伤性关节炎。
实施例
提供以下实施例的目的是向本领域普通技术人员完整地公开和描述如何制备和使用本发明,这些实施例不意在限制发明人认为的发明范围,也不代表下述实验是所进行的所有或仅有的实验。努力保证所用数值(如量、温度等)的准确性,但应允许一些实验误差和偏差。除非另有说明,份数是重量份数,分子量是重量均分子量,温度是摄氏度,压力是大气压或接近大气压。
实施例1
TPX-100在膝骨关节炎患者中的随机双盲安慰剂对照研究
临床研究方法
研究大纲
设计了一项多中心、随机双盲、安慰剂对照的研究,旨在探讨双侧髌股膝骨关节炎对象每周给予四次TPX-100剂量的安全性、耐受性、药代动力学和疗效。这项研究是在美国FDA(美国食品和药物管理局)CDER(药物评价和研究中心)的开放IND(研究性新药申请)下进行的,符合GCP(良好临床实践)和ICH(人用药物注册技术要求协调国际会议)指南。美国十八(18)个骨科、风湿病和家庭实践中心参与了这项研究。
本研究分为A、B两部分。A部分旨在评估膝关节骨性关节炎对象关节内(I.A.)给予不同剂量水平(20、50、100或200mg/次连续组中的注射)的TPX-100的安全性,并为B部分选择剂量。B部分是评价所选剂量TPX-100的安全性和有效性。
A部分的对象被纳入连续组,并单膝(指标膝)随机接受20、50、100或200mg TPX-100并且在对侧(对照)膝接受相同安慰剂。对象、站点、主办方和中心MRI检视者对治疗分配不知情。安全审查委员会(SRC)对每个给药组的安全性进行评估。SRC评估了安全性,并确定是否可以加入下一个更高剂量的方案。在剂量选择和开始B部分之前,完成并分析A部分中的所有给药组的安全性。
A部分包括四(4)次关节内(I.A.)注射,一周一次,在20、50、10O和200mg TPX-100与安慰剂的连续给药组中。六(6)名对象分别入选20、50和100mg组,九(9)名对象入选200mg组。
根据安全性审查和SRC的批准,为B部分选择200mg剂量。此剂量或A部分研究的3个低剂量没有剂量限制毒性。87名对象登记在B部分(200mg剂量)。根据统计分析计划,将这些对象与A部分200mg组中的9名对象合并进行疗效分析。总共分析了93名对象的药物疗效数据,每个对象在指标膝接受4次每周一次的200mg/剂量的TPX-100注射,在对侧膝接受相同的安慰剂,随机分配。
在A部分和B部分中,对象在膝接受4次,每周一次剂量的活性药物,随机分为指标膝的活性药物和对侧(对照)膝的安慰剂,通过关节内途径给药。没有给予其他剂量的药物或安慰剂。所有对象在第一次给药后3个月、6个月和12个月访问各自的临床站点,进行安全性和疗效评估。
对象筛选
获得知情同意后,对象接受临床和实验室筛选评估,评估其初步研究资格。筛查包括以下程序:
·包括药史的病史
·聚焦身体检查
·包括静息血压、脉搏、呼吸率和体温的生命体征
·体重,身高和BMI
膝的X-射线(如果没有在3个月的筛选内获得)
包括血液学、凝血概况、全面代谢组等的实验室评估
·伴随用药记录
满足全部临床和实验室适格标准的对象经历标准双侧膝MRI。
纳入和排除标准
筛选A部分或B部分对象的纳入和排除标准如下:
纳入标准
1.年龄≥25且≤75
2.轻度至中度双膝髌股骨关节炎,半月板完整,韧带稳定(十字韧带和副韧带)
·临床上,通过筛选问卷,主要研究员判断(可由膝的成像研究支持)确定;通过两膝的中心读取筛选MRI确认,ICRS 1-3级,或4级,只有局灶性缺损,没有缺损超过1cm。
·半月板完整(MRI退变信号最多并且包括可接受的II级)
·由临床检查定义的十字韧带和副韧带稳定
3.能够阅读、理解、签署对象知情同意书并注明日期
4.只使用对乙酰氨基酚作为主要镇痛(止痛)研究药物的意愿。对乙酰氨基酚的最大剂量不得超过4克/天(4000mg/天)。
5.愿意在注射期间(研究第30天)仅使用氢可酮/对乙酰氨基酚或单独使用氢可酮治疗突破性疼痛。
6.在研究的前30天不使用非甾体抗炎药,如阿司匹林、布洛芬或萘普生(NSAIDS)的意愿。
7.性活跃(非禁欲)的有生育潜力的女性对象在参与研究时必须同意并遵守两种高效的避孕方法(口服避孕药、植入物、可注射或留置宫内节育器、含杀精剂的避孕套或性禁欲)。
排除标准
1.MRI禁忌症,包括:大脑、眼睛或椎管内的金属碎片、夹或装置;磁程序植入装置;体重>300磅;中度或重度幽闭恐怖症;既往MRI程序不耐受
2.ICRS大于3级,中心读取筛选MRI证实局灶性缺损不大于1cm的4级除外
3.炎性或肥大性滑膜炎或显著软骨钙化的MRI证据
4.以前有过膝盖手术,不包括清创手术
5.膝关节置换术或计划在未来12个月内进行的任何其他膝关节手术
6.类风湿性关节炎、银屑病性关节炎或任何其他自身免疫性或传染性关节炎病史
7.膝关节积液>2+,符合以下临床量表:
0=下冲程时不产生波
痕量=下冲程时内侧小波
1+=下冲程时内侧较大的凸起
2+=上冲程后积液自发回到内侧(无需下冲程)
3+=液体过多,无法将渗出液移出膝盖内侧
8.不到筛选前3个月,最后一次黏性补给(例如
9.不到筛选前2个月,最后一次膝关节内注射皮质类固醇
10.在筛选前一个月内使用任何类固醇(因呼吸问题吸入糖皮质激素除外)
11.已知对TPX-100过敏
12.已知对扑热息痛或氢可酮过敏
13.筛选前3个月内任何一膝镜检查史
14.筛选前一年任一膝关节的化脓性关节炎、痛风或假性痛风病史
15.急性半月板撕裂的临床症状(如与半月板撕裂一致的闭锁或新的急性机械症状)
16.髌骨软骨钙质沉着症的X射线表现
17.皮肤问题、皮疹或过敏,影响注射部位的任一膝
18.出血问题,血小板或凝血不足,禁止关节内注射
19.活动性全身感染
20.当前或筛选访视前2年内除皮肤基底细胞癌或鳞状细胞癌以外的任何恶性肿瘤的治疗,除非主办方的医学监护人员提供了特别书面许可
21.怀孕、哺乳或计划怀孕的有生育潜力的妇女,以及不同意在整个研究期间继续采用可接受的节育方法的妇女
22.在筛选前一年内参与其他临床骨关节炎药物研究(镇痛药研究除外)
23.目前正在摄取紫杉醇(有丝分裂抑制剂)和/或纳他珠单抗(抗整合素)。
24.有严重肝病史或每天饮酒超过3杯。(饮酒一杯的定义:12盎司啤酒、8盎司麦芽酒、5盎司葡萄酒、1.5盎司或一“子单杯”80度蒸馏酒(如杜松子酒、朗姆酒、伏特加或威士忌))。
随机化
如果符合所有临床纳入和排除标准,则获得两个膝的MRI,并由中心检视者进行评估,以确定每个膝的ICRS等级(gICRS)作为最终筛选标准。如果双膝髌股关节腔的软骨在ICRS等级1-3级范围内,或仅有不大于1cm的小局灶性缺损的4级,则对象被登记。随机化中心将每个对象随机分为“右膝活动”或“左膝活动”。活动膝接受TPX-100,对侧膝接受相同的安慰剂。
对于招募的对象,进行对象内随机分组,一只膝接受活性药物注射,对侧膝接受相同的安慰剂注射。当一个人的两个膝形成一个匹配的集合时,个体水平的混杂因素(如活动水平、遗传和表观遗传因素、痛阈)的影响被消除,从而增加了研究检测治疗效果的能力(如果存在)。
随机分为A部分的对象被排除在B部分的招募之外。
给药
在第一个给药日,随机化的对象通过体检和生命体征进行评估。此外,他们完成了膝关节损伤和骨关节炎转归评分(KOOS),其包括西安大略省和麦克马斯特大学骨关节炎指数(WOMAC)。KOOS问卷评估了膝关节特异性的日常生活、运动和休闲活动、膝相关的生活质量、其他症状,如僵硬和膝关节疼痛。KOOS已广泛用于膝骨关节炎的纵向研究。评估完成后,对象在每个膝接受一次关节内注射,每次注射均从该膝关节标记的小瓶中制备。一只膝接受TPX-100,对侧膝接受安慰剂,对象、部位和主办方对治疗分配不知情。对象在注射期间和注射后的几个小时内接受不良事件监测。注射后还监测了生命体征。
在第一次给药后的第7天、第14天和第21天,对象分别接受第二次、第三次和第四次(最后一次)相同研究材料的给药。从第一个给药日开始进行安全性和不良事件评估。
治疗后随访
对象在第一个给药日后3个月、6个月和12个月返回各自的研究地点进行随访评估。此外,研究地点在第一天给药9个月后通过电话联系监测对象的情况。在治疗后的3个月、6个月和12个月内,通过体检、生命体征、血清化学以及完成患者报告的转归(包括KOOS)对对象进行现场评估。记录不良事件和伴随用药。在6个月和12个月的随访中获得双膝MRI。
疗效分析
分析所有KOOS子量表评分、WOMAC总分和子量表评分、基于MRI的髌股和胫股软骨厚度、基于MRI的关节周围骨面积和3D骨形状。
MRI图像被提供给中心检视者用于软骨和关节周围骨测量。中心检视者对治疗分配不知情。
利用iMorphics开发的专门用于评估骨关节炎膝关节的关节周围骨的骨面积和三维形状的AAM软件(www.imorphics.com)对这些参数进行分析。
在5%显著性水平下,采用双侧配对t检验进行统计分析。转归变量是与安慰剂暴露的膝(“对照膝”)相比,治疗的膝(“指标膝”)从基线到6个月和12个月时,KOOS各子量表得分变化、软骨厚度变化、关节周围骨面积变化和3D骨形状得分(“B得分”)变化的差异。
关于任何两个选定参数(如膝关节功能与软骨厚度)之间可能存在的相关性,采用皮尔逊和斯皮尔曼相关分析对其进行检验。
结果
根据统计学分析计划,93名对象被纳入疗效分析,这些对象单膝接受200mg/剂量的TPX-100治疗,对侧膝接受安慰剂治疗,并且至少进行了一次随访MRI。
全部膝中约47%具有gICRS 4(最严重的)膝OA,均位于胫股(TF)腔。另外约40%的患者在髌股关节(PF)和/或TF腔有gICRS 3(次严重)膝OA,其余约20%的患者在一个或两个膝中有gICRS 2(中度)PF和/或TF。没有具有gICRS 1(轻度)膝OA的对象。所有对象的平均体重指数(BMI)均超过30,属于肥胖范围,与美国OA人群的平均BMI一致。对象的平均年龄为58.1岁,58%的对象为女性,也与美国OA人群的人口统计学一致。大多数对象的一个或两个膝有严重OA。
TPX-100治疗安全,耐受性好。没有出现与TPX-100治疗相关的严重不良事件。治疗相关的不良事件是轻度或中度的,短暂的,并且在基线时在许多对象中是常见的。
包括大多数KOOS子量表在内的一些患者报告的转归(PRO)显示,与对照(安慰剂暴露)膝相比,指标(TPX-100治疗)膝有临床意义和统计学意义的改善。
KOOS ADL(日常生活活动中的功能)子量表由17个问题组成,这些问题涉及对日常膝关节功能至关重要的各种日常活动。在6个月和12个月的时间点上,KOOS-ADL域的结果显示,与对照膝相比,指标膝的改善具有临床意义和统计学意义(p<0.05)。见图1。由与KOOS-ADL相同的问题组成的WOMAC功能子量表,毫不奇怪的显示与对照膝相比,指标膝也有同样稳健的改善。
KOOS运动和休闲子量表包括五个与体育活动有关的问题,如跳跃、跑步和蹲坐。在6个月时,KOOS运动和休闲显示与对照膝相比,指标膝的改善具有临床意义和统计学意义。见图2。
KOOS膝相关生活质量(QOL)子量表由四个问题组成,包括对象膝的一般困难和对问题的认识(对于其每个膝的信心)。在12个月时,KOOS膝相关QOL显示与对照膝相比,指标膝的改善具有临床意义和统计学意义。见图3。
KOOS疼痛子量表由9个问题组成,关于1)疼痛频率和2)不同活动中的疼痛量。见图4。在12个月时,KOOS疼痛子量表显示,与对照膝相比,指标膝的改善具有临床意义,且有统计学意义的趋势(p<0.09)。WOMAC疼痛域由图4中的问题6-9组成,与对照膝相比,12个月时指标膝的改善有临床意义,尽管差异没有达到具有统计学意义的程度。
构成KOOS疼痛(和WOMAC疼痛)子量表的问题之一是“上下楼梯疼痛”。这种常见活动中的疼痛是膝OA患者最常见的主诉之一,12个月时,与对照膝相比,指标膝疼痛明显改善(p<0.05)。见图5。
KOOS疼痛子量表(问题1)中的一个问题是,“你多久经历一次右膝/左膝疼痛?”这是唯一与疼痛频率有关的问题。这个问题是KOOS疼痛子量表独有的,不包括在WOMAC疼痛域中。12个月时,与对照膝相比,指标膝疼痛频率显著降低(p<0.05)。见图6。
通过MRI测量6个月时髌股软骨厚度相对于基线的变化是主要疗效转归度量。在6个月或12个月时,指标膝和对照膝之间没有可测量的差异。在12个月的研究期间,绝大多数(84%)的膝的髌股关节腔的软骨厚度变化小于最小可检测变化。由于只有16%的膝显示出软骨的可测量变化,无论是增加还是减少,有效样本量明显有限,检测治疗差异的能力也相应较低。
同样,在6个月或12个月的时间点,指标膝和对照膝的整体胫股软骨厚度相对于基线的变化之间无可测量的差异。然而,根据KOOS-ADL和WOMAC功能域的测量,在功能改善的膝中,胫股软骨厚度增加或稳定与12个月时指标膝的膝关节功能改善显著相关。在对照膝中没有发现这种相关性。参见表1。
也比较了指标膝组和对照膝组之间通过MRI测量的关节周围骨面积和三维骨形状的变化的差异。值得注意的是,有8名对象的MRI图像质量不高,被排除在骨面积和形状分析之外。因此,每个可评估的治疗组由85个膝组成。
显示在股骨内侧,6个月时,与对照膝相比,指标膝的病理性骨面积增加较少,有统计学意义的趋势(p=0.08)。见图8。
在股骨外侧、髌骨外侧和内侧,前6个月指标膝的病理性骨面积增加几乎为零,与对照膝相比,12个月时增加较慢。见图9。
这些数据表明,用SEQ ID NO:1的肽治疗膝OA可以延缓、阻滞甚至逆转膝关节周围骨面积的增加,这与OA的发生和发展有关。
在6个月和12个月时,与对照膝相比,通过骨形状(B)评分量化的股骨关节周围三维骨形状变化显示有利于指标膝的统计学显著性差异(p<0.05)。见图10。
虽然没有统计学上的显著差异,但是胫骨和髌骨的三维关节周围骨形状变化也表明,与对照膝相比,指标膝的变化较慢。这些数据还表明,用SEQ ID NO:1的肽治疗膝OA延缓、阻滞或逆转膝OA进展的病理性关节周围骨结构变化。
如表1所示,胫股关节软骨增厚/稳定与指标膝的KOOS-ADL/WOMAC功能改善显著相关,但在对照膝中则不是。进一步分析表明,在指标膝中股骨关节周围三维骨形状变化较少与胫股关节软骨增厚/稳定显著相关,而在对照膝中则没有。见表2和3。这些结果表明,用SEQ ID NO:1的肽治疗膝OA患者减缓股骨关节周围骨形状的病理改变,增加/稳定胫股关节软骨厚度,同时改善膝关节功能。
在症状性膝OA的文献中,髌股关节病理学与疼痛主诉最明显相关。在指标膝中,而不是在对照膝中,较慢的髌骨形状变化与疼痛频率降低显著相关。参见表4。
此外,对TPX-100的反应者表现出疼痛频率的稳健改善,平均而言,疼痛频率从基线时的每日疼痛降低到12个月时的半月疼痛。见图11。疼痛频率的稳健改善也与髌骨三维骨形状最终没有改变有关。见图12。值得注意的是,在12个月的研究期间,总的镇痛药使用量减少了62.5%。
根据这些轻至重度膝OA患者的临床数据,SEQ ID NO:1的肽显著减少、阻滞甚至逆转膝关节多个腔室的病理性关节周围骨结构变化,并为患者提供关键益处,包括改善膝关节功能和疼痛。
实施例2膝骨关节炎患者中TPX-100的随机双盲安慰剂对照研究-应用于MRI图像质量的更严格鉴定标准的数据分析
目标
在实施例1中的数据分析之后,对稍多的MRI图像的技术质量提出了质疑,以便能够评估关节周围骨形状随时间的变化。为了确保总体分析结果的质量,对实施例1中使用的MRI图像应用更严格鉴定标准,并进行再鉴定。79名对象被再鉴定。以与实施例1所述相同的方式,分别对这些对象的MRI膝图像进行重新分析以确定其关节周围骨形状变化,以及其与胫股软骨厚度和疼痛变化的相关性。
结果
再鉴定的79名对象按照统计分析计划纳入疗效分析。
全部膝中约34%有gICRS 4(最严重的)膝OA,均位于胫股(TF)腔。另外约44%的患者在髌股关节(PF)和/或TF腔有gICRS 3膝OA,其余约22%的患者在一个或两个膝中有gICRS 2(中度)PF和/或TF。患者的人口统计学与实施例1非常相似;平均体重指数(BMI)为30.9,平均年龄为58.1岁,女性占62%。
所有指标(TPX-100治疗)膝的膝关节功能和生活质量(QOL)相关患者报告的转归(PRO)在6个月或12个月或两个时间点与对照(安慰剂暴露)膝相比表现出具有临床意义和统计显著性(p<0.05)的改善:KOOS ADL(日常生活活动功能),WOMAC功能和KOOS膝相关QOL。
KOOS疼痛子量表也显示出与实施例1相似的结果:12个月时,与对照膝相比,指标膝的临床意义改善有统计学意义的趋势(p<0.09)。
在构成KOOS疼痛子量表的9个问题中,12个月时,与对照膝相比,指标膝的疼痛频率、完全弯曲膝关节的疼痛和上下楼梯疼痛显著改善(p<0.05)。
关于骨形状评分量化的关节周围三维骨形状变化,在6个月和12个月时,与对照膝相比,指标膝的股骨骨形状变化延迟有统计学意义(p<0.05)。见图13。
如表5所示,在指标膝中股骨关节周围三维骨形状变化较少与胫股关节软骨增厚/稳定显著相关,而在对照膝中则没有。
表5。治疗后6个月和12个月股骨病理性三维骨形状变化减少与胫股关节软骨增厚/稳定之间的相关性
在指标膝中,而不是在对照膝中,较慢的髌骨形状变化与疼痛频率降低显著相关。参见表6。
表6。指标膝治疗后12个月时髌骨病理性三维骨形状变化与疼痛频率降低之间的相关性
此外,对TPX-100的反应者表现出疼痛频率的稳健改善,平均而言,疼痛频率从基线时的每日疼痛降低到12个月时的半月疼痛。见图14。疼痛频率的稳健改善也与髌骨三维骨形状最终没有改变有关。见图15。
在本实施例2中,通过对MRI图像的质量进行更严格控制的数据集,获得了与实施例1非常相似的结果。根据这些数据,SEQ ID NO:1的肽显著减少、阻滞甚至逆转膝关节多个腔室的病理性关节周围骨结构变化,并为患者提供关键益处,包括改善膝关节功能和疼痛。
参考文献Bowes MA,Vincent GR,Wolstenholme CB,Conaghan PG.一种新的骨面积测量方法为骨关节炎及其进展提供了新的见解(A novel method for bone areameasurement provides new insights into osteoarthritis and its progression).Ann Rheum Dis 2015;74:519-525.
Buckwalter JA.关节软骨损伤(Articular cartilage injuries).Clin OrthopRelat Res 2002;21-37
Chevalier X,等,有症状的原发性膝关节骨关节炎对象中6cc hylan G-F 20单关节内治疗:一项随机、多中心、双盲、安慰剂对照试验(Single,intra-articular treatmentwith 6cc hylan G-F 20in subjects with symptomatic primary osteoarthritis ofthe knee:a randomized,multi-centre,double-blind,placebo-controlled trial).AnnRheum Dis 2010;69:113-119.
Cohen MD.膝OA的透明质酸治疗(黏液补给)(Hyaluronic acid treatment(viscosupplementation)for OA of the knee).Bull Rheum Dis.1998;47;4-7.
Davies AP,Vince AS,Shepstone L,Donell ST,Glasgow MM.,髌股骨关节炎的影像学患病率(The Radiographic Prevalence of Patellofemoral Osteoarthritis).Clinical Orthopaedics and Related Research 2002;402:206-212
Dube B,Bowes MA,Barr AJ,Hensor EM,Kingsbury SR,Conaghan PG.,骨关节炎骨病理学、骨髓病变和三维骨形状两种不同测量方法之间的关系:来自骨关节炎倡议的数据(The relationship between two different measures of osteoarthritis bonepathology,bone marrow lesions and 3D bone shape:data from the osteoarthritisinitiative).Osteoarthritis and Cartilage 2018;26:1333-1337
FDA(美国卫生和公众服务部,食品和药物管理局).骨关节炎:药物、器械和生物制品开发的结构终点,用于工业治疗指导(Osteoarthritis:Structural Endpoints for theDevelopment of Drugs,Devices,and Biological Products for Treatment Guidancefor Industry).DRAFT GUIDANCE 2018年8月
Felson DT,Hannan MT,Naimark A,Berkeley J,Gordon g,Wilson PW,等,职业生理需求,膝关节弯曲和膝骨关节炎:Framingham研究的结果(Occupational PhysicalDemands,knee bending,and knee osteoarthritis:results from the FraminghamStudy).J Rheumatol.1991;18:1587-92.
Guermazi A,Kalsi G,Niu J,Crema MD,Copeland RO,Orlando A,Noh MJ,RoemerFW.关节内TGF-β1对中晚期膝骨关节炎的结构影响:随机对照试验中基于MRI的评估(Structural effects of intra-articular TGF-β1in moderate to advanced kneeosteoarthritis:MRI-based assessment in a randomized controlled trial).BMCMusculoskeletal Disord 2017;18:461
Haj-Mirzaian A,Guermazi A,Roemer FW,Bowes MA,Conaghan PG,Demehri S.双膦酸盐摄入量及其与关节周围骨面积和三维形状变化的关系:来自骨关节炎倡议(OAI)的数据(Bisphosphonates intake and its association with changes of periarticularbone area and three-dimensional shape:data from the osteoarthritis Initiative(OAI)).Osteoarthritis and Cartilage 2018;26:564-568
Hardcastle SA,Gregson CL,Deere KC Smith GD,Dieppe P,Tobias JH.高骨量与关节置换率增加相关:一项病例对照研究(High bone mass is associate with anincreased prevalence of joint replacement:a case-control study).Rheumatology2013;52:1042-1051
Hayashibara T,Hiraga T,Yi B,Nomizu M,Kumagai Y,Nishimura R,Yoneda T.人MEPE的合成肽片段在体外和体内刺激新骨形成(A synthetic peptide fragment ofhuman MEPE stimulates new bone formation in vitro and in vivo).JBMR 2004;19:455
Hellio le Graverand MP,Clemmer RS,Redifer P,Brunell RM,Hayes CW,Brandt KD,Abramson SB,Manning PT,Miller CG,Vignon E.症状性膝关节骨关节炎患者中口服选择性iNOS抑制剂辛尼司他(SD-6010)的2年随机、双盲、安慰剂对照、多中心研究(A2-year randomized,double-blind,placebo-controlled,multicenter study of oralselective iNOS inhibitor,cindunistat (SD-6010),in patients with symptomaticosteoarthritis of the knee).Ann Rheum Dis2013;72:187-195
Hochberg MC,Guermazi A,Guehring H,Aydemir A,Wax S,Fleuranceau-MorelP,Bihlet AR,Byrjalsen I,Andersen JR,Eckstein F.关节内注射斯非福明治疗症状性膝骨关节炎的疗效和安全性:一项为期5年的随机、安慰剂对照、2期研究的2年初步分析结果(Efficacy and safety of intra-articular Sprifermin in symptomaticradiographic knee osteoarthritis:results of the 2-year primary analysis froma 5-year randomized,placebo-controlled,Phase 2study).Arthritis Rheumatol2017;69(增刊10):1L
Hochberg MC,Guermazi A,Guehring H,Aydemir A,Wax S,Fleuranceau-MorelP,Bihlet AR,Byrjalsen I,Andersen JR,Eckstein F.关节内注射斯非福明治疗症状性膝骨关节炎的疗效和安全性:一项5年随机、安慰剂对照、II期研究的3年数据预先分析(Efficacy and safety ofintra-articular Sprifermin in symptomatic radiographicknee osteoarthritis:pre-specified analysis of3-year data from a5-yearrandomized,placebo-controlled,Phase II study).Osteoarthritis and Cartilage2018;26:S32
Hunter D,Nevitt M,Lynch J,Kraus VB,Katz JN,Collins JE,Bowes M,Guermazi A,Roemer FW,Losina E.关节周围骨面积和三维形状作为膝OA进展生物标志物的纵向验证?数据来自FNIH OA生物标志物联盟(Longitudinal validation ofperiarticular bone area and 3D shape as biomarkers for knee OA progression?Data from the FNIH OA Biomarkers Consortium).Ann Rheum Dis 2016;75:1607-1614.
Joseph GB,Hou SW,Nardo L,Heilmeier U,Nevitt MC,McCulloch CE,LinkTM.48个月内发生膝关节疼痛的MRI表现:来自骨关节炎倡议的数据(MRI findingsassociated with development of incident knee pain over 48moBths:data from theosteoarthritis initiative).Skeletal Radiol.2016;45(5):653-660
Karsdal MA,Byrjalsen I,Alexandersen P,Bihlet A,Andersen JR,Riis BJ,Bay-Jensen AC,Christiansen C.口服鲑鱼降钙素治疗症状性膝骨关节炎:两个3期试验的结果(Treatment of symptomatic knee osteoarthritis with oral salmoncalcitonin:results from two phase 3trials).Osteoarthritis Cartilage 2015;23(4):532
Krsezki P,Buckland-Wright C,Balint G,Cline GA,Stoner K,Lyon R,BearyJ,Aronstein WS,Spector TD.Arthritis Res Ther 2007;9(5):R109
Laslett LL,Dore DA,Quinn SJ,Boon P,Ryan E,Winzenberg TM,Jones G.唑仑膦酸在1年内减轻膝关节疼痛和骨髓病灶:一项随机对照试验(Zolendronic acid reducesknee pain and bone marrow lesions over 1year:a randomized contr0lled trial).Ann Rheum Dis 2012;71:1322-8
Lazarov M,Shih MS,Gerome C,Blacher R,Kumagai Y,Rosen DM.AC-100是MEPE的一个片段,在大鼠模型中促进骨折愈合(AC-100,a fragment of MEPE,promotesfracture healing in a rat model).ASBMR 2004
Lazarov M,Fellmann J,Rosen DM,DenBesten PK,Pameijer CH.AC-100,促进人类牙本质形成的新生物学方法(AC-100,novel biological approach to promotingdentin formation in humans).AADR 2006
McAlindon TE,LaValley MP,Harvey WF,Price LL,Driban JB,Zhang M,WardRJ.关节内曲安奈德与生理盐水对膝骨关节炎患者膝关节软骨体积和疼痛的影响——一项随机临床试验(Effect of Intra-articular triamcinolone vs saline on kneecartilage volume and pain in patients with knee osteoarthritis-a randomizedclinical trial).JAMA 2017;317(19):1967-1975.doi:10.1001/jama.2017.5283
McGuire D,Lane N,Segal N,Metyas S,Barthel HR,Miller M,Rosen D,KumagaiY.关节内TPX-100治疗后膝关节功能显著持续改善:一项双盲、随机、多中心、安慰剂对照的2期试验(Significant,sustained improvement in knee function after intra-articular TPX-100:A double-blind,randomized,multi-center,placebo-controlledPhase 2trial).Arthritis Rheumatol 2017;69(增刊10):13L.
McGuire D,Segal N,Metyas S,Barthel HR,Miller M,Rosen D,Kumagai Y.膝关节骨关节炎的关节内TPX-100∶6个月和12个月时稳健的功能反应与胫股软骨厚度增加有关(Intra-articular TPX-100in knee osteoarthritis:Robust functional response at6and 12months is associated with increased tibiofemoral cartilage thickness).Arthritis Rhematol 2018;70(增刊10).:L16
Neogi T,Bowes M,Niu J,De Souza K,Vincent G,Goggins J,Zhang Y,FelsonDT.基于MRI的膝关节三维骨形状预测膝关节骨关节炎的发病:来自骨关节炎倡议的数据(MRI-based three-dimensional bone shape of the knee predicts onset of kneeosteoarthritis:Data from the Osteoarthritis Initiative).Arthritis Rheum.2013;65(8):2048-2058
Nevitt,M,Zhang Y,Javaid,MK,Neogi T,Curtis JR,Niu J,McCulloch CE,SegalNA,Felson DT.高全身骨密度增加了膝OA和关节间隙变窄的风险,但不是现有膝关节骨性关节炎的影像学进展:MOST研究(High systemic bone mineral density increases therisk of incident knee OA and joint space narrowing,but not radiographicprogression of existing knee OA:The MOST study).Ann Rheum Dis.2010;69(1):163-168
Niemeyer,MD,等,自体软骨细胞植入治疗膝关节软骨缺损后的特征性并发症(Characteristic Complications After Autologous Chondrocyte Implantation forCartilage Defects of the Knee Joint).Am J Sports Med 2008;36:2091-2099
Reginster JY,Badurski J,Bellamy N,Bensen W,Chapurlat R,Chevalier X,Christiansen C,Genant H,Navarro F,Nasonov e,Sambrook PN,Spector TD,Cooper C.雷奈酸锶治疗膝骨关节炎的疗效和安全性:一项双盲、随机安慰剂对照试验的结果(Efficacy and safety of strontium ranelate in the treatment of kneeosteoarthritis:results of a double-blind,randomized placebo-controlledtrial).Ann Rheum Dis 2013;72:179-186.
Reichenbach S,Guermazi A,Niu J,Neogi T,Hunter DJ,Roemer FW,McLennanCE,Hernandez-Molina G,Felson DT.社区人群膝关节X射线片和MRI骨磨损的患病率(Prevalence of Bone Attrition on Knee Radiographs and MRI in a Community-based Cohort).Osteoarthritis Cartilage 2008;16(9):1005-1010
Sandmark H.Hogstedt C,Vingord E.男性和女性的原发性膝关节骨性关节炎,是由于终身的工作负荷所致(Primary osteoarthritis of the knee in men and women asa result of lifelong physical load from work).Scand J Work Environ Health2000;26:20-5.
Six N,Septier D.,Chaussain-Miller C,Blacher R,DenBesten P,GoldbergM.Dentonin是MEPE的一个片段,它能启动牙髓对损伤的修复反应(Dentonin,a MEPEFragment,Initiates Pulp-healing Response to Injury).J Dent Res 2007;86(8):780-785
Woolf AD,Pfleger B,主要肌肉骨骼疾病负担(Burden of majormusculoskeletal conditions).Bulletin of the World Health Organization 2003;81(9):646-656.
Zaslav K,等,膝关节软骨缺损治疗失败对象的自体软骨细胞植入的前瞻性研究:关节修复治疗研究(STAR)临床试验结果(A prospective study of autologouschondrocyte implantation in subjects with failed prior treatment forarticular cartilage defect of the knee:Results of the Study of the Treatmentof Articular Repair(STAR)clinical trial).Am J Sports Med.2009;37:42-55.
前述内容只是说明本发明的原理。应理解,本领域技术人员能够设计各种安排,虽然本文没有明确描述或显示这些安排,但它们均体现本发明的原理并包含在本发明构思和范围内。而且,本文所述的所有实施例和条件语言主要旨在辅助读者理解本发明的原理和本发明对发展现有技术作出的贡献,且不对这些具体引用的实施例和条件构成限制。而且,本文有关本发明原理、方面、实施方式以及具体实施例的所有陈述都应包括其结构和功能等同物。此外,这些等同物应包括目前已知的等同物和将来开发的等同物,即新开发的具有相同功能的任何元件,无论其是何种结构。因此,本发明的范围不应仅限于本文所示和所述的示范性实施方式。适当的是,本发明的范围和构思由所附权利要求书限定。
序列表
<110> 熊谷是成(Kumagai, Yoshinari)
D·麦克圭尔(McGuire, Dawn)
M·米勒(Miller, Meghan)
D·罗森(Rosen, David)
<120> 治疗骨关节炎的方法
<130> BEAR-019WO
<150> US 62/838,712
<151> 2019-04-25
<150> US 62/811,366
<151> 2019-02-27
<150> US 62/787,881
<151> 2019-01-03
<150> US 62/775,056
<151> 2018-12-04
<160> 6
<170> PatentIn version 3.5
<210> 1
<211> 23
<212> PRT
<213> 人工序列
<220>
<223> 合成序列
<400> 1
Thr Asp Leu Gln Glu Arg Gly Asp Asn Asp Ile Ser Pro Phe Ser Gly
1 5 10 15
Asp Gly Gln Pro Phe Lys Asp
20
<210> 2
<211> 23
<212> PRT
<213> 人工序列
<220>
<223> 合成序列
<400> 2
Thr Asp Leu Gln Glu Arg Gly Asp Asn Asp Met Ser Pro Phe Ser Gly
1 5 10 15
Asp Gly Gln Pro Phe Lys Asp
20
<210> 3
<211> 23
<212> PRT
<213> 人工序列
<220>
<223> 合成序列
<400> 3
Pro Asp Leu Gln Glu Arg Gly Asp Asn Asp Ile Ser Pro Phe Ser Gly
1 5 10 15
Asp Gly Gln Pro Phe Lys Asp
20
<210> 4
<211> 23
<212> PRT
<213> 人工序列
<220>
<223> 合成序列
<400> 4
Pro Asp Leu Gln Gly Arg Gly Asp Asn Asp Leu Ser Pro Phe Ser Gly
1 5 10 15
Asp Gly Pro Pro Phe Lys Asp
20
<210> 5
<211> 23
<212> PRT
<213> 人工序列
<220>
<223> 合成序列
<400> 5
Pro Asp Leu Leu Val Arg Gly Asp Asn Asp Val Pro Pro Phe Ser Gly
1 5 10 15
Asp Gly Gln His Phe Met His
20
<210> 6
<211> 20
<212> PRT
<213> 人工序列
<220>
<223> 合成序列
<220>
<221> misc_feature
<222> (3)..(4)
<223> Xaa可以是任何天然氨基酸
<220>
<221> misc_feature
<222> (10)..(11)
<223> Xaa可以是任何天然氨基酸
<220>
<221> misc_feature
<222> (18)..(19)
<223> Xaa可以是任何天然氨基酸
<400> 6
Asp Leu Xaa Xaa Arg Gly Asp Asn Asp Xaa Xaa Pro Phe Ser Gly Asp
1 5 10 15
Gly Xaa Xaa Phe
20
- 一种用于治疗膝骨关节炎的间充质干细胞制剂及其研究方法
- 一种专用于治疗骨关节炎的干细胞制剂注射剂瓶
