一种增强细胞干性的小分子组合物及其应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及生物医药技术领域,尤其涉及一种增强细胞干性的小分子组合物及其应用。
背景技术
天然小分子化合物是可以从动植物体内提取到的活性成分,其参与多种细胞活动,能够特异性、可逆性调节细胞代谢途径。有研究表明,小分子化合物可以诱导小鼠胚胎成纤维细胞转变为多能干细胞,具有安全性高、成本低和易操作的优势(Hou P,Li Y,ZhangX,et al.Pluripotent stem cells induced from mouse somatic cells by small-molecule compounds[J].Science,2013,341(6146):651-654.)。β-烟酰胺单核苷酸是一种自然存在的生物活性核苷酸,广泛参与人体多项免疫、代谢反应。有研究表明,β-烟酰胺单核苷酸可以促进间充质干细胞在体内外的增殖,促进其在骨损伤中的疗效。甜菜碱普遍存在于动植物体内,在营养物质的代谢中起着至关重要的作用。
Oct-4基因主要表达于胚胎干细胞及生殖干细胞中,对于维持胚胎干细胞的多潜能性和自我更新具有极其重要的作用,也是产生诱导多能干细胞的必要因子。Nanog主要在胚泡的内细胞团中表达,其与细胞的分裂、分化情况以及细胞的干细胞特性密切相关。在细胞的培养过程中可通过检测Oct-4基因和Nanog基因的表达情况来分析细胞干性。然而,采用常规细胞培养方法会出现细胞增殖能力下降和细胞干性缺失的情况。因此,如何利用天然小分子化合物维持其细胞干性是目前亟需解决的问题。
发明内容
本发明的目的在于提供一种增强细胞干性的小分子组合物及其应用,所述小分子组合物可以明显增强细胞干性,并且不会抑制细胞增殖和生长。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了一种增强细胞干性的小分子组合物,包括β-烟酰胺单核苷酸和甜菜碱,所述β-烟酰胺单核苷酸的浓度为10~100μmol/L,所述甜菜碱的浓度为10
进一步地,所述β-烟酰胺单核苷酸的浓度为20~80μmol/L,所述甜菜碱的浓度为10
进一步地,所述β-烟酰胺单核苷酸的浓度为30~60μmol/L,所述甜菜碱的浓度为1~10μmol/L。
本发明还提供了上述小分子组合物在制备增强细胞干性的药物中的应用。
进一步地,所述细胞为小鼠胚胎成纤维细胞。
进一步地,所述小分子组合物通过提高Oct-4基因表达水平来增强细胞干性。
本发明还提供了一种增强细胞干性的3D细胞培养方法,包括以下步骤:将细胞悬液与Matrigel基质胶混合,进行第一培养,胶滴凝固后向培养体系中加入400~600μL无血清条件培养基和上述小分子组合物,进行第二培养。
进一步地,所述细胞悬液和Matrigel基质胶的比例关系为1×10
进一步地,所述第一培养为倒置培养,所述第一培养的温度为35~40℃,所述第一培养的时间为20~40min。
进一步地,所述第二培养的温度为35~40℃,所述第二培养的CO
相比于现有技术,本发明的有益效果为:
本发明将β-烟酰胺单核苷酸和甜菜碱相结合,能够明显促进Oct-4mRNA表达(P<0.05),β-烟酰胺单核苷酸和甜菜碱组联合3D培养后大于50μm的克隆球数目明显增多(P<0.05)。在MEF细胞中,β-烟酰胺单核苷酸和甜菜碱联合3D培养组Oct-4和Nanog蛋白表达量明显高于2D培养组、未经药物处理的3D培养组(P<0.05),细胞在3D环境下生长,干性明显增高。加入小分子组合物β-烟酰胺单核苷酸和甜菜碱后,能够进一步提高细胞的干性。
附图说明
图1为小分子组合物对MEF细胞中Oct-4mRNA表达的影响;
图2为小分子组合物处理MEF细胞后CCK8检测增殖情况图;
图3为MEF细胞在小分子组合物联合3D培养条件下形态变化图;
图4为小分子组合物联合3D培养条件下直径大于50μm的克隆球数比较图;
图5为qRT-PCR检测小分子组合物联合3D培养对MEF细胞中Oct-4表达量的影响图;
图6为蛋白质免疫印迹法检测MEF细胞中Oct-4和Nanog蛋白表达量图;
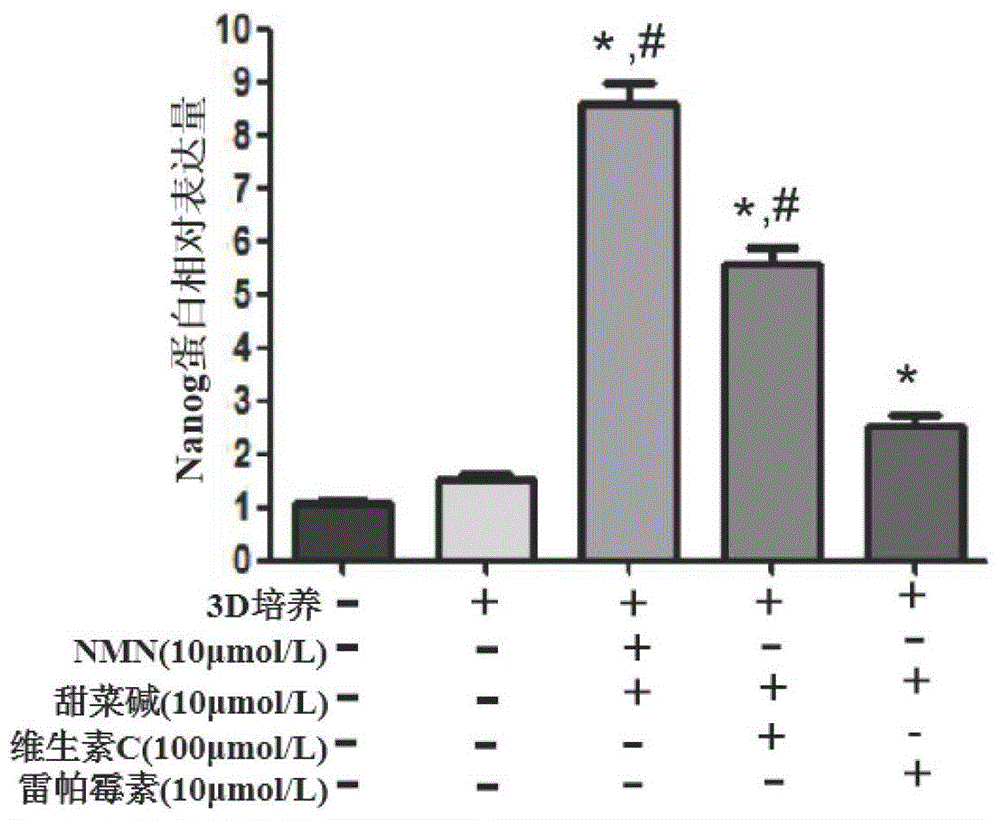
图7为Nanog蛋白相对表达量灰度分析图;
图8为Oct-4蛋白相对表达量灰度分析图。
具体实施方式
本发明提供了一种增强细胞干性的小分子组合物,包括β-烟酰胺单核苷酸和甜菜碱。
在本发明中,所述β-烟酰胺单核苷酸的浓度为10~100μmol/L,优选为20~80μmol/L,进一步优选为30~60μmol/L。
在本发明中,所述甜菜碱的浓度为10
本发明还提供了上述小分子组合物在制备增强细胞干性的药物中的应用。
在本发明中,所述细胞优选为小鼠胚胎成纤维细胞。
在本发明中,所述小分子组合物优选通过提高Oct-4基因表达水平来增强细胞干性。
本发明还提供了一种增强细胞干性的3D细胞培养方法,包括以下步骤:将细胞悬液与Matrigel基质胶混合,进行第一培养,胶滴凝固后向培养体系中加入400~600μL无血清条件培养基和上述小分子组合物,进行第二培养。
在本发明中,所述细胞悬液和Matrigel基质胶的比例关系为1×10
在本发明中,所述第一培养优选为倒置培养,所述培养的温度为35~40℃,优选为36~39℃,进一步优选为37~38℃;所述培养的时间为20~40min,优选为25~35min,进一步优选为28~32min。
在本发明中,待胶滴凝固呈凸起的穹顶状后向培养板每孔加入无血清条件培养基和上述小分子组合物,进行第二培养,所述无血清条件培养基的添加量为400~600μL,优选为450~550μL,进一步优选为480~520μL。
在本发明中,所述第二培养的温度为35~40℃,优选为36~39℃,进一步优选为37~38℃;所述培养箱中CO
在本发明中,所述培养体系中添加的小分子组合物优选为β-烟酰胺单核苷酸和甜菜碱,所述添加β-烟酰胺单核苷酸的浓度为10~100μmol/L,优选为20~80μmol/L,进一步优选为30~60μmol/L;所述添加甜菜碱的浓度为10
下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
本实施例提供了一种增强细胞干性的小分子组合物,包括10μmol/L的β-烟酰胺单核苷酸和10μmol/L的甜菜碱。
实施例2
本实施例提供了一种增强细胞干性的小分子组合物,包括100μmol/L的β-烟酰胺单核苷酸和10
实施例3
本实施例提供了实施例1中小分子组合物联合细胞3D培养,所述3D培养的具体方法为:将处于对数生长期的MEF细胞(购买自中科院上海细胞研究所)消化后制备成细胞悬液,计数5×10
实施例4
本实施例提供了实施例1中小分子组合物联合细胞3D培养,所述3D培养的具体方法为:将处于对数生长期的MEF细胞(购买自中科院上海细胞研究所)消化后制备成细胞悬液,计数8×10
对照例1
本对照例提供了一种小分子组合物,包括10μmol/L的β-烟酰胺单核苷酸和10μmol/L的雷帕霉素(购买自美国MCE公司)。
对照例2
本对照例提供了一种小分子组合物,包括10μmol/L的β-烟酰胺单核苷酸和100μmol/L的维生素C。
对照例3
本对照例提供了一种小分子组合物,包括10μmol/L的甜菜碱和10μmol/L的雷帕霉素。
对照例4
本对照例提供了一种小分子组合物,包括10μmol/L的甜菜碱和100μmol/L的维生素C。
对照例5
本对照例提供了一种小分子组合物,包括10μmol/L的雷帕霉素和100μmol/L的维生素C。
实验例1qRT-PCR检测小分子组合物处理细胞Oct-4mRNA相对表达量
采用实施例1和对照例1~5的小分子组合物处理小鼠胚胎成纤维细胞(MEF细胞,购买自中科院上海细胞研究所),使用试剂Trizol(购自南京诺唯赞公司)提取MEF细胞总RNA,使用逆转录试剂盒(购自美国Thermo Fisher Scientific公司)进行逆转录,配置10μL反应体系,4.1μLDEPC水、5μL SYBR Premix Ex TaqⅡ和上、下游引物各0.2μL、0.5μLcDNA混合均匀后加入8联管中。95℃预变性30s,95℃变性5s,55℃退火30s,40个循环。独立样本均设3个复孔并将其逆转录成cDNA。针对NCBI上查找的基因序列设计引物,Oct-4mRNA上游引物(SEQ ID NO:1)为5’-TTAAGAACATGTGTAAGCTGCG-3’,下游引物(SEQ ID NO:2)为5’-GCATATCTCCTGAAGGTTCTCA-3’,将GAPDH设为内参,以2
结果表明:相比于对照组和对照例,10μmol/L的β-烟酰胺单核苷酸和10μmol/L的甜菜碱处理MEF细胞后能够明显促进Oct-4mRNA表达(P<0.05),结果见图1。
实施例2CCK8法检测细胞增殖
在96孔板中每孔接种3000个MEF细胞(每孔100μL培养基)。将培养板放在37℃,5%CO
结果表明:相比于对照组和对照例,10μmol/L的β-烟酰胺单核苷酸和10μmol/L的甜菜碱处理MEF细胞后不会抑制细胞增殖,结果见图2。
实施例3小分子组合物联合3D培养
采用实施例3的培养方法进行培养,将实施例1、对照例3、对照例4的小分子组合物加入到3D培养体系中为实验组,以未经小分子组合物处理的2D培养、未经小分子组合物处理的3D培养、甜菜碱和雷帕霉素联合3D培养(对照例3)、甜菜碱和维生素C联合3D培养(对照例4)作为对照组,每隔一天记录细胞生长状态。在第6天时,显微镜(40×)下计数直径大于50μm的克隆球个数。
采用蛋白质印迹法检测相关蛋白表达量,具体方法为:
制备含1%PMSF的蛋白裂解液,分别收集实验组和对照组6d后的MEF细胞,加入裂解液,充分裂解后,100℃加热10min,12000×g、4℃离心10min。配制10%的SDS-PAGE分离胶,加入蛋白,80V电泳120min分离样品;300mA转膜150min将蛋白转移至PVDF膜;配制5%的奶粉作为封闭液,室温封闭1~2h;按照1:2000比例稀释兔抗鼠Oct-4抗体(购自美国CellSignaling Technology公司)、兔抗鼠Nanog抗体(购自美国Cell SignalingTechnology公司),按照1∶5000比例稀释兔抗人β-Tubulin抗体(购自英国Abcam公司),于4℃一抗孵育过夜;TBST溶液洗膜;37℃孵育二抗1h;TBST溶液清洗3次;ECL发光液(购买自美国MilliporeImmobilon公司)显色,分析图像。
结果表明:细胞在3D培养体系中生长,逐渐形成不同数量和大小的克隆球,相对于不添加小分子组合物和添加其他小分子组合物的对照组,β-烟酰胺单核苷酸和甜菜碱联合3D培养组克隆球数目和大小明显增多(P<0.05)。MEF细胞在小分子组合物联合3D培养条件下形态变化图见图3,小分子组合物联合3D培养条件下直径大于50μm的克隆球数比较图见图4。在MEF细胞中,β-烟酰胺单核苷酸和甜菜碱联合3D培养组Oct-4和Nanog蛋白表达量明显高于对照组(P<0.05),qRT-PCR检测小分子组合物联合3D培养对MEF细胞中Oct-4表达量的影响图见图5,蛋白质免疫印迹法检测MEF细胞中Oct-4和Nanog蛋白表达量见图6,Nanog蛋白相对表达量灰度分析图见图7,Oct-4蛋白相对表达量灰度分析图见图8。
上述结果表明,β-烟酰胺单核苷酸和甜菜碱联合3D培养细胞,能够使细胞干性明显增强。
由以上实施例和实验例可知,本发明提供了一种增强细胞干性的小分子组合物及其应用,所述小分子组合物可以明显增强细胞干性,并且不会抑制细胞增殖和生长。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
