小麦茎基腐病抗性基因TaHSP18.6、其表达产物、重组载体及应用
文献发布时间:2023-06-19 19:30:30
技术领域
本申请涉及基因工程技术领域,具体涉及一种小麦茎基腐病抗性基因
背景技术
小麦是我国重要的粮食作物,在国民经济中占有举足轻重的地位。近年来,小麦茎基腐病(Fusarium crown rot,FCR)发生严重,该病发生过程中不但给小麦造成严重的产量损失和经济损失,还会产生多种毒素和次级代谢物,严重影响人畜健康,已被称为新时期的“小麦癌症”。当前,国内外尚未鉴定出高抗或者免疫小麦茎基腐病的品种,其报道的抗性基因更是寥寥无几。因此,筛选小麦茎基腐病的抗病资源、挖掘抗病基因对控制病害的发生和蔓延意义重大。
小麦茎基腐病是由微效多基因控制的一种潜在土传病害,当前对小麦茎基腐病的研究多集中在材料的抗性鉴定和基因的初步定位上。Ma等(2010)利用CSCR6/Lang的RIL群体在茎基腐病温室实验中检测到3B上一个显著QTL,该位点来源于CSCR6,LOD值为10.8,表型变异率可达49%,随后在RIL群体中验证显示该QTL能降低FCR严重程度33%。目前,在六倍体小麦的21条染色体上已有14条报道了含有小麦茎基腐病抗性QTL(Liu等,2015;Yang等,2019)。在这些QTLs位点中,能重复检测到的位点分别位于2DL、3BL、4B和5DS染色体上,其中3BL上效应最大。Yang等发现TaDIR-B1能显著负调控小麦茎基腐病抗性,其功能缺失增强了小麦FCR抗性。敲除受体激酶TaCRK-7A增加小麦对FCR的敏感性,进而降低小麦中防御基因的表达水平(Wu等,2021)。鉴定和分离抗病基因,进行抗病育种是小麦病害防治各种措施中最经济、有效和环保的途径。
目前,关于小麦茎基腐病抗性基因的克隆仅有少量报道。在小麦茎基腐病研究中,通过发掘和利用优良抗病基因,探究抗病基因参与的调控途径,对小麦抗病育种增产具有重要指导意义。
公开于该背景技术部分的信息仅用于加深对本公开的背景技术的理解,而不应当被视为承认或以任何形式暗示该信息构成本领域技术人员所公知的现有技术。
发明内容
本申请提供一种小麦茎基腐病抗性基因
根据本公开的一个方面,筛选得到一种小麦茎基腐病抗性基因
(1)如SEQ ID NO.2所示的核苷酸序列;
(2)由SEQ ID NO.2限定的核苷酸序列衍生的具有同等功能的核苷酸序列,包括与SEQ ID NO.2序列具有80%以上同源性及编码控制小麦籽粒大小相关蛋白的。
根据本公开的另一个方面,提供了一种小麦茎基腐病抗性基因
(1)如序列SEQ ID NO.3所示的基酸序列;
(2)将SEQ ID NO.3限定的氨基酸序列基础上进行一个或者多个氨基酸缺失、添加、替换而获得的可翻译有活性的片段或者保守性变异体。
根据本公开的再一个方面,提供了一种扩增上述基因的引物对,其全核苷酸序列如下所示:
TaHSP18.6
TaHSP18.6
根据本公开的另一个方面,提供了小麦茎基腐病抗性基因
在本公开的一些实施例中,将序列表SEQ ID NO.2所示序列中自5'末端第1~180位的特异性DNA片段插入BSMV-γ-PDS载体的Pacl和Notl双酶切位点之间得到VIGS沉默重组载体。
在本公开的一些实施例中,将小麦茎基腐病抗性基因
携带有上述
根据本公开的又一个方面,将所述麦茎基腐病抗性基因
根据本公开的再一个方面,将所述小麦茎基腐病抗性基因
根据本公开的再一个方面,将所述小麦茎基腐病抗性基因
根据本公开的再一个方面,提供一种提高小麦抗茎基腐病的方法,使所述小麦茎基腐病抗性基因
本申请实施例中提供的一个或多个技术方案,至少具有如下技术效果或优点:
1. 首次公开、并确认了一个新的小麦茎基腐病抗性基因,命名为
2. 明确了小麦茎基腐病抗性基因
3. 首次利用VIGS技术对小麦茎基腐病抗性基因
4. 首次利用农杆菌介导的转化系统将携带有本申请
5. 有助于揭示小麦茎基腐病的分子遗传基础,同时对利用基因工程技术提高小麦品质和培育小麦抗病品种起到重要作用。
附图说明
图1为本申请一实施例中VIGS试验中
图2为本申请一实施例中VIGS试验中不同处理小麦对茎基病的抗性对比图。
图3为本申请一实施例中VIGS试验中不同处理小麦对茎基病病情指数统计和DAB染色对比图。
图4为本申请一实施例中
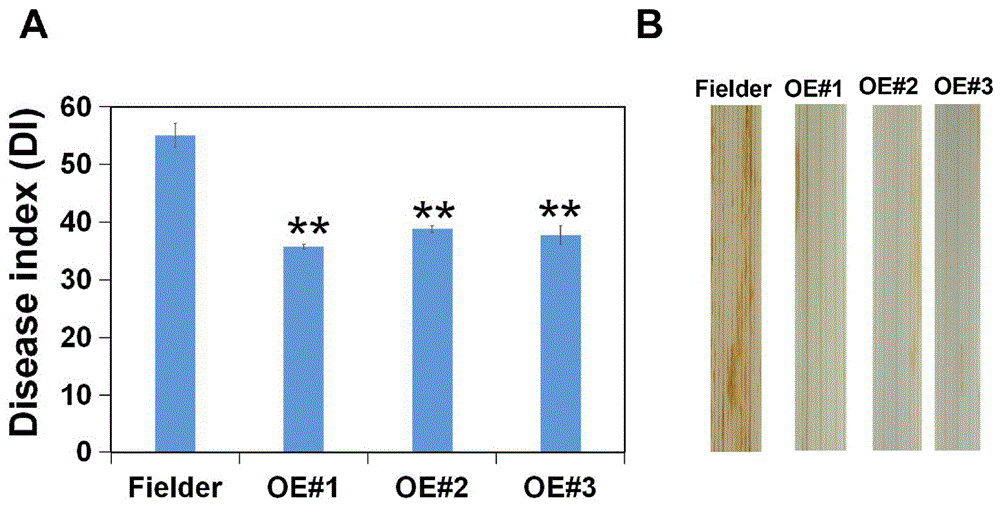
图5为本申请一实施例中过表达株系(OE#2、OE#3和OE#4)与对照Fielder对小麦茎基腐病的抗性对比图。
图6为本申请一实施例中过表达株系(OE#2、OE#3和OE#4)与对照Fielder对小麦茎基腐病的病情指数统计和DAB染色对比图。
具体实施方式
为了更好的理解本申请技术方案,下面将结合说明书附图以及具体的实施方式对上述技术方案进行详细的说明。
在以下实施例中所涉及的仪器设备如无特别说明,均为常规仪器设备;所涉及的试剂、载体等试验材料如无特别说明,均为市售常规产品;所涉及的试验方法、检测方法等,如无特别说明,均为常规方法。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。引物合成及测序工作均由生工生物工程(上海)股份有限公司完成。
实施例一:小麦茎基腐病抗性基因
通过转录组测序进行小麦茎基腐病抗性基因的挖掘,具体如下:
1. 供试菌株和试验土壤:试验所用菌株为假禾谷镰刀菌 WZ-8A,是黄淮麦区当前流行的优势病原菌,具有侵染范围广和致病力强等显著特点。试验所用土壤为中等肥力的壤土。土壤使用前先用目的筛子除去杂草和大土块,于 121℃,0.1Mpa 灭菌锅中灭菌 1h备用。
2. 试验培养基:PDA培养基和小米培养基。PDA 培养基:选取大小适中的新鲜土豆去皮切成中等薄块,称取 200g 薄块放入锅中,加蒸馏水煮沸约 20 min,四层纱布过滤。滤液回锅继续加热,并依次加入 15g 琼脂粉,20g 葡萄糖,搅拌均匀后定容至 1000 mL,冷却后分装,包扎,于 121℃,0.1 Mpa 条件下湿热灭菌 20 min 备用。小米培养基:选取大小均匀一致的小米,放入沸水中煮沸 3min,然后倒出用冷水冲洗干净并平铺在干净纱布上于通风处晾至表面无水,晾好后分装到 150 mL 三角瓶中并扎好瓶口,于 121℃,0.1 Mpa 条件下湿热灭菌 30 min 备用。
3. 病原菌扩繁:将保存的假禾谷镰刀菌取出,活化到 PDA 培养基上。扩繁时从新活化的假禾谷镰刀菌 PDA 培养板边缘挑取健康旺盛带菌丝的菌块接入灭菌的小米培养基中培养,培养条件为 25℃,7 天。
4. 材料接种、培养及取样:参照Yang(2019)的方法。在 7cm * 7cm 小方盒中称入150g 无菌土,表面均匀摆放 12 粒小麦品种农优9号,覆土 20g,每个处理三次重复,放入托盘,底部浇水浸透,置于 16h/8h,25℃/15℃,湿度 60-80%的培养箱中培养。苗后 3 天,剔除弱势苗,在盒中接入 0.4g 带菌小米,均匀铺满小盒并确保每株麦苗基部有一粒小米菌,培养条件同前,每 2d 浇水一次。分别对接菌后0h、24h、48h、72h、96h的茎基部进行快速取样,液氮速冻,放入-80℃备用。-80℃保存的茎基部材料用于RNA的提取。
5. 小麦茎基腐病抗性基因挖掘
利用Illumina DNBSEQ-T7平台对不同接菌时间点的小麦茎基部进行转录组研究。转录水平共鉴定到132,570转录本,涉及到11,2964个基因。依据|log
选取10个候选基因进行荧光定量表达验证,结果显示其中6个基因在24h、48h、72h、96h四个接菌时间点的RNA水平上均响应小麦茎基腐。包括热激蛋白(heat shockproteins 18.6,
在已公布的中国春参考序列基础上,对小麦农优9号中的
① DNA的提取:利用SLS法分别提取农优9号苗期DNA。
② 总RNA提取及cDNA第一条链的合成:利用TRIZOL试剂分别提取农优9号苗期总RNA。取质量符合要求的总RNA,参照PrimeScript
③
TaHSP18.6
TaHSP18.6
以农优9号的DNA为模板,用
用上述类似的方法再以农优9号的cDNA为模板,用
测序结果表明,以小麦农优9号的DNA为模板进行PCR扩增得到的DNA片段为
实施例二:
1.
选取SEQ ID NO.2序列中自5’端第1至180位、长度为180bp的特异性DNA片段,根据
TaHSP18.6
TaHSP18.6
以小麦大麦条纹花叶病毒 (barley stripe mosaic virus,BSMV) 高感品种郑麦9023的cDNA为模板,进行PCR扩增产物,产物回收备用。进一步将
2. 载体的线性化和体外转录
将病毒载体(α、β、γ、γ-PDS)及γ-
3. 病毒接种
小麦苗2叶1心时期进行病毒接种。接种之前,先将叶片喷少许DEPC处理水, 然后取8-10μL接种病毒混合液点加在戴有乳胶手套的食指上,与拇指轻轻接触,后磨擦幼苗第二叶叶片3次,摩擦时从叶片基部直至叶尖,能够听到轻微的吱吱声。接种后喷少许DEPC处理水,室温保持23±2˚C,保湿、避光24h,再进行正常16/8h光暗周期培养。定期观察表型并记录。
4. VIGS沉默效率鉴定
接菌2周后,用荧光定量技术对基因沉默效率进行鉴定。总RNA 的提取及 cDNA 的反转同实施例一。
针对
TaHSP18.6
TaHSP18.6
内参基因选用
β
β
荧光定量用美国伯乐Bio-Rad IQ5 Real-Time PCR Detection System进行。20μL的反应体系,上下游引物各0.4μL,Go Taq® qPCR Master Mix (Perfect Real Time;Promega)10μL,nuclease-free water 7.2μL。PCR程序:95℃ for 3 min,95℃ for 5s,60℃ for 30 s,72℃ for 30 s,40个循环数。利用
实施例三:
接续实施例二,于接菌2周后调查植株表型。将VIGS沉默植株和对照组从培养盒中取出,用水清洗植株基部,参考 Smiley等(2005b)的病级划分方法统计植株病害发生程度,计算其病情指数。结果如图2和图3A所示。由图2可知,与野生型相比,
研究表明HSPs通过正向调节抗氧化酶系统,提高膜的稳定性和解毒活性氧(reactive oxygen species,ROS) 。推测HSPs的抗病功能可能与ROS途径相关,因此利用DAB法对VIGS沉默植株和对照组进行过氧化物酶的活性检测。当过氧化物酶存在时,DAB会被H
实施例四:
1.
根据实施例 1 中克隆的
TaHSP18.6
TaHSP18.6
表达载体选择LGY-OE3,将上述537bp的DNA片段克隆入植物表达载体LGY-OE3的酶切位点BamHI 和SacI之间,得到含有小麦
2.
将LGY-OE3-
3. 转基因小麦的PCR鉴定
利用潮酶素标签(Hyg)引物Hyg-F和Hyg-R引物对T
Hyg-F:5’-TCTGCACCATCGTCAACCAC-3’;
Hyg-R:5’-AAACCCACGTCATGCCAGTT-3’。
共获得12个阳性转基因植株,经过加代,获得T
4. 转基因小麦的表达鉴定
对转基因株系OE#1、OE#2和OE#3和Fielder进行荧光定量分析;总 RNA 的提取、cDNA 的反转同实施例一。荧光定量PCR反应体系和方法同实施例二。利用
实施例五:
对上述T
由图5可知,与野生型相比,
由图6A可知,T
由图6B可知,与野生型相比,T
综合来看,
尽管已描述了本申请的一些优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例做出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本申请范围的所有变更和修改。
显然,本领域的技术人员可以对本申请进行各种改动和变型而不脱离本申请之发明精神和范围。这样,倘若这些修改和变型属于本申请权利要求及其等同技术的范围之内,则本申请也意图包含这些改动和变型在内。
