用于全身炎症的体外诊断和/或预后的生物标志物
文献发布时间:2024-04-18 20:00:25
发明领域
本发明涉及全身炎症的体外诊断或者具有全身炎症的受试者的死亡风险的预后的领域。在另一个方面,本发明涉及监测全身炎症的领域。本发明进一步涉及生物标志物用于体外诊断受试者中的全身炎症或者预后具有全身炎症的受试者的死亡风险的用途。优选地,所述全身炎症由感染因子引起,更特别地为脓毒症。
根据本发明的方法还涉及关于在罹患全身炎症(特别是脓毒症)的受试者(特别是人受试者)中的治疗干预的决策制定过程的领域。
发明背景
全身炎症,特别是由感染因子引起的全身炎症,例如脓毒症,是全世界中一个重要的死亡原因。特别地,脓毒症是德国和其他发达国家中第三最常见的死亡原因。
脓毒症典型地在当下述情况时发生:病原体或它们产生的毒素从炎症的局部位点经由循环扩散到整个身体,从而达到远端器官并且触发全身炎症。全身炎症可以导致独个或几个器官的衰竭以及多器官衰竭,和在另外的血压严重下降的情况下,导致脓毒性休克。因此,脓毒症、严重脓毒症或脓毒性休克典型地由感染因子引起。
脓毒性休克与高致死率相关联。因此,全身炎症(特别是脓毒症)的早期诊断以及随后的适当的治疗干预对于治疗成功和疾病后果来说是关键性的。
然而,全身炎症(特别是脓毒症)难以诊断;有效的监测是具有挑战性的。血流感染(特别是菌血症)和全身感染也是在诊断和疗法中的一大挑战。
微生物学方法,例如培养患者血液和随后的病原体鉴定,是非常耗时的,并且由于高的假阴性结果发生率而是不可靠的。此外,对于在危重患者中的微生物学发现的解释经常是有问题的,因为可能检测到可能仅代表定殖者的微生物,但是并不必然表明由感染因子引起的全身炎症。
生物物理检测方法,例如质谱法,特别是基质辅助激光解吸电离-飞行时间质谱法(MALDI-TOF MS),也可以用于基于对于每种病原体来说特征性的蛋白质特性谱来检测在血液样品中的病原体。然而,该方法通常用预培养至少一小段时间的血液样品来进行。此外,该方法典型地在阳性血液培养物上采用,即在MALDI-TOF MS之前需要额外的方法步骤(Clin.Microbiol.Infect.2020,26:142-150)。
通过引入分子生物学方法,例如PCR诊断学,可以以有针对性的和部分平行化的方式在生物学样品中鉴定病原体。通过PCR分析的在患者血液样品中的病原体检测是高度灵敏和特异性的,但是样品制备和测量是耗时的并且在一些情况下仅可以由高度有经验的人员来施行。多重PCR可以用于平行地进行多个病原体检测,但是可以平行地进行的测量的数目是有限的。因此,阴性PCR结果不能排除具有未测试的病原体的当前感染。
与全身炎症的强度或者与感染的严重度相关的在临床诊断学中已知并使用的标志物主要尤其是降钙素原(PCT)、C反应蛋白(CRP)和白介素-6(IL-6)(Crit.Care 2020,24(1):287;Anaesthesiol.Intensive Ther.2019,51:299-305)。PCT在健康个体的血浆中以低浓度(低于0.1ng/ml)可检测到;在由细菌引起的严重脓毒症的状况下,PCT浓度可以增加5,000至10,000倍。血浆PCT浓度的增加是时间依赖性的,并且在感染后相当快地发生。PCT在CRP浓度增加之前可检测到,但是比细胞因子的上调更慢出现。然而,大手术、多发性创伤和心源性休克也可以导致归因于全身炎症反应的明显升高的血浆PCT浓度,从而降低了PCT作为脓毒症标志物的普适性。总之,单独的目前的标志物和甚至PCT和CRP的组合对于全身炎症(特别是脓毒症)的诊断来说都是不令人满意的,因为其阳性和阴性预测值太低。
在文献中已描述了其他脓毒症生物标志物(Crit.Care 2020,24(1):287),但是它们中的大多数尚未完全得到证实,或者其有效性由于用小病例数的群组研究、独个病例研究或缺乏与PCT和CRP的比较而是严重受限的。
总之,目前的生物标志物中没有一个允许关于全身炎症(特别是脓毒症)的诊断作出清楚和明晰的结论。
发明概述
因此,本发明的目标是提供用于诊断全身炎症或者预后具有全身炎症(特别是由感染因子引起的全身炎症,特别是脓毒症)的受试者的死亡风险的生物标志物。进一步地,本发明的目标是提供用于此类目的的经改善的生物标志物或生物标志物组合。
在本发明的一个特别的方面,目标是提供比目前所使用的生物标志物(例如,PCT和CRP)更可靠的生物标志物,特别是考虑到由感染因子引起的全身炎症(例如脓毒症)与不由感染因子引起的全身炎症(例如SIRS)的区分。
在权利要求书中所定义的本发明解决了这些目标中的至少一个。特别地,这些目标中的至少一个通过下述实施方案而得到解决:体外诊断全身炎症或者预后具有全身炎症的受试者的死亡风险的方法,其中所述方法包括:
a)测定在生物学样品中可溶性含V-set和免疫球蛋白结构域的蛋白4(soluble V-set and immunoglobulin domain-containing protein;sVSIG4)的水平,和
b)从sVSIG4的存在和/或水平得出关于全身炎症的诊断或者具有全身炎症的受试者的死亡风险的预后的结论。
发明人令人惊讶地鉴定出,可溶性含V-set和免疫球蛋白的蛋白4(sVSIG4)或者sVSIG4与在生物学样品(例如,全血、血浆和血清)中的其他蛋白质和肽的组合可以用作关于全身炎症的唯一或支持性诊断标准。特别地,sVSIG4或者sVSIG4与其他蛋白质或肽的组合可以用于体外诊断由感染因子引起的全身炎症(例如脓毒症、全身感染或血流感染)或者不由感染因子引起的全身炎症(例如SIRS)。
因此,用根据本发明的方法,可能的是,通过测定sVSIG4的水平来可靠地诊断全身炎症,特别是脓毒症,而无需任何其他生物标志物或诊断工具。所述方法是灵敏的和特异性的。所述方法是快速的并且不需要培养生物学样品。它是一种无偏倚的方法,因为不需要预诊断。将所述诊断与其他生物标志物或诊断工具相组合也是可能的。
所述方法在体外进行,因为它利用事先已从受试者(例如人患者)中获取的生物学样品。
可以基于用于指明全身炎症(特别是SIRS、血流感染或脓毒症)的截止水平(阈值),从sVSIG4的存在和/或水平得出关于全身炎症的诊断或者死亡风险的预后的结论。也可以基于在两名受试者(例如一名健康受试者,和一名具有疑似全身炎症特别是脓毒症的受试者)的生物学样品之间的差异表达来得出结论。
所述方法允许在疾病的早期阶段鉴定出具有全身炎症(特别是脓毒症)的受试者。这对于疗法决策是特别有用的。另外,所述方法允许在感染的过程中调适疗法,如果上面的步骤a)和b)重复至少一次(监测)。例如,如果在已经被诊断为具有脓毒症的患者中检测到高水平的sVSIG4,那么可能需要更具攻击性的疗法,例如在细菌病原体作为感染因子的情况下,更具攻击性的抗生素疗法或不同的抗生素疗法是必要的。
另外,所述方法允许预后具有全身炎症的受试者的死亡风险。由此,独个患者可以经历有针对性的强化监测以便在早期阶段检测在疾病过程中的并发症。测定随时间的sVSIG4(单独地或者与一个或多个其他生物标志物相组合地)的浓度也适合于通过生物标志物水平的增加或降低来监测抗微生物疗法的效果。
发明人还已发现,来自受试者的生物学样品(例如人血浆)可以在来自具有严重脓毒症或脓毒性休克的患者和具有有着或没有器官功能障碍的全身炎症反应综合征(SIRS)的患者的生物学样品(按照脓毒症-2定义收集的)中包含浓度改变的蛋白质,其中在这两个组中具有显著不同的丰度或浓度。
因此,在本发明的一个进一步的方面,提供了在受试者中区分SIRS和脓毒症的方法,其中所述方法包括:
a)测定在所述受试者的生物学样品中sVSIG4的水平,和
b)比较在所述生物学样品中sVSIG4的水平与在罹患SIRS的受试者的生物学样品中sVSIG4的参考水平,
其中相比于步骤b)的参考水平而言步骤a)的在所述生物学样品中的水平增加表明在步骤a)的所述受试者中的脓毒症。
在一个进一步的方面,提供了在受试者中区分不由感染因子引起的全身炎症(即,无菌性全身炎症)和菌血症的方法,其中所述方法包括:
a)测定在所述受试者的生物学样品中sVSIG4的水平,和
b)比较在所述生物学样品中sVSIG4的水平与在罹患无菌性全身炎症的受试者的生物学样品中sVSIG4的参考水平,
其中相比于步骤b)的参考水平而言步骤a)的在所述生物学样品中的水平增加表明在步骤a)的所述受试者中的菌血症。
根据本发明的另一个方面,本发明涉及用于在治疗受试者中的感染或者治疗具有疑似感染的受试者的方法中使用的抗生试剂,其中所述感染为血流感染、全身感染或脓毒症中的一部分,并且其中所述血流感染、全身感染或脓毒症通过在生物学样品中sVSIG4的水平来进行诊断或监测。由此,可以根据受试者的需要对疗法进行个体化和调适。
根据本发明的一个进一步的方面,将sVSIG4用作用于体外诊断受试者中的全身炎症或者预后具有全身炎症的受试者的死亡风险的生物标志物。sVSIG4可以用作唯一的生物标志物或者用作与其他生物标志物或诊断工具相组合的生物标志物。
根据本发明的另外一个进一步的方面,提供了试剂盒,其包含对于sVSIG4的结合分子和对于至少一个进一步的生物标志物的结合分子,所述试剂盒用于定量检测sVSIG4和所述至少一个进一步的生物标志物。
本申请的其他目标、特征、优点和方面从下面的描述和所附权利要求书中对于本领域技术人员来说将会变得明显。然而,应当理解的是,下面的描述、所附权利要求书和具体的实施例虽然指明了本申请的优选实施方案,但是仅以举例说明方式给出。
附图简述
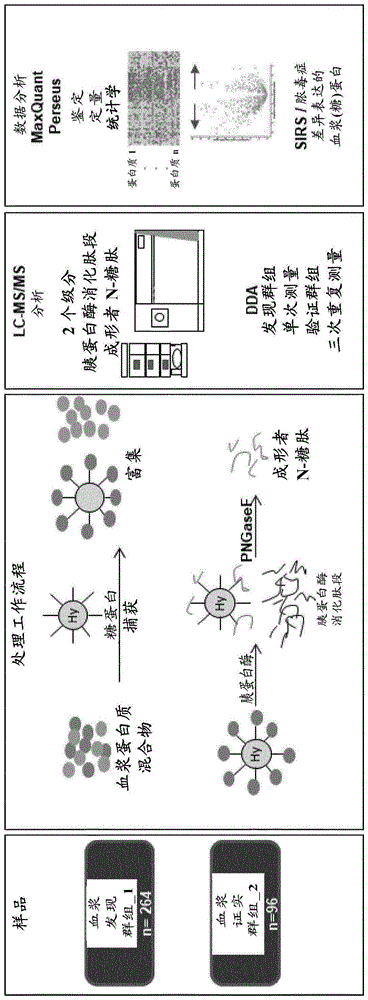
图1:实验设计。用于SIRS和脓毒症患者的血浆样品分析的蛋白质组工作流程。将糖蛋白通过酰肼化学捕获在sepharose珠粒上,在珠粒上用胰蛋白酶进行消化,和用PNGaseF释放N-糖肽。通过LC-MS/MS独个地分析胰蛋白酶消化肽段和成形者N-糖肽。肽鉴定和蛋白质推断在MaxQuant中进行,并且统计学分析用Perseus来进行。
图2:在来自发现群组(discovery cohort)的患者样品中的蛋白质组鉴定和可重现定量。A:在264份独个的患者血浆样品中鉴定出的肽和蛋白质的数目。B:在来自SIRS和脓毒症患者的血浆中的糖蛋白鉴定的频率。C:在数据集中的血浆蛋白质浓度范围。在蛋白质组数据中以100%(黑色)、95%(深灰色)、90%(中灰色)和50%(浅灰色)可重现地鉴定出的血浆蛋白质,相比于在The Human Protein Atlas处汇编的血浆蛋白质浓度数据(浅灰色)相比。D:在100%的覆盖几乎五个数量级的所有样品中检测出的五种蛋白质的LFQ强度的可重现性。绘制的是α-1-抗胰蛋白酶(A1AT,基因名SERPINA1)、簇蛋白(CLUS,基因名CLU)、α-2-抗纤溶酶(A2AP,基因名SERPINF2)、凝血因子XI(FA11,基因名F11)和N-乙酰葡糖胺-1-磷酸转移酶亚基γ(GNPTG,基因名GNPTG)的值。E:以箱线图和离群值显示了在整个群组上从其平均丰度水平开始的糖蛋白LFQ强度的倍数变化的分布。显示了以100%可重现性鉴定出的并且按照其平均强度水平进行分类整理的(从左至右降低)糖蛋白。
图3:在发现群组的SIRS和脓毒症患者中血浆蛋白质的差异表达。A:蛋白质组数据集的主要组分分析。第一组分解释了在数据集中的变化的7.12%。浅灰色:SIRS患者;和深灰色:脓毒症患者。B:在SIRS和脓毒症患者中丰度有差异的蛋白质的火山图。将t-检验p-值对所有鉴定出的蛋白质的丰度倍数变化进行作图,在最少10名患者中进行鉴定。该绘制图的下部中心区域的数据点(灰色,空心圆圈)指明了没有变化或具有不显著的倍数变化的蛋白质,而在左上和右上象限中的数据点指明了在脓毒症组中具有显著(FDR小于0.05)(经Benjamini-Hochberg调整的)较小丰度(左)或者在脓毒症组中具有显著较高丰度(右)的蛋白质(黑色和灰色实心圆圈)。黑色圆圈展示了具有倍数变化≥2的血浆蛋白质,和灰色圆圈展示了具有FC<2的丰度有显著差异的蛋白质。
图4:在验证群组(validation cohort)的SIRS和脓毒症患者中血浆蛋白质的有差异的丰度。在SIRS和脓毒症患者中丰度有差异的蛋白质的火山图。将t-检验p-值对所有鉴定出的蛋白质的丰度倍数变化进行作图,在最少10名患者中进行鉴定。该绘制图的下部中心区域的数据点(灰色,空心圆圈)指明了没有变化或具有不显著的倍数变化的蛋白质,而在左上和右上象限中的数据点指明了在脓毒症组中具有显著(FDR小于0.05)(经Benjamini-Hochberg调整的)较小丰度(左)或者在脓毒症组中具有显著较高丰度(右)的蛋白质(浅灰色和深灰色实心圆圈)。红色圆圈展示了具有倍数变化≥2的血浆蛋白质,和灰色圆圈展示了具有FC<2的丰度有显著差异的蛋白质。
图5:以文氏图描绘的在发现群组(左)中和在验证群组(右)中鉴定出的在SIRS和脓毒症患者中丰度有显著差异的血浆蛋白质之间的重叠。A:在两个群组中都鉴定出的所有显著血浆蛋白质之间的重叠。B+C:在脓毒症患者中具有显著较高(B)或较低(C)血浆水平的血浆蛋白质之间的重叠。
图6:A+B:用于区别SIRS和脓毒症的在发现群组数据集中的24种表现最好的血浆蛋白质的接受者操作特征(ROC)曲线。A左:条形图,其描绘了关于在蛋白质组数据集(发现群组)中鉴定出的血浆蛋白质的曲线下面积(AUC)值和来自门诊的PCT和CRP(深灰色)值。绘制图描绘了在发现群组(DC,黑色)和验证群组(VC,灰色)中关于给定蛋白质的ROC曲线以及其特征。为了简单起见,给出基因名称:ITIH1=间-α-胰蛋白酶抑制物重链H1,ITIH2=间-α-胰蛋白酶抑制物重链H2,GPLD1=磷脂酰肌醇-聚糖-特异性磷脂酶D,PGLYRP2=N-乙酰基胞壁酰基-L-丙氨酸酰胺酶,SERPINA4=Kallistatin,VSIG4=可溶性含V-set和免疫球蛋白结构域的蛋白4,AHSG=α-2-HS-糖蛋白,ITIH3=间-α-胰蛋白酶抑制物重链H3,AFM=Afamin,MRC1=巨噬细胞甘露糖受体1,BCHE=胆碱酯酶,IGFALS=胰岛素样生长因子结合蛋白复合物酸不稳定亚基,TF=血清转铁蛋白,crp.day.sample=在取样日在门诊中测量的CRP,LCAT=磷脂酰胆碱甾醇酰基转移酶,CNDP1=β-Ala-His二肽酶,KLKB1=血浆激肽释放酶,SERPINA3=α-1-抗胰凝乳蛋白酶,CD14=单核细胞分化抗原CD14,LCN2=嗜中性粒细胞明胶酶相关脂笼蛋白,HGFAC=肝细胞生长因子激活物,CD163=清道夫受体富半胱氨酸1型蛋白M130,FN1.15=纤连蛋白,同种型15,HRG=血红素转运蛋白HRG1,SERPINA1=α-1-抗胰蛋白酶,PCT.day.sample=在取样日在门诊中测量的PCT。
图7:关于区别SIRS和脓毒症患者的24种表现最好的血浆蛋白质的组合的接受者操作特征曲线(A),显现了被选择用于线性判别分析(linear discrimination analysis)的至少两种血浆蛋白质的FC。在向后消除过程的每个步骤中,从列表中消除对于LDA的结果预测器(predictor)具有最小贡献的蛋白质直至列表包含仅四种(B)、三种(C)或两种(D)蛋白质:磷脂酰肌醇-聚糖-特异性磷脂酶D(GPLD1)和可溶性含V-set和免疫球蛋白结构域的蛋白4(VSIG4)。选择这两种蛋白质的线性组合(LDA)作为新的预测器。(E):源自GPLD1和sVSIG4的线性预测器的x-y图(黑色空心圆圈:脓毒症患者;黑色实心圆圈:死于脓毒症的脓毒症患者;灰色空心圆圈:SIRS患者;实心灰色圆圈:死于脓毒症的SIRS患者);和(F)用源自关于GPLD1和sVSIG4的蛋白质组结果的线性预测器的SIRS和脓毒症患者的分布的散点图。为了简单起见,给出基因名称:GPLD1=磷脂酰肌醇-聚糖-特异性磷脂酶D,SERPINA4=Kallistatin,VSIG4=可溶性含V-set和免疫球蛋白结构域的蛋白4,AHSG=α-2-HS-糖蛋白,AFM=Afamin,MRC1=巨噬细胞甘露糖受体1,BCHE=胆碱酯酶,IGFALS=胰岛素样生长因子结合蛋白复合物酸不稳定亚基,CNDP1=β-Ala-His二肽酶,LCN2=嗜中性粒细胞明胶酶相关脂笼蛋白,CD163=清道夫受体富半胱氨酸1型蛋白M130,SERPINA5=血浆丝氨酸蛋白酶抑制物,LRG1=富亮氨酸α-2-糖蛋白,CRP=C反应蛋白,REG1A=胰石蛋白(Lithostathine)-1-α,LBP=脂多糖结合蛋白,LYVE1=淋巴管内皮透明质酸受体1,IGFBP3=胰岛素样生长因子结合蛋白3,CR2=补体受体2型,FN1=纤连蛋白,ASGR2=脱唾液酸糖蛋白受体2,ALPL=碱性磷酸酶,组织非特异性同工酶,SAA2=血清淀粉样A-2蛋白,DPP4=二肽基肽酶4。
图8:关于被选择用于线性判别分析的区别SIRS和脓毒症患者(无FC标准)的24种表现最好的血浆蛋白质的组合的接受者操作特征曲线(A)。在向后消除过程的每个步骤中,从列表中消除对于LDA的结果预测器具有最小贡献的蛋白质直至列表包含仅四种(B)、三种(C)或两种(D)蛋白质:间-α-胰蛋白酶抑制物重链H1(ITIH2)和可溶性含V-set和免疫球蛋白结构域的蛋白4(VSIG4)。选择这两种蛋白质的线性组合(LDA)作为新的预测器。(E):源自ITIH2和sVSIG4的线性预测器的x-y图(黑色空心圆圈:脓毒症患者;黑色实心圆圈:死于脓毒症的脓毒症患者;灰色空心圆圈:SIRS患者;实心灰色圆圈:死于脓毒症的SIRS患者);和(F)用源自关于ITIH2和sVSIG4的蛋白质组结果的线性预测器的SIRS和脓毒症患者的分布的散点图。为了简单起见,给出基因名称:ITIH2=间-α-胰蛋白酶抑制物重链H2,ITIH1=间-α-胰蛋白酶抑制物重链H1,GPLD1=磷脂酰肌醇-聚糖-特异性磷脂酶D,PGLYRP2=N-乙酰基胞壁酰基-L-丙氨酸酰胺酶,SERPINA4=Kallistatin,VSIG4=可溶性含V-set和免疫球蛋白结构域的蛋白4,AHSG=α-2-HS-糖蛋白,ITIH3=间-α-胰蛋白酶抑制物重链H3,AFM=Afamin,MRC1=巨噬细胞甘露糖受体1,BCHE=胆碱酯酶,IGFALS=胰岛素样生长因子结合蛋白复合物酸不稳定亚基,TF=血清转铁蛋白,LCAT=磷脂酰胆碱甾醇酰基转移酶,CNDP1=β-Ala-His二肽酶,KLKB1=血浆激肽释放酶,SERPINA3=α-1-抗胰凝乳蛋白酶,CD14=单核细胞分化抗原CD14,LCN2=嗜中性粒细胞明胶酶相关脂笼蛋白,HGFAC=肝细胞生长因子激活物,CD163=清道夫受体富半胱氨酸1型蛋白M130,FN1.15=纤连蛋白,同种型15,HRG=血红素转运蛋白HRG1,SERPINA1=α-1-抗胰蛋白酶。
图9:在发现群组的具有经微生物培养证明的阳性或阴性结果的患者中血浆蛋白质的有差异的丰度,相比于在脓毒症患者组中以有差异的丰度检测出的血浆蛋白质而言。A:在具有阳性或阴性(SIRS和脓毒症)培养结果的患者中丰度有差异的蛋白质的火山图。将t-检验p-值对所有鉴定出的蛋白质的丰度倍数变化进行作图,在最少10名患者中进行鉴定。该绘制图的下部中心区域的数据点(灰色,空心圆圈)指明了没有变化或具有不显著的倍数变化的蛋白质,而在左上和右上象限中的数据点指明了在培养阳性患者组中具有显著(FDR小于0.05)(经Benjamini-Hochberg调整的)较小丰度(左)或者显著较高丰度(右)的蛋白质(黑色和灰色实心圆圈)。黑色实心圆圈展示了具有倍数变化≥2的血浆蛋白质,和灰色实心圆圈展示了具有FC<2的丰度有显著差异的蛋白质。B:以文氏图描绘的SIRS对脓毒症患者(右)和微生物阳性对阴性(左)结果这些比较的丰度有显著差异的血浆蛋白质的重叠。C+D:在微生物培养阳性患者中具有较高水平(左)和在脓毒症患者中具有较高水平的血浆蛋白质之间的重叠(C),和在脓毒症患者组中在具有微生物培养阳性结果和较小丰度的患者中以较小丰度检测出的血浆蛋白质之间的重叠(D)。
图10:具有通过培养方法检测出的革兰氏阴性或革兰氏阳性菌血症(A)和在呼吸道或腹部中具有原发感染病灶(B)的脓毒症患者中的血浆蛋白质丰度。A+B:丰度有差异的蛋白质的火山图。将t-检验p-值对所有鉴定出的蛋白质的丰度倍数变化进行作图,在最少10名患者中进行鉴定。该绘制图的下部中心区域的数据点(灰色,空心圆圈)指明了没有变化或具有不显著的倍数变化的蛋白质,而在左上和右上象限中的数据点分别指明了在革兰氏阳性组(右)对革兰氏阴性组(左)的比较中具有显著(FDR小于0.05)(经Benjamini-Hochberg调整的)较小丰度(左)或显著较高丰度的蛋白质(黑色和灰色实心圆圈)或者在具有腹部病灶(左)和呼吸道病灶(右)的患者组中丰度较高的蛋白质。黑色实心圆圈展示了具有倍数变化≥2的血浆蛋白质,和实心灰色圆圈展示了具有FC<2的丰度有显著差异的蛋白质。注意在革兰氏阴性对革兰氏阳性对比中不存在显著蛋白质。突出强调了在具有腹部病灶的患者中具有高丰度的蛋白质TIMP1、MMP9、MMP8和sVSIG4,和在具有呼吸道病灶的患者中具有高丰度的蛋白质NEGR1。
图11:在幸存的患者或死于脓毒症的患者中在第1天和第2天时的有差异的血浆蛋白质丰度。A+B:在(A)发现群组和(B)验证群组中丰度有差异的血浆蛋白质的火山图。将t-检验p-值对所有鉴定出的蛋白质的丰度倍数变化进行作图,在最少10名患者中进行鉴定。该绘制图的下部中心区域的数据点(灰色,空心圆圈)指明了没有变化或具有不显著的倍数变化的蛋白质,而在左上和右上象限中的数据点指明了在死于脓毒症的患者(已故者)中具有显著(FDR小于0.05)(经Benjamini-Hochberg调整的)较小丰度(左)或者显著较高丰度的蛋白质(黑色和灰色实心圆圈)。黑色实心圆圈展示了具有显著的倍数变化≥2的血浆蛋白质,和实心灰色圆圈展示了具有FC<2的丰度有显著差异的蛋白质。
图12:A-C:用于区别幸存者和死于脓毒症的患者的在发现群组的数据集中的25种表现最好的血浆蛋白质的接受者操作特征(ROC)曲线。A左:条形图,其描绘了关于在蛋白质组数据集中鉴定出的血浆蛋白质的曲线下面积(AUC)值和来自门诊的PCT和CRP(深灰色)值。绘制图描绘了在发现群组(黑色)中关于给定蛋白质的ROC曲线以及其特征,以及CRP(灰色线)或PCT(灰色虚线)。为了简单起见,给出基因名称:VSIG4=可溶性含V-set和免疫球蛋白结构域的蛋白4,CD163=清道夫受体富半胱氨酸1型蛋白M130,SERPINA4=Kallistatin,MRC1=巨噬细胞甘露糖受体,LYVE1=淋巴管内皮透明质酸受体1,BCHE=胆碱酯酶,RNASE1=胰腺核糖核酸酶,GPLD1=磷脂酰肌醇-聚糖-特异性磷脂酶D,AFM=Afamin,IGFALS=胰岛素样生长因子结合蛋白复合物酸不稳定亚基,LCN2=嗜中性粒细胞明胶酶相关脂笼蛋白,PIK3IP1=磷酸肌醇-3-激酶互作蛋白1,AHSG=α-2-HS-糖蛋白,GM2A=神经节苷脂GM2激活物,CNDP1=β-Ala-His二肽酶,PILRA=成对免疫球蛋白样2型受体α,CD177=CD177抗原,ATP6AP1=V-型质子ATP酶亚基S1,SERPINA5=血浆丝氨酸蛋白酶抑制物,FSTL3=促滤泡素抑制素相关蛋白3,SFTPB=肺表面活性剂相关蛋白B,TNFRSF1B=肿瘤坏死因子受体超家族成员1B,WFDC2=WAP四二硫化物核心结构域蛋白2,ALPL=碱性磷酸酶,组织非特异性同工酶,TIMP1=金属蛋白酶抑制物1,crp.day.sample和PCT.day.sample=在取样日在门诊中测量的CRP和PCT。
图13:A-C:发现群组的患者的通过ELISA测量的sVSIG4的接受者操作特征(ROC)曲线和临床参数。A左:条形图,其描绘了关于在蛋白质组数据集中鉴定出的血浆蛋白质的曲线下面积(AUC)值和来自门诊的PCT和CRP(深灰色)值。绘制图描绘了在发现群组(黑色)中关于给定蛋白质的ROC曲线以及其特征,以及CRP(灰色线)或PCT(灰色虚线)。
图14:用ELISA的在血浆样品中的可溶性VSIG4检测。将来自发现群组和验证群组的SIRS和脓毒症患者的血浆样品进行稀释,并且用针对人VSIG4蛋白的夹心ELISA进行检测。A:在发现群组(264)和验证群组(96)的SIRS和脓毒症患者中sVSIG4的检测(***=p<0.0001)。B:在这两个群组的亚组“SIRS”、“SIRS+器官功能障碍(OD)”、“脓毒症”、“严重脓毒症”和“脓毒性休克”中的sVSIG4的血浆水平(***=p<0.001)。C:在微生物阳性(MiBi+)和阴性(无)血浆样品中的sVSIG4的血浆水平(****=p<0.001)。D:在具有腹部病灶或呼吸道中的病灶的脓毒症患者中的sVSIG4血浆水平(*=p<0.0139)。E:在具有SOFA-得分≤6或SOFA-得分≥7的患者(SIRS和脓毒症)中的sVSIG4水平(****=p<0.0001)。F:在幸存的、死于脓毒症的或死于其他原因的患者中在诊断后第1天或第2天时在血浆中的sVSIG4水平(****=p<0.0001)。
图15:sVSIG4(ELISA)与CRP和PCT(在取样日)的相关性。sVSIG4和CRP(A-C)或PCT(D-E)浓度的x-y图。A和D:在发现群组的所有患者中的sVSIG4相关性;B和E:在SIRS患者中的sVSIG4相关性;和C和F:在脓毒症患者中的sVSIG的相关性。
图16:用可溶性含V-set和免疫球蛋白结构域的蛋白4(sVSIG4)、磷脂酰肌醇-聚糖-特异性磷脂酶D(GPLD1)、C反应蛋白(CRP)以及与GPLD1、CRP和成髓细胞蛋白酶(PRTN3)的sVSIG4-线性组合来进行的脓毒症预测。用于脓毒症诊断的生物标志物的灵敏度、特异性、截止值(灵敏度=特异性)和AUC。A:关于单独的sVSIG4的蛋白质组数据。B:单独的sVSIG4 ELISA数据。C:单独的磷脂酰肌醇-聚糖-特异性磷脂酶D(GPLD1)蛋白质组数据。D:单独的在门诊中测量的CRP-值。E:sVSIG4和GPLD1蛋白质组数据的线性组合。F:sVSIG4(ELISA数据)和CRP临床数据的线性组合。G:sVSIG4(ELISA数据)和PRTN3的线性组合。
图17:用ELISA来进行的在血浆样品中的可溶性VSIG4检测。在按照脓毒症-3定义进行收集和分组的群组中在脓毒症患者、脓毒性休克患者和健康对照中的CRP(A)、PCT(B)、SOFA-得分(C)和sVSIG4(D)水平。
发明详述
目前还不存在单独可以导致全身炎症(特别是SIRS、血流感染、全身感染或脓毒症)的诊断的参数。包括了实验室值、血液动力学数据和器官功能以及(在历史上)其他至关重要的征候的组合来进行诊断。甚至脓毒症诊断的先决条件,有记录的或疑似的感染,目前也无法由单独的单个参数(实验室值或至关重要的征候)来清晰地进行描述。进一步地,危重患者也可能具有不需要与感染因果相关的器官功能障碍。因此,持续需要用于早期诊断全身炎症,特别是用于诊断或预后脓毒症的可靠方法。
本发明提供了体外诊断全身炎症或者预后具有全身炎症(特别是由感染因子引起的全身炎症,特别是脓毒症)的受试者的死亡风险的方法。特别地,基于蛋白质的生物标志物可溶性含V-set和免疫球蛋白结构域的蛋白4(sVSIG4)允许全身扩散性感染的早期检测。该基于蛋白质的生物标志物有利地是在生物学样品(例如体液)中容易可得的,并且可以直接进行测量,因为该生物标志物在所述生物学样品中是可溶的。
在本发明的第一个方面,提供了体外诊断全身炎症或者预后具有全身炎症的受试者的死亡风险的方法,其中所述方法包括:
a)测定在生物学样品中可溶性含V-set和免疫球蛋白结构域的蛋白4(sVSIG4)的水平,和
b)从sVSIG4的存在和/或水平得出关于全身炎症的诊断或者具有全身炎症的受试者的死亡风险的预后的结论。
根据本发明的“体外诊断”是指不需要待诊断的受试者在场的诊断,因为事先已从所述受试者中获得了生物学样品。随后,可以在所述受试者不在场的情况下分析所述生物学样品,即可以测定sVSIG4的水平。
VSIG4(含V-set和免疫球蛋白结构域的4(V-set and immunoglobulin domaincontaining 4))也称为免疫球蛋白超家族的补体受体(CRIg)和Z39Ig。VSIG4是在细胞外的苏氨酸-264上O-糖基化的I型跨膜糖蛋白。它是B7家族相关蛋白和Ig超家族成员。它牵涉在巨噬细胞上的吞噬过程并且是T-细胞增殖的强大的负调节物。VSIG4是补体替代途径转化酶的强有力的抑制剂。VSIG4包含细胞外结构域,其包含Ig-样结构域1(SEQ ID NO:4),或Ig-样结构域1(SEQ ID NO:4)和Ig-样结构域2(SEQ ID NO:5);和进一步包含跨膜结构域和胞质结构域。
VSIG4特别地选自由VSIG4同种型1(UniProt标识符Q9Y279-1)、VSIG4同种型2(UniProt标识符Q9Y279-2)和VSIG4同种型3(UniProt标识符Q9Y279-3)组成的组,或者具有与VSIG4同种型1(UniProt标识符Q9Y279-1)、VSIG4同种型2(UniProt标识符Q9Y279-2)或VSIG4同种型3(UniProt标识符Q9Y279-3)的氨基酸序列至少90%同一的氨基酸序列。
表1.VSIG4同种型的UniProt标识符和序列。从具有发行版本号202101的UniProt数据库中检索出的序列。
同种型2缺少同种型1的氨基酸322至399。在同种型3中,同种型1的氨基酸138至232被组氨酸(H)替代。细胞外Ig-样结构域1(SEQ ID NO:4)包括任一种同种型的氨基酸21至131。细胞外Ig-样结构域2(SEQ ID NO:5)包括同种型1和同种型2的氨基酸143-226,而在同种型3中是缺少的。
表2.VSIG4的Ig-样结构域1、Ig-样结构域2、细胞外结构域、跨膜结构域和胞质结构域的序列。
可溶性VSIG4(sVSIG4)这种蛋白质优选地包含VSIG4的细胞外结构域或细胞外结构域的片段。在另一个优选的实施方案中,sVSIG4不包含VSIG4的跨膜结构域和胞质结构域。在一个特别的实施方案中,sVSIG4包含VSIG4的细胞外结构域或细胞外结构域的片段,并且不包含VSIG4的跨膜结构域和胞质结构域。
sVSIG4是可溶性蛋白质,即sVSIG4是优选地不与细胞相结合或整合入膜(例如细胞膜)中的游离蛋白质。sVSIG4优选地在血浆中是可溶的,特别是在人血浆中。在一个优选的实施方案中,sVSIG4溶解在生物学样品中,特别是在生物学样品的非细胞级分中。因此,可以在无细胞的或细胞耗竭的生物学样品中检测sVSIG4。
优选地,所述细胞外结构域包含Ig-样结构域1(SEQ ID NO:4),或Ig-样结构域1(SEQ ID NO:4)和Ig-样结构域2(SEQ ID NO:5)。在另一个优选的实施方案中,所述细胞外结构域包含SEQ ID NO:6中所定义的序列,其包含Ig-样结构域1(SEQ ID NO:4)和Ig-样结构域2(SEQ ID NO:5)以及在Ig-样结构域1(SEQ ID NO:4)与Ig-样结构域2(SEQ ID NO:5)之间的第一连接体区域和在Ig-样结构域2(SEQ ID NO:5)之后的第二连接体区域。
测定sVSIG4或任何其他生物标志物的“水平”与测定在生物学样品中的sVSIG4或此类其他生物标志物的浓度是同义的。所述水平可以用在下面进一步解释的各种方法来测定。
根据本发明的“全身炎症”是指受试者(优选地,人受试者)对于有害刺激的全身应答。所述有害刺激为例如感染因子,即病原体。所述有害刺激也可以为创伤、多发性创伤或严重烧伤。在所述全身炎症不由感染因子引起的那种情况下,所述应答典型地牵涉受试者的免疫系统的强烈反应,包括从免疫细胞释放细胞因子,从而导致受试者的全身反应(与局部反应相反)。
“感染”是指受试者被感染因子(即病原体)侵袭。因此,全身炎症可以由感染因子引起。感染因子,即病原体,可以为细菌、病毒或真菌,特别是细菌或病毒。也可能的是,多于一种类型的病原体感染所述受试者,例如被细菌和真菌感染。
由感染因子引起的全身炎症优选地为脓毒症、全身感染或血流感染,更特别地脓毒症。
全身炎症也可以不由感染因子引起。这典型地是指无菌性全身炎症,并且意味着没有感染因子是可检测到的。优选地,不由感染因子引起的全身炎症为被称为全身炎症反应综合征(SIRS)的医学状况。SIRS以受试者的全身反应为特征。
“全身感染”是以局部开始但是随后跨越受试者的器官进行扩散的感染。因此,在人中的全身感染典型地同时牵涉身体的不同部分或者多于一个的身体系统。
“血流感染”是指在血液中存在的感染。血流感染典型地发生于在外科手术期间或者由于异物(例如导管或心脏瓣膜)病原体进入血流之时。血流感染包括菌血症、病毒血症和真菌血症,取决于病原体(分别为细菌、病毒或真菌)。菌血症是最常见的。
“脓毒症”可以以几种方式来定义。按照“脓毒症-2定义”(Int.Arch.AllergyAppl.Immunol.1984,73:97-103),过度的炎症反应(包括所谓的细胞因子风暴)对于脓毒症的发病机制负有责任。具有疑似或经证明的感染的SIRS被称为脓毒症。除了要求有记录的或疑似的感染外,German Sepsis Society在其脓毒症定义中还列出了四个SIRS标准:(1)发热(≥38.0℃)或低体温(≤36.0℃),(2)心动过速(心率≥90/分钟),(3)呼吸急促(呼吸频率≥20/分钟)或换气过度(通过采取具有PaCO2≤4.3kPa或33mmHg的动脉血气分析所确证的),(4)白细胞增多(≥12,000/mm
按照脓毒症-2定义的“严重脓毒症”是指其中一个或多个器官衰竭的医学状况。如果该事件还导致血压的极端下降,其中尽管流体给予充足,但是心脏不再能够通过严重扩张的血管来泵送血液,并且需要血管加压药,那么这被称为“脓毒性休克”。
在本发明的意义上,术语“脓毒症”包括“严重脓毒症”和“脓毒性休克”,除非单独指明。
“脓毒症-3定义”(JAMA 2016,315:801-10;JAMA 2016,315:775-87)用脓毒症的经验性的、基于数据的和由证据驱动的定义代替了SIRS标准。因此,按照脓毒症-3定义的脓毒症被定义为由失调的对于感染的宿主应答所引起的威胁生命的器官功能障碍。因为根据定义,器官衰竭已经是脓毒症的组成部分,因此在该定义中不使用严重脓毒症这一类别。按照该定义,如果(A)存在经诊断的或疑似的感染并且(B)序贯性器官衰竭评估(SequentialOrgan Failure Assessment)(SOFA;参见Intensive Care Med.1996,22:707-10)得分增加≥2个点,那么存在脓毒症。按照该定义,脓毒性休克是脓毒症的子集,其中作为基础的循环和细胞/代谢异常严重到足以实质上增加死亡率。由于这个原因,除了严重低血压外,为了诊断脓毒性休克还测量乳酸盐浓度,并且使用在容积置换后≥2mmol/L的值作为关于脓毒性休克的标准(JAMA 2016,315:775-87)。除了患者的重症监护管理外,还建议使用所谓的快速序贯性器官衰竭评估(Quick Sequential Organ Failure Assessment)(qSOFA;参见Jama 2016,315:762-74)得分(一种缩减的用于检测器官衰竭的程序)来密集监测具有疑似全身感染的患者。除了ITS部门之外定期收集qSOFA得分已作为用于检测对高风险患者的生命威胁的预测值而得到接受,但是它只能由受过培训的工作人员来施行并且需要时间。
另外,目前使用微生物学和分子生物学方法来检测感染或疑似感染,特别是全身感染或疑似全身感染,其是脓毒症、严重脓毒症或脓毒性休克的一部分(按照脓毒症-2和脓毒症-3)。
目前的诊断学是不利的,因为典型地样品是从看起来为可能的感染病灶的所有身体位置取得的,例如感染病灶、血液、脑脊液、支气管肺泡灌洗物或尿。应当从哪些部位取得样品的决定需要治疗团队方面的仔细考虑。如果怀疑血流感染(例如,由于导管诱导的感染),那么还建议来自导管的培养。
根据本发明,不需要这个关于感染病灶定位的决定做出过程。本发明仅需要一个生物学样品,典型地是全血或分离自全血的血浆。不需要做出是否被怀疑感染的决定,因为本方法允许基于在生物学样品中sVSIG4的水平来区别由感染因子引起的全身炎症和不由感染因子引起的全身炎症,特别是区别脓毒症和SIRS。在生物学样品中sVSIG4的水平的测定是快速和可靠的。快速测定是尤其有利的,因为诊断越早,治疗开始就越早,这伴随着死亡率的降低。例如,如果通过使用特异性生物标志物而怀疑和诊断细菌感染(特别地,其引起脓毒症),那么可以容易地起始用广谱抗生素进行的疗法。快速开始疗法对于脓毒症管理是尤其关键性的。用特定抗生素进行的疗法可以在分析血液培养物后起始,但是这不是时间要求严格的,只要已起始用广谱抗生素进行的治疗。因此,本发明通过使得全身炎症(特别是由感染因子引起的)的治疗的快速开始成为可能而有所帮助。
脓毒症最经常由细菌性病原体引起,虽然病毒、原生动物和真菌也罕见地触发脓毒症。抗生素的早期靶向使用可以包括由细菌性病原体引起的炎症反应,减少严重过程,并且降低死亡率。相反地,诊断的延迟可以增加严重后果例如器官衰竭、慢性疼痛、截肢或死亡的风险。尽管认识到了早期诊断的重要性,但是由于具有多种多样的生理学和生物化学变化和表现的该疾病的复杂性,诊断仍然是困难的。
关于脓毒症疗法,已建立了一“束(bundle)”疗法,其比独个治疗干预在后果方面产生更大的益处。目前的脓毒症束包括测定乳酸盐、获得血液培养物和施用抗生素。
具有全身炎症(特别是脓毒症)的受试者的死亡风险涉及死于全身炎症(特别是死于脓毒症)的风险。本发明允许基于sVSIG4的存在和/或水平来测定归因于全身炎症(特别是归因于脓毒症)的死亡风险。
典型地,死亡风险是在某个时间范围内来定义的,例如死亡风险可以是指在全身炎症(特别是脓毒症)的诊断后至少7天、至少10天、至少15天、至少20天、至少25天或至少30天内,优选地在28天内的死亡的风险。
所述风险可以表示为以百分比表示的概率。例如,在28天内20%的具有全身炎症的受试者的死亡风险意味着存在20%的在28天内所述受试者死于全身炎症的概率。
倘若受试者处于较高的死于全身炎症的风险下,即具有全身炎症的受试者具有高的死亡风险,例如60%、70%、80%或90%,那么所述受试者可以经历有针对性的强化监测以便在早期阶段检测并发症。可以例如将受试者转移至过渡监护病房或转移至重症监护病房。因此,在临床实践中了解死亡风险是非常有益的。
优选地,死亡风险可以在疾病进程中非常早期地进行检测,典型地在诊断后第1或2天。受试者典型地具有较高的死于由感染因子引起的全身炎症(典型地在28天内)的风险,如果在生物学样品中(优选地在人血浆中)sVSIG4的水平是高的,例如,至少4500pg/ml、至少9000pg/ml、至少15000pg/ml、至少40000pg/ml或至少50000pg/ml。
因此,在本发明的一个优选的实施方案中,至少4500pg/ml、至少9000pg/ml、至少15000pg/ml、至少40000pg/ml或至少50000pg/ml的在生物学样品中sVSIG4的水平指明了在28天内至少50%的具有由感染因子引起的全身炎症的受试者的死亡风险。特异性优选地为大约82%。在一个优选的实施方案中,所述受试者为人受试者。优选地,所述生物学样品为血浆。
在本发明的一个特别的实施方案中,至少4500pg/ml、优选地至少9000pg/ml、更优选地至少15000pg/ml、更优选地至少40000pg/ml、更优选地至少50000pg/ml的在生物学样品中sVSIG4的水平指明了在28天内至少50%的具有由感染因子引起的全身炎症的受试者的死亡风险。特异性优选地为大约82%。在一个优选的实施方案中,所述受试者为人受试者。优选地,所述生物学样品为血浆。
在本发明的另一个优选的实施方案中,至少70000pg/ml、至少75000pg/ml、至少80000pg/ml或至少85000pg/ml的在生物学样品中sVSIG4的水平指明了在28天内至少30%的具有由感染因子引起的全身炎症的受试者的死亡风险。特异性优选地为大约85%。在一个优选的实施方案中,所述受试者为人受试者。优选地,所述生物学样品为血浆。
在本发明的一个特别的实施方案中,至少70000pg/ml、优选地至少75000pg/ml、更优选地至少80000pg/ml、更优选地至少85000pg/ml的在生物学样品中sVSIG4的水平指明了在28天内至少30%的具有由感染因子引起的全身炎症的受试者的死亡风险。特异性优选地为大约85%。在一个优选的实施方案中,所述受试者为人受试者。优选地,所述生物学样品为血浆。
在生物学样品中sVSIG4的水平对于疗法管理也具有影响。如果在生物学样品中sVSIG4的水平指明了由感染因子引起的全身炎症,例如血流感染或脓毒症,那么可以相应地治疗所述受试者。治疗者由此得知何时采取治疗措施。有利的是,本发明的方法允许非常快速的疗法决策。例如,可以一知道sVSIG4的水平就起始用抗生素进行的疗法。
如果需要,可以进行鉴别诊断。例如,倘若因为受试者具有例如导管而怀疑血流感染,那么可以开始来自导管的培养并且其揭示潜在的病原体。倘若怀疑脓毒症,那么血液培养可以揭示负有责任的病原体。进一步的诊断措施也可以用于区分脓毒症、严重脓毒症和脓毒性休克的目的。然而,根据本发明的方法给出了关于下述方面的快速指示:受试者是否罹患由或不由感染因子引起的全身炎症;和在由感染因子引起的全身炎症的情况下,受试者是否罹患血流感染或脓毒症。
所述方法也可以包括用于诊断全身炎症(优选地,由感染因子引起的全身炎症)的进一步的参数,所述进一步的参数特别地为序贯性器官衰竭评估(SOFA)得分、快速序贯性器官衰竭评估(qSOFA)得分、急性生理学和慢性健康评价II(Acute Physiology andChronic Healthy Evaluation II)(APACHE-II)得分和/或简化急性生理学得分II(Simplified Acute Physiology Score II)(SAPS-II)。
“急性生理学和慢性健康评价II”(APACHE-II)得分是一种ICU疾病严重度分类系统。它在进入ICU后24小时内应用,并且基于几个测量来计算从0至71的整数得分。较高的得分相应于更严重的疾病和更高的死亡风险。从下面的变量来计算点得分:血气张力(PaO2)或肺泡-动脉梯度(AaDO2)、体温、平均动脉压、血液pH、心率、呼吸频率、血清钠、血清钾、肌酸酐、血细胞比容、白细胞计数、格拉斯哥昏迷量表。
简化急性生理学得分II(SAPS-II)也是在ICU中的一种疾病严重度分类评分系统。从下列参数来计算点得分:年龄、心率、收缩期血压、体温、格拉斯哥昏迷量表、机械通气或连续气道正压通气(CPAP)、血气张力(PaO2)、吸入氧气分数(FiO2)、尿排出量、血液尿素氮、钠、钾、碳酸氢盐、胆红素、白细胞计数、慢性疾病、入院类型。
在一个优选的实施方案中,至少20pg/ml、至少50pg/ml、至少100pg/ml、至少150pg/ml、至少200pg/ml或至少250pg/ml的在生物学样品中sVSIG4的水平指明了全身炎症。在一个优选的实施方案中,所述受试者为人受试者。优选地,所述生物学样品为血浆。
在一个特别的实施方案中,至少20pg/ml、优选地至少50pg/ml、更优选地至少100pg/ml、更优选地至少150pg/ml、更优选地至少200pg/ml、更优选地至少250pg/ml的在生物学样品中sVSIG4的水平指明了全身炎症。在一个优选的实施方案中,所述受试者为人受试者。优选地,所述生物学样品为血浆。
因此,至少20pg/ml、至少50pg/ml、至少100pg/ml、至少150pg/ml、至少200pg/ml或至少250pg/ml的sVSIG4的水平指明,所述受试者不是健康的,并且特别地具有全身炎症。所述全身炎症可以是任何类型的全身炎症,包括SIRS和脓毒症。
在一个优选的实施方案中,至少20pg/ml、至少50pg/ml、至少100pg/ml、至少150pg/ml、至少200pg/ml或至少250pg/ml并且小于100000pg/ml、小于50000pg/ml、小于12500pg/ml、小于10000pg/ml或小于6000pg/ml的在生物学样品中sVSIG4的水平指明了SIRS。在一个优选的实施方案中,所述受试者为人受试者。优选地,所述生物学样品为血浆。
在一个特别的实施方案中,至少20pg/ml、优选地至少50pg/ml、更优选地至少100pg/ml、更优选地至少150pg/ml、更优选地至少200pg/ml、更优选地至少250pg/ml并且小于100000pg/ml、优选地小于50000pg/ml、更优选地小于12500pg/ml、更优选地小于10000pg/ml、更优选地小于6000pg/ml的在生物学样品中sVSIG4的水平指明了SIRS。在一个优选的实施方案中,所述受试者为人受试者。优选地,所述生物学样品为血浆。
在另一个优选的实施方案中,至少200pg/ml、至少250pg/ml、至少300pg/ml、至少350pg/ml或至少400pg/ml的在生物学样品中sVSIG4的水平指明了血流感染。例如,当怀疑或证明感染时,所指出的水平指向血流感染。在一个优选的实施方案中,所述受试者为人受试者。优选地,所述生物学样品为血浆。
在一个特别的实施方案中,至少200pg/ml、优选地至少250pg/ml、更优选地至少300pg/ml、更优选地至少350pg/ml、更优选地至少400pg/ml的在生物学样品中sVSIG4的水平指明了血流感染。例如,当怀疑或证明感染时,所指出的水平指向血流感染。在一个优选的实施方案中,所述受试者为人受试者。优选地,所述生物学样品为血浆。
在另一个优选的实施方案中,至少500pg/ml、至少550pg/ml、至少600pg/ml、至少650pg/ml、至少700pg/ml、至少750pg/ml、至少1000pg/ml、至少1500pg/ml、至少2500pg/ml、至少3500pg/ml、至少5000pg/ml、至少7500pg/ml、至少10000pg/ml或至少12500pg/ml的在生物学样品中sVSIG4的水平指明了脓毒症。在一个优选的实施方案中,所述受试者为人受试者。优选地,所述生物学样品为血浆。
在一个特别的实施方案中,至少500pg/ml、优选地至少550pg/ml、更优选地至少600pg/ml、更优选地至少650pg/ml、更优选地至少700pg/ml、更优选地至少750pg/ml、更优选地至少1000pg/ml、更优选地至少1500pg/ml、更优选地至少2500pg/ml、更优选地至少3500pg/ml、更优选地至少5000pg/ml、更优选地至少7500pg/ml、更优选地至少10000pg/ml、更优选地至少12500pg/ml的在生物学样品中sVSIG4的水平指明了脓毒症。在一个优选的实施方案中,所述受试者为人受试者。优选地,所述生物学样品为血浆。
特别地,至少1500pg/ml、至少5000pg/ml、至少10000pg/ml或至少12500pg/ml的截止值允许鉴定具有脓毒症而不具有SIRS的受试者。在一个优选的实施方案中,所述受试者为人受试者。优选地,所述生物学样品为血浆。
因此,在一个实施方案中,至少1500pg/ml、至少5000pg/ml、至少10000pg/ml或至少12500pg/ml的在生物学样品中sVSIG4的水平指明了脓毒症,并且区别SIRS和脓毒症。在一个优选的实施方案中,所述受试者为人受试者。优选地,所述生物学样品为血浆。
在一个特别的实施方案中,至少1500pg/ml、优选地至少5000pg/ml、更优选地至少10000pg/ml、更优选地至少12500pg/ml的在生物学样品中sVSIG4的水平指明了脓毒症,并且区别SIRS和脓毒症。在一个优选的实施方案中,所述受试者为人受试者。优选地,所述生物学样品为血浆。
在本发明的情景下,蛋白质sVSIG4也可以被称为生物标志物。本发明的意义下,“生物标志物”例如是指生物学化合物,例如肽、多肽或蛋白质,优选地多肽或蛋白质。因此,所述生物标志物可以是基于蛋白质的,即所述生物标志物包含多肽或蛋白质,优选地为多肽或蛋白质。
本发明的意义下,生物标志物优选地为人的多肽或蛋白质。生物标志物的名称在本文中通常以全名和在括号中的其缩写来呈现,或者仅呈现缩写。所有生物标志物及其序列和缩写都从UniProt数据库中检索。生物标志物的缩写(也称为输入项名称)可以备选地具有后缀“_HUMAN”。具有和没有该后缀,意味着相同的多肽或蛋白质。
在一个方面,其在来自受试者的生物学样品中的水平超过参考水平(截止值)的生物标志物指明了全身炎症本身。相同或另一个参考水平(优选地,更高的参考水平)指明了脓毒症。如果一个水平的数值高于参考水平的数值,那么该水平超过该参考水平。测定水平的方法可以为任何合适的方法,并且将会在下面进一步进行描述。
在本文中所使用的“截止值”是指用于通过比较测定法结果与预先确定的截止值/sVSIG4水平来评估诊断、预后或治疗效力结果的测定法截止值(阈值或参考水平),其中所述预先确定的截止值/sVSIG4水平已经与各种临床参数(例如,疾病的存在,疾病的阶段,疾病的严重度,疾病的进展、无进展或改善,等等)相联系或关联。本公开内容提供了示例性的预先确定的水平。然而,众所周知,截止值可以依赖于免疫测定法(例如,所采用的抗体、反应条件、样品纯度等)的性质而变化。进一步地完全在本领域技术人员的普通技能之内的是,使在本文中的公开内容适应于其他免疫测定法,以基于由本公开内容所提供的描述来获得用于那些其他免疫测定法的免疫测定法特异性的截止值。虽然预先确定的截止值/sVSIG4水平的精确值可以在测定法之间变化,但是在本文中所描述的相关性通常是适用的。
截止值/参考水平在本文中可以用于确定个体是罹患由感染因子引起的全身炎症还是罹患不由感染因子引起的全身炎症,或者是没有全身炎症的健康受试者。sVSIG4或者与其他关于感染的标志物相组合的sVSIG4的参考水平可以用于确定受试者是罹患由感染因子引起的全身炎症还是罹患不由感染因子引起的全身炎症,或者是没有全身炎症的健康受试者。单独的或以特定组合进行使用的sVSIG4的参考水平可以是预先确定的截止值或者从对照受试者测定的水平,其中那个对照受试者已知是没有全身炎症的健康受试者、具有不由感染因子引起的全身炎症(例如,SIRS)的受试者或具有由感染因子引起的全身炎症的受试者。
截止值(或预先确定的截止值)可以通过来自患者组的生物学样品的接受者操作曲线(ROC)分析来确定。在生物学领域中通常已知的ROC分析是一个测试区别一种条件与另一种条件的能力的测定,例如,测定标志物在鉴定具有由或不由感染因子引起的全身炎症(特别是脓毒症、严重脓毒症或脓毒性休克)的受试者中的表现。备选地,截止值可以通过患者组的生物学样品的四分位数分析(quartile analysis)来确定。截止值也可以通过选择相应于在第25-75个百分位数范围中的任何值的值(优选地,相应于第25个百分位数、第50个百分位数或第75个百分位数,优选地第75个百分位数的值)来确定。
截止值可以例如如在图16中所显示的那样通过实验来确定。例如,截止值可以是灵敏度和特异性曲线交叉之处的水平。然而,也可以选择较低的截止值,其将会伴随有以较低特异性为代价的灵敏度增加。较高的截止值也是可能的,其将会伴随有较低的灵敏度和增加的特异性。高灵敏度典型地意味着,鉴定出每个阳性受试者,然而以假阳性为代价。高特异性意味着,未患病的受试者被可靠地排除,但是以假阴性为代价。取决于一个人的需要,可以选择最佳的截止值。
在另一个方面,相比于来自对照受试者的相当的生物学样品而言,所述生物标志物在来自具有全身炎症(特别是脓毒症)的受试者的生物学样品中是丰度有差异的。所述对照受试者可以为健康受试者,或者没有经诊断的或疑似的感染的受试者(非感染的受试者),或者具有脓毒症的阴性诊断的受试者。例如,所述对照受试者为罹患SIRS的受试者。
术语“肽”、“多肽”和“蛋白质”可以同义地进行使用,并且是指氨基酸的聚合物并且不限于最小或最大长度。全长蛋白质和其片段均被该定义所涵盖。
还涵盖了肽、多肽或蛋白质的翻译后修饰,例如,糖基化、乙酰化、羟基化、磷酸化和/或氧化,特别是糖基化。
术语“丰度有差异的”或“差异表达的”是指相比于对照受试者而言,在从具有例如全身炎症(特别是脓毒症)的受试者中获取的生物学样品中生物标志物的数量(即所测定的水平)的差异。因此,相比于对照受试者而言,所述生物标志物的水平可以增加或降低。
如果在一个生物学样品中生物标志物的水平不同于在另一个样品中生物标志物的水平,那么所述生物标志物在两个生物学样品之间是丰度有差异的或差异表达的。例如,如果相比于另一个生物学样品而言生物标志物的水平增加至少大约20%、至少大约30%、至少大约50%、至少大约80%、至少大约100%、至少大约200%、至少大约400%,或者如果它在一个生物学样品中是可检测的而在另一个生物学样品中是不可检测的,那么所述生物标志物在两个生物学样品中是丰度有差异的或差异表达的。
所述全身炎症可以由感染因子引起或不由感染因子引起。倘若所述全身炎症由感染因子引起,那么它可以为脓毒症、全身感染或血流感染。倘若所述全身炎症不由感染因子引起,例如没有感染因子是可检测到的,那么所述全身炎症可以为SIRS。
典型地,所述感染因子为细菌、真菌或病毒。在一个实施方案中,所述细菌为革兰氏阳性或革兰氏阴性细菌。
所述病毒可以为甲型流感病毒、乙型流感病毒、呼吸道合胞病毒(RSV)、鼻病毒和/或冠状病毒,特别是重症急性呼吸综合征冠状病毒2型(SARS-CoV2)。
在一个非常优选的实施方案中,所述全身炎症由感染因子引起,并且为脓毒症、严重脓毒症或脓毒性休克,按照脓毒症-2定义。
在一个实施方案中,所述方法进一步包括:
-测定在所述生物学样品中一个或多个另外的生物标志物的水平,和
-在步骤b)中,从sVSIG4的存在和/或水平以及与之相联合的所述一个或多个另外的生物标志物的存在和/或水平得出关于全身炎症的诊断或者具有全身炎症的受试者的死亡风险的预后的结论。
所述一个或多个另外的生物标志物可以用于确证或削弱所述诊断或预后。所述一个或多个另外的生物标志物优选地是在与sVSIG4相同的生物学样品中可检测的并且优选地也是可溶的,因为它们未结合至细胞或膜。虽然所述方法允许仅基于作为生物标志物的sVSIG4来进行诊断和预后,但是一个或多个进一步的生物标志物因此可以是有帮助的。
所述一个或多个另外的生物标志物可以通过实验来揭示,例如,因为分析了在脓毒症和SIRS患者中的丰度有差异的蛋白质或者因为比较了后来死于全身炎症的患者的生物标志物的水平。
所述一个或多个另外的生物标志物优选地选自由下列各项组成的组:IgGFc结合蛋白(FCGBP),GDNF家族受体α-2(GFRA2),羧肽酶D(CBPD),脱唾液酸糖蛋白受体1(ASGR1),低氧上调蛋白1(HYOU1),生腱蛋白(TENA),多聚免疫球蛋白受体(PIGR),Sushi,冯·维勒布兰德因子A型,含EGF和正五聚蛋白结构域的蛋白1(SVEP1),白介素-1受体2型(IL1R2),层粘连蛋白亚基β-1(LAMB1),内质网分子伴侣BiP(BIP),Peroxidasin同源物(PXDN),促滤泡素抑制素相关蛋白1(FSTL1),富亮氨酸α-2糖蛋白(A2GL),金属蛋白酶抑制物1(TIMP1),NPC细胞内胆固醇转运蛋白2(NPC2),肽聚糖识别蛋白1(PGRP1),乳转铁蛋白(TRFL),Dystonin(DYST),脂多糖结合蛋白(LBP),触珠蛋白(HPT),脱唾液酸糖蛋白受体2(ASGR2),非分泌性核糖核酸酶(RNAS2),天青杀素(Azurocidin)(CAP7),壳多糖酶-3-样蛋白1(CH3L1),肿瘤坏死因子受体超家族成员1B(TNR1B),II类HLA组织相容性抗原γ链(HG2A),嗅介蛋白-4(OLFM4),白细胞免疫球蛋白样受体超家族A成员3(LIRA3),胰岛素样生长因子结合蛋白2(IBP2),生长/分化因子15(GDF15),层粘连蛋白亚基α-2(LAMA2),酪氨酸蛋白磷酸酶非受体类型底物1(SHPS1),Basigin(BASI),纤维介素(Fibroleukin)(FGL2),组织蛋白酶Z(CATZ),E-选择蛋白(LYAM2),淋巴管内皮透明质酸受体1(LYVE1),含解联蛋白和金属蛋白酶结构域的蛋白9(ADAM9),桥粒芯胶黏蛋白-2(DSC2),白介素-1受体样1(ILRL1),基质金属蛋白酶-9(MMP9),抑半胱氨酸蛋白酶蛋白-C(CYTC),白介素-18结合蛋白(I18BP),成对免疫球蛋白样2型受体α(PILRA),巨噬细胞甘露糖受体1(MRC1),骨桥蛋白(OSTP),清道夫受体富半胱氨酸1型蛋白M130(C163A),整合膜蛋白2B(ITM2B),纤维蛋白原样蛋白1(FGL1),血清淀粉样A-1蛋白(SAA1),白介素-1受体拮抗剂蛋白(IL1RA),核结合蛋白-1(NUCB1),高尔基体膜蛋白1(GOLM1),肌营养不良蛋白聚糖(DAG1),CD177抗原(CD177),碱性磷酸酶,组织非特异性同工酶(PPBT),嗜中性粒细胞胶原酶(MMP8),成髓细胞蛋白酶(PRTN3),嗜中性粒细胞弹性蛋白酶(ELNE),β-1,4-半乳糖基转移酶1(B4GT1),C反应蛋白(CRP),WAP四二硫化物核心结构域蛋白2(WFDC2),促滤泡素抑制素相关蛋白3(FSTL3),胰腺核糖核酸酶(RNAS1),嗜中性粒细胞明胶酶相关脂笼蛋白(NGAL),血清淀粉样A-2蛋白(SAA2),胰石蛋白-1-α(REG1A),血浆激肽释放酶(KLKB1),磷脂酰胆碱甾醇酰基转移酶(LCAT),血清转铁蛋白(TRFE),降钙素原(PCT),补体受体2型(CR2),电压依赖性钙通道亚基α-2/δ-1(CA2D1),印度刺猬蛋白(IHH),血清对氧磷酶/内酯酶3(PON3),纤连蛋白(FINC),β-Ala-His二肽酶(CNDP1),胰岛素样生长因子结合蛋白复合物酸不稳定亚基(ALS),磷脂酰肌醇-聚糖-特异性磷脂酶D(PHLD),胰岛素样生长因子结合蛋白3(IBP3),炭疽毒素受体1(ANTR1),神经元生长调节物1(NEGR1),血浆丝氨酸蛋白酶抑制物(IPSP),Intelectin-1(ITLN1),Kallistatin(KAIN),成纤维细胞生长因子受体1(FGFR1),α-2-HS-糖蛋白(FETUA),胆碱酯酶(CHLE),Afamin(AFAM),组织蛋白酶F(CATF),胆固醇酯转移蛋白(CETP),钙黏着蛋白相关家族成员5(CDHR5),间-α-胰蛋白酶抑制物重链H2(ITIH2),N-乙酰基胞壁酰基-L-丙氨酸酰胺酶(PGRP2),接触蛋白-1(CNTN1),载脂蛋白(a)(APOA),具有EF手结构域的细胞生长调节物蛋白1(CGRE1),凝血因子VIII(FA8),磷脂转移蛋白(PLTP),蛋白Z依赖性蛋白酶抑制物(ZPI),α-1-抗胰凝乳蛋白酶(AACT),维生素K依赖性蛋白S(PROS),凝血因子XIII B链(F13B),异戊二烯基半胱氨酸氧化酶1(PCYOX),血清淀粉样A-4蛋白(SAA4),载脂蛋白C-I(APOC1),脯氨酰基内肽酶FAP(SEPR),二肽基肽酶4(DPP4),血管紧张素转变酶2(ACE2),白介素-1受体辅助蛋白(IL1AP),二-N-乙酰基壳二糖酶(DIAC),肝细胞生长因子激活物(HGFA),含硒蛋白P(SEPP1),具有血小板反应蛋白基序的A解联蛋白和金属蛋白酶13(ATS13),单核细胞分化抗原CD14(CD14),补体因子H相关蛋白1(FHR1),冯·维勒布兰德因子(VWF),层粘连蛋白亚基γ-1(LAMC1),清道夫受体类别A成员5(SCAR5),ADAMTS-样蛋白4(ATL4),滞蛋白-1(CUL1),肺表面活性剂相关蛋白B(PSPB),成神经细胞瘤致肿瘤性阻抑物(NBL1),神经节苷脂GM2激活物(SAP3),蛋白质二硫化物异构酶CRELD1(CREL1),钙黏着蛋白相关家族成员2(CDHR2),胰凝乳蛋白酶样弹性蛋白酶家族成员3B(CEL3B),磷酸肌醇-3-激酶互作蛋白1(P3IP1),胰石蛋白-1-β(REG1B),激肽原-1(KNG1),多功能蛋白聚糖核心蛋白(CSPG2),EMILIN-2(EMIL2),癌胚抗原相关细胞黏附分子6(CEAM6),纤调蛋白聚糖(FMOD),β-半乳糖苷α-2,6-唾液酸转移酶1(SIAT1),白细胞免疫球蛋白样受体亚家族B成员5(LIRB5),潜在转化生长因子β结合蛋白2(LTBP2),嗜铬粒蛋白-A(CMGA),和肾上腺肌割蛋白(ADSV),富组氨酸糖蛋白(HRG),间-α-胰蛋白酶抑制物重链H1(ITIH1),和间-α-胰蛋白酶抑制物重链H3(ITIH3),其中在步骤b)中,关于全身炎症的诊断得出结论。优选地,所述全身炎症为脓毒症。
在一个特别的实施方案中,在所述生物学样品中的所述一个或多个另外的生物标志物选自下列中的一项或多项:
(i)间-α-胰蛋白酶抑制物重链H2(ITIH2),间-α-胰蛋白酶抑制物重链H1(ITIH1),磷脂酰肌醇-聚糖-特异性磷脂酶D(PHLD),N-乙酰基胞壁酰基-L-丙氨酸酰胺酶(PGRP2),Kallistatin(KAIN),α-2-HS-糖蛋白(FETUA),间-α-胰蛋白酶抑制物重链H3(ITIH3),Afamin(AFAM),巨噬细胞甘露糖受体1(MRC1),胆碱酯酶(CHLE),胰岛素样生长因子结合蛋白复合物酸不稳定亚基(ALS),血清转铁蛋白(TRFE),磷脂酰胆碱甾醇酰基转移酶(LCAT),β-Ala-His二肽酶(CNDP1),血浆激肽释放酶(KLKB1),α-1-抗胰凝乳蛋白酶(AACT),单核细胞分化抗原CD14(CD14),嗜中性粒细胞明胶酶相关脂笼蛋白(NGAL),肝细胞生长因子激活物(HGFA),清道夫受体富半胱氨酸1型蛋白M130(C163A),纤连蛋白(FINC),富组氨酸糖蛋白(HRG),和α-1-抗胰蛋白酶(A1AT);
(ii)磷脂酰肌醇-聚糖-特异性磷脂酶D(PHLD),Kallistatin(KAIN),α-2-HS-糖蛋白(FETUA),Afamin(AFAM),巨噬细胞甘露糖受体1(MRC1),胆碱酯酶(CHLE),胰岛素样生长因子结合蛋白复合物酸不稳定亚基(ALS),β-Ala-His二肽酶(CNDP1),嗜中性粒细胞明胶酶相关脂笼蛋白(NGAL),清道夫受体富半胱氨酸1型蛋白M130(C163A),血浆丝氨酸蛋白酶抑制物(IPSP),富亮氨酸α-2-糖蛋白(A2GL),胰石蛋白-1-α(REG1A),脂多糖结合蛋白(LBP),淋巴管内皮透明质酸受体1(LYVE1),胰岛素样生长因子结合蛋白3(IBP3),补体受体2型(CR2),纤连蛋白(FINC),脱唾液酸糖蛋白受体2(ASGR2),碱性磷酸酶,组织非特异性同工酶(PPBT),血清淀粉样A-2蛋白(SAA2),和二肽基肽酶4(DPP4);
(iii)间-α-胰蛋白酶抑制物重链H2(ITIH2),N-乙酰基胞壁酰基-L-丙氨酸酰胺酶(PGRP2),和单核细胞分化抗原CD14(CD14);
(iv)间-α-胰蛋白酶抑制物重链H2(ITIH2);
(v)磷脂酰肌醇-聚糖-特异性磷脂酶D(PHLD),富亮氨酸-α-2-糖蛋白(A2GL),和胰岛素样生长因子结合蛋白3(IBP3);
(vi)磷脂酰肌醇-聚糖-特异性磷脂酶D(PHLD);
(vii)C反应蛋白(CRP);
(viii)降钙素原(PCT);
(ix)胰石蛋白-1-α(REG1A);
(x)成髓细胞蛋白酶(PRTN3);
(xi)CRP和PCT,
其中在步骤b)中,关于全身炎症的诊断得出结论。优选地,所述全身炎症为脓毒症。
在本发明的意义下,作为生物标志物的sVSIG4可以与上面所记述的一个或多个另外的生物标志物中的一个或多个相组合。特别地,作为生物标志物的sVSIG4可以与组(i)至(xi)中的一个或多个相组合。因此,在一个实施方案中,在步骤a)中,除了测定sVSIG4的水平外,还测定在所述生物学样品中一个或多个进一步的可溶性蛋白质(其可以用作生物标志物)的水平。虽然仅测定sVSIG4的水平就足够了,但是测定进一步的可溶性蛋白质的水平对于诊断来说可能是有益的。
在另一个优选的实施方案中,所述一个或多个另外的生物标志物优选地选自由下列各项组成的组:激肽原-1(KNG1),生腱蛋白(TENA),多功能蛋白聚糖核心蛋白(CSPG2),钙黏着蛋白相关家族成员2(CDHR2),EMILIN-2(EMIL2),骨桥蛋白(OSTP),酪氨酸蛋白磷酸酶非受体类型底物1(SHPS1),胰石蛋白-1-β(REG1B),癌胚抗原相关细胞黏附分子6(CEAM6),成对免疫球蛋白样2型受体α(PILRA),II类HLA组织相容性抗原γ链(HG2A),清道夫受体富半胱氨酸1型蛋白M130(C163A),纤维介素(FGL2),促滤泡素抑制素相关蛋白3(FSTL3),纤调蛋白聚糖(FMOD),β-半乳糖苷α-2,6-唾液酸转移酶1(SIAT1),成髓细胞蛋白酶(PRTN3),白细胞免疫球蛋白样受体亚家族B成员5(LIRB5),N-乙酰基胞壁酸基-L-丙氨酸酰胺酶(PGRP2),白介素-1受体样1(ILRL1),嗜中性粒细胞明胶酶相关脂笼蛋白(NGAL),潜在转化生长因子β结合蛋白2(LTBP2),白介素-1受体拮抗剂蛋白(IL1RA),嗜铬粒蛋白-A(CMGA),磷酸肌醇-3-激酶互作蛋白1(P3IP1),胰腺核糖核酸酶(RNAS1),神经节苷脂GM2激活物(SAP3),嗜中性粒细胞弹性蛋白酶(ELNE),肾上腺肌割蛋白(ADSV),含解联蛋白和金属蛋白酶结构域的蛋白9(ADAM9),胰石蛋白-1-α(REG1A),核结合蛋白-1(NUCB1),和WAP四二硫化物核心结构域蛋白2(WFDC2),其中在步骤b)中,关于具有全身炎症的受试者的死亡风险的预后得出结论。优选地,所述全身炎症为脓毒症。
在一个特别的实施方案中,在所述生物学样品中的所述一个或多个另外的生物标志物选自下列中的一项或多项:
(i)激肽原-1(KNG1)和生腱蛋白(TENA);
(ii)多功能蛋白聚糖核心蛋白(CSPG2),钙黏着蛋白相关家族成员2(CDHR2),EMILIN-2(EMIL2),骨桥蛋白(OSTP),酪氨酸蛋白磷酸酶非受体类型底物1(SHPS1),胰石蛋白-1-β(REG1B),癌胚抗原相关细胞黏附分子6(CEAM6),成对免疫球蛋白样2型受体α(PILRA),II类HLA组织相容性抗原γ链(HG2A),清道夫受体富半胱氨酸1型蛋白M130(C163A),纤维介素(FGL2),促滤泡素抑制素相关蛋白3(FSTL3),纤调蛋白聚糖(FMOD),β-半乳糖苷α-2,6-唾液酸转移酶1(SIAT1),成髓细胞蛋白酶(PRTN3),白细胞免疫球蛋白样受体亚家族B成员5(LIRB5),N-乙酰基胞壁酸基-L-丙氨酸酰胺酶(PGRP2),白介素-1受体样1(ILRL1),嗜中性粒细胞明胶酶相关脂笼蛋白(NGAL),潜在转化生长因子β结合蛋白2(LTBP2),白介素-1受体拮抗剂蛋白(IL1RA),嗜铬粒蛋白-A(CMGA),磷酸肌醇-3-激酶互作蛋白1(P3IP1),胰腺核糖核酸酶(RNAS1),神经节苷脂GM2激活物(SAP3),嗜中性粒细胞弹性蛋白酶(ELNE),肾上腺肌割蛋白(ADSV),含解联蛋白和金属蛋白酶结构域的蛋白9(ADAM9),胰石蛋白-1-α(REG1A),核结合蛋白-1(NUCB1),和WAP四二硫化物核心结构域蛋白2(WFDC2);
(iii)清道夫受体富半胱氨酸1型蛋白M130(C163A),Kallistatin(KAIN),巨噬细胞甘露糖受体1(MRC1),淋巴管内皮透明质酸受体1(LYVE1),胆碱酯酶(CHLE),胰腺核糖核酸酶(RNAS1),磷脂酰肌醇-聚糖-特异性磷脂酶D(PHLD),Afamin(AFAM),胰岛素样生长因子结合蛋白复合物酸不稳定亚基(ALS),嗜中性粒细胞明胶酶相关脂笼蛋白(NGAL),磷酸肌醇-3-激酶互作蛋白1(P3IP1),α-2-HS-糖蛋白(FETUA),神经节苷脂GM2激活物(SAP3),β-Ala-His二肽酶(CNDP1),成对免疫球蛋白样2型受体α(PILRA),CD177抗原(CD177),V-型质子ATP酶亚基S1(VAS1),血浆丝氨酸蛋白酶抑制物(IPSP),促滤泡素抑制素相关蛋白3(FSTL3),肺表面活性剂相关蛋白B(PSPB),肿瘤坏死因子受体超家族成员1B(TNR1B),WAP四二硫化物核心结构域蛋白2(WFDC2),碱性磷酸酶,组织非特异性同工酶(PPBT),和金属蛋白酶抑制物1(TIMP1);
(iv)C反应蛋白(CRP);
(v)降钙素原(PCT);
(vi)胰石蛋白-1-α;
(vii)CRP和PCT,
其中在步骤b)中,关于具有全身炎症的受试者的死亡风险的预后得出结论。优选地,所述全身炎症为脓毒症。
在本发明的意义下,作为生物标志物的sVSIG4可以与上面所记述的一个或多个另外的生物标志物中的一个或多个相组合。特别地,作为生物标志物的sVSIG4可以与组(i)至(vii)中的一个或多个相组合。因此,在一个实施方案中,在步骤a)中,除了测定sVSIG4的水平外,还测定在所述生物学样品中一个或多个进一步的可溶性蛋白质(其可以用作生物标志物)的水平。虽然仅测定sVSIG4的水平就足够了,但是测定进一步的可溶性蛋白质的水平对于死亡率的预后来说可能是有益的。
在一个非常优选的实施方案中,sVSIG4可以与CRP、成髓细胞蛋白酶(PRTN3)、磷脂酰肌醇-聚糖-特异性磷脂酶D(PHLD)和/或PCT相组合地用于诊断全身炎症,优选地由感染因子引起的全身炎症,优选地脓毒症。因此,sVSIG4可以与CRP相组合地用在脓毒症的诊断中。在另一个实施方案中,sVSIG4与成髓细胞蛋白酶(PRTN3)相组合用在脓毒症的诊断中。在另一个实施方案中,sVSIG4与磷脂酰肌醇-聚糖-特异性磷脂酶D(PHLD)相组合地用在脓毒症的诊断中。在另一个实施方案中,sVSIG4与PCT相组合地用在脓毒症的诊断中。在另外一个实施方案中,sVSIG4与CRP和PCT相组合地用在脓毒症的诊断中。
相同的组合对于测定具有全身炎症(优选地脓毒症)的受试者的死亡风险来说也是有益的。
可以以两个变量的组合来构建预测器。可以通过对于SIRS vs脓毒症患者的分类使用线性判别分析(linear discriminant analysis)(LDA)来计算所述两个变量的各自权重。在LDA之前,优选地对数据进行对数变换、居中(至平均值)和按比例缩放(通过标准偏差)。优选地,对于每个预测器,将灵敏度和特异性进行绘图。
例如,对于sVSIG4和CRP的线性组合,可以使用下述计算来计算所述预测器(参见图16F):
预测器=-0.4268478 x ln(sVSIG4)-0.4500494 x ln(CRP)+5.927552。小于3、优选地小于0.5、优选地小于0、更优选地小于-0.2的通过该等式计算出的预测器可以指明脓毒症,基于在生物学样品中sVSIG4和CRP的水平的测定。
因此,在一个优选的实施方案中,提供了这样的方法,其中小于3、优选地小于0.5、优选地小于0、更优选地小于-0.2的预测器(其基于在生物学样品中sVSIG4和CRP的水平的测定并且通过-0.4268478 x ln(sVSIG4)-0.4500494 x ln(CRP)+5.927552来计算)指明了脓毒症。在一个优选的实施方案中,所述受试者为人受试者。优选地,所述生物学样品为血浆。
在另一个实施方案中,提供了这样的方法,其中小于1、优选地小于0、更优选地小于-1的预测器(其基于在生物学样品中sVSIG4和CRP的水平的测定并且通过-0.4268478 xln(sVSIG4)-0.4500494 x ln(CRP)+5.927552来计算)指明了在28天内至少50%的具有全身炎症(优选地脓毒症)的受试者的死亡风险。在一个优选的实施方案中,所述受试者为人受试者。优选地,所述生物学样品为血浆。
对于sVSIG4和成髓细胞蛋白酶(PRTN3)的线性组合,可以使用下述计算来计算所述预测器(参见图16G):
预测器=-0.4331127 x ln(sVSIG4)-0.4901329 x ln(PRTN3)+9.942252。
因此,在一个优选的实施方案中,小于2、优选地小于1、更优选地小于-0.1的预测器(其基于在生物学样品中sVSIG4和成髓细胞蛋白酶(PRTN3)的水平的测定并且通过-0.4331127 x ln(sVSIG4)-0.4901329 x ln(PRTN3)+9.942252来计算)指明了脓毒症。在一个优选的实施方案中,所述受试者为人受试者。优选地,所述生物学样品为血浆。
在另一个优选的实施方案中,小于0、优选地小于-1的预测器(其基于在生物学样品中sVSIG4和成髓细胞蛋白酶(PRTN3)的水平的测定并且通过-0.4331127 x ln(sVSIG4)-0.4901329 x ln(PRTN3)+9.942252来计算)指明了在28天内至少50%的具有全身炎症(优选地脓毒症)的受试者的死亡风险。在一个优选的实施方案中,所述受试者为人受试者。优选地,所述生物学样品为血浆。
在一个实施方案中,sVSIG4是糖蛋白,即包含共价附接至氨基酸侧链的寡糖链(聚糖)的蛋白质。特别地,所述糖基化包含N-糖基化和/或O-糖基化,优选地O-糖基化。
所述糖基化可以例如通过下述方式来进行分析:通过酰肼化学来化学氧化与sVSIG4相连接的聚糖结构从而导致醛,和用经生物素标记的交联剂或经酰肼活化的琼脂糖珠粒进行修饰从而经由腙键形成稳定的缀合物。sVSIG4的生物素化可以通过下述方式来进行检测:对经标记的sVSIG4进行免疫沉淀,和使用缀合有辣根过氧化物酶的抗生物素蛋白或链霉抗生物素蛋白来进行Western印迹分析。
因此,所述方法可以包括富集在生物学样品中的糖基化蛋白质。由此,所述样品关于糖基化蛋白质而言是更浓缩的,并且sVSIG4的测定将会得到改善。
在生物学样品中的糖基化蛋白质的富集优选地在步骤a)之前进行。特别地,富集在生物学样品中的糖基化蛋白质包括用所述生物学样品进行一个或多个分离步骤,特别是在步骤a)之前。
在一个实施方案中,所述一个或多个分离步骤包括色谱法分离,优选地亲和色谱法分离。本领域技术人员熟悉色谱方法。
在一个优选的实施方案中,所述亲和色谱法分离选自由下列各项组成的组:凝集素亲和色谱法、通过酰肼化学的分离、亲水相互作用色谱法和免疫亲和色谱法。
在一个进一步的实施方案中,在所述一个或多个分离步骤中对生物学样品的蛋白质进行酶促降解以用于进一步的分析,特别是定量分析。酶促降解也可以被称为蛋白水解切割,并且允许分析例如质谱法。
测定步骤a)优选地通过一种或多种从由下列各项组成的组中选择的方法来进行:色谱法、光谱测定法、电泳、光谱学、生物化学测定法和免疫测定法,优选地光谱测定法,特别是质谱法,和/或免疫测定法。
优选地,所述质谱法为液相色谱法-质谱法(LC-MS)、LC-MS/MS或基质辅助激光解吸电离-飞行时间质谱法(MALDI-TOF MS)。
通过质谱法进行的血清和血浆样品的蛋白质组分析经常是困难的,因为20种高丰度蛋白质占总血浆蛋白质量的95%,这意味着以显著较低的量存在的蛋白质经常是不可检测的或不可重现的。为了避免这个问题,可能的是,不分析全部血浆蛋白质,而是分析选择出的血浆蛋白质,其首先进行富集和随后进行分析。焦点例如在糖基化蛋白质上,它们在其在核糖体处合成后用糖基团以酶促方式进行了翻译后修饰。然而,质谱法在寻找未知蛋白质中是有用的。
在另一个优选的实施方案中,所述免疫测定法选自由下列各项组成的组中的一项或多项:酶联免疫测定法(ELISA)、免疫筛选、侧流免疫色谱测定法、磁力免疫测定法和放射免疫测定法,优选地ELISA。在一个非常优选的实施方案中,进行ELISA以用于特异性地和准确地测定在生物学样品中sVSIG4的水平。所述ELISA优选地用特异于人VSIG4(尤其是特异于人VSIG4的细胞外结构域)的单克隆抗体来进行。ELISA是有利的,因为不需要在使用前处理生物学样品,例如全血、血浆或血清。本领域技术人员熟悉ELISA技术。所述ELISA还可以包括进一步的针对VSIG4的细胞外结构域的抗体以进行夹心ELISA。
所述ELISA还可以包括进一步的针对另一个生物标志物的抗体,从而可以检测sVSIG4和另一个生物标志物的水平。
也在本发明的意义内的是:步骤a)包括进行LC-MS、LC-MS/MS或MALDI-TOF MS,和随后的分析所获得的数据的步骤,以测定在生物学样品中sVSIG4的水平。该组合可以进一步提高准确性。
在一个特别优选的实施方案中,所述方法包括:
-在步骤a)之前进行在生物学样品中的糖基化蛋白质的耗竭步骤和/或分级分离步骤和/或富集;和
-在步骤a)中进行质谱法以测定在生物学样品中sVSIG4的水平。
所述“耗竭步骤”典型地牵涉从生物学样品中分离和弃去细胞或细胞碎片,例如通过离心。在本发明的意义下,“分级分离”是指将所述生物学样品分开为其组成部分,例如通过离心。所述组成部分典型地为血浆,其也可以被分级分离为其组分,白细胞和血小板,和红细胞。
血浆的分级分离典型地牵涉改变血浆的条件(例如,温度、酸度或蛋白质的水合),以致于正常地在血浆流体中溶解的蛋白质变成不可溶的,从而形成大的团块,称为沉淀物。沉淀可以例如用三氯乙酸、丙酮、甲醇-氯仿或硫酸铵来取得。不可溶蛋白质可以通过离心来收集。
步骤a)之前在生物学样品中的糖基化蛋白质的耗竭步骤和/或分级分离步骤和/或富集典型地服务于增加待检测的蛋白质(例如sVSIG4)的浓度的目的。倘若sVSIG4的水平对于检测来说足够高,那么可以省略这些步骤。
所述方法还可以包括:
-富集糖基化蛋白质,其包括:进行亲和色谱法分离步骤,特别是凝集素亲和色谱法、通过酰肼化学的分离或免疫亲和色谱法;
-任选地,在所述亲和色谱法分离步骤中酶促降解生物学样品的蛋白质。
倘若进行任选的降解步骤,那么在经酶促降解的蛋白质(即肽)的基础上测定sVSIG4的水平。倘若不进行任选的降解步骤,那么可以在总体可溶性蛋白质的基础上测定sVSIG4的水平。
降解步骤的可能的肽可以通过蛋白水解降解或化学切割方法来产生。关于使用胰蛋白酶来蛋白水解消化血浆相关sVSIG4的例子为在表3中所描述的那些。也可以使用其他用于蛋白水解消化血浆相关sVSIG4的酶。
表3.通过质谱法鉴定出的胰蛋白酶消化肽段序列。
优选地,所述生物学样品为体液样品。典型地,生物学样品具有细胞和非细胞级分。在一个特别优选的实施方案中,所述生物学样品为生物学样品的非细胞级分。
所述体液样品优选地选自由下列各项组成的组中的一项或多项:全血、血浆、血清、滑液、胸腔积液、淋巴液、尿、脑脊液、脑脊髓液、腹水和支气管灌洗物,以及源自上述那些的样品,特别是通过去除细胞而源自上述样品的无细胞的或耗竭了细胞的样品。
在一个特别优选的实施方案中,所述生物学样品选自由下列各项组成的组:全血、血浆和血清。血浆是指血液的液体部分,即它基本上是耗竭了细胞的,优选地是无细胞的。血清典型地是指没有纤维蛋白原的血浆。全血、血浆和血清可以容易地从受试者中取回并且进行处理,从而使得本发明的方法方便和容易施行。
所述生物学样品按照常规标准来进行制备。例如,倘若抽取血液以用于血浆分离,那么典型地向血液样品添加抗凝剂,例如肝素、EDTA和/或柠檬酸盐。其他补充物也是可能的。
在一个优选的实施方案中,所述生物学样品是无细胞的或耗竭了细胞的样品。这是特别有用的,因为sVSIG4是可溶性蛋白质。
在一个优选的本发明的方法中,在步骤a)之前处理生物学样品,特别是通过获得所述生物学样品的非细胞级分。
在一个特别优选的实施方案中,所述生物学样品为体液,特别是全血、血浆或血清,并且在步骤a)之前处理所述生物学样品。
在本发明的意义下,处理包括细胞分离或耗竭和/或色谱法。
在感染的情况下,感染病灶可能对于对抗致病病原体来说是重要的。因此,有利的是鉴定出感染区域。因此,在一个优选的实施方案中,所述全身炎症由感染因子引起,并且通过根据本发明的方法关于由感染因子引起的感染的起源区域得出结论。
由感染因子引起的感染的起源区域可以为腹部、呼吸系统或泌尿道。
一个或多个区域生物标志物可以有助于鉴定感染区域。因此,所述方法可以进一步包括:
-测定在生物学样品中一个或多个区域生物标志物的水平;和
-基于在生物学样品中所述一个或多个区域生物标志物的水平,确定感染起源区域。
所述一个或多个区域生物标志物优选地选自下列中的一项或多项:
(i)由下列各项组成的组:具有EF手结构域的细胞生长调节物蛋白1(CGRE1),凝血因子VIII(FA8),磷脂转移蛋白(PLTP),蛋白Z依赖性蛋白酶抑制物(ZPI),α-1-抗胰凝乳蛋白酶(AACT),基质金属蛋白酶-9(MMP9),白介素-1受体拮抗剂蛋白(IL1RA),嗜中性粒细胞胶原酶(MMP8),壳多糖酶-3-样蛋白1(CH3L1),白介素-1受体样1(ILRL1),CD177抗原(CD177),嗜中性粒细胞明胶酶相关脂笼蛋白(NGAL),乳转铁蛋白(TRFL),白介素-18结合蛋白(I18BP),金属蛋白酶抑制物1(TIMP1),脂多糖结合蛋白(LBP),巨噬细胞甘露糖受体1(MRC1),IgGFc结合蛋白(FCGBP),和间-α-抑制物重链H3(ITIH3),用于确定来源于腹部的感染;或
(ii)由下列各项组成的组:神经元生长调节物1(NEGR1),载脂蛋白C-I(APOC1),血浆丝氨酸蛋白酶抑制物(IPSP),血清淀粉样A-4蛋白(SAA4),磷脂酰肌醇-聚糖-特异性磷脂酶D(PHLD),异戊二烯基半胱氨酸氧化酶1(PCYOX),凝血因子XIII B链(F13B),间-α-抑制物重链H1(ITIH1),间-α-抑制物重链H2(ITIH2),和维生素K依赖性蛋白S(PROS),用于确定来源于呼吸系统的感染。
在本发明的一个非常优选的实施方案中,所述受试者为人受试者。所述受试者可以是健康的或者患病的(基于怀疑或确证的诊断)。人受试者也可以称为患者。
在本发明的一个进一步的方面,提供了监测受试者的全身炎症的方法,其中所述方法包括:
i)施行上面所陈述的体外诊断全身炎症或者预后具有全身炎症的受试者的死亡风险的方法;和
ii)重复步骤i)至少一次。
监测允许评估治疗成功或治疗失败。这反过来允许独个地调适疗法。因此,所述方法可以进一步包括重复步骤ii)直至诊断出不存在所述全身炎症,或者用于监测治疗成功或治疗失败。
在一个实施方案中,重复步骤ii)包括施行步骤i)至少两次,例如至少三次、至少四次、至少五次、至少六次、至少七次、至少八次、至少九次、至少10次、至少12次、至少15次、至少20次、至少25次、至少30次或至少35次,优选地至少25次。
在另一个实施方案中,所述方法包括在12小时内,特别地在24小时内,更特别地在48小时内重复步骤ii),以用于疗法控制(监测)。通常,每48小时重复所述步骤。如果观察到症状恶化或者受试者处于更高的风险下,例如因为受试者已得了另一种感染,那么每24小时或每12小时重复所述步骤。
在另一个实施方案中,监测治疗成功或治疗失败包括在已起始或完成所述全身炎症的治疗后重复步骤i)至少一次,优选地重复施行步骤i)直至诊断出不存在所述全身炎症。
监测还包括关于脓毒症的发展和疾病的进展监测具有非感染性全身炎症的受试者。
在本发明的一个进一步的方面,提供了治疗全身炎症的方法,其包括:
i)施行上面所描述的方法,和
ii)起始针对所述全身炎症的治疗。
可以在步骤b)中诊断脓毒症,并且可以用抗生试剂在步骤ii)中起始治疗。所述抗生治疗可以是按照流行的国家和国际指南的标准抗生治疗,例如广谱抗生素。用抗生试剂进行的治疗对抗细菌感染。
在本发明的一个进一步的方面中,提供了用于在治疗受试者中的感染或者治疗具有疑似感染的受试者的方法中使用的抗生试剂,其中所述感染为血流感染、全身感染或脓毒症中的一部分,并且其中所述血流感染、全身感染或脓毒症通过在生物学样品中sVSIG4的水平来进行诊断或监测。在一个优选的实施方案中,所述血流感染、全身感染或脓毒症(优选地脓毒症)通过上面所定义的方法来诊断或监测。在一个进一步的优选的实施方案中,所述受试者具有增加的sVSIG4水平。所述水平可以与在非感染对照中sVSIG4的参考水平进行比较。
在本发明的一个进一步的方面,提供了在受试者中区分SIRS和脓毒症的方法,其中所述方法包括:
a)测定在所述受试者的生物学样品中sVSIG4的水平,和
b)比较在所述生物学样品中sVSIG4的水平与在罹患SIRS的受试者的生物学样品中sVSIG4的参考水平,
其中相比于步骤b)的参考水平而言步骤a)的在所述生物学样品中的水平增加表明在步骤a)的所述受试者中的脓毒症。特别地,所述方法如在本文中所描述的那样来进行。
在该情景下,SIRS特别地包括具有或没有器官功能障碍的SIRS。
在本发明的另外一个进一步的方面,将sVSIG4用作生物标志物,用于体外诊断受试者中的全身炎症或者预后具有全身炎症的受试者的死亡风险。sVSIG4可以作为唯一的生物标志物或者与一个或多个进一步的生物标志物相组合地进行使用。特别地,所述方法如在本文中所描述的那样来进行。
在本发明的另外一个方面,提供了试剂盒,其包含对于sVSIG4的结合分子和对于至少一个进一步的生物标志物的结合分子,所述试剂盒用于定量检测sVSIG4和所述至少一个进一步的生物标志物。
优选地,借助于所述试剂盒来检测的所述至少一个进一步的生物标志物为CRP和/或PCT。
将所述试剂盒与在受试者的生物学样品中的乳酸盐水平的测定相组合也是优选的。
在一个优选的实施方案中,所述试剂盒借助于受试者的全血、血浆或血清(优选地,血浆)来进行使用。
所述检测可以基于生色、荧光和/或发光反应,和/或色谱方法。
在所述试剂盒中的结合分子优选地选自由下列各项组成的组:抗体、适配体和纳米抗体。
优选地,所述试剂盒基于ELISA或色谱法。
在一个优选的实施方案中,所述试剂盒是快速测试或POC(床旁)测试。凭此,快速和可靠的诊断和预后是可能的。
进一步的实施方案
下面再次和更详细地描述了本发明的实施方案。本发明特别地公开和提供了下面的实施方案:
1.体外诊断全身炎症或者预后具有全身炎症的受试者的死亡风险的方法,其中所述方法包括:
c)测定在生物学样品中可溶性含V-set和免疫球蛋白结构域的蛋白4(sVSIG4)的水平,和
d)从sVSIG4的存在和/或水平得出关于全身炎症的诊断或者具有全身炎症的受试者的死亡风险的预后的结论。
2.根据实施方案1的方法,其中所述全身炎症由感染因子引起。
3.根据实施方案2的方法,其中所述由感染因子引起的全身炎症为脓毒症、全身感染或血流感染,优选地脓毒症。
4.根据实施方案2或3的方法,其中所述感染因子为细菌、真菌或病毒。
5.根据实施方案4的方法,其中所述细菌为革兰氏阴性或革兰氏阳性细菌。
6.根据实施方案4的方法,其中所述病毒为甲型流感病毒、乙型流感病毒、呼吸道合胞病毒(RSV)、鼻病毒和/或冠状病毒,特别是重症急性呼吸综合征冠状病毒2型(SARS-CoV2)。
7.根据实施方案1的方法,其中所述全身炎症不由感染因子引起。
8.根据实施方案7的方法,其中所述不由感染因子引起的全身炎症为全身炎症反应综合征(SIRS)。
9.根据实施方案1至8中一项或多项的方法,其中至少20pg/ml、至少50pg/ml、至少100pg/ml、至少150pg/ml、至少200pg/ml或至少250pg/ml的在生物学样品中sVSIG4的水平指明了全身炎症。
10.根据实施方案1至8中一项或多项的方法,其中至少20pg/ml、至少50pg/ml、至少100pg/ml、至少150pg/ml、至少200pg/ml或至少250pg/ml并且小于100000pg/ml、小于50000pg/ml、小于12500pg/ml、小于10000pg/ml或小于6000pg/ml的在生物学样品中sVSIG4的水平指明了SIRS。
11.根据实施方案3至6中一项或多项的方法,其中至少200pg/ml、至少250pg/ml、至少300pg/ml、至少350pg/ml或至少400pg/ml的在生物学样品中sVSIG4的水平指明了血流感染。
12.根据实施方案3至6中一项或多项的方法,其中至少500pg/ml、至少550pg/ml、至少600pg/ml、至少650pg/ml、至少700pg/ml、至少750pg/ml、至少1000pg/ml、至少1500pg/ml、至少2500pg/ml、至少3500pg/ml、至少5000pg/ml、至少7500pg/ml、至少10000pg/ml或至少12500pg/ml的在生物学样品中sVSIG4的水平指明了脓毒症。
13.根据实施方案3至6中一项或多项的方法,其中至少1500pg/ml、至少5000pg/ml、至少10000pg/ml或至少12500pg/ml的在生物学样品中sVSIG4的水平指明了脓毒症,并且区别SIRS和脓毒症。
14.根据实施方案1至8中一项或多项的方法,其中至少4500pg/ml、至少9000pg/ml、至少15000pg/ml、至少40000pg/ml或至少50000pg/ml的在生物学样品中sVSIG4的水平指明了在28天内至少50%的具有由感染因子引起的全身炎症的受试者的死亡风险。
15.根据实施方案1至8中一项或多项的方法,其中至少70000pg/ml、至少75000pg/ml、至少80000pg/ml或至少85000pg/ml的在生物学样品中sVSIG4的水平指明了在28天内至少30%的具有由感染因子引起的全身炎症的受试者的死亡风险。
16.根据实施方案1至15中一项或多项的方法,其中sVSIG4包含VSIG4的细胞外结构域或细胞外结构域的片段。
17.根据实施方案1至16中一项或多项的方法,其中sVSIG4不包含VSIG4的跨膜结构域和胞质结构域。
18.根据实施方案16或17的方法,其中VSIG4选自由VSIG4同种型1(UniProt标识符Q9Y279-1;SEQ ID NO:1)、VSIG4同种型2(UniProt标识符Q9Y279-2;SEQ ID NO:2)和VSIG4同种型3(UniProt标识符Q9Y279-3;SEQ ID NO:3)组成的组,或者具有与VSIG4同种型1(UniProt标识符Q9Y279-1;SEQ ID NO:1)、VSIG4同种型2(UniProt标识符Q9Y279-2;SEQ IDNO:2)或VSIG4同种型3(UniProt标识符Q9Y279-3;SEQ ID NO:3)的氨基酸序列至少90%同一的氨基酸序列。
19.根据实施方案16至18中一项或多项的方法,其中所述细胞外结构域包含Ig-样结构域1(SEQ ID NO:4),或者Ig-样结构域1(SEQ ID NO:4)和Ig-样结构域2(SEQ ID NO:5),或者SEQ ID NO:6中所定义的细胞外结构域。
20.根据实施方案1至19中一项或多项的方法,其中sVSIG4溶解在所述生物学样品中,特别是在所述生物学样品的非细胞级分中。
21.根据实施方案1至20中一项或多项的方法,其中所述方法进一步包括:
-测定在所述生物学样品中一个或多个另外的生物标志物的水平,和
-在步骤b)中,从sVSIG4的存在和/或水平以及与之相联合的所述一个或多个另外的生物标志物的存在和/或水平得出关于全身炎症的诊断或者具有全身炎症的受试者的死亡风险的预后的结论。
22.根据实施方案21的方法,其中所述一个或多个另外的生物标志物选自由下列各项组成的组:IgGFc结合蛋白(FCGBP),GDNF家族受体α-2(GFRA2),羧肽酶D(CBPD),脱唾液酸糖蛋白受体1(ASGR1),低氧上调蛋白1(HYOU1),生腱蛋白(TENA),多聚免疫球蛋白受体(PIGR),Sushi,冯·维勒布兰德因子A型,含EGF和正五聚蛋白结构域的蛋白1(SVEP1),白介素-1受体2型(IL1R2),层粘连蛋白亚基β-1(LAMB1),内质网分子伴侣BiP(BIP),Peroxidasin同源物(PXDN),促滤泡素抑制素相关蛋白1(FSTL1),富亮氨酸α-2糖蛋白(A2GL),金属蛋白酶抑制物1(TIMP1),NPC细胞内胆固醇转运蛋白2(NPC2),肽聚糖识别蛋白1(PGRP1),乳转铁蛋白(TRFL),Dystonin(DYST),脂多糖结合蛋白(LBP),触珠蛋白(HPT),脱唾液酸糖蛋白受体2(ASGR2),非分泌性核糖核酸酶(RNAS2),天青杀素(Azurocidin)(CAP7),壳多糖酶-3-样蛋白1(CH3L1),肿瘤坏死因子受体超家族成员1B(TNR1B),II类HLA组织相容性抗原γ链(HG2A),嗅介蛋白-4(OLFM4),白细胞免疫球蛋白样受体超家族A成员3(LIRA3),胰岛素样生长因子结合蛋白2(IBP2),生长/分化因子15(GDF15),层粘连蛋白亚基α-2(LAMA2),酪氨酸蛋白磷酸酶非受体类型底物1(SHPS1),Basigin(BASI),纤维介素(Fibroleukin)(FGL2),组织蛋白酶Z(CATZ),E-选择蛋白(LYAM2),淋巴管内皮透明质酸受体1(LYVE1),含解联蛋白和金属蛋白酶结构域的蛋白9(ADAM9),桥粒芯胶黏蛋白-2(DSC2),白介素-1受体样1(ILRL1),基质金属蛋白酶-9(MMP9),抑半胱氨酸蛋白酶蛋白-C(CYTC),白介素-18结合蛋白(I18BP),成对免疫球蛋白样2型受体α(PILRA),巨噬细胞甘露糖受体1(MRC1),骨桥蛋白(OSTP),清道夫受体富半胱氨酸1型蛋白M130(C163A),整合膜蛋白2B(ITM2B),纤维蛋白原样蛋白1(FGL1),血清淀粉样A-1蛋白(SAA1),白介素-1受体拮抗剂蛋白(IL1RA),核结合蛋白-1(NUCB1),高尔基体膜蛋白1(GOLM1),肌营养不良蛋白聚糖(DAG1),CD177抗原(CD177),碱性磷酸酶,组织非特异性同工酶(PPBT),嗜中性粒细胞胶原酶(MMP8),成髓细胞蛋白酶(PRTN3),嗜中性粒细胞弹性蛋白酶(ELNE),β-1,4-半乳糖基转移酶1(B4GT1),C反应蛋白(CRP),WAP四二硫化物核心结构域蛋白2(WFDC2),促滤泡素抑制素相关蛋白3(FSTL3),胰腺核糖核酸酶(RNAS1),嗜中性粒细胞明胶酶相关脂笼蛋白(NGAL),血清淀粉样A-2蛋白(SAA2),胰石蛋白-1-α(REG1A),血浆激肽释放酶(KLKB1),磷脂酰胆碱甾醇酰基转移酶(LCAT),血清转铁蛋白(TRFE),降钙素原(PCT),补体受体2型(CR2),电压依赖性钙通道亚基α-2/δ-1(CA2D1),印度刺猬蛋白(IHH),血清对氧磷酶/内酯酶3(PON3),纤连蛋白(FINC),β-Ala-His二肽酶(CNDP1),胰岛素样生长因子结合蛋白复合物酸不稳定亚基(ALS),磷脂酰肌醇-聚糖-特异性磷脂酶D(PHLD),胰岛素样生长因子结合蛋白3(IBP3),炭疽毒素受体1(ANTR1),神经元生长调节物1(NEGR1),血浆丝氨酸蛋白酶抑制物(IPSP),Intelectin-1(ITLN1),Kallistatin(KAIN),成纤维细胞生长因子受体1(FGFR1),α-2-HS-糖蛋白(FETUA),胆碱酯酶(CHLE),Afamin(AFAM),组织蛋白酶F(CATF),胆固醇酯转移蛋白(CETP),钙黏着蛋白相关家族成员5(CDHR5),间-α-胰蛋白酶抑制物重链H2(ITIH2),N-乙酰基胞壁酰基-L-丙氨酸酰胺酶(PGRP2),接触蛋白-1(CNTN1),载脂蛋白(a)(APOA),具有EF手结构域的细胞生长调节物蛋白1(CGRE1),凝血因子VIII(FA8),磷脂转移蛋白(PLTP),蛋白Z依赖性蛋白酶抑制物(ZPI),α-1-抗胰凝乳蛋白酶(AACT),维生素K依赖性蛋白S(PROS),凝血因子XIII B链(F13B),异戊二烯基半胱氨酸氧化酶1(PCYOX),血清淀粉样A-4蛋白(SAA4),载脂蛋白C-I(APOC1),脯氨酰基内肽酶FAP(SEPR),二肽基肽酶4(DPP4),血管紧张素转变酶2(ACE2),白介素-1受体辅助蛋白(IL1AP),二-N-乙酰基壳二糖酶(DIAC),肝细胞生长因子激活物(HGFA),含硒蛋白P(SEPP1),具有血小板反应蛋白基序的A解联蛋白和金属蛋白酶13(ATS13),单核细胞分化抗原CD14(CD14),补体因子H相关蛋白1(FHR1),冯·维勒布兰德因子(VWF),层粘连蛋白亚基γ-1(LAMC1),清道夫受体类别A成员5(SCAR5),ADAMTS-样蛋白4(ATL4),滞蛋白-1(CUL1),肺表面活性剂相关蛋白B(PSPB),成神经细胞瘤致肿瘤性阻抑物(NBL1),神经节苷脂GM2激活物(SAP3),蛋白质二硫化物异构酶CRELD1(CREL1),钙黏着蛋白相关家族成员2(CDHR2),胰凝乳蛋白酶样弹性蛋白酶家族成员3B(CEL3B),磷酸肌醇-3-激酶互作蛋白1(P3IP1),胰石蛋白-1-β(REG1B),激肽原-1(KNG1),多功能蛋白聚糖核心蛋白(CSPG2),EMILIN-2(EMIL2),癌胚抗原相关细胞黏附分子6(CEAM6),纤调蛋白聚糖(FMOD),β-半乳糖苷α-2,6-唾液酸转移酶1(SIAT1),白细胞免疫球蛋白样受体亚家族B成员5(LIRB5),潜在转化生长因子β结合蛋白2(LTBP2),嗜铬粒蛋白-A(CMGA),和肾上腺肌割蛋白(ADSV),富组氨酸糖蛋白(HRG),间-α-胰蛋白酶抑制物重链H1(ITIH1),和间-α-胰蛋白酶抑制物重链H3(ITIH3),其中在步骤b)中,关于全身炎症的诊断得出结论。
23.根据实施方案21或22的方法,其中在所述生物学样品中的所述一个或多个另外的生物标志物选自下列中的一项或多项:
(i)间-α-胰蛋白酶抑制物重链H2(ITIH2),间-α-胰蛋白酶抑制物重链H1(ITIH1),磷脂酰肌醇-聚糖-特异性磷脂酶D(PHLD),N-乙酰基胞壁酰基-L-丙氨酸酰胺酶(PGRP2),Kallistatin(KAIN),α-2-HS-糖蛋白(FETUA),间-α-胰蛋白酶抑制物重链H3(ITIH3),Afamin(AFAM),巨噬细胞甘露糖受体1(MRC1),胆碱酯酶(CHLE),胰岛素样生长因子结合蛋白复合物酸不稳定亚基(ALS),血清转铁蛋白(TRFE),磷脂酰胆碱甾醇酰基转移酶(LCAT),β-Ala-His二肽酶(CNDP1),血浆激肽释放酶(KLKB1),α-1-抗胰凝乳蛋白酶(AACT),单核细胞分化抗原CD14(CD14),嗜中性粒细胞明胶酶相关脂笼蛋白(NGAL),肝细胞生长因子激活物(HGFA),清道夫受体富半胱氨酸1型蛋白M130(C163A),纤连蛋白(FINC),富组氨酸糖蛋白(HRG),和α-1-抗胰蛋白酶(A1AT);
(ii)磷脂酰肌醇-聚糖-特异性磷脂酶D(PHLD),Kallistatin(KAIN),α-2-HS-糖蛋白(FETUA),Afamin(AFAM),巨噬细胞甘露糖受体1(MRC1),胆碱酯酶(CHLE),胰岛素样生长因子结合蛋白复合物酸不稳定亚基(ALS),β-Ala-His二肽酶(CNDP1),嗜中性粒细胞明胶酶相关脂笼蛋白(NGAL),清道夫受体富半胱氨酸1型蛋白M130(C163A),血浆丝氨酸蛋白酶抑制物(IPSP),富亮氨酸α-2-糖蛋白(A2GL),胰石蛋白-1-α(REG1A),脂多糖结合蛋白(LBP),淋巴管内皮透明质酸受体1(LYVE1),胰岛素样生长因子结合蛋白3(IBP3),补体受体2型(CR2),纤连蛋白(FINC),脱唾液酸糖蛋白受体2(ASGR2),碱性磷酸酶,组织非特异性同工酶(PPBT),血清淀粉样A-2蛋白(SAA2),和二肽基肽酶4(DPP4);
(iii)间-α-胰蛋白酶抑制物重链H2(ITIH2),N-乙酰基胞壁酰基-L-丙氨酸酰胺酶(PGRP2),和单核细胞分化抗原CD14(CD14);
(iv)间-α-胰蛋白酶抑制物重链H2(ITIH2);
(v)磷脂酰肌醇-聚糖-特异性磷脂酶D(PHLD),富亮氨酸-α-2-糖蛋白(A2GL),和胰岛素样生长因子结合蛋白3(IBP3);
(vi)磷脂酰肌醇-聚糖-特异性磷脂酶D(PHLD);
(vii)C反应蛋白(CRP);
(viii)降钙素原(PCT);
(ix)胰石蛋白-1-α(REG1A);
(x)成髓细胞蛋白酶(PRTN3);
(xi)CRP和PCT,
其中在步骤b)中,关于全身炎症的诊断得出结论。
24.根据实施方案21的方法,其中所述一个或多个另外的生物标志物选自由下列各项组成的组:激肽原-1(KNG1),生腱蛋白(TENA),多功能蛋白聚糖核心蛋白(CSPG2),钙黏着蛋白相关家族成员2(CDHR2),EMILIN-2(EMIL2),骨桥蛋白(OSTP),酪氨酸蛋白磷酸酶非受体类型底物1(SHPS1),胰石蛋白-1-β(REG1B),癌胚抗原相关细胞黏附分子6(CEAM6),成对免疫球蛋白样2型受体α(PILRA),II类HLA组织相容性抗原γ链(HG2A),清道夫受体富半胱氨酸1型蛋白M130(C163A),纤维介素(FGL2),促滤泡素抑制素相关蛋白3(FSTL3),纤调蛋白聚糖(FMOD),β-半乳糖苷α-2,6-唾液酸转移酶1(SIAT1),成髓细胞蛋白酶(PRTN3),白细胞免疫球蛋白样受体亚家族B成员5(LIRB5),N-乙酰基胞壁酸基-L-丙氨酸酰胺酶(PGRP2),白介素-1受体样1(ILRL1),嗜中性粒细胞明胶酶相关脂笼蛋白(NGAL),潜在转化生长因子β结合蛋白2(LTBP2),白介素-1受体拮抗剂蛋白(IL1RA),嗜铬粒蛋白-A(CMGA),磷酸肌醇-3-激酶互作蛋白1(P3IP1),胰腺核糖核酸酶(RNAS1),神经节苷脂GM2激活物(SAP3),嗜中性粒细胞弹性蛋白酶(ELNE),肾上腺肌割蛋白(ADSV),含解联蛋白和金属蛋白酶结构域的蛋白9(ADAM9),胰石蛋白-1-α(REG1A),核结合蛋白-1(NUCB1),和WAP四二硫化物核心结构域蛋白2(WFDC2),其中在步骤b)中,关于具有全身炎症的受试者的死亡风险的预后得出结论。
25.根据实施方案21或22的方法,其中在所述生物学样品中的所述一个或多个另外的生物标志物选自下列中的一项或多项:
(i)激肽原-1(KNG1)和生腱蛋白(TENA);
(ii)多功能蛋白聚糖核心蛋白(CSPG2),钙黏着蛋白相关家族成员2(CDHR2),EMILIN-2(EMIL2),骨桥蛋白(OSTP),酪氨酸蛋白磷酸酶非受体类型底物1(SHPS1),胰石蛋白-1-β(REG1B),癌胚抗原相关细胞黏附分子6(CEAM6),成对免疫球蛋白样2型受体α(PILRA),II类HLA组织相容性抗原γ链(HG2A),清道夫受体富半胱氨酸1型蛋白M130(C163A),纤维介素(FGL2),促滤泡素抑制素相关蛋白3(FSTL3),纤调蛋白聚糖(FMOD),β-半乳糖苷α-2,6-唾液酸转移酶1(SIAT1),成髓细胞蛋白酶(PRTN3),白细胞免疫球蛋白样受体亚家族B成员5(LIRB5),N-乙酰基胞壁酸基-L-丙氨酸酰胺酶(PGRP2),白介素-1受体样1(ILRL1),嗜中性粒细胞明胶酶相关脂笼蛋白(NGAL),潜在转化生长因子β结合蛋白2(LTBP2),白介素-1受体拮抗剂蛋白(IL1RA),嗜铬粒蛋白-A(CMGA),磷酸肌醇-3-激酶互作蛋白1(P3IP1),胰腺核糖核酸酶(RNAS1),神经节苷脂GM2激活物(SAP3),嗜中性粒细胞弹性蛋白酶(ELNE),肾上腺肌割蛋白(ADSV),含解联蛋白和金属蛋白酶结构域的蛋白9(ADAM9),胰石蛋白-1-α(REG1A),核结合蛋白-1(NUCB1),和WAP四二硫化物核心结构域蛋白2(WFDC2);
(iii)清道夫受体富半胱氨酸1型蛋白M130(C163A),Kallistatin(KAIN),巨噬细胞甘露糖受体1(MRC1),淋巴管内皮透明质酸受体1(LYVE1),胆碱酯酶(CHLE),胰腺核糖核酸酶(RNAS1),磷脂酰肌醇-聚糖-特异性磷脂酶D(PHLD),Afamin(AFAM),胰岛素样生长因子结合蛋白复合物酸不稳定亚基(ALS),嗜中性粒细胞明胶酶相关脂笼蛋白(NGAL),磷酸肌醇-3-激酶互作蛋白1(P3IP1),α-2-HS-糖蛋白(FETUA),神经节苷脂GM2激活物(SAP3),β-Ala-His二肽酶(CNDP1),成对免疫球蛋白样2型受体α(PILRA),CD177抗原(CD177),V-型质子ATP酶亚基S1(VAS1),血浆丝氨酸蛋白酶抑制物(IPSP),促滤泡素抑制素相关蛋白3(FSTL3),肺表面活性剂相关蛋白B(PSPB),肿瘤坏死因子受体超家族成员1B(TNR1B),WAP四二硫化物核心结构域蛋白2(WFDC2),碱性磷酸酶,组织非特异性同工酶(PPBT),和金属蛋白酶抑制物1(TIMP1);
(iv)C反应蛋白(CRP);
(v)降钙素原(PCT);
(vi)胰石蛋白-1-α;
(vii)CRP和PCT,
其中在步骤b)中,关于具有全身炎症的受试者的死亡风险的预后得出结论。
26.根据实施方案3至25中一项或多项的方法,其中小于3、优选地小于0.5、优选地小于0、更优选地小于-0.2的预测器(其基于在生物学样品中sVSIG4和CRP的水平的测定并且通过-0.4268478x ln(sVSIG4)-0.4500494x ln(CRP)+5.927552来计算)指明了脓毒症。
27.根据实施方案1至25中一项或多项的方法,其中小于1、优选地小于0、更优选地小于-1的预测器(其基于在生物学样品中sVSIG4和CRP的水平的测定并且通过-0.4268478xln(sVSIG4)-0.4500494x ln(CRP)+5.927552来计算)指明了在28天内至少50%的具有全身炎症(优选地脓毒症)的受试者的死亡风险。
28.根据实施方案3至25中一项或多项的方法,其中小于2、优选地小于1、更优选地小于-0.1的预测器(其基于在生物学样品中sVSIG4和成髓细胞蛋白酶(PRTN3)的水平的测定并且通过-0.4331127x ln(sVSIG4)-0.4901329x ln(PRTN3)+9.942252来计算)指明了脓毒症。
29.根据实施方案1至25中一项或多项的方法,其中小于0、优选地小于-1的预测器(其基于在生物学样品中sVSIG4和成髓细胞蛋白酶(PRTN3)的水平的测定并且通过-0.4331127x ln(sVSIG4)-0.4901329x ln(PRTN3)+9.942252来计算)指明了在28天内至少50%的具有全身炎症(优选地脓毒症)的受试者的死亡风险。
30.根据实施方案1至25中一项或多项的方法,其中在步骤a)中,除了测定sVSIG4的水平外,还测定在所述生物学样品中一个或多个进一步的可溶性蛋白质的水平。
31.根据实施方案1至30中一项或多项的方法,其中所述方法包括用于诊断全身炎症的进一步的参数,所述进一步的参数特别地为序贯性器官衰竭评估(SOFA)得分、快速序贯性器官衰竭评估(qSOFA)得分、急性生理学和慢性健康评价II(APACHE-II)得分和/或简化急性生理学得分II(SAPS-II)。
32.根据实施方案1至31中一项或多项的方法,其中所述方法包括富集在所述生物学样品中的糖基化蛋白质。
33.根据实施方案32的方法,其中富集在所述生物学样品中的糖基化蛋白质在步骤a)之前进行。
34.根据实施方案32或33中一项或多项的方法,其中富集在所述生物学样品中的糖基化蛋白质包括用所述生物学样品进行一个或多个分离步骤,特别是在步骤a)之前。
35.根据实施方案34的方法,其中所述一个或多个分离步骤包括色谱法分离,优选地亲和色谱法分离。
36.根据实施方案35的方法,其中所述亲和色谱法分离选自由下列各项组成的组:凝集素亲和色谱法、通过酰肼化学的分离、亲水相互作用色谱法和免疫亲和色谱法。
37.根据实施方案34至36中一项或多项的方法,其中在所述一个或多个分离步骤中对所述生物学样品的蛋白质进行酶促降解。
38.根据实施方案1至37中一项或多项的方法,其中步骤a)通过一种或多种从由下列各项组成的组中选择的方法来进行:色谱法、光谱测定法、电泳、光谱学、生物化学测定法和免疫测定法,优选地光谱测定法,特别是质谱法,和/或免疫测定法。
39.根据实施方案38的方法,其中所述质谱法为液相色谱法-质谱法(LC-MS)、LC-MS/MS或基质辅助激光解吸电离-飞行时间质谱法(MALDI-TOF MS)。
40.根据实施方案38或39的方法,其中所述免疫测定法选自由下列各项组成的组中的一项或多项:酶联免疫测定法(ELISA)、免疫筛选、侧流免疫色谱测定法、磁力免疫测定法和放射免疫测定法,优选地ELISA。
41.根据实施方案1至40中一项或多项的方法,其中步骤a)包括进行LC-MS、LC-MS/MS或MALDI-TOF MS,和随后的分析所获得的数据的步骤,以测定在所述生物学样品中sVSIG4的水平。
42.根据实施方案1至41中一项或多项的方法,其中所述方法包括:
-在步骤a)之前进行在所述生物学样品中的糖基化蛋白质的耗竭步骤和/或分级分离步骤和/或富集;和
-在步骤a)中进行质谱法以测定在所述生物学样品中sVSIG4的水平。
43.根据实施方案42的方法,其中
-富集糖基化蛋白质包括进行亲和色谱法分离步骤,特别是凝集素亲和色谱法、通过酰肼化学的分离或免疫亲和色谱法;
-任选地,在所述亲和色谱法分离步骤中酶促降解所述生物学样品的蛋白质。
44.根据实施方案1至43中一项或多项的方法,其中所述生物学样品为体液样品。
45.根据实施方案1至44中一项或多项的方法,其中所述生物学样品为生物学样品的非细胞级分。
46.根据实施方案44或45的方法,其中所述体液样品选自由下列各项组成的组中的一项或多项:全血、血浆、血清、滑液、胸腔积液、淋巴液、尿、脑脊液、脑脊髓液、腹水和支气管灌洗物,以及源自上述那些的样品,特别是通过去除细胞而源自上述样品的无细胞的或耗竭了细胞的样品。
47.根据实施方案1至46中一项或多项的方法,其中所述生物学样品选自由下列各项组成的组:全血、血浆和血清,优选地血浆。
48.根据实施方案1至47中一项或多项的方法,其中所述生物学样品为无细胞的或耗竭了细胞的样品。
49.根据实施方案1至48中一项或多项的方法,其中在步骤a)之前处理所述生物学样品,特别是通过获得所述生物学样品的非细胞级分。
50.根据实施方案1至49中一项或多项的方法,其中所述生物学样品为体液,特别是全血、血浆或血清,并且在步骤a)之前处理所述生物学样品。
51.根据实施方案49或50的方法,其中处理包括细胞分离或耗竭和/或色谱法。
52.根据实施方案1至51中一项或多项的方法,其中另外关于由感染因子引起的感染的起源区域得出结论。
53.根据实施方案52的方法,其中所述由感染因子引起的感染的起源区域为腹部、呼吸系统或泌尿道。
54.根据实施方案52或43中一项或多项的方法,其中所述方法进一步包括:
-测定在所述生物学样品中一个或多个区域生物标志物的水平;和
-基于在所述生物学样品中所述一个或多个区域生物标志物的存在和/或水平,确定由感染因子引起的感染的起源区域。
55.根据实施方案54的方法,其中所述一个或多个区域生物标志物选自下列中的一项或多项:
(i)由下列各项组成的组:具有EF手结构域的细胞生长调节物蛋白1(CGRE1),凝血因子VIII(FA8),磷脂转移蛋白(PLTP),蛋白Z依赖性蛋白酶抑制物(ZPI),α-1-抗胰凝乳蛋白酶(AACT),基质金属蛋白酶-9(MMP9),白介素-1受体拮抗剂蛋白(IL1RA),嗜中性粒细胞胶原酶(MMP8),壳多糖酶-3-样蛋白1(CH3L1),白介素-1受体样1(ILRL1),CD177抗原(CD177),嗜中性粒细胞明胶酶相关脂笼蛋白(NGAL),乳转铁蛋白(TRFL),白介素-18结合蛋白(I18BP),金属蛋白酶抑制物1(TIMP1),脂多糖结合蛋白(LBP),巨噬细胞甘露糖受体1(MRC1),IgGFc结合蛋白(FCGBP),和间-α-抑制物重链H3(ITIH3),用于确定来源于腹部的感染;或
(ii)由下列各项组成的组:神经元生长调节物1(NEGR1),载脂蛋白C-I(APOC1),血浆丝氨酸蛋白酶抑制物(IPSP),血清淀粉样A-4蛋白(SAA4),磷脂酰肌醇-聚糖-特异性磷脂酶D(PHLD),异戊二烯基半胱氨酸氧化酶1(PCYOX),凝血因子XIII B链(F13B),间-α-抑制物重链H1(ITIH1),间-α-抑制物重链H2(ITIH2),和维生素K依赖性蛋白S(PROS),用于确定来源于呼吸系统的感染。
56.根据实施方案1至55中一项或多项的方法,其中所述受试者为人受试者。
57.监测受试者的全身炎症的方法,其中所述方法包括:
iii)施行根据实施方案1至56中一项或多项的体外诊断全身炎症或者预后具有全身炎症的受试者的死亡风险的方法;和
iv)重复步骤i)至少一次。
58.根据实施方案57的方法,其中所述方法包括重复步骤ii)直至诊断出不存在所述全身炎症,或者用于监测治疗成功或治疗失败。
59.根据实施方案57或58的方法,其中重复步骤ii)包括施行步骤i)至少两次,例如至少三次、至少四次、至少五次、至少六次、至少七次、至少八次、至少九次、至少10次、至少12次、至少15次、至少20次、至少25次、至少30次或至少35次,优选地至少25次。
60.根据实施方案57至59中一项或多项的方法,其中所述方法包括在12小时内,特别地在24小时内,更特别地在48小时内重复步骤ii)。
61.根据实施方案58的方法,其中监测治疗成功或治疗失败包括在已起始或完成所述全身炎症的治疗后重复步骤i)至少一次,优选地重复施行步骤i)直至诊断出不存在所述全身炎症。
62.根据实施方案57至61中一项或多项的方法,其中关于脓毒症的发展监测具有不由感染因子引起的全身炎症的受试者。
63.治疗全身炎症的方法,其包括:
i)施行根据实施方案1至62中一项或多项的方法,和
ii)起始针对所述全身炎症的治疗。
64.根据实施方案63的方法,其中在步骤b)中诊断脓毒症,并且用抗生试剂在实施方案63的步骤ii)中起始治疗。
65.用于在治疗受试者中的感染或者治疗具有疑似感染的受试者的方法中使用的抗生试剂,其中所述感染为血流感染、全身感染或脓毒症中的一部分,并且其中所述血流感染、全身感染或脓毒症通过在生物学样品中sVSIG4的水平来进行诊断或监测。
66.根据实施方案65的用于在所述方法中使用的抗生试剂,其中所述受试者具有相比于未感染的对照而言增加的sVSIG4水平。
67.根据实施方案65或66中一项或多项的用于在所述方法中使用的抗生试剂,其中所述血流感染、全身感染或脓毒症通过根据实施方案1至62中一项或多项所定义的方法来诊断或监测。
68.在受试者中区分SIRS和脓毒症的方法,其中所述方法包括:
a)测定在所述受试者的生物学样品中sVSIG4的水平,和
b)比较在所述生物学样品中sVSIG4的水平与在罹患SIRS的受试者的生物学样品中sVSIG4的参考水平,
其中相比于步骤b)的参考水平而言步骤a)的在所述生物学样品中的水平增加表明在步骤a)的所述受试者中的脓毒症。
69.根据实施方案68的方法,其中所述方法具有在实施方案1至62中一项或多项之中所定义的特征。
70.sVSIG4作为生物标志物用于体外诊断受试者中的全身炎症或者预后具有全身炎症的受试者的死亡风险的用途。
71.实施方案70的用途,其中在根据实施方案1至62中一项或多项所定义的方法之中使用所述sVSIG4。
72.试剂盒,其包含对于sVSIG4的结合分子和对于至少一个进一步的生物标志物的结合分子,所述试剂盒用于定量检测sVSIG4和所述至少一个进一步的生物标志物。
73.根据实施方案72的试剂盒,其中所述检测基于生色、荧光和/或发光反应,和/或色谱方法。
74.根据实施方案72或73的试剂盒,其中所述结合分子选自由下列各项组成的组:抗体、适配体和纳米抗体。
75.根据实施方案72至74中一项或多项的试剂盒,其中所述试剂盒是快速测试或POC(床旁)测试。
本发明并不局限于在本文中所公开的示例性的方法和材料,并且在本发明的实施方案的实践或测试中可以使用与在本文中所描述的那些相似或等价的任何方法和材料。数值范围包括定义所述范围的数字。在本文中所提供的标题并不是本发明的各个方面或实施方案(其可以通过参考整个说明书来阅读)的限制。
如在主题说明书、条目和权利要求书中所使用的,单数形式“a”、“an”和“the”包括复数方面,除非上下文另有明确规定。术语“包括”、“具有”、“包含”及其变化形式同义地进行使用,并且应当被解释为非限制的。可以存在进一步的组分和步骤。在整个说明书中,当组合物被描述为包含组分或材料时,另外还考虑,所述组合物在实施方案中也可以基本上由或由所记述的组分或材料的任何组合组成,除非另有描述。提及“本公开内容”和“本发明”等包括在本文中所教导的单个或多个方面等。术语“本发明”涵盖了在本文中所教导的方面。
优选的是选择和组合在本文中所描述的优选实施方案,并且产生自优选实施方案的各自组合的特定主题也属于本公开内容。
实施例
应当理解,下面的实施例仅为了举例说明的目的,并且不应当以任何方式被解释为限制本发明。下面的实施例证明,sVSIG4适合于在体外诊断全身炎症(特别是脓毒症)的方法中使用。特别地,所述实施例显示,sVSIG4是用于区分由感染因子引起的全身炎症(例如,脓毒症)与不由感染因子引起的全身炎症(例如,SIRS)的合适的生物标志物。所述实施例进一步证明,sVSIG4是用于在监测受试者的全身炎症(特别是脓毒症)的方法中使用的合适的生物标志物。
脓毒症相关生物标志物的鉴定
为了鉴定在患者血浆中的脓毒症相关生物标志物,使用了从Jena UniversityHospital的生物银行(biobank)可得的血浆样品,其是在Jena University Hospital,Department of Anesthesiology and Critical Care Medicine按照脓毒症-2定义(根据美国胸内科医师协会/危重症医学会(American College of Chest Physicians/Societyof Critical Care Medicine)共识会议的脓毒症标准;参见Chest 1992,101(6):1644-55)收集的。既未怀疑也未证明具有作为基础的感染的具有阳性SIRS标准的在重症监护病房中的患者充当对照组。通过将他们划分为四个组来招募患者:第1组-具有SIRS的患者;第2组-具有SIRS和器官功能障碍的患者;第3组-具有严重脓毒症的患者;和第4组-具有脓毒性休克的患者。最终将来自这些患者的样品合并为2个组以用于蛋白质组分析:具有“SIRS”亚组和“SIRS+器官功能障碍”亚组的SIRS组,和具有“严重脓毒症”亚组和“脓毒性休克”亚组的脓毒症组。不分析按照脓毒症-2定义具有较低程度的“脓毒症”的患者。
对于分析,来自在由治疗医师进行脓毒症诊断后最早的可能时间(第1或2天)的柠檬酸化的血浆样品被选择用于鉴定全身感染以及严重脓毒症或脓毒性休克发作的早期标志物。在第一个患者群组中,研究了264名患者,143名患者具有严重脓毒症(n=26)或脓毒性休克(n=117),并且121名患者具有SIRS(n=53)或SIRS+器官功能障碍(n=68)(参见表4中的临床参数)。这两个患者组未显示年龄或体重指数(BMI)的差异。在这两个组中招募的男性都比女性稍多,但是所述组在统计学上没有显著差异。在脓毒症组中危重护理评分系统SOFA-得分、APACHE-得分和SAPS-得分显著增加。在脓毒症组中还显著更频繁地发生发热、白细胞增多、低氧血、肾功能障碍、代谢性酸中毒和低血压。PCT和CRP在脓毒症组中显著升高。感染的微生物学证实在脓毒症组中在所有病例的39.2%中是成功的,其中革兰氏阳性细菌以34.3%被检测到,革兰氏阴性细菌以16.1%被检测到,并且所有阳性病例的7.7%中检测到真菌感染。所有脓毒症患者的53.8%在呼吸道中具有感染病灶,其中35.0%在腹部中和4.9%在生殖泌尿道中。关于院内死亡和重症监护病房死亡的死亡率在脓毒症组中分别为44.8%和33.5%,和在SIRS组中分别14%和9.0%。
表4.对于每名患者对于第一可得样品(第1或2天)在发现群组(群组1)中的具有脓毒症或SIRS的患者的临床参数。数据为中值和四分位数间距(IQR),或计数,数目(%)。缩写的定义:APACHE=急性生理学和慢性健康评价II,SOFA=序贯性器官衰竭评估,SAPS=简化急性生理学得分II,PCT=降钙素原(ng/ml),CRP=C反应蛋白(mg/l),WBC=白细胞计数,ICU=重症监护病房。统计学分析用Mann-Whitney-U-检验或
为了还检测以较低量存在的蛋白质,富集在血浆样品中的糖基化蛋白质。利用与蛋白质支架共价连接的糖残基,在温和氧化后经由所谓的酰肼化学将糖基化蛋白质偶联至固相(Sepharose)。非糖基化蛋白质被洗去,并且可以处理血浆糖蛋白的经富集的制备物以用于蛋白质组研究和质谱法。与sepharose共价连接的糖蛋白在半胱氨酸残基处还原,这些通过烷基化而在其氧化状态中是稳定化的,并且在充分洗涤后,将糖蛋白通过蛋白酶(胰蛋白酶)在固相处切割为肽,其现在可以自由地移动到sepharose的上清液中。在sepharose上还剩余很少一些肽,它们仍然携带确保与sepharose的连接的糖残基。通过添加另一种酶,PNGaseF,可以从蛋白质的肽部分上直接切割最常见的糖基化类型(称为N-糖基化)的糖残基,从而甚至允许糖蛋白的这些最后的肽进入溶液并且变得可用于MS分析。在通过PNGase释放的先前所使用的N-糖基化位点处,将天冬酰胺通过脱氨作用转变为天冬氨酸,其可以通过质量变化和随后的质谱分析来检测。将所得的血浆样品的两个肽级分(胰蛋白酶和PNGaseF肽)通过反向液相色谱来分开并且通过质谱法(LC-MS/MS)来进行分析,从而提供了对于以低浓度存在的糖蛋白的良好灵敏度,这是由于样品(尤其是PNGaseF肽级分)的低复杂性。在原始数据的随后的软件辅助计算中,再次将所述两个级分的结果合并在一个样品中(图1)。结果是血浆样品的糖蛋白特性谱,具有很少几个未完全去除的非糖基化蛋白质作为污染物。除了鉴定在样品中存在的肽和蛋白质之外,现代质谱法还提供了对于所鉴定出的肽的定量值。经由用于分析样品的软件包可以将这些转变为关于在样品中所包含的独个蛋白质的定量值。所使用的分析软件,MaxQuant(1.5.5.1版),计算蛋白质的相对浓度并且以所谓的无标记量(label-free-quantity;LFQ)值来给出丰度。在最终的结果中,获得了关于在样品中的独个蛋白质的具有其相对定量值的所鉴定出的蛋白质的结果列表,其可以为统计学考虑而进一步使用和比较。
在分析来自发现群组的264份血浆样品后,在整个数据集中在所述样品中鉴定出总共997种不同的蛋白质,包括731种糖蛋白(下面的表6)。
平均而言,在脓毒症组的血浆样品中鉴定出了685±40种血浆蛋白质,和在SIRS组中鉴定出了663±35种血浆蛋白质(图2A)。在100%的所有患者样品中可以鉴定和定量209种糖蛋白,并且在≥50%的所有患者样品中可以发现498种糖蛋白(图2B)。用关于HumanPlasma Protein Consortium的血浆蛋白质的定量值进行的比较显示,以50%可重现性鉴定出的血浆蛋白质在0.1-1ng/ml的浓度范围中(图2C),其相应于所述方法的非常良好的灵敏度。
关于具有100%检测可重现性(覆盖5个数量级的浓度范围)的五种所选择的糖蛋白的定量值(LFQ值)的比较显示,关于在来自独个危重患者的样品中的这些蛋白质的无标记量(LFQ)值显示出相当的方差(图2D)。也就是说,在测量范围上的可重现性是高的,具有从33.4%至57.1%变动的标准偏差(SD),其中稍微倾向于在较低的LFQ强度下具有较高的标准偏差(图2E)。
主要组分分析(principal component analysis;PCA)显示,在数据集中存在这样的标准,其允许在方差基础上区分SIRS组与脓毒症组。第一主要组分的比例为7.12%。下面的患者血浆样品的统计学分析显示,在SIRS和脓毒症患者组的血浆样品中可检测到令人惊讶的数目的丰度有显著差异的蛋白质。在这两个组中显著不等地表达了总共312种蛋白质(t-检验,p
在验证群组中sVSIG4的鉴定
然后,将来自264名患者的发现群组的结果与来自第二个96名患者群组的结果进行比较,以进行证实(验证群组,SIRS组:n=55,包括30名具有SIRS的患者和26名具有SIRS+器官功能障碍的患者;或脓毒症组:n=41,包括7名具有严重脓毒症的患者和34名具有脓毒性休克的患者,也可参见表5)。
表5.对于每名患者对于第一可得样品在验证群组中的具有脓毒症或SIRS的患者的临床参数。数据为中值和四分位数间距(IQR),或计数,数目(%)。缩写的定义:APACHE=急性生理学和慢性健康评价II,SOFA=序贯性器官衰竭评估,SAPS=简化急性生理学得分II,PCT=降钙素原(ng/ml),CRP=C反应蛋白(mg/l),WBC=白细胞计数,ICU=重症监护病房。统计学分析用Mann-Whitney-U-检验来进行,除非另有说明。
也是在该群组中,SOFA-得分、APACHE ii-得分、CRP-水平和PCT-水平在脓毒症组中显著高于在SIRS组中,而死亡率在脓毒症组中仅稍高于在SIRS组中。如在发现群组中的血浆样品那样处理在验证群组中的血浆样品。与发现群组的分析相反,验证群组的LC-MS/MS分析通过三次重复测量(技术性三次重复)来进行,以增加在验证群组的样品中的肽和蛋白质鉴定的灵敏度和可重现性。
在验证群组中鉴定出的987种蛋白质(包括695种糖蛋白)之中(表6),当在脓毒症组和SIRS组之间进行比较时,294种血浆蛋白质显著地不同,包括193种具有较高浓度或丰度的血浆蛋白质和101种具有较低浓度或丰度的血浆蛋白质(图4)。
表6.在发现群组和验证群组中的肽和蛋白质鉴定
通过比较所述两个群组,在这两个群组中总共199种血浆蛋白质显示出显著不同的浓度或丰度(图5A),和在脓毒症组中总共122种血浆蛋白质同时显示出较高的丰度或浓度和76种血浆蛋白质同时显示出较低的丰度或浓度(图5B和5C)。一种血浆蛋白质显示出不同的倾向。在SIRS组和脓毒症组中的199种具有显著不同丰度的血浆蛋白质之中的183种在UniProt数据库中被注释为糖蛋白;对于在SIRS组和脓毒症组中具有不同表达的其余16种蛋白质(8%),迄今还不知道糖基化。在这16种血浆蛋白质之中,包括在脓毒症组中以较高水平检测到的C反应蛋白(CRP),和血清淀粉样蛋白-1(SAA1)和血清淀粉样蛋白-2(SAA2)这些急性期蛋白质。令人惊讶地,可溶性蛋白质含V-set和免疫球蛋白结构域的蛋白4(sVSIG4),一种被注释为非糖基化的蛋白质,显示出在发现群组和验证群组两者中所有经检测的血浆蛋白质的最大的在脓毒症组和SIRS组之间的倍数变化。在这两个群组中,在脓毒症患者样品中以显著升高的水平可检测到该蛋白质(表7)。
表7.在发现群组中和在验证群组中鉴定出的在SIRS和脓毒症患者中丰度有显著差异的蛋白质的蛋白质登录号(蛋白质ID)、输入项名称、p-值、倍数变化(FC)和肽数目。蛋白质ID和输入项名称从具有发行版本号2016_04的UniProt数据库中检索。输入项名称可以备选地具有后缀“_HUMAN”;具有和没有该后缀,意味着相同的蛋白质。
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
表11列出了所有鉴定出的适合于检测在SIRS或脓毒症患者中具有显著不同浓度的血浆蛋白质的肽(表7)(在用显著不同浓度进行研究的所述两个群组中)。
接受者操作特征(ROC)曲线分析
为了测定在发现群组数据集中以显著改变的浓度检测到的蛋白质的诊断质量,进行接受者操作特征(ROC)曲线分析,其中使用以蛋白质组学方式测定的LFQ值,比较真阳性率与假阳性率。取在临床上测定的PCT值的ROC曲线作为基线参考(图6)。在264名患者的发现群组数据集中的PCT值显示出仅0.63的AUC。相反地,以蛋白质组学检测到的CRP值显示出0.81的显著更高的AUC。当使用在门诊中测量的值时,关于CRP的值稍微更好;0.85的AUC揭示了相比于PCT值而言显著经改善的灵敏度和特异性。
相比于脓毒症组在SIRS组中具有显著不同血浆水平的在发现群组的蛋白质组数据集中检测出的蛋白质之中的十三种显示出相比于CRP而言经改善的AUC(图6):血清转铁蛋白(TRFE,基因名称TF),AUC=0.85;胰岛素样生长因子结合蛋白复合物酸不稳定亚基(ALS,基因名称:IGFALS),AUC=0.85;胆碱酯酶(CHLE,基因名称BCHE),AUC=0.86;巨噬细胞甘露糖受体1,MMR(MRC1,基因名称MRC1),AUC=0.86;afamin(AFAM,基因名称AFM),AUC=0.86;间-α-胰蛋白酶抑制物重链H3(ITIH3,基因名称ITIH3),AUC=0.86;α-2-HS-糖蛋白(FETUA,基因名称AHSG),AUC=0.87;可溶性含V-set和免疫球蛋白结构域的蛋白4(sVSIG4,基因名称VSIG4),AUC=0.87;calistatin(KAIN,基因名称SERPINA4),AUC=0.88;N-乙酰基胞壁酰基-L-丙氨酸酰胺酶(PGRP2,基因名称PGLYRP2),AUC=0.88;磷脂酰肌醇-聚糖-特异性磷脂酶D(PHLD,基因名称GPLD1),AUC=0.90;间-α-胰蛋白酶抑制物重链H1(ITIH1,基因名称ITIH1),AUC=0.91;间-α-胰蛋白酶抑制物重链H2(ITIH2,基因名称ITIH2),AUC=0.93。然而,这13种血浆蛋白质之中,TRFE、ITIH3、PGRP2、ITIH1和ITIH2相比于脓毒症组在SIRS组中仅显示出稍微不同的丰度水平(FC≤2)。在验证群组中,ALS(0.82)、CHLE(0.83)、AFAM(0.82)、ITIH3(0.78)、PHLD(0.81)和ITIH1(AUC=0.84)具有比CRP稍微更低的AUC。相反地,在验证群组中,TRFE(AUC=0.90)、MRC1(AUC=0.91)、FETUA(AUC=0.91)、sVSIG4(AUC=0.88)、KAIN(AUC=0.91)和ITIH2(AUC=0.86)也显示出比CRP更高的灵敏度和更高的特异性。
线性判别分析(LDA)
然后,通过使用用在发现群组中显示出最高AUC值的24种血浆蛋白质(具有倍数变化排除标准FC>2)来进行的线性判别分析(LDA,向后消除方法),搜寻组合地产生比独个标志物更加好的AUC的分类器(图7)。用所有24个标志物候选物的AUC为0.971,4个标志物(PHLD、IBP3、A2GL和sVSIG4)的组合显示出0.959的AUC,并且两种血浆蛋白质PHLD和sVSIG4的组合显示出0.940的AUC。
随后用血浆蛋白质进行相同的方法,而不考虑在SIRS组和脓毒症组之间的倍数变化标准≥2(图8)。在开始时所考虑的24种蛋白质取得了0.973的AUC。在减少至四个标志物(ITIH2、PGRP2、sVSIG4和CD14)后,仍然可以观察到0.966的AUC。减少至2个标志物(sVSIG4和ITIH2)具有AUC=0.952,相比于具有FC≥2(作为排除标准)的LDA稍有改善。
在所述两种情况下,所述组合的AUC都优于使用CRP作为唯一标志物。出人意料地,在所述两种方法中均在具有两个标志物的组合中包括了sVSIG4,作为用于诊断脓毒症的标志物。因此,单独的或者与一种(在该实例中,ITIH2和PHLD)或多种其他血浆蛋白质相组合的sVSIG4适合于脓毒症诊断并且显示出相比于使用CRP和PCT而言更好的AUC。
微生物学比较
在发现群组中,相比于来自没有在微生物学方面阳性的结果的患者(205名患者,诊断为具有SIRS或脓毒症;微生物学发现阴性或未测试)的血浆样品而言,在具有在微生物学方面阳性的结果的患者样品(59名患者)中检测到的血浆蛋白质的统计学分析显示,在数据集中可检测到104种丰度有显著差异的血浆蛋白质,其中34种具有FC≥2,在所述两个组之间丰度不同(图9A)。在微生物培养阳性/阴性(MiBi pos/neg)的比较中显著不同地检测出的蛋白质之中的100种也在脓毒症与SIRS的比较中显示出显著不同的丰度(图9B)。所有39种相比于MiBi pos/neg而言在培养阳性的患者的血浆中显示出降低的水平的血浆蛋白质也在脓毒症患者中以相比于SIRS患者而言降低的水平被检测到(图9D)。在65种在MiBipos/neg比较中以升高的水平可检测到的血浆蛋白质之中,61种也在来自脓毒症患者的血浆中升高(图9C)。MiBi-pos/neg和SIRS/脓毒症比较的结果显示了强相关性,这表明脓毒症患者的不同地可检测的血浆蛋白质水平的结果的一部分实际上是由作为脓毒症基础的全身感染引起的。
在MiBi-阳性患者样品中显示出显著更高的血浆水平的血浆蛋白质之中,可溶性含V-set和免疫球蛋白结构域的蛋白4(sVSIG4)是在该比较中具有最突出的正倍数变化的蛋白质(表8)。这表明,sVSIG4是用于诊断全身感染(例如,在具有疑似脓毒症的危重患者中)的在患者血液中的合适的标志物。
表8.在发现群组中在具有阳性微生物培养的患者和具有阴性微生物学结果的危重患者中丰度有显著差异的蛋白质的蛋白质登录号(蛋白质ID)、输入项名称、p-值和倍数变化(FC)。蛋白质ID和输入项名称从具有发行版本号2016_04的UniProt数据库中检索。输入项名称可以备选地具有后缀“_HUMAN”;具有和没有该后缀,意味着相同的蛋白质。
/>
/>
/>
由革兰氏阳性和革兰氏阴性细菌引起的脓毒症与具有腹部和呼吸道来源的脓毒症的比较
sVSIG4在血浆中在由革兰氏阳性(n=49)和革兰氏阴性(n=23)细菌引起的全身感染(经微生物学证实的脓毒症)中同等地升高(FC=1.002)(图10A),并且因此对于检测由任一组细菌引起的全身感染来说是有用的。然而,当比较在来自发现群组的患者血浆中原始炎症位点的不同的感染来源位点时,存在差异。例如,当比较“腹部病灶”(n=50)与“呼吸系统病灶”(n=77)时,在30种蛋白质的血浆水平方面存在显著差异,其中13种具有FC≥2(图10B)。特别地,金属蛋白酶-9(MMP9)、白介素-1受体拮抗剂蛋白(IL1RN)、可溶性含V-set和免疫球蛋白结构域的蛋白4(sVSIG4)、金属蛋白酶8(MMP8)、壳多糖酶-3-样蛋白1(CHI3L1)、白介素受体样1(IL1RA)、CD177抗原(CD177)、嗜中性粒细胞明胶酶相关脂笼蛋白(NGAL)、乳转铁蛋白(TRFL)、白介素-18结合蛋白(IL18BP)、金属蛋白酶抑制物1(TIMP1)和具有EF手结构域的细胞生长调节物蛋白1(CGRE1)显示出在腹部病灶处的显著增加的血浆水平(FC≥2),而神经元生长调节物1(NEGR1)在呼吸道病灶处在数据集中增加(FC≥2)(表9)。因此,sVSIG4是用于检测有着腹部病灶的全身感染和脓毒症的在血浆中的合适的生物标志物,但是高的sVSIG4水平在具有有着呼吸道病灶的全身感染或脓毒症的患者的血浆样品中也是可检测到的。因此,sVSIG4也适合作为用于有着呼吸道病灶的全身感染或脓毒症的诊断目的的生物标志物。
表9.在发现群组的具有腹部病灶或在呼吸系统中的病灶的患者血浆中丰度有显著差异的蛋白质的蛋白质登录号(蛋白质ID)、输入项名称、p-值和倍数变化(FC)。负FC表明了在具有腹部病灶的患者中的更高的丰度。蛋白质ID和输入项名称从具有发行版本号2016_04的UniProt数据库中检索。输入项名称可以备选地具有后缀“_HUMAN”;具有和没有该后缀,意味着相同的蛋白质。
死亡率的预后
发现群组数据集的进一步分析显示,已经在诊断开始时(在第1天或第2天)在患者样品中检测到与增加的脓毒症死亡风险相关的血浆蛋白质。相比于来自所有其他危重但幸存的患者的数据,来自死于脓毒症的患者的蛋白质组定量数据的统计学分析揭示了总共179种显著改变的血浆蛋白质,125种具有≥2的在两个组之间的FC(图11A)。相反地,在较小的96名患者的验证群组中,仅4种血浆蛋白质是丰度有显著差异的(当比较脓毒症死者组与幸存者组时检测到的),其中的三种(可溶性含V-set和免疫球蛋白结构域的蛋白4,sVSIG4;生腱蛋白,TENA;激肽原-1,KNG1)也已经在发现群组中被鉴定为显著改变的(图11B)。表10列出了在死于脓毒症的患者和幸存的危重患者中丰度有显著差异的蛋白质(发现群组和验证群组)。
表10.在发现群组中和在验证群组中鉴定出的在死于脓毒症的患者和幸存的危重患者中丰度有显著差异的蛋白质的蛋白质登录号(蛋白质ID)、输入项名称、p-值、倍数变化(FC)和肽数目。蛋白质ID和输入项名称从具有发行版本号2016_04的UniProt数据库中检索。输入项名称可以备选地具有后缀“_HUMAN”;具有和没有该后缀,意味着相同的蛋白质。
/>
/>
/>
/>
在发现群组的接受者操作特征分析中,sVSIG4显示出在数据集中所鉴定出的所有蛋白质(其预后性地表明具有增加的死亡风险的脓毒症)的最高AUC(图12)。sVSIG4的AUC为0.77,而在该预后中CRP和PCT的临床数据显示出分别为0.66和0.56的显著更差的AUC值。为了用于鉴定处于增加的死亡风险中的患者的预后目的的sVSIG4的AUC不仅在所检测的血浆蛋白质的蛋白质组数据集方面是最佳的,而且比可得的临床参数表现更好,比在样品收集日时的SOFA-得分、APACHE ii-得分和SAPS-得分(AUC
通过ELISA的证实和定量分析
随后,通过ELISA(酶联免疫吸附测定法,定量的)来定量sVSIG4的血浆水平以进行证实。使用针对VSIG4的细胞外结构域(并因此与sVSIG4相结合)的合适的抗体对,就sVSIG4对来自发现群组和验证群组的血浆样品进行检定。结果是,在发现群组和验证群组中来自脓毒症患者的血浆样品显示出相比于SIRS组而言显著升高的水平:在发现群组和验证群组中在来自脓毒症患者的血浆中的sVSIG4浓度(平均值±SD)分别为83493±82876pg/ml和84391±83982pg/ml,和在发现群组和验证群组中在来自SIRS患者的血浆样品中的sVSIG4浓度分别为12572±40392和11532±41672(单向ANOVA Dunn多重比较检验p<0.0001,图14A)。关于作为基础的疾病的严重度,相比于“SIRS”和“SIRS+器官功能障碍”患者而言,在来自具有严重脓毒症和脓毒性休克的患者的血浆样品中存在显著增加的sVSIG4水平。具有脓毒性休克的患者显示出最高的sVSIG4血浆水平,但是这与来自具有严重脓毒症的患者的样品相比并没有显著升高(图14B)。在发现群组中对于具有经微生物学证实的阳性结果的患者组(相比于培养阴性的患者而言,图14C)和对于具有升高的SOFA-得分(≥7)的患者(相比于具有SOFA≤6的患者而言,图14E),也检测到显著升高的水平的血浆相关sVSIG4(p<0.0001)。在具有有着腹部病灶(相对于在呼吸道中的病灶)的脓毒症的患者中检测到血浆sVSIG4浓度的轻微但显著的增加(p<0.05),这与蛋白质组数据相一致(图14D)。来自在疾病过程期间死于脓毒症的患者的血浆样品(在诊断后第1或2天)显示出相比于幸存的患者而言显著增加的早期sVSIG4血浆浓度(图14F)(SIRS和脓毒症):脓毒症(平均值+SD)=99617±76947pg/mL,和SIRS(平均值+SD)=40020±71920pg/mL。
通过ELISA测定的sVSIG4水平与在门诊中测量的CRP和PCT水平的比较(发现群组和证实群组,n=360,图15)显示,在所有患者的血浆中的sVSIG4水平与CRP水平轻微相关,即升高的CRP水平也导致在患者血浆中的升高的sVSIG4水平(图15A)。当单独地检查来自SIRS组的样品时,该相关性丢失(图15B),其中sVSIG4水平从1000至10,000pg/ml变动。在具有脓毒症的患者组中,发现sVSIG4水平在所有患者中都是高的(在10,000-100,000pg/ml的范围中,图15C),并且与在相同检查日的患者的渐增的CRP水平的相关性是不明显的。具有低CRP值的脓毒症患者大多数已经显示出高的sVSIG4值。与PCT的相关性是相似的。虽然在所有患者或SIRS组的患者的检查中可以显示出没有血浆VSIG4与PCT的相关性,但是明显的是,和与CRP的比较相似地,sVSIG4在所有患者组中在检查日时都以高浓度出现(具有3个低于检测水平的例外),与所测量的PCT值无关(图15D和15E)。特别地,在脓毒症组中,sVSIG4浓度强烈升高,与PCT值无关(图15F)。
总之,通过ELISA的证实实验表明,通过使用定量方法来测定在患者血液样品(例如,血浆)中的sVSIG水平(单独地,或者与其他生物标志物相组合地),可能在诊断上区分具有严重脓毒症或脓毒性休克的患者与具有SIRS或SIRS+器官功能障碍的患者。进一步地,高的sVSIG4水平已经在该疾病的早期阶段指明了患者的增加的死亡风险,从而该患者组可以被鉴定并且因此可以得到个性化的、更密集的监测以便能够在早期阶段在治疗上进行干预。在具有全身感染的微生物学阳性确证和具有高的SOFA-得分值的患者中,在血浆中sVSIG4水平是特别高的。
sVSIG4的血浆浓度仅显示出与CRP的轻微相关性(高的CRP值与高的sVSIG4值相关),但是尤其是在脓毒症组中,当在诊断的第1或2天在CRP值仍然相当低时,已经可检测到高的sVSIG4水平。因此,sVSIG4是关于全身感染、脓毒症和脓毒性休克的标志物,其不依赖于CRP以及PCT。
作为具有非常良好表现的脓毒症预测器,可以考虑单独的sVSIG4(图16A+B)和与其他生物标志物相组合的sVSIG4,例如PHLD(其单独地也显示出良好表现,图16C,质谱法数据),但是与CRP(临床数据,图16D)(其已经在门诊中使用)的组合也是可能的。sVSIG4和PHLD的组合(图16E)在0.262的截止值处具有88.4%的灵敏度与特异性(这两个标志物的线性组合),AUC为0.94。基于仅PHLD值,通过ELISA的定量测定可以导致更加准确的值和经改善的特异性/灵敏度。sVSIG4和CRP的组合相比于sVSIG4/PHLD组合而言表现稍差,但是在-0.203的截止值处具有86.7%的灵敏度与特异性和具有0.916的AUC(图16F,ELISA数据,sVSIG4)。与成髓细胞蛋白酶(PRTN3)的组合也是可能的(图16G),其中在-0.126的截止值处具有87.1%的灵敏度与特异性(这两个标志物的线性组合),AUC为0.917。
在脓毒症患者(脓毒症-3定义)的血浆中增加的sVSIG4丰度的证实
在脓毒症患者(按照脓毒症-3定义进行分类的)群组中,在来自脓毒症患者、具有脓毒性休克的患者和一组健康志愿者的EDTA-血浆(15个样品/组)中通过ELISA(酶联免疫吸附测定法,定量的)来定量sVSIG4的血浆水平,其中使用针对VSIG4的细胞外结构域(并因此与sVSIG4相结合)的合适的抗体对。相比于脓毒症组而言,在脓毒性休克组中的患者显示出更高的CRP水平(分别为201±91.7mg/ml和275.4±138.3mg/ml(平均值±SD),图17A),显著更高的PCT水平(分别为4.4±7.7ng/ml和48.2±119.4ng/ml(平均值±SD),p=0.040,双尾t-检验,图17B),和显著增加的SOFA-得分(分别为2.5±1.8和11.3±3.2(平均值±SD),p<0.0001,双尾t-检验,图17C)。在15个健康志愿者样品中的14个之中,在血浆中的sVSIG4低于该测定法的检测极限。被诊断为具有脓毒症的患者显示出在血浆中的显著升高的sVSIG4水平,具有31889±91603pg/ml(平均值+SD)的平均浓度,而两名患者具有低于检测水平的sVSIG4水平。具有脓毒性休克的患者显示出在血浆样品中的进一步增加的sVSIG4水平,具有90124±91684pg/ml(平均值+SD),这相比于脓毒症组而言显著增加(p<0.0007,双尾t-检验)。数据表明,在脓毒症患者(按照脓毒症-3定义进行定义的)中的sVSIG4水平实质上随死亡率增加而升高。
临床研究
本发明的发现可以用下面的临床研究(其以示例性方式来描述)来进一步进行分析。
1.筛选(n=2000)
ICU接纳:
在15个月的研究招募期期间对10个ICU的合格性进行评估:具有严重心血管疾病的患者、被诊断为具有脓毒症或疑似脓毒症的患者、具有脓毒性休克的患者。
2.分配(n=900)(预期被排除的(n=1100))
患者招募:
(i)基本特征(年龄、性别、SOFA-得分、APACHE-ii-得分、SAPS-ii-得分、CRP、PCT、低血压治疗、乳酸盐、器官功能障碍、感染病灶)的评估;
(ii)取样日1(在ICU接纳后最多24小时),用于血浆制备的EDTA血液样品,储存于-80℃。
3.追踪
随访:
(i)基本特征(年龄、性别、SOFA-得分、APACHE-ii-得分、SAPS-ii-得分、CRP、PCT、低血压治疗、乳酸盐、器官功能障碍、感染病灶、微生物学结果)的评估;
(ii)在第1天和每隔一天(如果可应用)的患者取样:用于血浆制备的EDTA血液,储存于-80℃。
病例:感染组
(泌尿道,呼吸道,腹部,伤口,外科手术后)
脓毒症,n=300
脓毒性休克,n=300
对照:无感染组,n=300
严重心血管疾病
4.分析
待分析的病例(n=900)
标志物_M1血浆浓度
待分析的对照(n=300)
标志物_M1血浆浓度
在SIRS和脓毒症患者中丰度有差异的蛋白质
下面的表11列出了在SIRS和脓毒症患者中丰度有差异的蛋白质的蛋白质名称和经鉴定的肽序列。在一个优选的实施方案中,可以将sVSIG4的水平与所鉴定出的蛋白质中任何一种或多种的水平相组合以用于在本文中所描述的方法。
表11.在SIRS和脓毒症患者的发现群组和验证群组中丰度有显著差异的蛋白质的蛋白质登录号(蛋白质ID)、基因名称、蛋白质名称和经鉴定的肽序列。序列从2016年5月11日的具有发行版本号2016_04的UniProt数据库中检索。
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
