适用于蓝耳病毒1型和2型的全基因组捕获试剂盒及应用
文献发布时间:2024-04-18 20:01:23
技术领域
本发明蓝耳病毒检测领域,特别涉及一种适用于蓝耳病毒1型和2型的全基因组捕获试剂盒及应用。
背景技术
猪繁殖与呼吸综合征(PRRS)的病原体是猪繁殖与呼吸综合征病毒(Porcinereproductive and respiratory syndrome virus,PRRSV),故猪蓝耳症是由PRRSV引起的一种以猪繁殖障碍和呼吸困难为主要症状的传染性疾病,以母猪发热、厌食、早产、流产、死胎、弱仔等繁殖障碍及猪的呼吸系统疾病和高死亡率为主要特征,该病危害严重,并且目前缺少有效的防治措施。
PRRSV属于正链RNA病毒,属动脉炎病毒科、动脉炎病毒属,病毒粒子呈卵圆形,外部具有囊膜,囊膜上的衣壳蛋白20面体对称。PRRSV没有血凝素蛋白(Hemagglutinin,HLA),因此不具有血凝素活性。PRRSV基因组大概有15kb,至少有八个ORF:ORF1a、ORF1b和ORFs2 -7,ORF1a和ORF1b编码多聚蛋白,可以制解成非结构蛋白(Nsps):Nsplα,Nsp1β和Nsp2-12,ORFs2-7编码结构蛋白GP2、GP3 -5、M和N。蓝耳病毒有不同的亚型和血清型,其中最常见的分为1型和2型,蓝耳病毒1型(PRRSV-1):这是最早被发现的蓝耳病毒类型之一,它也被称为欧洲型(European type)或经典型(classical type)。蓝耳病毒1型感染的猪通常表现出较轻的临床症状,但仍然可能导致生殖和呼吸系统问题,影响猪的生产效益,这一型蓝耳病毒在欧洲和其他地区广泛传播;蓝耳病毒2型(PRRSV-2):蓝耳病毒2型也被称为北美型(NorthAmerican type)或新世界型(new world type),与1型不同,2型蓝耳病毒感染的猪通常表现出更严重的临床症状,包括高发病率和死亡率,这一型蓝耳病毒主要在北美地区流行,特别是美国可以引起相似的临床症状和病理变化。
蓝耳病毒对猪产业造成了重大经济损失,因为它会导致生产效益下降、生猪死亡率增加,同时也会增加兽医和治疗成本,目前对于蓝耳病毒的研究主要有以下几种方法:
1、血清学诊断方法:
常用的血清学方法有血清中和试验、IFA试验、酶联免疫吸附试验等血清学诊断,但迄今为止,尚无任何一种血清学方法能检测所有的PRRSV病毒株;
2、RT-PCR或荧光RT-PCR方法:
现有检测样本中PRRSV有无的方法主要是基于qPCR的方法,而目前qPCR方法只检测一个基因位点,存在由于病毒在引物区域的变异或降解而导致假阴性的检测结果和不能获得序列变异信息的局限性;
3、测序技术:
现用检测序列变异的技术是基于PCR结合一代测序检测1到2个基因区域的变异信息,存在低效、监测范围有限的局限。因此为了获取更全面的序列变异,典型的方法是将整个基因组分为多段,比如14或15段,采用重叠的引物进行PCR扩增和产物的一代测序,然后基于测序结果进行基因组的组装,但是这种方法依赖于病毒的分离培养,而病毒的分离培养比较困难;即使培养成功,由于病毒的高变异性,采用已有引物也很难将全部片段扩增成功,存在灵敏度低、效率低和耗时的局限。
因此,急需一种无需培养即可实现高灵敏度的蓝耳病毒1型和2型的全基因检测和变异监测的方案。
发明内容
本方案提供了一种适用于蓝耳病毒1型和2型的全基因组捕获试剂盒及应用,能从肺组织、血液、唾液、病毒液等环境中提取的核酸样本中进行蓝耳病毒1亚型和2亚型全基因组反转录与富集扩增,可以用于检测与鉴定蓝耳病毒,也可为蓝耳病毒的进化分析、分子流行病学研究及科学防控提供了有力的技术手段。
本方案提供的适用于蓝耳病毒1型和2型的全基因组捕获试剂盒不仅可用于蓝耳病毒1型和2型全基因组的扩增与测序,而且还可用于蓝耳病毒1型和2型的快速检测与鉴定,不仅适用于近几年流行毒株,而且还适用于回溯性队列研究,具有操作简便、特异性强、灵敏度高和准确性好的优点,同时也为蓝耳病毒1型和2型病毒的进化分析、分子流行病学研究及科学防控提供了有力的技术手段。
为实现以上发明目的,本方案提供了一种适用于蓝耳病毒1型和2型的全基因组捕获试剂盒,包括:四组引物池,其中第一引物池内的引物含有引物序列如SEQ ID NO.1-SEQID NO.22所示的靶向引物;第二引物池内的引物含有引物序列如SEQ ID NO 23-SEQ IDNO.41所示的靶向引物,第三引物池内的引物含有引物序列如SEQ ID NO 42-SEQ ID NO.63所示的靶向引物,第四引物池内的引物含有引物序列如SEQ ID NO.64-SEQ ID NO.82所示的靶向引物。
具体的,第一引物池内的靶向引物的引物序列如下表一所示:
表一第一引物池的靶向引物
其中第一引物池中的SEQ ID NO.1-SEQ ID NO.22所示的靶向引物中相邻序号的正向的靶向引物和反向的靶向引物依次序两两组成一个引物对,SEQ ID NO.1,SEQ IDNO.3,SEQ ID NO.5,SEQ ID NO.7,SEQ ID NO.9,SEQ ID NO.11,SEQ ID NO.13,SEQ IDNO.15,SEQ ID NO.17,SEQ ID NO.19和SEQ ID NO.21对应的是正向的靶向引物,SEQ IDNO.2,SEQ ID NO.4,SEQ ID NO.6,SEQ ID NO.8,SEQ ID NO.10,SEQ ID NO.12,SEQ IDNO.14,SEQ ID NO.16,SEQ ID NO.18,SEQ ID NO.20和SEQ ID NO.22对应的是反向的靶向引物。
具体的,第二引物池内的的靶向引物的引物序列如下表二所示:
表二第二引物池的靶向引物
其中第二引物池中的SEQ ID NO.23-SEQ ID NO.41所示的靶向引物中相邻序号的正向的靶向引物和反向的靶向引物依次序两两组成一个引物对,SEQ ID NO.23,SEQ IDNO.25,SEQ ID NO.27,SEQ ID NO.29,SEQ ID NO.31,SEQ ID NO.33,SEQ ID NO.35,SEQ IDNO.37,SEQ ID NO.39和SEQ ID NO.41对应的是正向的靶向引物,SEQ ID NO.24,SEQ IDNO.26,SEQ ID NO.28,SEQ ID NO.30,SEQ ID NO.32,SEQ ID NO.34,SEQ ID NO.36,SEQ IDNO.38和SEQ ID NO.40对应的是反向的靶向引物。
具体的,第三引物池内的靶向引物的引物序列如下表三所示:
表三第三引物池的靶向引物
其中第三引物池中的SEQ ID NO.42-SEQ ID NO.63所示的靶向引物中相邻序号的正向的靶向引物和反向的靶向引物依次序两两组成一个引物对,SEQ ID NO.42,SEQ IDNO.44,SEQ ID NO.46,SEQ ID NO.48,SEQ ID NO.50,SEQ ID NO.52,SEQ ID NO.54,SEQ IDNO.56,SEQ ID NO.58,SEQ ID NO.60和SEQ ID NO.62对应的是正向的靶向引物,SEQ IDNO.43,SEQ ID NO.45,SEQ ID NO.47,SEQ ID NO.49,SEQ ID NO.51,SEQ ID NO.53,SEQ IDNO.55,SEQ ID NO.57,SEQ ID NO.59,SEQ ID NO,61和SEQ ID NO.63对应的是反向的靶向引物。
具体的,第四引物池内的靶向引物引物序列如下表四所示:
表四第四引物池的靶向引物
。
其中第四引物池中的SEQ ID NO.64-SEQ ID NO.82所示的靶向引物中相邻序号的正向的靶向引物和反向的靶向引物依次序两两组成一个引物对,SEQ ID NO.64,SEQ IDNO.66,SEQ ID NO.68,SEQ ID NO.70,SEQ ID NO.72,SEQ ID NO.74,SEQ ID NO.76,SEQ IDNO.78,SEQ ID NO.80和SEQ ID NO.82对应的是正向的靶向引物,SEQ ID NO.65,SEQ IDNO.67,SEQ ID NO.69,SEQ ID NO.71,SEQ ID NO.73,SEQ ID NO.75,SEQ ID NO.77,SEQ IDNO.79和SEQ ID NO.81对应的是反向的靶向引物。
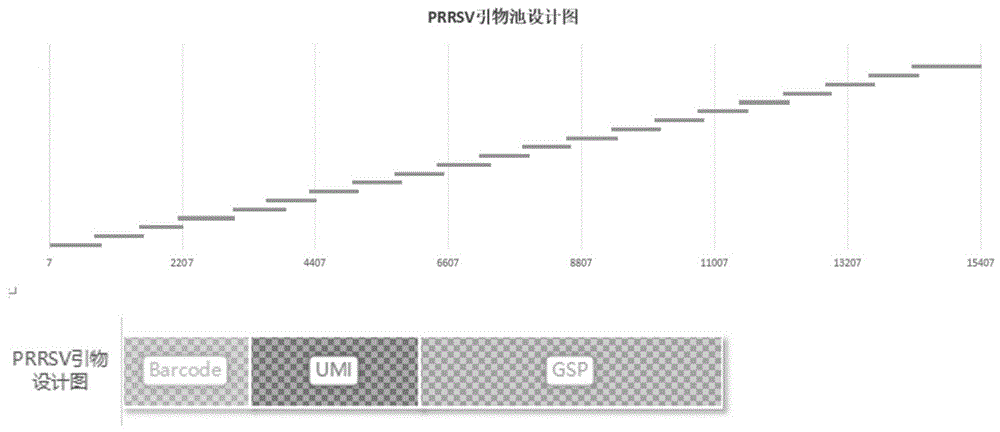
需要说明的是,本方案针对于蓝耳病毒1型和2型的全基因组按照叠瓦式原理设计了82个引物对应于41个引物对,分成四个引物池对诺如病毒进行扩增,第一引物池和第二引物池内的引物对蓝耳病毒2型进行扩增,扩增完的管产物混合后就得到了蓝耳病毒2型的全基因组序列,第三引物池和第四引物池内的引物对蓝耳病毒1型进行扩增,扩增完的管产物混合后就得到了蓝耳病毒1型的全基因组序列,通过软件把数据进行拼接成完整的一致性序列。
如图1所示,在一些实施例中,本方案提供的四组引物池中的每一引物由序列如SEQ ID NO.1-SEQ ID NO.82所示的靶向引物、UMI序列和barcdoe序列排列组成,其中UMI序列连接在每一靶向引物的5’端,每一barcdoe序列连接在UMI序列的5’端,故第一引物池、第二引物池、以及第三引物池内的引物表示为:“Barcode-Nx-靶向引物”的形式。其中UMI序列含有6-8个N,表示为(N)x,x=6-8,其中Barcode序列共有96条序列,每条序列对应于24bp(三代)或8bp(二代),这样编译的好处在于可以有效降低后续建库过程中连接加barcdoe序列的成本,起到降低成本的作用;可进行病原微生物的绝对定量,可提高检测准确性,避免假阳性和交叉污染;数据量充足的情况下,可提高检测灵敏度。
关于Barcode序列的示意如下表五所示:
表五Barcode序列
在一些实施例中,四组引物池内的引物的总体积比相同。
在一些实施例中,四组引物池内的引物分别对蓝耳病毒1型和2型进行多重PCR扩增,且四组引物池的多重PCR扩增条件相同。
在一些实施例中,多重PCR扩增条件如下表六所示:
表六多重PCR扩增条件
需要说明的是,本方案设计的针对于引物池的多重PCR扩增条件中的阶梯式温度条件可有效提高靶向捕获效率,针对CT临界值的样本也可实现高效捕获。
在一些实施例中,包括HiFi高保真DNA聚合酶预混液和无核酸酶纯水。
在一些实施例中,适用于蓝耳病毒1型和2型的的全基因组捕捉试剂盒进一步包括逆转录反应预混液与逆转录引物池,以用于从纯化的诺如病毒的总RNA中一致且快速的合成cDNA。
在一些实施例中,逆转录的反应程序如下表七所示:
表七逆转录的反应程序
第二方面,本方案提供了一种适用于蓝耳病毒1型和2型的全基因组捕捉试剂盒的应用方法,包括:获取待测的蓝耳病毒的逆转录cDNA链,分别利用第一引物池、第二引物池、第三引物池以及第四引物池中的引物对蓝耳病毒的逆转录cDNA链进行扩增得到扩增产物,将扩增产物拼接后利用测序平台测序得到蓝耳病毒1型和2型的全基因序列,其中第一引物池内的引物含有引物序列如SEQ ID NO.1-SEQ ID NO.22所示的靶向引物;第二引物池内的引物含有引物序列如SEQ ID NO 23-SEQ ID NO.41所示的靶向引物,第三引物池内的引物含有引物序列如SEQ ID NO 42-SEQ ID NO.63所示的靶向引物,第四引物池内的引物含有引物序列如SEQ ID NO.64-SEQ ID NO.82所示的靶向引物。
在一些实施例中,取待测蓝耳病毒的RNA后加入逆转录反应预混液与逆转录引物后进行逆转录得到逆转录cDNA链。
关于逆转录的条件如表七所示:
表七逆转录的反应程序
。
在一些实施例中,分别利用第一引物池、第二引物池、第三引物池以及第四引物池中的引物对蓝耳病毒的逆转录cDNA链进行多重PCR扩增,多重PCR扩增条件如表六所示:
表六多重PCR扩增条件
在一些实施例中,利用二代测序平台和三代测序平台对扩增产物进行测序,可利用Illumina、MGI、Nanopore等在内的所有主流测序平台对扩增产物进行测序。
在一些实施例中,自肺组织、血液、唾液、病毒液等环境中提取的核酸样本中进行蓝耳病毒1亚型和2亚型全基因组反转录与富集扩增。
相较于现有技术,本技术方案具有以下特点和有益效果:
本方案提供的全基因组捕获试剂盒可实现包括血液、组织、唾液、病毒液等在内的多种样本中的蓝耳病毒1亚型和2亚型所有分型的全基因组扩增,能覆盖蓝耳病毒2亚型99.9%的完整序列,具有覆盖度均一的特点,且扩增产物可适用于包括illumina和Nanopore等在内的所有主流测序平台。
且该试剂盒中提供的42对引物所有体系一致、退火温度一致,扩增条件一致的特点,省去了一个引物一个最适退火温度的操作,使操作方法更加简便,省时、省力,同一反应程序可以同时扩增多种基因片段,可快速获得猪蓝耳病毒的基因组全长序列,且采用采用短扩增子方案以有效捕获发生降解的样本,对样本完整性要求低。
本方案提供的引物设计避开结构变异区域,有效避免因结构变异引入的扩增失败,提高成功率,且通过在靶向引物的5’端添加barcdoe序列,可有效降低建库过程中连接法加barcode的成本,更加经济,通过在靶向引物的5’端添加UMI序列,可通过统计蓝耳病毒序列占比,计算出样本中蓝耳病毒含量实现绝对定量,可提高检测准确性和灵敏度并避免假阳性和交叉污染。
附图说明
图1是根据本方案的蓝耳病毒1型和2型的引物设计原理图。
图2是本方案实施例1的肺组织样本的组装分析结果。
图3是本方案实施例1的唾液样本的组装分析结果。
图4是本方案实施例1的病毒液的组装分析结果。
图5是本方案实施例1的血液样本的组装分析结果。
图6是实施例1中病毒含量和测序结果关联性分析结果。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员所获得的所有其他实施例,都属于本发明保护的范围。
可以理解的是,术语“一”应理解为“至少一”或“一个或多个”,即在一个实施例中,一个元件的数量可以为一个,而在另外的实施例中,该元件的数量可以为多个,术语“一”不能理解为对数量的限制。
实施例一
样本来源:温氏生鲜蓝耳病毒样品11株,其中取自肺组织样本的蓝耳病毒3株,取自唾液样本的蓝耳病毒3株,取自病毒液样本的蓝耳病毒3株,取自血液样本的蓝耳病毒2株。
1、RNA逆转录:
将3μL逆转录反应预混液、以及12μL蓝耳病毒RNA加入到PCR管中进行混合,轻柔吹吸混匀后瞬时离心,按照表七所示的逆转录反应条件进行逆转录得到逆转录cDNA链;
表七逆转录的反应程序
。
2.全基因组扩增:
取相同体积量的逆转录cDNA链分别使用第一引物池、第二引物池、第三引物池和第四引物池中的引物进行扩增,配置预混液并转移至对应的PCR管中,每一PCR管内的混合体系如表八所示:
表八PCR管内的混合体系
对每一PCR管分别按照表六所示的多重PCR反应体系进行反应,表六如下;
表六多重PCR扩增条件
将同一样品的不同PCR管的扩增产物合并到1.5mL离心管中即得到蓝耳病毒1型和2型的全基因组扩增核酸。
3.三代测序
用1倍体积的磁珠对扩增产物进行纯化,纯化后qubit定量在10ng/ul以上的样本可直接进行后续的建库实验,用BK-AUX024和SQK-LSK110进行纳米孔测序建库和测序,数据通过组装软件进行组装分析。分析结果如图2-所示,测序数据覆盖了基因组100%区域。
分析结果如图6所示,测序数据中登革热病毒序列占比与蓝耳病毒在样本中含量正相关,与CT值负相关。表明该技术可有效通过统计蓝耳病毒序列数,评估该样本中病毒含量。
本发明不局限于上述最佳实施方式,任何人在本发明的启示下都可得出其他各种形式的产品,但不论在其形状或结构上作任何变化,凡是具有与本申请相同或相近似的技术方案,均落在本发明的保护范围之内。
- 信号交叉口设置外置左转车道的需求判定方法和装置
- 一种电机三相信号有效性判定方法和判定装置
- 一种信号控制平面交叉口可变导向车道属性动态调整阈值设置方法
- 一种交叉口设置对角斑马线的判定方法和装置
- 一种交叉口设置右转信号灯的需求判定方法和装置
