一种基于SPR生物传感器的流感病毒快速检测方法
文献发布时间:2023-06-19 11:26:00
技术领域
本申请属于病毒检测技术领域,涉及一种基于SPR生物传感器的流感病毒快速检测方法。
背景技术
流感病毒是一种重要的人兽共患传染病病原,其宿主广泛,传播能力强,曾引起数次全球大流行,每年不定期引起区域性暴发流行,给人类健康和畜牧养殖业带来严重损失。传统的流感病毒检测方法采用PCR检测或ELISA方法。但这些方法耗时耗力,无法满足现场原位检测的需求。
SPR生物传感器在环境监测、病原诊断和食品安全方面应用广泛,同时也是研究生物分子间相互作用的首选方法。由于SPR技术极大缩短了亲和力检测所需时间,因此该方法还被广泛应用到疫苗筛选与设计的相关研究。利用SPR生物传感器研究分子间相互作用,需要将检测物特异性抗体偶联到传感器芯片表面,一般分为如下几步:偶联pH筛选、抗体偶联、亲和力常数测定及结合力分析等过程。在进行相关检测之前,需要筛选适用于检测物的抗体。抗体质量、检测物所处缓冲环境是决定检测结果的两个重要因素。
发明内容
本发明提供了一种基于SPR生物传感器的流感病毒快速检测方法,并且从检测方法的简便性、灵敏度和特异性等方面对该方法进行评价,为流感病毒的快速检测提供新手段。
本发明的技术方案如下:
一种基于SPR生物传感器的流感病毒快速检测方法,包括以下步骤:
步骤1:准备设备、材料与试剂,包括SPR生物传感器,CM5芯片,pH值分别为4.0、4.5、5.0和5.5的10mmol/L乙酸钠溶液,50mmol/L NaOH,pH 7.4的HBS-EP缓冲液,氨基偶联试剂盒,流感病毒特异性抗体以及流感病毒等。
步骤2:筛选流感病毒抗体最佳偶联pH
利用pH分别为4.0、4.5、5.0和5.5的10mmol/L乙酸钠溶液将流感病毒抗体稀释至10μg/ml。将CM5芯片插入SPR生物传感器,运行SPR生物传感器抗体筛选程序,将稀释后的抗体放入进样槽,设置进样流速10μL/min,运行时间2min,待分析程序结束后,用25μL的50mmol/L NaOH清洗CM5芯片,然后进行下一抗体样品的分析。所有四种稀释抗体分析完毕后,选择反应值不低于8000pg/mm
步骤3:流感病毒抗体偶联芯片
确定最佳偶联pH后,将该pH值的10mmol/L乙酸钠溶液作为偶联缓冲液,并将流感抗体稀释至10μg/mL。将CM5芯片插入SPR生物传感器,采用氨基偶联试剂盒和SPR生物传感器自动化程序将抗体偶联在芯片表面。CM5芯片F2通道偶联流感特异性抗体,F1通道作为空白参照,偶联目标为反应值8000pg/mm
步骤4:待测样品与抗体的亲和动力学常数分析
利用pH 7.4的HBS-EP缓冲液将待检测样品按照1:5,1:10,1:20,1:40,1:80的比例稀释,分别进样检测。利用SPR生物传感器亲和动力学分析程序进行分析,每次检测流程后,利用10mmol/L glycine-HCL(pH 2.5)对芯片进行再生(20μL/min,30s),整个过程温度为25℃。利用SPR生物传感器软件程序对结合常数(K
步骤5:待测样品与抗体的结合力分析
利用pH 7.4的HBS-EP缓冲液将待检测样品按照1:5,1:10,1:20,1:40,1:80,1:160,1:320,1:640,1:1280,1:2560,1:5120,1:10240的比例稀释,分别进样检测。利用SPR生物传感器结合力分析程序进行分析。每次检测流程后,利用10mmol/L glycine-HCL(pH2.5)对芯片进行再生(20μL/min,30s),整个过程温度为25℃。
步骤6:阳性结果判定。若待测样品进样后,响应曲线呈抛物线持续上升形态,10mmol/L glycine-HCL(pH 2.5)进样后,响应曲线呈抛物线持续下降形态,且响应值与样品浓度呈现明显的梯度效应,则判定待测样品为流感病毒阳性,否则为阴性。
进一步特征,抗体偶联目标值为8000pg/mm
进一步特征,进样前,待测样品应12000rpm,4℃离心5min,以去除杂质。
进一步特征,可采用已知浓度的流感样品梯度稀释后进行检测,获得该方法的检测极限。
本申请的基于SPR生物传感器的流感病毒快速检测方法,可在18分钟内获得样品的检测结果,与传统核酸PCR检测和ELISA检测方法相比,具有明显的优势。
附图说明
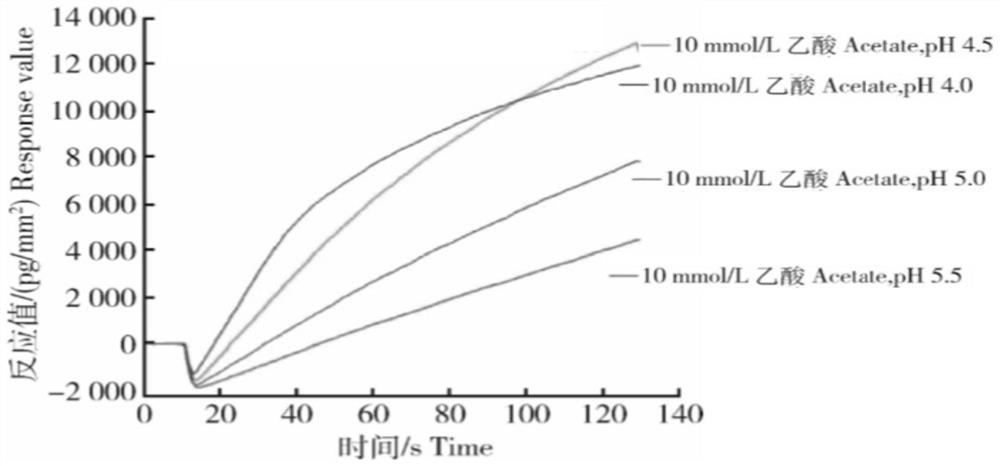
图1为在CM5芯片表面偶联H5N1流感病毒特异性抗体的最佳pH条件筛选图。
图2(a)为梯度稀释的H5N1(a)流感病毒与H5N1特异性抗体的亲和动力学分析图。
图2(b)为梯度稀释的H1N1(b)流感病毒与H5N1特异性抗体的亲和动力学分析图。
图3(a)为梯度稀释的H5N1流感病毒与芯片表面H5N1特异性抗体结合力分析曲线图。
图3(b)为梯度稀释的H5N1流感病毒与芯片表面H5N1特异性抗体的结合力检测值分析图。
具体实施方式
下面结合附图和技术方案对本发明做进一步的详细说明。
实施例1:
一种基于SPR生物传感器的H5N1流感病毒快速检测方法,包括以下步骤:
步骤1:准备设备、材料与试剂:SPR生物传感器选用瑞典Biacore公司Biacore3000生物传感器;CM5芯片,pH值分别为4.0、4.5、5.0和5.5的10mmol/L乙酸钠溶液,50mmol/L NaOH,pH 7.4的HBS-EP缓冲液,氨基偶联试剂盒购自瑞典Biacore公司;H5N1特异性抗体购自美国Santa Cruz生物技术公司;山羊抗鼠IgG-HRP抗体购自上海Abmart生物医药有限公司;TMB底物购自北京索莱宝科技有限公司;H5N1、H1N1流感病毒为军事兽医研究所保存,病毒滴度均为分别为10
步骤2:筛选流感病毒抗体最佳偶联pH
利用pH分别为4.0、4.5、5.0和5.5的10mmol/L乙酸钠溶液将H5N1特异性抗体稀释至10μg/ml。将CM5芯片插入Biacore 3000生物传感器,运行Biacore 3000生物传感器抗体筛选程序,将稀释后的抗体放入进样槽,设置进样流速10μL/min,运行时间2min,待分析程序结束后,用25μL的50mmol/L NaOH清洗CM5芯片,然后进行下一抗体样品的分析。所有四种稀释抗体分析完毕后,选择反应值不低于8000pg/mm
步骤3:H5N1特异性抗体偶联芯片
采用pH5.0的10mmol/L乙酸钠溶液作为偶联缓冲液,并将流感抗体稀释至10μg/mL。将CM5芯片插入Biacore 3000生物传感器,采用氨基偶联试剂盒和Biacore 3000生物传感器自动化程序将抗体偶联在芯片表面。CM5芯片F2通道偶联流感特异性抗体,F1通道作为空白参照,偶联目标为反应值8000pg/mm
步骤4:H5N1和H1N1流感病毒与H5N1特异性抗体的亲和动力学常数分析
利用pH 7.4的HBS-EP缓冲液将H5N1和H1N1流感病毒分别按照1:5,1:10,1:20,1:40,1:80的比例稀释,分别进样检测。利用Biacore 3000生物传感器亲和动力学分析程序进行分析,每次检测流程后,利用10mmol/L glycine-HCL(pH 2.5)对芯片进行再生(20μL/min,30s),整个过程温度为25℃。利用Biacore 3000生物传感器软件程序BIAevalutionSoftware 4.1对结合常数(K
表1为H5N1、H1N1流感病毒与H5N1单克隆抗体的亲和动力学分析
注:1:1Langmuir-binding模型用来测定动力学平衡常数K
步骤5:H5N1流感病毒与H5N1特异性抗体的结合力分析
利用pH 7.4的HBS-EP缓冲液将H5N1流感病毒按照1:5,1:10,1:20,1:40,1:80,1:160,1∶320,1∶640,1∶1280,1∶2560,1∶5120,1∶10240的比例稀释,分别进样检测。利用Biacore 3000生物传感器结合力分析程序进行分析。每次检测流程后,利用10mmol/Lglycine-HCL(pH 2.5)对芯片进行再生(20μL/min,30s),整个过程温度为25℃。如图3(a)、图3(b)所示为H5N1流感病毒与H5N1特异性抗体的结合力分析。
步骤6:阳性结果判定。如图2(a)、图2(b)所示,H5N1流感病毒进样后,响应曲线呈抛物线持续上升形态,10mmol/L glycine-HCL(pH 2.5)进样后,响应曲线呈抛物线持续下降形态,且响应值与样品浓度呈现明显的梯度效应,因此检测结果为阳性。而H1N1流感病毒进样后,响应曲线并未呈抛物线持续上升,因此为阴性。
步骤7:检测灵敏度分析(与传统ELISA检测方法相比)
利用相同的H5N1流感病毒特异性抗体,分别进行SPR生物传感器检测和ELISA检测。检测结果如表2所示,SPR生物传感器检测方法检测限略高于ELISA检测方法,但是抗体使用量和检测时间方面,要明显优于ELISA检测。因此,SPR检测方法在面对大量待检样品时具有明显优势,适合快速初筛使用。
表2为SPR生物传感器检测方法与传统ELISA检测方法的比较。
注:H5N1检测样品为140μL。H5N1单克隆抗体在芯片上的偶联量为8000RU,而1RU对应1pg/mm
- 一种基于SPR生物传感器的流感病毒快速检测方法
- 一种基于双适体RCA技术快速诊断H1N1流感病毒的试剂盒及检测方法
