一种对虾益生菌及应用
文献发布时间:2023-06-19 11:30:53
技术领域
本发明属于微生物技术领域;尤其涉及一种对虾益生菌及应用。
背景技术
在对虾养殖业的发展过程中,养殖模式由粗放、半粗放养殖转变为高密度、集约化养殖,伴生出养殖环境污染、养殖病害频繁发生、产品品质下降等问题。抗生素的使用也愈加频繁,特别是抗生素的长期使用,会造成抗生素在养殖动物体内残留、养殖环境中的细菌发生耐药性和转移,并对机体产生严重的毒副作用。一般而言,对虾益生菌是宿主体内的正常菌群成分,通过加强肠道微生物的屏障作用或通过增强非特异性免疫功能来维持宿主微生态平衡,提高其健康水平,促进养殖生物的生长。再加上其具有天然、无毒副作用等特点,益生菌制剂已被开发、研制成各种产品广泛应用于水产养殖中。
饲料中添加的活性益生菌以芽孢杆菌为主,相较于其他种类益生菌,芽孢杆菌具有耐受性强,繁殖速度快,易于培养等优点。在对虾养殖中,用芽孢杆菌 S11 菌株喂养斑节对虾,其免疫反应如血细胞数、血清酚氧化酶和抗菌活力得到提高。此外在饲料中添加芽孢杆菌也能够提高斑节对虾的生长效率及免疫力。目前,国内外研究发现贝莱斯芽孢杆菌(
发明内容
本发明的目的是提供一种对虾益生菌及应用。
本发明是通过以下技术方案实现的:
本发明涉及一种对虾益生菌LB29-3,分类命名为贝莱斯芽孢杆菌
本发明还涉及对虾益生菌在对虾养殖中的应用。
本发明具有以下优点:本发明对虾益生菌应用在对虾养殖中,可使大塘出虾产量提高10-15%。
附图说明
图1是菌株LB 29-3致病菌拮抗能力测定结果图;其中,左图为副溶血弧菌;右图为灿烂弧菌;
图2是菌株LB 29-3在80℃下25 min内的存活曲线图;
图3 是菌株LB 29-3的革兰氏染色图;如菌体呈蓝色为革兰氏阳性,如呈红色为革兰氏阴性;
图4是菌株LB 29-3的芽孢染色图;其中,菌体呈蓝色,以▲指示;芽孢呈紫色,以→指示;
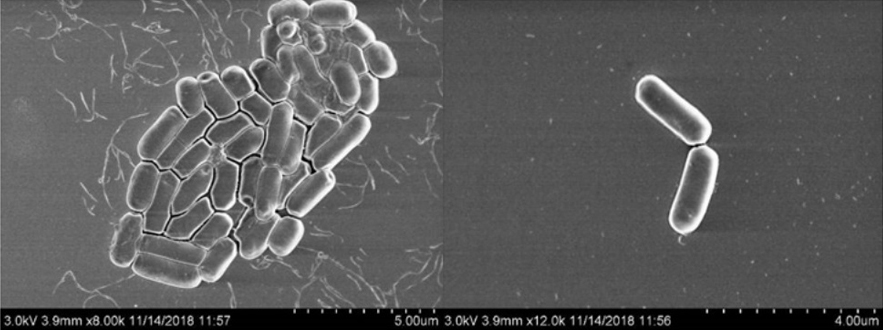
图5是菌株LB 29-3的扫描电镜图;
图6是菌株LB 29-3的菌落形态图;
图7是菌株LB 29-3的16S rDNA PCR扩增产物分析图;
图8是副溶血弧菌侵染存活率图;
图9是血细胞吞噬活性图;
图10是血细胞呼吸爆发活性图;
图11是肝胰腺消化酶和转氨酶活力变化图;
图12是血清和肝胰腺中免疫相关酶活力图;
图13是疫相关基因表达量图;
图14是肝胰腺组织形态结构图;其中,圆形为肝小管呈圆形;三角形为肝小管呈星形或多边形;
图15是肠道组织形态图;
图16是稀释曲线图;
图17是等级聚类曲线图;
图18是韦恩图;
图19是肠道主要细菌在属水平上的相对丰度图。
具体实施方式
下面结合具体实施例对本发明进行详细说明。应当指出的是,以下实施例只是对本发明的进一步说明,但本发明的保护范围并不限于以下实施例。
实施例
实施例1 菌株LB29-3的分离纯化、性能测试及鉴定,包括如下步骤:
步骤1,菌株的分离和纯化:将对虾置于冰盒中冷藏带回实验室,用75%乙醇进行体表消毒;无菌解剖取其中肠置于2 ml 匀浆管,加入1 ml预冷的灭菌生理盐水和适量磁力匀浆珠,以5500次/min的频率充分匀浆2×20 s,中间间隔10 s;匀浆液经10倍系列稀释到10
步骤2,菌株产酶能力分析:取10 μl 保种菌株接种到1 ml LB营养肉汤培养基中,28℃、165 rpm/min 培养 24 h进行活化,活化的菌株接种于产酶筛选培养基上,于30℃恒温培养 24-48 h,根据菌落周围是否有透明圈、变色圈产生,判断其是否产生特定酶;用直尺分别测量透明圈/变色圈的直径(D)和菌落直径(d),根据两者的比值大小确定菌株分泌酶活力的高低。其中,蛋白酶和植酸酶筛选平板直接根据菌落周围是否有透明圈产生判断其是否产生蛋白酶和植酸酶;淀粉酶筛选平板采用革兰氏碘液染色后,根据菌落周围是否有透明圈产生判断其是否产生淀粉酶;脂肪酶根据维多利亚蓝酸碱指示变色原理,根据菌落周围是否形成变色圈,判断菌株是否产生脂肪酶;纤维素酶筛选平板采用刚果红染色,1mg/ml 刚果红染色1 h,然后用1mol/L NaCl洗去染液,再用1mol/ml HCl 定色,根据菌落周围是否形成变色圈,判断菌株是否产生纤维素酶,10株菌株产酶结果如表1所示:实验结果表明,菌株LB 29-3具有较强的产淀粉酶、蛋白酶和植酸酶的能力,选择LB29-3进行后续实验。
表1
“-”代表不产生透明圈或变色圈;“+”代表透明圈或变色圈与菌落直径的比值在0-2(包含2)之间;
“++”代表透明圈或变色圈与菌落直径的比值在2-4(包含4)之间;“+++”代表透明圈或变色圈与菌落直径的比值在4以上。
步骤3,菌株安全性评价:采用血平板划线法判断菌株安全性;产生透明圈的为严重溶血-α溶血,产生草绿色溶血环的为轻微溶血-β溶血,没有溶血环产生的为不溶血-γ溶血,实验结果证明LB 29-3菌株为安全性菌株,可用于后续实验;
步骤4,药敏性检测:采用纸片琼脂扩散法进行;取过夜培养的LB29-3菌悬液100 μl涂布于LB平板上,贴放抗菌药物纸片,预扩散30 min后,置于30℃下恒温培养18-24 h,培养结束后测量并记录抑菌圈直径;每种抗菌药物纸片均作三个重复;根据 WHO 提供的NCCLS 最新版本对敏感或耐药的判断标准,得出菌株 LB 29-3对8大类 16 种抗生素的药敏结果如表2所示:其对测试的11类30种抗生素均表现为敏感。对喹诺酮类、四环素类、磺胺类、大环内酯素类、氨基糖苷类、硝基呋喃类、酰胺醇类和头孢菌素类中的部分抗生素(头孢氨苄、头孢唑啉、头孢拉定、头孢哌酮)非常敏感,抑菌圈半径在1 cm以上;对糖肽类,青霉素类中的羧苄西林、苯唑西林和头孢菌素类中的头孢呋辛敏感,抑菌圈半径在0.5 - 1 cm之间;对青霉素类中的氨苄西林、青霉素和哌拉西林,头孢菌素类中的头孢曲松和头孢他定,及多粘菌素B表现为较为敏感,抑菌圈半径在5 -2 mm之间。
表2
VS: 超级敏感 (抑菌圈半径 > 1 cm);S: 敏感(1 cm > 抑菌圈半径 >0.5cm);SS: 略微敏感 (0.5 cm > 抑菌圈半径> 0.2 cm)。
步骤5,菌株LB 29-3拮抗能力测定:采用琼脂扩散法测定菌株LB 29-3的致病菌拮抗能力,以副溶血弧菌(
步骤6,菌株LB 29-3耐热能力测定;将菌株LB 29-3于30℃、165 rpm/min过夜培养进行活化,在80℃下继续培养3 h,在0 h、0.5 h、1 h、2 h、3 h测定菌落存活个数,计算菌株在高温下的耐受能力;用平板涂布法检测菌株存活个数,样品以10倍梯度稀释,每个稀释度的样品必须混合均匀。取10
步骤7,菌株LB 29-3自凝率、共凝率和粘附性测定。检测菌株的自凝率。将菌株LB29-3于30℃、165 rpm/min过夜培养进行活化,3000 rpm/min 离心 10min收集菌体,经PBS洗涤两次,记录OD
细菌自身聚集的测定是测定益生菌对肠粘膜粘附能力的间接方法;共凝集率间接代表菌株凝集病原菌的能力。LB 29-3自凝率、共凝率和粘附性测定结果如表3。
表3
步骤8,菌株LB 29-3菌落形态及生理生化特征:将菌株LB 29-3划线接种于LB固体培养基上,30℃培养24h后,观察平板上的菌落形态及表面特征;
挑适量单菌落于载玻片上,进行革兰氏染色、芽孢染色。
用扫描电镜技术观察菌株微观表面形态特征,包括具体形态,是否具有荚膜,鞭毛等。具体步骤如下:
a)取对数培养期的供试菌株,5000 rpm离心5min去掉上清液;
b)用PBS清洗三遍,温柔悬浮;
c)经PBS清洗后,用2.5%戊二醛固定3 h;PBS漂洗2-3次,每次10 min,再用纯水漂洗两次;
d)分别用30%、50%、70%、80%、90%酒精梯度脱水10 min;再用无水乙醇脱水两次,每次10 min;再将样品置于乙醇和叔丁醇1:1混合液中15 min;每步脱水离心后温柔悬浮。
e) 将处理好的样品置于5×5 mm的盖玻片上,晾干后,镀膜并进行扫描电镜观察。
研究结果发现,通过革兰氏染色和芽孢染色镜检(图3,图4),确定菌株LB 29-3为革兰氏阳性菌、杆状、非凝集状态下呈单个或短链排列;可产芽孢,芽孢中生,呈椭圆形,念珠状排列。LB 29-3的扫描电镜照片见图 5,菌体大小为0.5 μm ×(1.5 - 3.5)μm,表面光滑,不具备鞭毛。如图6所示,图6是观察菌株的单菌落形态,用于菌株的初级鉴定,LB 29-3在 LB固体培养基上30℃过夜培养后,单菌落呈乳白色,形态近似圆形,表面干燥褶皱,菌落隆起,中央凹陷呈火山口状,菌落大小为1.5-3 mm。
步骤9,生理生化鉴定:经形态学观察和芽孢染色,初步判断菌株LB 29-3为产芽孢类菌株,根据《常见细菌系统鉴定手册》上的生理生化指标鉴定进行试验。该生理生化指标包括:糖发酵试验、运动性实验、明胶液化、发酵产酸(OF)试验、甲基红(MR)试验、乙酰甲基甲醇(V-P)试验、硫化氢、尿素酶和过氧化氢酶试验;实验结果表明,菌株LB 29-3无运动性、过氧化氢酶阳性;不产H2S和尿素酶;可液化明胶;VP阳性、MR阴性、发酵型;可以利用葡萄糖、木糖、蔗糖、甘露醇、阿拉伯糖为碳源,但不产生气体,少量利用淀粉。
步骤10,菌株分子鉴定:采用PCR 扩增技术,扩增菌株16S rDNA区域;扩增完成后,PCR产物经1%琼脂糖凝胶电泳系统检测和回收。16S rDNA的长度为1500 bp左右,如PCR产物在相应分子量处出现明亮条带,说明16S rDNA扩增成功,如图7所示。回收胶电泳时应使用新制的缓冲液,电场强度不超过20 V,电泳温度低于30℃,避免出现条带模糊和条带不规则迁移。
扩增片段经北京睿博生物科技公司 Illumina Miseq PE300 测序平台进行测序。根据16SrDNA序列PCR扩增测序结果,在NCBI网站上进行BLAST比对,发现菌株LB 29-3与
实施例2
本发明实施例主要是通过养殖中试来评价菌株的益生效果,养殖中试是规模较大的养殖效果评估,比实验室评估更接近生产实践。具体如下:
选取购自山东烟台海阳养殖场的健康凡纳滨对虾幼虾,,体长3.0 ± 0.3 cm,体质量0.3 ± 0.03 g,先在25 - 27℃、30℃海水循环系统中暂养2周,暂养期间饲喂基础饲料。随后虾苗随机分散到海水养殖循环系统的玻璃缸中,玻璃缸容积为300 L,实验设置1个对照组,3个不同浓度的处理组,每个处理组设3个重复,每个重复100尾虾。
实验海水经加热棒升温、砂滤缸过滤、紫外线消毒后使用。饲养期间连续充气,水温27 ± 2℃,盐度28 - 30 ‰,pH 8.0 - 8.2,溶解氧不低于6.5 mg/L。每天投喂4次至饱食状态,投喂时间为早上6:00,中午11:00,傍晚17:00,晚上23:00,各时间点投喂量占日总投饵量的比值分别为30%、20%、20%、30%,投食量根据对虾摄食情况、水质情况及剩余对虾数量进行调整,避免因饥饿发生残食状况,或者过量投喂引起水质剧烈变化。每天18:30吸出残饵粪便,换水1/3并记录死虾个数,整个饲养实验持续6周。
饲养试验结束后,进行为期1周的的副溶血弧菌侵染实验。每个玻璃缸中留50 L海水,用浓度为10
将贝莱斯芽孢杆菌
采用平板菌落计数法进行菌株数量统计。用 PBS 缓冲液将菌液稀释至 10
幼虾饲料配方以鱼粉为动物蛋白原,豆粕、玉米粕为植物蛋白源,鱼油和磷脂油为脂肪源,配制成粗蛋白为64.6 %,粗脂肪为7.4%的基础饲料,具体饲料配方见表4。
表4
鱼粉:粗蛋白,710 g/kg干物质;粗脂质,108 g/kg干物质;
豆粕,粗蛋白,527 g/kg干物质;粗脂质,19 g/kg干物质;
小麦粉,粗蛋白,940 g/kg干物质;粗脂质,140 g/kg干物质;
花生粉,粗蛋白,540 g/kg干物质;粗脂质,34 g/kg干物质;
磷虾粉,粗蛋白,797 g/kg干物质;粗脂肪,36 g/kg干物质;多矿:NaCl (99.5%),0.767 g;KCl (99.5%),1.916 g;ZnSO
饲料原料经粉碎,80目过筛、混合均匀后,添加不同体积固定浓度的益生菌LB 29-3配制终浓度为10
养殖实验结束后,收集对虾血淋巴细胞、肝胰腺和肠道,进行后续实验的测定。
使用含有抗凝剂的1 ml无菌注射器从对虾的围心腔内抽取血淋巴。抗凝剂与血淋巴的体积比为1:1,注入无菌的1.5 ml离心管中,3只对虾的血淋巴合一管。血淋巴离心,用PBS调整至血细胞达到10
收集对虾肝胰腺置于液氮速冻,储存于-80℃,用于消化酶、抗氧化和免疫相关酶活性的分析,每个处理8个平行。采集50 mg的肝胰腺组织浸入800 μlTRIzol中,置于液氮速冻,储存于-80℃用于提取RNA,每个处理6个平行。解剖对虾中肠和肝胰腺,快速轻柔修理组织边缘,用波恩氏液固定24 h,然后用70%乙醇换洗数次,待洗脱液体接近透明后置于70%乙醇保存,用于石蜡组织切片,每个处理3个平行。无菌收集对虾中肠进行肠道微生物测序,每个处理3个平行。
侵染结束后,收集感染对虾的血细胞和肝胰腺,用于测定血细胞的免疫活性和肝胰腺免疫相关酶活力、免疫相关基因表达量。
在试验周期的前4周,每周测量一次体长体重,计算对虾特定生长率,每缸随机选取8尾对虾。实验结束后,对各缸对虾进行计数,计算存活率;称量对虾的终体长,终体重,计算增长率,增重率,肥满度和特定生长率。特定生长率计算公式为:SGR (%) = (lnW
在养殖实验结束后,对虾生长相关指数表(表 5饲料中添加不同浓度的
表5
副溶血弧菌侵染7 d内,对照组与
吞噬活性反应
用PBS调整血细胞浓度为10
呼吸爆发反应
血细胞呼吸爆发产生的ROS可以将二氢罗丹明123(DHR)氧化为发荧光的罗丹明123(RHO),经流式细胞仪检测,比较峰的偏移程度以比较血细胞的呼吸爆发程度。将对虾血细胞调整浓度为10
与对照组比较,饲料中添加BV可以提高对虾血细胞的吞噬活性,降低呼吸爆发活性(图10)。饲养结束后,吞噬活性随着BV 添加量的增加而升高,在BV 3组达到最高值,差异显著(
酶活力测定
将适量对虾肝胰腺样品加入PBS匀浆缓冲液中制成20%的组织匀浆样品,4℃,2500g离心10 min,收集上层澄清样品分装备用。酶活力均采用南京建成酶活力测定试剂盒进行测定。
蛋白含量采用碧云天BCA蛋白浓度测定试剂盒进行(P0006),标准蛋白浓度为0mg/ml,0.2 mg/ml,0.4 mg/ml,0.6 mg/ml,0.8 mg/ml,1.0 mg/ml,绘制标准曲线。待测对虾血清和肝胰腺匀浆液用生理盐水稀释到合适浓度,以保证其吸光度值不超出标准曲线浓度范围。制作蛋白标准曲线,通过吸光度值和斜率求出相应蛋白水平。
消化酶和转氨酶活力测定
消化酶活力采用南京建成试剂盒进行测定(C016-1-1、A080-2-2、A054-1-1)。方法简述如下,淀粉酶(AMS)在一定浓度下水解过量的淀粉,碘与未分解的淀粉结合形成蓝络合物,在660 nm处测定吸光度以计算淀粉酶活性。胰蛋白酶(TRP)水解精氨酸乙酯的酯链,在253 nm处测定吸光度值,计算酶活性。在碱性条件下,脂肪酶(LPS)水解1, 2-邻-二月桂宗甘油-3-戊二酸-(6'-甲基试卤灵)-酯形成红色甲基试卤灵,并在波长580 nm处根据红色甲基试卤灵产生量确定LPS酶活。
转氨酶活力采用南京建成试剂盒进行测定(C009-2-1、C010-2-1)。方法简述如
下,谷丙转氨酶(GPT)作用于丙氨酸和α-酮戊二酸组成的底物上,在37℃、pH 7.4、30 min时产生丙酮酸和谷氨酸,谷草转氨酶与α-酮戊二酸和天冬氨酸反应生成谷氨酸和草酰乙酸,然后脱羧生成丙酮酸。最后加入DNPH盐酸溶液终止反应。
研究结果如图11所示。BV 2和BV 3组的TRP活力显著高于对照组(
抗氧化酶活力测定
抗氧化酶活力采用南京建成试剂盒进行测定(A007-1-1、A001-3-2、A001-3-1、A060-2-1)。方法简述如下,超氧阴离子自由基(O
与对照组相比,添加BV 能不同程度提高对虾肝胰腺的免疫相关酶活力(如图12)。随着BV 的添加, ACP、AKP和CAT活力呈先上升后下降的趋势,在BV 2 组中达到最高;SOD活力呈现不断上升的趋势,在BV 3组达到最高。与对照组相比,ACP活力没有显著差异(P >0.05),而BV 2组中的AKP、CAT、SOD活力和BV 3组的CAT、SOD活力显著升高(P < 0.05)。侵染一周后,这四种酶活力均显示出先上升后降低的趋势,在BV 2 组中达到最高。与对照组相比,ACP活力在BV 1和BV 2组中没有显著变化(P > 0.05),在BV 3组显著下降(P < 0.05);AKP,CAT和SOD活力在BV 2和BV 3组均显著上升(P < 0.05)。AKP和CAT活力在各BV 添加组之间没有显著差异(P > 0.05)。
免疫相关基因表达量变化
使用 Trizol 试剂提取组织的总RNA并根据反转录合成cDNA模板。采用实时荧光定量qRT-PCR技术基于ABI 7500基因定量实时检测系统,测定不同处理下免疫相关基因在转录水平上的相对表达量。
的提取
采用Trizol法提取样品中的RNA。
反转录
a. 消化DNA
反应体系:
RNase Inhibitor0.6 μl(2.5U)
提取的RNA8 μl
DNase I(RNase-Free)1 μl
10×DNase I Buffer(RNase-Free)2.5 μl
置于37℃反应30 min后,向体系中加入Stop solution 1 μl,65℃反应10 min灭活DNA酶;然后向体系中加入2×Oligo dT 2.5 μl,在70℃使RNA变性5 min后,冰上放置2min;b. 反转录
反应体系:
5×M- MLV反转录缓冲液6.5 μl
dd water(RNase-Free)1 μl
dNTP(RNase-Free)12.5 μl
M- MLV反转录酶2.5 μl
RNase Inhibitor1.25 μl
42℃反转录1 h,95℃ 5 min灭活反转录酶。
引物设计
qRT-PCR引物是采用Primer Premier 5.0软件进行设计,由北京睿博生物技术公司进行合成。参照凡纳滨对虾相关序列进行引物设计,β-actin作为内参基因与目的基因一起扩增时加入等量的模板,扩增后进行溶解曲线分析确定有无非特异性扩增。引物信息见表6。
表6
qRT-PCR反应
利用荧光嵌合原理(SYBR green Ⅰ)实时测定基因表达量。首先将合成的 cDNA 模板稀释 20 倍;在荧光定量专用 96 孔板中加入混合体系,每管的反应体系如下:
模板cDNA2.5 µl
引物F(10 µM)0.5 µl
引物R(10 µM)0.5 µl
SYBR Mix I2.5 µl
dd H
设定PCR反应条件为:
预变性95℃ 1 min
变性95℃ 20s
退火60℃ 20s
延伸72℃ 20s,
其中变性、退火、延伸重复40个循环。
温度从57℃逐步升高到95℃,每升高1℃进行信号采集,测定溶解曲线。
以凡纳滨对虾β-actin作为内参基因。采用2
(5)免疫基因表达量结果
与对照组相比,BV 添加能不同程度提高对虾免疫相关基因表达量(见图13所示)。饲喂BV 菌株6周后,
肝胰腺和中肠显微结构观察
对虾肝胰腺和中肠用Bouin’s溶液固定,乙醇梯度脱水后进行石蜡包埋,按常规方法制备石蜡切片,HE 染色后显微镜下观察其结构。用显微拍摄系统进行肝胰腺和肠道形态指标拍摄。
(1)石蜡包埋
石蜡包埋主要包括组织脱水、透明、浸蜡、包埋过程,对应数据如下表7所示,具体步骤如下所示:
表7
使用加热石蜡包埋系统包埋石蜡,待包裹组织的石蜡完全硬蜡后,将蜡块修成梯状;采用超薄切片机切片,厚度为 0.6 µm,,42℃水浴锅展片,37℃恒温培养箱烘干。
(2)HE染色
使用全自动组织切片染色机(Leica,德国)进行染色。具体步骤如下,见表8所示:
表8
(3)封片
在载玻片中心滴加半滴中性树胶,盖上盖玻片,通风晾晒一天使树胶彻底凝固,玻片室温存放。
(4)显微拍摄及图像测量
光学显微镜下进行观察,并使用显微摄影系统拍照。随机选取玻片拍照,每张切片选取 5 个不同视野及数据测量,而后使用Image-pro Plus 6.0 软件进行图像数据测量。
本试验所有测量对象的选择,均遵守组织学样品采集与图像数据测量中的随机等距原则。肝胰腺测量指标包括肝小体、胚胎细胞(E 细胞)、吸收细胞(R 细胞)、分泌细胞(B细胞)和纤维细胞(F细胞)数量和形态;肠道测量指标包括微绒毛高度和绒毛密度。
(5)肝胰腺和中肠显微观察结果
各组肝胰腺组织切片如图14所示,与对照组相比,BV添加组中肝小体排列相对更加紧密,肝小体之间基底膜基本完整;对照组的肝小管管腔大都成圆形,BV添加组更普遍呈星形或多边形,其中BV 2组基本都呈现星形。对照组的肝小体周围分布很多未分化的E 细胞(胚胎细胞,细胞个体非常小,负责分裂和分化成其他类型的肝胰腺细胞),而BV 添加组的B细胞(体积最大,含有大液泡,主要负责分泌消化酶)、F细胞(主要负责吸收营养物质和合成蛋白质)和R细胞(细胞核位于近基部主要负责吸收和储存能量)的数量明显增加,其中BV 2组的B细胞、F细胞和R细胞数量最多。
对虾肠壁由内向外分单层柱状上皮细胞、结缔组织、肌层和结缔组织,由图15可知,各组的肠壁厚度没有明显差异,但是对照组的肠道组织结构的肠绒毛与肠壁明显脱离,肠壁完整性遭到破坏,且绒毛长度较短。与对照组相比,BV添加组的肠道组织结构相对完整,肠绒毛和皱襞长度有所增长且与肠壁紧密相连。尤其在BV 2组中,细胞上皮细胞紧密连接,游离面的微绒毛排列整齐、致密。
对肠道微生物组成的影响
(1)对虾肠道DNA的提取
对虾肠道DNA的提取,步骤如下:
a)将对虾肠道充分匀浆,向匀浆液中加入1.35 ml DNA提取缓冲液和5 μl蛋白酶K(20 mg/ml)混匀,37℃下震荡消化1 h;
b)加入150 μl 20%的SDS,65℃水浴2 h,过程中经常翻转混合;
c)6000 g离心10 min后收集上清,加入等倍体积的苯酚/氯仿/异戊醇混合液(25:24:1),抽提10 min;
d)6000 g离心10 min后取上清,加入等倍体积的氯仿/异戊醇混合液(24:1),继续抽提10 min;
e)6000 g离心10 min后取上清,加0.6倍体积的异丙醇,4℃过夜处理;
f)13000 g离心10 min后弃掉上清。加500 μl 70%乙醇洗涤,离心去上清,将沉淀干燥成半透明状后溶于50 μl TE(pH 8.0)中。
(2)PCR扩增
以提取的总DNA为模板,采用引物515F:GTGNCAGCMGCCGCGGTAA和926R:CCGYCAATTYMTTTRAGTTT进行16S rDNA的V4-V5可变区扩增。PCR扩增反应体系如下:
10×PCR buffer(含25 mM MgCl
DNTP(10 mM)2 μl
27F (10 mM)1 μl
1492R (10 mM)1 μl
DNA模板1 μl
ExTaq DNA 聚合酶(5 U/μl)0.25 μl
dd H
PCR热循环条件按以下程序进行。
预变性95℃5 min
变性95℃1 min
退火65℃(-1℃,touch down)1 min
延伸72℃2 min
变性、退火、延伸要重复20个循环;
变性95℃1 min
退火 55℃ 1 min
延伸72℃ 3 min
变性、退火、延伸要重复10个循环;
加尾72℃ 10 min
保持4℃∞
(3)肠道微生物统计分析
首先对原始数据进行拼接、过滤,得到有效数据。然后基于有效数据进行OTUs(Operational Taxonomic Units )聚类和物种分类分析。对OTU的序列信息进行物种注释和其丰度分布情况。同时进行Alpha多样性计算、Venn图等以得到样本内物种丰富度和均匀度信息、不同样本或分组间的共有和特有OTUs信息等。另一方面,可以对OTUs进行多序列比对并构建系统发生树,通过PCoA、PCA、NMDS等降维分析和样本聚类树展示,可以探究不同样本或组间群落结构的差异。用T-test、Simper、MetaStat、LEfSe、Anosim和MRPP等方法检验组间物种组成和群落结构的显著性。
(4)测序基本数据
肠道微生物V4-V5测序每组得到的优化序列均大于50000 bp,平均长度为 470bp,各组样品所得 OTUs 和物种数。稀释曲线(Rarefaction Curve,图 16)趋向平坦,说明测序数据量渐进合理,随着数据量进行,只产生少量新的物种/OTUs,测序深度足以反映群落样本中的微生物多样性。
(5)菌群丰富度及样本复杂度分析(α-多样性)
等级聚类曲线(Rank Abundance)是OTUs丰度和编号所构建的曲线,如图17,反映出BV 2和BV 3组横轴跨度相对较大、曲线相对平滑,反映了这两组样本中物种丰富度相对较高,物种分布相对均匀。表9显示,BV 3组平均总OTUs数最高,达到587 ± 128.27;BV 2组其次,为454.5 ± 170.41。平均observed_species以BV 2组最高,达到639.5 ± 183.14;BV 3组其次,为595 ± 2.8,与BV 1组差异显著。BV 3组特有OTU数量最多,为245个,BV 2组含197个特有OUT,BV 1组和对照组特有OUT 仅有40余个(图18)。
α-多样性(Alpha Diversity)用于分析样本内的微生物群落多样性,统计采用Shannon、Simpson、Chao1、ACE和PD-whole Tree计算,其中BV 3组和BV 2组的α-多样性指数均显著地高于BV 1组,而BV 1组的所有指数都同对照组相近,都处于较低水平。
表9
(6)微生物群落组成差异(β-多样性)
β-多样性(Beta Diversity)是对不同样本的微生物群落构成进行比较分析。通过多变量统计学方法主成分分析(PCA,Principal Component Analysis),主坐标分析(PCoA,Principal Co-ordinates Analysis),非加权组平均聚类分析(UPGMA,Unweighted Pair-group Method with Arithmetic Means)等分析方法以及β-多样性指数组间差异分析等方法,从中发现不同样本(组)间的差异。
(7)典型菌株分布情况
凡纳滨对虾肠道的主要细菌在属水平的相对丰度比较,如图19所示。优势菌主要包括
采用该菌株制备的饲料与未添加该菌株的饲料进行野外土池养殖实验,发现添加该益生菌后,大塘出虾产量提高了10-15%。证明该菌株可用于养殖生产活动。
以上对本发明的具体实施例进行了描述。需要理解的是,本发明并不局限于上述特定实施方式,本领域技术人员可以在权利要求的范围内做出各种变形或修改,这并不影响本发明的实质。
- 一种对虾益生菌及应用
- 一种益生菌组合及其在凡纳滨对虾苗种培育中的应用
