1,2,4-噁二唑苯甲酸的药物组合物和盐
文献发布时间:2023-06-19 11:30:53
本申请为2015年3月5日提交的、发明名称为“1,2,4-噁二唑苯甲酸的药物组合物和盐”、申请号为201580023750.3的中国发明专利申请的分案申请。
本申请要求2014年3月6日提交的美国临时申请系列号61/949,052和2014年6月 6日提交的美国临时申请系列号62/009,111的优先权益,其各自全文引入并出于所有目的作为参考。
1.技术领域
本文提供了药物组合物,其包含1,2,4-噁二唑苯甲酸或其药学上可接受的盐。本文进一步提供了某些1,2,4-噁二唑苯甲酸的药物组合物和制备其的方法。本文进一步提供了某些药学上可接受的1,2,4-噁二唑苯甲酸的盐和制备其的方法。本文进一步提供了某些包含1,2,4-噁二唑苯甲酸盐的药物组合物和制备其的方法。本文进一步提供了治疗或预防与无义突变或提前终止密码子相关的眼病的方法,包括对患有与无义突变或提前终止密码子相关的眼病的患者给药该药物组合物或药学上可接受的盐。本文进一步提供了产前治疗或预防与无义突变或提前终止密码子相关的眼病的方法,包括对患有与无义突变或提前终止密码子相关的眼病的患者给药该1,2,4-噁二唑苯甲酸的药物组合物或药学上可接受的1,2,4-噁二唑苯甲酸的盐的药物组合物。本文进一步提供了出生后治疗或预防与无义突变或提前终止密码子相关的眼病的方法,包括对患有与无义突变或提前终止密码子相关的眼病的患者给药该1,2,4-噁二唑苯甲酸的药物组合物或药学上可接受的 1,2,4-噁二唑苯甲酸的盐的药物组合物。
2.发明背景
美国专利号6,992,096描述了用于治疗、预防或控制通过调节提前翻译终止或无义介导的mRNA降解而减轻的疾病的1,2,4-噁二唑化合物,其公开内容在此全文引入作为参考。该化合物之一是通用名为ataluren的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸或其药学上可接受的盐,在此称为化合物1。化合物1的某些物理性质可能影响眼用剂型的加工、制造和药物接受度。粒径、溶解度和流动性质也可能影响3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的眼用剂型的生产效率。参见,Prescott等,Pharm.Tech. 2000,10月,60-85。某些本领域已知的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸眼用剂型的制剂仍然对眼睛有刺激。从而,对于具有改善的物理和药学性质的新的包含 3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的药剂剂型存在需求。此外,对于具有改善的物理和药学性质的新的包含3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的盐形态的药剂剂型存在需求。
3.发明概述
本文提供了在缓冲系统中包含3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的药物组合物,其中缓冲系统以药学上可接受的pH溶解3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸以提供适于眼部应用的改进的溶液。本文提供了盐形态的3-[5-(2-氟-苯基)-[1,2,4] 噁二唑-3-基]苯甲酸,其中3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸缀合阳离子改性剂以提供具有增强的渗透性和降低的刺激性的离子化的盐形态的3-[5-(2-氟-苯基)-[1,2,4] 噁二唑-3-基]苯甲酸,其中离子化的盐形态包括化合物1的镁盐,钾盐,钠盐,氨丁三醇盐,L-赖氨酸盐,L-精氨酸盐,N-甲基葡糖胺盐和L-组氨酸盐。本文进一步提供了在缓冲系统中包含盐形态的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的药物组合物,其中缓冲系统以药学上可接受的pH溶解盐形态的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸以提供适于眼部应用的改进的化合物1的溶液。
本文进一步提供了药物组合物,其包含3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸或其药学上可接受的盐;和一种或多种额外的药学上可接受的赋形剂以提供适于眼部应用的改进的溶液。
在一个方面,本公开提供了一种用于在有需求的哺乳动物受试者中预防、治疗或减轻眼病的方法,该方法包括对受试者给药治疗有效量的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3- 基]苯甲酸或其药学上可接受的盐。在某些实施方式中,该方法包括产前或出生后给药,其中产前给药是口服或肠胃外的,出生后给药是眼部给药。在另一方面,本公开提供了一种用于在有需求的哺乳动物受试者中预防、治疗或减轻眼病的方法,该方法包括对受试者给药治疗有效量的药物组合物,其包含3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸或其药学上可接受的盐和一种或多种额外的药学上可接受的赋形剂。在某些实施方式中,该方法包括产前或出生后给药,其中产前给药是口服或肠胃外的,出生后给药是眼部给药。
在一些实施方式中,治疗有效量的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸或其药学上可接受的盐对一个或多个眼部区域进行眼部给药。在一些实施方式中,治疗有效量的药物组合物,其包含3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸或其药学上可接受的盐和一种或多种额外的药学上可接受的赋形剂,对一个或多个眼部区域进行眼部给药。
在一些实施方式中,该一个或多个眼部区域选自后房,锯齿缘,睫状肌,睫状小带,施累姆的管,瞳孔,前房,角膜,虹膜,晶状体皮质,晶状体核,睫状突,眼结膜,下斜肌,下直肌,内直肌,视网膜动脉和静脉,视盘,硬脑膜,视网膜中央动脉,视网膜中央静脉,视神经,涡静脉,眼球鞘,黄斑,小窝,巩膜,脉络膜,上直肌和视网膜。在一些实施方式中,眼部区域是角膜。在一些实施方式中,眼部区域是小窝。在一些实施方式中,眼部区域是脉胳膜。在一些实施方式中,眼部区域是视网膜。在一些实施方式中,哺乳动物是人类。
在一些实施方式中,受试者有风险患有、疑似患有或诊断患有一种或多种的无虹膜,无脉络膜,肾缺损综合症,莱伯先天性黑朦,色素性视网膜炎,巴比二氏综合征,青光眼,小窝发育不全,白内障,Usher综合征,中枢听觉处理困难,脉络膜视网膜变性,先天性晶状体混浊,升高的眼内压,渗出性血管性视网膜病变,青光眼,虹膜发育不全,角膜病(角膜变性),视神经发育不全,视网膜脱离,次级斜视和晶状体血管膜。
在一些实施方式中,3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸或其药学上可接受的盐联合至少一种额外的治疗剂给药。在一些实施方式中,额外的治疗剂在3-[5-(2-氟- 苯基)-[1,2,4]噁二唑-3-基]苯甲酸或其药学上可接受的盐给药前给药,在3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸或其药学上可接受的盐给药后给药,与3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸或其药学上可接受的盐的给药同时给药或其组合。
在一些实施方式中,药物组合物,其包含3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸或其药学上可接受的盐和一种或多种额外的药学上可接受的赋形剂,联合至少一种额外的治疗剂给药。在一些实施方式中,额外的治疗剂在药物组合物给药前,药物组合物给药后,药物组合物给药同时给药,或其组合。
本文进一步提供了用于治疗、预防或控制通过调节提前翻译终止或无义介导的mRNA降解而减轻的眼病的方法,包括对患有通过调节提前翻译终止或无义介导的 mRNA降解而减轻的眼病的患者给药有效量的本文提供的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的药物组合物或有效量的本文提供的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的盐的药物组合物。
本文进一步提供了治疗、预防或控制与无义突变相关的眼病的方法,包括对患有与无义突变相关的眼病的患者给药有效量的本文提供的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3- 基]苯甲酸的药物组合物或有效量的本文提供的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的盐的药物组合物。
本文进一步提供了治疗、预防或控制与提前终止密码子相关的眼病的方法,包括对患有与提前终止密码子相关的眼病的患者给药有效量的本文提供的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的药物组合物或有效量的本文提供的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的盐的药物组合物。
4.附图简述
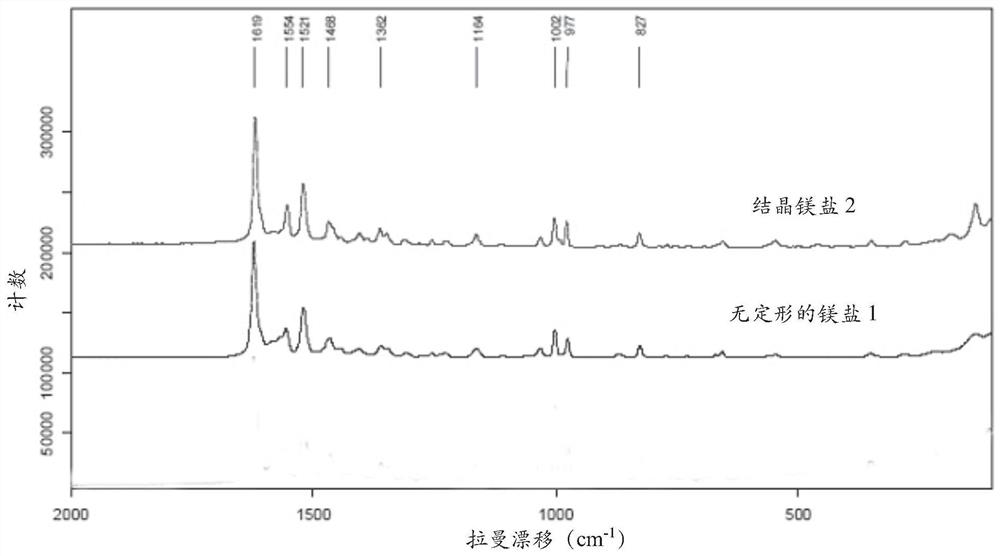
图1描述了作为无定型的化合物1的镁盐1与晶体形态镁盐2对比的拉曼光谱。
图2描述了作为无定型的化合物1的镁盐1与晶体形态镁盐2对比的PXRD图谱。
图3描述了化合物1的钾盐1的拉曼光谱。
图4描述了化合物1的钾盐1的PXRD图谱。
图5描述了化合物1的钠盐1的拉曼光谱。
图6描述了化合物1的钠盐1的PXRD图谱。
图7描述了化合物1的氨丁三醇盐1的拉曼光谱。
图8描述了化合物1的氨丁三醇盐1的PXRD图谱。
图9描述了化合物1的氨丁三醇盐1的
图10描述了叠加的制备的化合物1的氨丁三醇盐1,4和5的PXRD图谱,包括水溶解度检测剩余的过量固相。
图11描述了化合物1的L-赖氨酸盐1的拉曼光谱。
图12描述了化合物1的L-赖氨酸盐1的PXRD图谱。
图13描述了化合物1的L-精氨酸盐的拉曼光谱。
图14描述了化合物1的L-精氨酸盐的PXRD图谱。
图15描述了化合物1的L-组氨酸盐1的拉曼光谱。
图16描述了化合物1的L-组氨酸盐1的PXRD图谱叠加化合物1的形态A和L- 组氨酸,显示化合物1峰和L-组氨酸盐1和L-组氨酸的重叠峰。
图17描述了化合物1的钾盐1的动态气相吸附(DVS),其显示可逆的水释放(左箭头)和滞后的小的不可逆的水吸收(右箭头)。
图18描述了化合物1的钠盐1的DVS,其显示逐步的不可逆的水吸收。
图19描述了化合物1氨丁三醇盐1的DVS,其显示在比初始更低的质量到来时滞后的大的可逆的水吸收。
图20描述了化合物1的L-赖氨酸盐1的DVS,其显示小的可逆的水吸收。
图21描述了化合物1的镁盐2的DVS,其显示滞后(右箭头)的大的水释放(左箭头)。
图22描述了化合物1的钾盐1制备时(底部),DVS后(中间)和水溶解度测定残留(顶部)的叠加FT-拉曼光谱。
图23描述了化合物1的钠盐1制备时(底部),DVS后(中间)和水溶解度测定残留(顶部)的叠加FT-拉曼光谱。
图24描述了化合物1氨丁三醇盐1制备时(底部),DVS后(中间)和水溶解度测定残留(顶部)的叠加FT-拉曼光谱。光谱中未观察到区别。
图25描述了化合物1的L-赖氨酸盐1制备时(底部),DVS后(中间)和水溶解度测定残留(顶部)的叠加FT-拉曼光谱。
图26描述了化合物1的镁盐2制备时(底部),DVS后(顶部)和水溶解度测定残留(中间)的叠加FT-拉曼光谱。
图27描述了化合物1的钾盐1制备时(右侧高的峰)和水溶解度后(右侧较低的峰)的叠加PXRD图谱。
图28描述了化合物1的钠盐1制备时和水溶解度后的叠加PXRD图谱。
图29描述了化合物1氨丁三醇盐1制备时和水溶解度后的叠加PXRD图谱。
图30描述了化合物1的L-赖氨酸盐1制备时和水溶解度后的叠加PXRD图谱。
图31描述了化合物1的镁盐2制备时(较高的峰)和水溶解度后(较低的峰)的叠加PXRD图谱。
图32描述了微粒化的和未微粒化的化合物1在含0.5%十二醇硫酸钠的0.1N HCl中的溶解度谱的图示。
图33描述了微粒化的化合物1在pH 7.4的磷酸盐缓冲盐水中的溶解度谱的图示。
图34描述了微粒化的化合物1样品在偏振光下的图像。
图35描述了未微粒化的化合物1样品在偏振光下的图像。
图36A-D描述了化合物1治疗在PAX6突变小鼠中的效果。图36A描述了全身性化合物1治疗在具有PAX6表型的小鼠中的效果。箭头头部指示晶状体茎(lenticular stalk);箭头指示角膜;星号指示睫状缘。WT=野生型;Mt=突变体;L=晶状体;R =视网膜;P=出生后天数。图36B描述了PAX6突变体眼睛中1%化合物1悬液剂局部滴注的组织学对比。图36C描述了PAX6野生型(WT)和PAX6突变体(SEY和NEU) 小鼠视网膜和角膜上皮中的PAX6蛋白检测。黑条描述了野生型小鼠;白条描述了未治疗的小鼠;方格条描述了给药悬液剂后的小鼠。*P<0.001(n=6)。图36D提供了比较局部水剂和悬液剂化合物1中的最大空间频率阈值(spatial frequency threshold)的箱线图。箱线图制为显示5%和95%分位数(线),25%和75%四分位数(箱)和用水平线表示的中值。
图37显示了nmPAX6(无义突变PAX6)突变小鼠中的视网膜和角膜组织学。图37A 描述了PAX6突变体眼睛中出生后第60天悬液剂的局部(顶部)治疗结果。未治疗的 PAX6突变体对照(CON)角膜上皮在出生后第60天保持很薄。P指出生后天数。图37B 提供了来自野生型全身性治疗的PAX6突变小鼠和未治疗的小鼠的视网膜切片图像,显示治疗的小鼠(n=6)中光感受器内段(IS)和外段(OS)更短。与野生型小鼠相比,治疗的小鼠中外核层(ONL)更紧密包裹。未治疗的小鼠中所有视网膜层都比正常的薄。INL指内核层;IPL指内网层;GCL=神经节细胞层。
5.发明详述
5.1.
如本文使用的术语“提前翻译终止”指将对应氨基酸的密码子变为终止密码子的突变的结果。
如本文使用的术语“无义介导的mRNA降解”指介导包含提前翻译终止密码子的mRNA降解的任何机理。在一个实施方式中,无义介导的mRNA降解来自DNA的无义突变。
如本文使用的术语“提前终止密码子”指终止密码子出现在本应该对应氨基酸的密码子的地方。
如本文使用的术语“无义突变”指将对应氨基酸的密码子变为终止密码子的点突变。在一个实施方式中,无义突变是在DNA中发生的突变,并随后转录入mRNA。
如本文使用的术语“无义抑制”指对提前翻译终止和/或无义介导的mRNA降解的抑制。在一个实施方式中,mRNA降解来自DNA的无义突变。
如本文使用的术语“提前翻译终止和/或无义介导的mRNA降解的调节”指在无义抑制剂存在下的基因表达上调。例如,如果期望增加由具备提前终止密码子的基因编码的缺陷蛋白的生产,即,为了允许疾病基因的提前终止密码子的通读(read through)从而 mRNA的翻译能够发生,那么提前翻译终止和/或无义介导的mRNA降解的调节需要使用无义抑制剂。
如本文使用的术语“不良反应”和“副作用”包括但不限于恶心,呕吐,腹泻,头痛,头晕,眼痛,眼胀,眼烧灼。
如本文使用的术语“活性剂”、“药物”和“原料药”指本文提供的3-[5-(2-氟-苯基)-[1,2,4] 噁二唑-3-基]-苯甲酸或其药学上可接受的盐(在此一并称为“化合物1”)。
如本文使用的术语“剂量”表示一次给药的活性剂的量。
如本文使用的术语“单位剂型”包括固体剂型如片剂,囊片,胶囊,锭剂,分散体,粉末,颗粒或凝胶等,或液体剂型如溶液悬浮液,乳剂或酏剂和可以重构以提供该液体剂型的固体形态,其中此类单位剂型适于局部(例如,眼)等和口服或肠胃外给予患者。
如本文使用的术语“给药方案”和“剂量”表示每时间单位给予的活性剂的量和给药持续时间。
如本文使用的术语“受试者”和“患者”可互换使用,是指动物或任何具有生物体感觉和自主运动的力量,并且需要氧气和有机食物来维持生存。非限制性的实例包括人类,灵长动物,马,猪,牛,兔,褐,鼠,犬和猫物种的成员。在一些实施方式中,受试者是哺乳动物或温血脊椎动物。在某些实施方式中,受试者是非人动物。在具体的实施方式中,受试者是人。在某些实施方式中,受试者是胎儿,胚胎,婴儿,儿童,青少年或成人。在一个实施方式中,遗传预筛分已确定受试者具有无义突变。在另一个实施方式中,遗传预筛分已确定患者具有哪些提前终止密码子(即,UAA,UGA或UAG)。
如本文使用的术语“有效量”在功能性通读蛋白的上下文中指对受试者具有预防性和/或治疗性益处的功能性通读蛋白的量。在具体实施方式中,有效量的功能性通读蛋白是具有一种、两种或更多下述效果的蛋白的量:(1)防止无义突变相关眼部病症的发生、发展和/或进展,(2)防止一种或多种无义突变相关眼部病症相关症状的发生、发展和/ 或进展,(3)降低无义突变相关眼部病症的持续时间和/或严重程度,(4)减少无义突变相关眼部病症相关症状的数量,(5)降低一种或多种无义突变相关眼部病症相关症状的持续时间,(6)降低一种或多种无义突变相关眼部病症相关症状的严重程度和(7)改善受试者的生活质量。在一个具体实施方式中,有效量的功能性通读蛋白防止失明或目盲。
如本文使用的术语“有效量”在本文描述的化合物的给药的上下文中指对受试者具有预防性和/或治疗性益处的化合物的量。在具体实施方式中,有效量的本文描述的化合物具有一种、两种或更多下述效果:(1)防止无义突变相关眼部病症的发生、发展和/ 或进展,(2)防止一种或多种无义突变相关眼部病症相关症状的发生、发展和/或进展, (3)降低无义突变相关眼部病症的持续时间和/或严重程度,(4)减少无义突变相关眼部病症相关症状的数量,(5)降低一种或多种无义突变相关眼部病症相关症状的持续时间, (6)降低一种或多种无义突变相关眼部病症相关症状的严重程度和/或(7)改善受试者的生活质量。在一个具体实施方式中,有效量的本文描述的化合物防止失明或目盲。有效量的本文描述的化合物的示例在下文5.4节提供。
如本文使用的术语“功能性”在功能性通读蛋白的上下文中指具有对应的野生型蛋白的足够功能,以在由编码该蛋白的核酸序列(例如,基因)中的突变(例如,无义突变)导致不产生野生型蛋白或产生的量不足的细胞或受试者中具有有益效果。在一个特别的实施方式中,功能性通读蛋白具有全长野生型蛋白的1、2、3或更多种功能。在某些实施方式中,产生的功能性通读蛋白是功能性非野生型蛋白。在某些实施方式中,产生的功能性通读蛋白是功能性野生型蛋白。在一些实施方式中,产生的功能性非野生型蛋白是全长的。在一些实施方式中,产生的功能性野生型蛋白是全长的。在其它实施方式中,产生的功能性非野生型蛋白不是全长的。在其它实施方式中,产生的功能性野生型蛋白不是全长的。
如本文使用的术语“眼病”或“与基因中的无义突变相关的眼部病症”指直接或间接由基因中的无义突变导致的疾病或病症,其中该无义突变阻止了受影响的细胞中野生型蛋白的产生。与无义突变相关的眼部病症涵盖了其中单一基因包含1、2、3或更多无义突变的疾病,以及2、3或更多(多个)基因包含1、2、3或更多无义突变的疾病。
如本文使用的,“联合”在给予治疗的上下文中指多于一种治疗方法的使用。术语“联合”的使用并不限制对患有疾病的受试者给予治疗方案的顺序。施行第一疗法可以在对过去患有疾病、患有疾病或对疾病敏感的受试者施行第二疗法之前(例如,1分钟、5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时、24小时、 48小时、72小时、96小时、1周、2周、3周、4周、5周、6周、8周或12周前)、与其同时或之后(例如,1分钟、5分钟、15分钟、30分钟、45分钟、1小时、2小时、4 小时、6小时、12小时、24小时、48小时、72小时、96小时、1周、2周、3周、4周、 5周、6周、8周或12周后)。治疗在一个时间间隔内顺序对受试者施行,从而本文描述的眼用剂型可以与另一疗法共同作用,以提供较之如果单独施行治疗而言增加的益处。在某些其它实施方式中,另一疗法可包括共同给药的口服或肠胃外剂型。
如本文使用的术语“控制”指患者源于施用包含3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基] 苯甲酸或其本文提供的盐的本文提供的药物组合物的有益效果,其不导致治疗或预防疾病。
如本文使用的术语“预防”指通过对患有疾病的患者给药包含3-[5-(2-氟-苯基)-[1,2,4] 噁二唑-3-基]苯甲酸或其本文提供的盐的本文提供的药物组合物来防止患者的疾病或其症状的发生、复发、扩散或恶化。由于与无义突变相关的疾病具有遗传基础,可以对患者筛分无义突变的存在。当通过筛分确定患者具有无义突变,即可对患者给药包含有效量的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸或其本文提供的盐的有效量的药物组合物来防止疾病或其症状的发生、复发、扩散或恶化。
如本文使用的术语“治疗”指疾病或疾病相关症状的消除或改善。在某些实施方式中,该术语指通过对患有疾病的患者给药包含3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸或其本文提供的盐的本文提供的药物组合物来最小化患者疾病的扩散或恶化。当确定患者患有无义突变相关疾病,即可对患者给药包含有效量的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸或其本文提供的盐的有效量的药物组合物,以消除、改善、最小化疾病或其症状的扩散或恶化。
如本文使用的术语“约”或“大约”表示如本领域普通技术人员确定的对一个特定值的可接受的误差,其部分取决于该值是如何检测或测量的。在某些实施方式中,术语“约”或“大约”表示在1,2,3或4个标准差之内。在某些实施方式中,术语“约”或“大约”表示在给定值或范围的50%,20%,15%,10%,9%,8%,7%,6%,5%,4%,3%,2%, 1%,0.5%或0.05%之内。
5.2.化合物
用于制备本文提供的药物组合物和盐的化合物是3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3- 基]-苯甲酸,也使用通用名ataluren,具有式(I)的结构:
式(I)的化合物可根据美国专利号6,992,096,美国专利号7,678,922和美国专利号 8,367,841中描述的方法进行制备,其公开内容在此全文引入作为参考。可选的,盐形态的式(I)的化合物也可以基于本文的教导进行制备。本文提供的式(I)的化合物和盐一起称为“化合物1”。
在一个实施方式中,用于本文提供的药物组合物、过程和方法的化合物1是游离酸。在一个实施方式中,游离酸是固体。在另一个实施方式中,固体游离酸是无定形的。在又一个实施方式中,固体游离酸是美国专利号7,863,456,美国专利号8,394,966和美国专利号8,748,625中描述的晶体形态,其公开内容在此全文引入作为参考。在又一个实施方式中,固体游离酸是晶体形态A。在又一个实施方式中,固体游离酸是晶体形态B。这些固体形态的式(I)的化合物也可以根据美国专利号7,863,456,美国专利号8,394,966 和美国专利号8,748,625中描述的方法进行制备,其公开内容在此全文引入作为参考。可选的,固体形态的式(I)的化合物也可以基于的本文教导根据本领域技术人员显而易见的其它方法制备。
在另一个实施方式中,式(I)的化合物的游离酸是药学上可接受的溶剂化物。在一个实施方式中,游离酸是水合物。在另一个实施方式中,式(I)的化合物是药学上可接受的无水形态。在另一个实施方式中,式(I)的化合物的游离酸是药学上可接受的共晶形态,例如螯合物,包合物或与DEAE-C(二乙氨基乙基纤维素)、DEAE-D(二乙氨乙基葡聚糖) 或环糊精的络合物。在某些实施方式中,环糊精选自α-环糊精,β-环糊精,γ-环糊精,羟丙基-β-环糊精,羟丙基-γ-环糊精,二甲基-β-环糊精和二甲基-γ-环糊精。
在又一个实施方式中,用于本文提供的药物组合物、过程和方法的化合物1是式(I) 的化合物的药学上可接受的游离酸。在另一个实施方式中,用于本文提供的药物组合物、过程和方法的化合物1是式(I)的化合物的药学上可接受的盐。在另一个实施方式中,用于本文提供的药物组合物、过程和方法的化合物1是式(I)的化合物的药学上可接受的无水游离酸或盐。
5.3.盐形态及其制备
本文提供了化合物1的盐形态,包含选自L-精氨酸,L-组氨酸,L-赖氨酸,甲醇镁,氢氧化钾,氢氧化钠或氨丁三醇的盐。更特别的,化合物1的盐形态包含选自L-赖氨酸,钠或氨丁三醇的盐。本文还提供了原位制备化合物1的盐形态的蒸发方法,包括下述步骤:(1)混合盐的溶液和化合物1的溶液;(2)特定温度下在某个流速的气流下蒸发混合溶液以产生盐形态;并(3)收集盐形态。
在一个实施方式中,用于制备盐溶液的溶剂选自丙酮,乙醇,THF,甲醇,水,二氯甲烷或其混合物。在一个实施方式中,所述盐选自L-精氨酸,L-组氨酸,L-赖氨酸,镁,钾,钠或氨丁三醇盐。在某些实施方式中,所述盐选自L-赖氨酸,钠或氨丁三醇盐。在某些实施方式中,化合物1游离酸可以被发现为刺激性的。当与选自L-精氨酸,L- 组氨酸,L-赖氨酸,镁,钾,钠或氨丁三醇的阳离子改性剂缀合;或者,与选自DEAE-C, DEAE-D或环糊精的络合剂缀合时,得到的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的离子-中性形态具有增加的眼膜渗透性并给眼表面提供了降低的过敏性。缀合或络合的化合物1羧酸不能结合眼睛表面上的离子位点,并从而降低了过敏性和增加了渗透性。其它实施方式包括选自α-环糊精,β-环糊精,γ-环糊精,羟丙基-β-环糊精,羟丙基-γ- 环糊精,二甲基-β-环糊精和二甲基-γ-环糊精的环糊精。在某些实施方式中,离子改性剂的范围为约0.01%至约5.0%w/v,约0.5%至约5.0%w/v,约0.1%至约5.0%w/v,约0.01%至约2.0%w/v,约0.5%至约2.0%w/v或约0.1%至约2.0%w/v。在某些实施方式中,络合剂的范围为约0.01%至约10.0%w/v,约0.5%至约10.0%w/v,约0.1%至约10.0%w/v,约0.01%至约2.0%w/v,约0.5%至约2.0%w/v或约0.1%至约2.0%w/v。
在一个实施方式中,用于制备化合物1的溶液的溶剂选自丙酮,乙醇,THF,甲醇,水,二氯甲烷或其混合物。在一个实施方式中,所述气体是氮气。在一个实施方式中,用于蒸发的气体流速为约0.4 L/分钟。在一个实施方式中,所述特定温度为约25℃。在一个实施方式中,每种混合溶液的体积为约200μL。在一个实施方式中,所述盐溶液浓度范围为约0.005mol/L至约0.250mol/L;或,更具体的,约0.008mol/L,约0.028mol/L,约0.050mol/L或约0.230mol/L。
在一个实施方式中,用于与化合物1使用的所述盐溶液浓度范围为约0.0025mol/L至约0.075mol/L;或,更具体的,约0.004mol/L,约0.011mol/L或约0.050mol/L。在一个实施方式中,化合物1∶盐的化学计量当量是约1∶1,约1∶1.15,约1∶1.25,约1∶1.5,约1∶1.66,约1∶2,约1∶2.5,约1∶3,约1∶4或约1∶5。
在一个实施方式中,所述盐和化合物1的质量比为约1.25,约1.5,约1.66,约2,约2.5,约3,约4或约5。在一个实施方式中,200μL混合溶液中所述盐和化合物1 的总质量为约0.001mg,约0.0015mg,约0.002mg,约0.0025mg,约0.003mg,约 0.004mg,约0.005mg,约0.006mg,约0.007mg,约0.008mg,约0.009mg,约0.01 mg,约0.015mg,约0.02mg,约0.025mg,约0.03mg,约0.04mg,约0.05mg,约 0.06mg,约0.07mg,约0.08mg,约0.09mg,约0.1mg,约0.15mg,约0.2mg,约 0.25mg,约0.3mg,约0.4mg,约0.5mg,约0.6mg,约0.7mg,约0.8mg,约0.9mg 或约1.0mg。
本文提供了包含3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的盐形态和选自镁盐,钾盐,钠盐,氨丁三醇盐,L-赖氨酸盐,L-精氨酸盐,N-甲基葡糖胺盐和L-组氨酸盐的盐。本文提供了包含3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的盐形态和选自氨丁三醇盐和L-赖氨酸盐的盐。
本文进一步提供了用于制备化合物1的盐形态的粉浆法(slurrymethods),包括下述步骤:(1)在溶剂中混合盐和化合物1;(2)特定温度下在某个流速的气流下蒸发混合物一段时间以产生盐形态;并(3)收集盐形态。在一个实施方式中,用于制备混合物的溶剂选自乙酸乙酯,异丙醇,叔丁基甲基醚,甲苯或其混合物。在一个实施方式中,所述气体为氮气。在一个实施方式中,气体流速为约0.4L/分钟。在一个实施方式中,所述特定温度为约25℃。在一个实施方式中,时间长度为约2天。
本文进一步提供了用于制备化合物1的盐形态的沉淀法,包括下述步骤:(1)向化合物1的溶液中添加盐溶液;(2)特定温度下在某个流速的气流下蒸发混合物一段时间以产生盐形态;并(3)收集所述盐。在一个实施方式中,用于制备所述盐溶液的溶剂是水。在一个实施方式中,用于获得化合物1的溶液的溶剂是THF。在一个实施方式中,所述气体是氮气。在一个实施方式中,气体流速为约80mL/分钟。在一个实施方式中,所述特定温度为约25℃。在一个实施方式中,时间长度为约2天。
5.3.1.化合物1的镁盐
在一个实施方式中,本文提供了化合物1的镁盐。
在一个实施方式中,化合物1的镁盐是化合物1的固体形态。在另一个实施方式中,镁盐是无定形的。在另一个实施方式中,镁盐是晶体。
在某些实施方式中,本文提供的镁盐通过蒸发法获得。在某些实施方式中,镁盐获得自某些溶剂系统,包括MeOH和CH
在某些实施方式中,本文提供的镁盐通过沉淀法获得。在一个实施方式中,所述盐形态的溶液的溶剂是水。在一个实施方式中,化合物1的溶液的溶剂是THF。在一个实施方式中,获得自THF和水的镁盐是晶体。
在一个实施方式中,镁盐是4摩尔水溶剂化物。
在一个实施方式中,化合物1∶镁的镁盐的化学计量比是约1∶0.5。
在某些实施方式中,本文提供的固体形态,例如,镁盐,基本上是晶体,如例如X 射线粉末衍射检测所示。在一个实施方式中,镁盐具有基本上如图2所示的X射线粉末衍射图谱。
在一个实施方式中,本文提供了具有基本上如
图1中所示的拉曼光谱的镁盐。
5.3.2.化合物1的钾盐
在一个实施方式中,本文提供了化合物1的钾盐。
在一个实施方式中,化合物1的钾盐是化合物1的固体形态。在另一个实施方式中,所述钾盐是晶体。
在某些实施方式中,本文提供的钾盐通过蒸发法获得。在某些实施方式中,钾盐获得自某些溶剂系统,包括THF和水的混合物(例如约5∶1v/v)。
在某些实施方式中,本文提供的固体形态,例如,钾盐,基本上是晶体,如例如X 射线粉末衍射检测所示。在一个实施方式中,钾盐具有基本上如图4所示的X射线粉末衍射图谱。
在一个实施方式中,本文提供了具有基本上如图3中所示的拉曼光谱的钾盐。
5.3.3.化合物1的钠盐
在一个实施方式中,本文提供了化合物1的钠盐。
在一个实施方式中,化合物1的钠盐是化合物1的固体形态。在另一个实施方式中,钠盐是晶体。
在某些实施方式中,本文提供的钠盐通过蒸发法获得。在某些实施方式中,钠盐获得自某些溶剂系统,包括乙醇和水的混合物(例如约8∶1v/v)。
在一个实施方式中,钠盐是1.5摩尔水溶剂化物。
在一个实施方式中,化合物1∶钠的钠盐的化学计量比是约1∶1。
在某些实施方式中,本文提供的固体形态,例如,钠盐,基本上是晶体,如例如X 射线粉末衍射检测所示。在一个实施方式中,钠盐具有基本上如图6所示的X射线粉末衍射图谱。
在一个实施方式中,本文提供了钠盐具有基本上如图5中所示的拉曼光谱。
5.3.4.化合物1的氨丁三醇盐
在一个实施方式中,本文提供了化合物1的氨丁三醇盐。
在一个实施方式中,化合物1的氨丁三醇盐是化合物1的固体形态。在另一个实施方式中,氨丁三醇盐是晶体。
在某些实施方式中,本文提供的氨丁三醇盐通过蒸发法获得。在某些实施方式中,氨丁三醇盐获得自某些溶剂系统,包括丙酮和甲醇的混合物(例如约10∶1v/v)或水和甲醇的混合物(例如约1∶1v/v)。
在一个实施方式中,化合物1∶氨丁三醇的氨丁三醇盐的化学计量比在0.5∶0.5甲醇:水混合物中是约1∶0.5。
在某些实施方式中,本文提供的固体形态,例如,氨丁三醇盐,基本上是晶体,如例如X射线粉末衍射检测所示。在一个实施方式中,氨丁三醇盐具有基本上如图8所示的X射线粉末衍射图谱。
在一个实施方式中,本文提供了具有基本上如图7中所示的拉曼光谱的氨丁三醇盐。
在一个实施方式中,本文提供了具有基本上如图9中所示的
在一个实施方式中,本文提供了具有基本上如图19中所示的DVS的氨丁三醇盐。在一个实施方式中,DVS结果显示约2%总重量损失。在一个实施方式中,DVS结果显示约3%总重量损失。在一个实施方式中,DVS结果显示约4%总重量损失。
5.3.5.化合物1的L-赖氨酸盐
在一个实施方式中,本文提供了化合物1的L-赖氨酸盐。
在一个实施方式中,化合物1的L-赖氨酸盐是化合物1的固体形态。在另一个实施方式中,所述L-赖氨酸盐是晶体。
在某些实施方式中,本文提供的L-赖氨酸盐通过蒸发法获得。在某些实施方式中,L-赖氨酸盐获得自某些溶剂系统,包括THF和水的混合物(例如约5∶1v/v)。
在一个实施方式中,化合物1∶L-赖氨酸的L-赖氨酸盐的化学计量比是约1∶1。
在某些实施方式中,本文提供的固体形态,例如,L-赖氨酸盐,基本上是晶体,如例如X射线粉末衍射检测所示。在一个实施方式中,L-赖氨酸盐具有基本上如图12所示的X射线粉末衍射图谱。
在一个实施方式中,本文提供了具有基本上如图11中所示的拉曼光谱的L-赖氨酸盐。
5.3.6.化合物1的L-精氨酸盐
在一个实施方式中,本文提供了化合物1的L-精氨酸盐。
在一个实施方式中,化合物1的L-精氨酸盐是化合物1的固体形态。在另一个实施方式中,L-精氨酸盐是晶体。
在某些实施方式中,本文提供的L-精氨酸盐通过蒸发法获得。在某些实施方式中,L-精氨酸盐获得自某些溶剂系统,包括乙醇和水的混合物(例如约10∶1v/v)。
在某些实施方式中,本文提供的固体形态,例如,L-精氨酸盐,基本上是晶体,如例如X射线粉末衍射检测所示。在一个实施方式中,L-精氨酸盐具有基本上如图14所示的X射线粉末衍射图谱。
在一个实施方式中,本文提供了具有基本上如图13中所示的拉曼光谱的L-精氨酸盐。
5.3.7.化合物1的L-组氨酸盐
在一个实施方式中,本文提供了化合物1的L-组氨酸盐。
在一个实施方式中,化合物1的L-组氨酸盐是化合物1的固体形态。在另一个实施方式中,L-组氨酸盐是晶体。
在某些实施方式中,本文提供的L-组氨酸盐通过蒸发法获得。在某些实施方式中,L-组氨酸盐获得自某些溶剂系统,包括THF和水的混合物(例如约5∶1v/v)。
在某些实施方式中,本文提供的固体形态,例如,L-组氨酸盐,基本上是晶体,如例如X射线粉末衍射检测所示。在一个实施方式中,L-组氨酸盐具有基本上如图16所示的X射线粉末衍射图谱。
在一个实施方式中,本文提供了具有基本上如图15中所示的拉曼光谱的L-组氨酸盐。
5.4.药物组合物
包含有效量的化合物1的药物组合物和单一单位剂型可用于本文提供的方法中。单独的剂型可以适合于口服,皮肤,粘膜(包括但不限于眼科,舌下,颊,直肠,鼻或阴道)或肠胃外给药(包括但不限于皮下,肌肉内,动脉内,腹膜内,脑室内,颅内,滑膜内,膀胱内,玻璃体内,眼内,角膜内或静脉内和任何其它类似的注射或输注技术)。优选的药物组合物和单一单位剂型适合于口服给药。在某些实施方式中,化合物1的产前给药可以通过口服或肠胃外途径。在某些实施方式中,化合物1可以口服给药,例如以片剂或胶囊剂型。在某些其它实施方式中,化合物1可以肠胃外给药,例如通过静脉内剂型。在某些实施方式中,化合物1可以出生后局部,口服或肠胃外给药。在某些实施方式中,化合物1可以使用例如局部眼用剂型(例如局部凝胶或滴眼液)的剂型出生后局部给药。
在某些实施方式中,药物组合物包含约0.1%至约99%,约5%至约90%,约5%至约50%,约10%至约40%,约20%至约30%,约0.1%至约5%,约0.1%至约2.5%,约 0.1%至约1%或约0.25%至约0.5%重量/体积比(w/v)的化合物1。在某些实施方式中,药物组合物包含约0.01%,约0.02%,约0.025%,约0.05%,约0.1%,约0.15%,约0.2%,约0.25%,约0.5%,约1%,约2%,约5%,约10%,约15%,约20%,约25%,约 30%,约35%,约40%,约50%,约60%,约70%,约80%或约90%重量的化合物1。在某些实施方式中,药物组合物包含约0.05%,约0.1%,约0.2%,约0.25%,约0.5%或约1%重量的化合物1。在其它实施方式中,药物组合物包含约0.05%,约0.1%,约 0.2%或约0.5%重量的化合物1。
在某些实施方式中,本文提供的药物组合物包含约1至5,000mg,约10至约2,000mg,约50至约1,000mg,约100至约1,000mg或约100至约500mg的化合物1。在某些实施方式中,本文提供的药物组合物包含约125mg,约200mg,约250mg,约325 mg,约400mg,约500mg或约1000mg的化合物1。在某些实施方式中,本文提供的药物组合物包含约120mg,约130mg,约195mg,约205mg,约245mg,约255mg,约320mg,约330mg,约395mg,约405mg,约495mg,约505mg,约mg995或约 1005mg的化合物1。
在某些实施方式中,本文提供的药物组合物中的化合物1是3-[5-(2-氟-苯基)-[1,2,4] 噁二唑-3-基]-苯甲酸的游离酸或3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]-苯甲酸的本文提供的盐。
本文提供的药物组合物可以以单位剂型或多剂量形式提供。本文所用的单位剂型是指适合于使用本领域已知的包装施用于人和动物受试者的物理上离散的单位。每个单位剂量含有预定量的足以产生所需治疗效果的活性成分,以及所需的药物载体或赋形剂。单位剂型的实例包括安瓿,注射器和单独包装的包装,小药囊,片剂,胶囊或滴眼剂。例如,125mg单位剂量在包装的小包,小药囊,片剂,胶囊或滴眼液中含有约125mg 的活性成分。单位剂型可以以其中一部分或多个一起施用。多剂量形式是包装在单个容器中以作为分离的单位剂型施用的多个相同的单位剂型。多剂量形式的实例包括颗粒或粉末的小包或小袋,片剂或胶囊的小瓶或瓶,或者通过滴眼器施用的液量盎司,品脱或加仑中的一瓶液体溶液。
本文提供的药物组合物可以在一段时间内作为单一剂量或分份剂量施用。应当理解,治疗的精确剂量和持续时间可随待治疗患者的年龄,体重和状况而变化,并且可以使用已知的测试方案或通过从体内或体外测试或诊断数据外推来凭经验确定。还应当理解,对于任何特定的个体,应当根据个体需要和施用或监督制剂施用的人员的专业判断随时间调整具体的剂量方案。
在某些实施方式中,本文提供的药物组合物直接对患者眼部施用,每天一次、两次或三次。
5.4.1.局部剂型和出生后给药
在某些实施方式中,本文提供的包含化合物1的药物组合物被配制为用于出生后局部给药。在具体实施方式中,本文提供的药物组合物被配制为局部眼药水(滴眼液),其通常作为无菌等渗溶液存在(即,pH约3至约8,约4至约8,或约4.5,约7至约 8,或约7.4),可选进一步包含防腐剂。
在某些实施方式中,本文提供的药物组合物包含具有增强的渗透性和溶解度和降低的刺激性的微粒化形态的化合物1。在某些实施方式中,本文提供的药物组合物包含具有增强的渗透性和溶解度和降低的刺激性的纳米颗粒形态的化合物1。
在具体实施方式中,本文提供的药物组合物包含微粒化形态的化合物1,其中>90%的化合物1颗粒具有约10微米,约9微米,约8微米,约7微米,约6微米,约5微米,约4微米,约3微米,约2微米或约1微米的直径(D
如本文所用的术语“滴眼剂”是指以滴剂的形态施用在眼睛的外表面上并且对眼睛的内部和后部具有局部作用的药物液体制剂,包括角膜,虹膜,脉络膜,视网膜色素上皮,视网膜,黄斑,视网膜中央凹,视神经和玻璃体液。
对于眼科应用,将化合物1配制成适合用于眼睛的溶液,悬浮液或软膏。对于眼用制剂,一般参见Mitra编,Ophthalmic Drug Delivery Systems,Marcel Dekker,Inc.,NewYork,N.Y.(1993)以及Havener,W.H.,Ocular Pharmacology,Mosby Co.,St.Louis(1983)。眼用药物组合物可适于以溶液,悬浮液,软膏,霜剂或作为固体插入物的形态局部给药至眼睛。对于单次剂量,可以将0.1ng至5000μg,1ng至500μg或10ng 至100μg的化合物1施用至眼睛表面。
局部制剂可以是适于局部施用的任何形态,包括但不限于眼用溶液(例如滴眼液),眼用悬浮液,眼用纳米悬浮液,眼用乳液,眼用纳米乳液,眼用凝胶或眼用软膏或油性洗剂。化合物1或其药学上可接受的盐的局部给药还包括使用在合适的含药物层中携带化合物1或其药学上可接受的盐的眼科贴片,并且放置在眼睛的顶部以及眼睛插入物,后者是含有化合物1或其药学上可接受的盐并且放置在下结膜囊或上结膜囊中的装置。
可以通过将化合物1或其药学上可接受的盐和阳离子改性剂溶解在无菌水溶液例如盐水,缓冲溶液等中,或通过在使用前组合溶解的粉末组合物来制备滴眼剂。滴眼剂中可以包括其它添加剂,例如等渗剂(例如氯化钠,硼酸,甘露醇,山梨醇,海藻糖,甘油等),缓冲剂(例如硼酸,磷酸二氢钠,磷酸二氢钠等),防腐剂(例如苯扎氯铵,苄索氯铵,乙二胺四乙酸二钠(EDTA),聚季铵盐-1(PolyQuad),聚六亚甲基双胍 (PHMB),氯丁醇等),糖类增稠剂(例如乳糖,甘露醇,麦芽糖等),透明质酸或其盐(例如透明质酸钠,透明质酸钾等),粘多糖(例如硫酸软骨素等),润湿聚合物 (例如聚丙烯酸钠,羧基乙烯基聚合物,交联聚丙烯酸酯等)。
本文所述的眼用制剂的实施方式含有张力等于0.9%氯化钠溶液(290mOsm)的张力的等渗眼用溶液。可以使用本领域技术人员已知的Remington:The Science andPractice of Pharmacy(DB Troy等人,2006)中描述的方法调节滴眼液的张力。
眼软膏可以通过将化合物1或其药学上可接受的盐混合到基质中来制备。用于眼软膏的碱的非限制性实例包括凡士林,selen 50,Plastibase,聚乙二醇等。
本文所述的眼用制剂的某些实施方式可任选地含有粘度增强剂,例如羧甲基纤维素,羧甲基纤维素钠,甲基纤维素,羟丙基纤维素,羟丙基甲基纤维素,羟乙基纤维素,聚乙二醇300,聚乙二醇400,聚乙烯醇,聚维酮等。
本文所述的眼用制剂的其它实施方式可任选地含有衍生自天然产物如硅酸镁铝,藻酸盐,黄原胶,明胶,阿拉伯胶,黄蓍胶等的粘度增强剂。
在一个实施方式中,本文描述的眼用递药系统包含用于多剂量眼科应用的等渗溶液,其使用化合物1用于出生后治疗、预防或控制通过调节提前翻译终止或无义介导的mRNA降解而减轻的眼病,包括对患有通过调节提前翻译终止或无义介导的mRNA降解而减轻的眼病的患者给药有效量的本文提供的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的药物组合物或有效量的本文提供的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的盐的药物组合物。
在一个实施方式中,包含用于每日多次或单次剂量使用的具有延长寿命的眼部应用的等渗溶液的眼用递药系统被用于出生后治疗、预防或控制通过调节提前翻译终止或无义介导的mRNA降解而减轻的眼病,包括对患有通过调节提前翻译终止或无义介导的 mRNA降解而减轻的眼病的患者给药有效量的本文提供的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的药物组合物或有效量的本文提供的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的盐的药物组合物。
在一个实施方式中,利用粘性溶液或热固性凝胶的眼用递药系统被用于单位或多次剂量眼部应用用于出生后治疗、预防或控制通过调节提前翻译终止或无义介导的mRNA降解而减轻的眼病,包括对患有通过调节提前翻译终止或无义介导的mRNA降解而减轻的眼病的患者给药有效量的本文提供的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的药物组合物或有效量的本文提供的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的盐的药物组合物。
在一个实施方式中,利用脂质体乳液以保护化合物1不受蛋白质水解的眼用递药系统被用于出生后治疗、预防或控制通过调节提前翻译终止或无义介导的mRNA降解而减轻的眼病,包括对患有通过调节提前翻译终止或无义介导的mRNA降解而减轻的眼病的患者给药有效量的本文提供的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的药物组合物或有效量的本文提供的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的盐的药物组合物。
在一个实施方式中,包含包埋在白蛋白微球中的化合物1的眼用递药系统被用于缓慢释放化合物1用于出生后治疗、预防或控制通过调节提前翻译终止或无义介导的 mRNA降解而减轻的眼病,包括对患有通过调节提前翻译终止或无义介导的mRNA降解而减轻的眼病的患者给药有效量的本文提供的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的药物组合物或有效量的本文提供的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的盐的药物组合物。
在一个实施方式中,包含包埋在可注射PLA/PGA微球中的化合物1的眼用递药系统被用于在眼组织中储存释放(depot release)化合物1用于出生后治疗、预防或控制通过调节提前翻译终止或无义介导的mRNA降解而减轻的眼病,包括对患有通过调节提前翻译终止或无义介导的mRNA降解而减轻的眼病的患者给药有效量的本文提供的 3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的药物组合物或有效量的本文提供的3-[5-(2- 氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的盐的药物组合物。
在一个实施方式中,包含在缓慢侵蚀的可生物降解的膜中的化合物1以局部或通过植入递送缓慢释放的化合物1的眼用递药系统被用于出生后治疗、预防或控制通过调节提前翻译终止或无义介导的mRNA降解而减轻的眼病,包括对患有通过调节提前翻译终止或无义介导的mRNA降解而减轻的眼病的患者给药有效量的本文提供的3-[5-(2-氟 -苯基)-[1,2,4]噁二唑-3-基]苯甲酸的药物组合物或有效量的本文提供的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的盐的药物组合物。
本文所述用于出生后治疗、预防或控制通过调节提前翻译终止或无义介导的mRNA降解而减轻的眼病的眼用溶液,悬浮液或软膏可以含有非毒性辅助物质,例如在使用中无害的防腐剂组分,例如,苯扎氯铵,EDTA二钠,聚季铵盐-1,聚六亚甲基双胍,甲基和丙基对羟基苯甲酸酯,苄基溴化十二烷基酯,苄醇或苯乙醇;缓冲成分如氯化钠,硼酸钠,乙酸钠,柠檬酸钠,硼酸,磷酸二氢钠,磷酸二氢钠或葡萄糖酸盐缓冲液;和其它常规成分,例如脱水山梨糖醇单月桂酸酯,三乙醇胺,聚氧乙烯失水山梨醇单棕榈酸酯,乙二胺四乙酸等。
本文所述的用于出生后治疗、预防或控制通过调节提前翻译终止或无义介导的mRNA降解而减轻的眼病的眼用溶液,悬浮液或软膏可以根据需要经常施用,以维持眼睛中可接受水平的化合物1。对哺乳动物眼睛的施用可以是每天约一次,两次或三次。
在某些实施方式中,化合物1可以与纯化水组合并使用缓冲剂调节溶解度,生理pH和等渗性。维持或调节pH的缓冲剂的实例包括但不限于乙酸盐缓冲液,柠檬酸盐缓冲液,磷酸盐缓冲液和硼酸盐缓冲液。维持或调节张力的试剂的实例包括但不限于氯化钠,硼酸,甘露醇,山梨醇,海藻糖,甘油等。在一个或多个实施方式中,张度剂的浓度范围可以是约0.01%至约10.0%w/v,约0.01%至约5.0%w/v,约0.01%至约2.0%w/v或约0.01%至约1.0%w/v。在某些实施方式中,张度剂的浓度范围可以是约0.1%至约5.0% w/v,约0.1%至约2.0%w/v或约0.1%至约1.0%w/v。
用于眼科使用的某些制剂可以任选地等分成多个离散的无菌一次性盒,每个盒适合于单位剂量给药,或单个药盒用于单位给药。这样的单个一次性盒可以是例如圆锥形或圆柱体的特定体积分配器,其具有容器,容器具有沿纵向轴线的径向方向可挤压的侧壁,以便在容器的一端分配容器内容物。这种一次性容器目前用于每单位剂量分配0.3至 0.4mL的滴眼剂,并且理想地适用于递送滴眼液。
眼用溶液也可以包装成多剂量形式,例如作为具有滴眼器的塑料瓶。在这种制剂中,任选地加入防腐剂以防止打开容器后的微生物污染。合适的防腐剂包括但不限于:苯扎氯铵,EDTA二钠,聚季铵盐-1,聚六亚甲基双胍,氯丁醇,对羟基苯甲酸甲酯,对羟基苯甲酸丙酯,苯乙醇,山梨酸或本领域技术人员已知的其它试剂,其全部预期用于本发明中。在某些实施方式中,防腐剂选自苯扎氯铵,EDTA二钠,聚季铵盐-1或聚六亚甲基双胍。含防腐剂的制剂可包含约0.001至约1.0%,约0.05至约0.75%,约0.05至约0.5%,约0.05至约0.25%或约0.01至约0.25%重量/体积的防腐剂。
在某些实施方式中,可以将聚合物加入到眼用制剂中,以增加载体的粘度,从而延长溶液与角膜的接触并提高生物利用度。在某些实施方式中,这样的聚合物选自纤维素衍生物(例如甲基纤维素,羟乙基纤维素,羟丙基纤维素或羧甲基纤维素),葡聚糖70,明胶,多元醇,甘油,聚乙二醇300,聚乙二醇400,聚山梨醇酯80,丙烯甘油,聚乙烯醇和聚维酮,或其组合。
在某些实施方式中,本文公开的眼用剂型可以进一步包含稳定剂/助溶剂,例如环糊精。在某些实施方式中,环糊精选自α-环糊精,β-环糊精,γ-环糊精,羟丙基-β-环糊精,羟丙基-γ-环糊精,二甲基-β-环糊精和二甲基-γ-环糊精。
在某些实施方式中,本文公开的化合物例如化合物1可以在持续释放眼用溶液制剂中施用。在具体实施方式中,持续释放眼用溶液制剂还包含“插入物”,其中插入物具有用于稳定固定到身体治疗目标区域的生物粘附性质;或具有用于装载治疗剂以在一段时间内释放的离子交换或渗透性的性质;或者具有在递送治疗剂的有效剂量后用于非侵入性移除的生物降解性质。
可以使用本领域技术人员已知的用于使细胞,器官或组织与化合物接触的任何方法。合适的方法包括体外,离体或体内方法。体内方法通常包括将化合物1给予哺乳动物,优选人。当在体内用于治疗时,以有效的量(即,具有所需治疗效果的量)向受试者施用化合物1。剂量和给药方案将取决于受试者的眼科病症的程度和化合物1的特征,例如受试者的治疗指数和受试者的临床病史。
可以在临床前试验和临床试验期间通过医生和临床医师熟悉的方法测定化合物1的有效量。可用于本发明的方法中,优选药物组合物中的有效量的化合物1可以通过用于施用药物化合物的许多公知方法中的任何一种施用于有此需要的哺乳动物。在一些实施方式中,化合物1全身施用。在一些实施方式中,化合物1局部给药。在一些实施方式中,化合物1通过皮上(epicutaneously),经口,经鼻,肠胃外(静脉内,肌内,腹膜内或皮下),局部,直肠,阴道内,皮内,经皮,通过吸入,动脉内,脑内,骨间,鞘内,膀胱内,离子电渗,眼睛等进行给药。给药包括自我给药和由另一人给药。
对于眼科应用,化合物1以治疗有效量递送至选择的眼睛部分,包括后房,锯缘,睫状肌,睫状带,Schlemm管,瞳孔,前房,角膜,虹膜,皮质,晶状体核,睫状突,结膜,下斜肌,下直肌,内直肌,视网膜动脉和静脉,视神经乳头,硬膜,视网膜中央动脉,视网膜中央静脉,视神经,黄斑,中央凹,巩膜,脉络膜,上直肌和视网膜。
在某些实施方式中,根据每个受试者的需要和待治疗的疾病的严重性,施用的频率可以变化很大,这样的施用可以是每周约一次至每天约十次,例如每周约三次至每天约三次,或每天一次或两次。
5.4.2.口服剂型和产前给药
在某些实施方式中,本文提供的药物组合物被配制用于通过口服给予天然母亲或替代物的产前递送。在某些实施方式中,本文提供的用于口服给药的药物组合物以用于口服给药的固体,半固体或液体剂型提供。如本文所用,口服给药还包括颊,舌和舌下给药。合适的口服剂型包括但不限于片剂,舌下或颊膜(即速溶),咀嚼片,胶囊,丸剂,条,锭剂,锭剂,锭剂,扁囊剂,丸剂,药用口香糖,散装粉剂,泡腾或非泡腾粉末或颗粒,口服雾剂,溶液,乳剂,混悬剂,糯米纸囊剂,洒剂,酏剂和糖浆剂。除了活性成分,药物组合物可以含有一种或多种药学上可接受的载体或赋形剂,包括但不限于粘合剂,填充剂,稀释剂,崩解剂,润湿剂,表面活性剂,润滑剂,助流剂,pH调节剂,着色剂,染料迁移抑制剂,甜味剂,调味剂,乳化剂,悬浮和分散剂,防腐剂,溶剂,非水液体,有机酸和二氧化碳源。
粘合剂或成粒剂赋予片剂粘结性以确保片剂在压缩后保持完整。合适的粘合剂或成粒剂包括但不限于淀粉,例如玉米淀粉,马铃薯淀粉和预胶化淀粉(例如,STARCH 1500);明胶;糖,例如蔗糖,葡萄糖,右旋糖,糖蜜和乳糖;天然和合成树胶,例如阿拉伯树胶,海藻酸,藻酸盐,爱尔兰藓提取物,潘瓦尔树胶,印度树胶,异麦芽糖壳胶,羧甲基纤维素,甲基纤维素,聚乙烯吡咯烷酮(PVP),硅酸镁铝,落叶松阿拉伯半乳聚糖,粉状黄蓍胶和瓜尔胶;纤维素如乙基纤维素,乙酸纤维素,羧甲基纤维素 (CMC),羧甲基纤维素钙,羧甲基纤维素钠,甲基纤维素,羟乙基纤维素(HEC),羟丙基纤维素(HPC),羟丙基甲基纤维素微晶纤维素,例如AVICEL-PH-101, AVICEL-PH-103,AVICEL RC-581,AVICEL-PH-105(FMC Corp.,MarcusHook,PA);及其混合物。合适的填充剂包括但不限于滑石,碳酸钙,微晶纤维素,粉状纤维素,葡萄糖结合剂,高岭土,甘露醇,硅酸,山梨醇,淀粉,预胶化淀粉及其混合物。
合适的稀释剂包括但不限于磷酸二钙,硫酸钙,乳糖,山梨醇,蔗糖,肌醇,纤维素,高岭土,甘露醇,氯化钠,干淀粉和糖粉。某些稀释剂,例如甘露醇,乳糖,山梨醇,蔗糖和肌醇,当以足够的量存在时,可赋予一些压制片剂以允许通过咀嚼在口中崩解的性质。这种压缩片剂可以用作咀嚼片。
合适的崩解剂包括但不限于琼脂;膨润土;纤维素,例如甲基纤维素和羧甲基纤维素;木制品;天然海绵;阳离子交换树脂;藻酸;树胶,例如瓜尔胶和硅酸镁铝HV;柑橘浆;交联纤维素,例如交联羧甲基纤维素;交联聚合物,例如交聚维酮;交联淀粉;碳酸钙;微晶纤维素,例如淀粉羟乙酸钠;波拉克林钾;淀粉,例如玉米淀粉,马铃薯淀粉,木薯淀粉和预胶化淀粉;粘土;aligns;及其混合物。本文提供的药物组合物可以含有约0.5至约15%或约1至约5%重量的崩解剂。
合适的润滑剂包括但不限于硬脂酸钙;硬脂酸镁;矿物油;轻矿物油;甘油;山梨醇;甘露醇;二醇,例如山嵛酸甘油酯和聚乙二醇(PEG);硬脂酸;十二烷基硫酸钠;滑石;氢化植物油,包括花生油,棉籽油,向日葵油,芝麻油,橄榄油,玉米油和大豆油;硬脂酸锌;油酸乙酯;月桂酸乙酯;琼脂;淀粉;番茄红素;二氧化硅或硅胶,例如
合适的助流剂包括但不限于胶体二氧化硅,CAB-O-
合适的甜味剂包括但不限于蔗糖,乳糖,甘露醇,糖浆,甘油和人造甜味剂,例如糖精和阿斯巴甜。合适的乳化剂包括但不限于明胶,阿拉伯胶,黄蓍胶,膨润土和表面活性剂,例如聚氧乙烯失水山梨醇单油酸酯(
应当理解,许多载体和赋形剂可以起到多种功能,甚至在相同的制剂中。
本文提供的用于口服给药的药物组合物可以作为压制片剂,粉剂片剂,可咀嚼锭剂,快速溶解片剂,多重压制片剂或肠溶衣片剂,糖包衣或薄膜包衣片剂提供。肠溶包衣片剂是用抗胃酸作用但在肠中溶解或崩解、从而保护活性成分免受胃酸性环境的物质包衣的压制片剂。肠溶衣包括但不限于脂肪酸,脂肪,水杨酸苯酯,蜡,虫胶,氨化虫胶和乙酸邻苯二甲酸纤维素。糖包衣片剂是被糖衣包裹的压制片剂,其可有益于覆盖令人不快的味道或气味以及保护片剂免于氧化。薄膜包衣片剂是用水溶性材料的薄层或薄膜覆盖的压制片剂。膜包衣包括但不限于羟乙基纤维素,羧甲基纤维素钠,聚乙二醇4000 和乙酸邻苯二甲酸纤维素。膜包衣赋予与糖包衣相同的一般特性。多压缩片剂是通过多于一个压缩循环制备的压制片剂,包括分层片剂和压制包衣或干包衣片剂。
片剂剂型可以由粉末,结晶或颗粒形态的活性成分单独或与本文所述的一种或多种载体或赋形剂组合制备,包括粘合剂,崩解剂,控释聚合物,润滑剂,稀释剂,和/或着色剂。调味剂和甜味剂特别适用于形成咀嚼片和锭剂。
本文提供的用于口服给药的药物组合物可以作为软或硬胶囊提供,其可以由明胶,甲基纤维素,淀粉或藻酸钙制成。硬明胶胶囊,也称为干填充胶囊(DFC),由两部分组成,一部分在另一部分上滑动,从而完全包封活性成分。软弹性胶囊(SEC)是软的球形壳,例如明胶壳,其通过添加甘油,山梨醇或类似的多元醇而增塑。软明胶壳可以含有防腐剂以防止微生物的生长。合适的防腐剂是本文所述的那些,包括对羟基苯甲酸甲酯和丙酯和山梨酸。本文提供的液体,半固体和固体剂型可以包封在胶囊中。合适的液体和半固体剂型包括在碳酸丙烯酯,植物油或甘油三酯中的溶液和悬浮液。胶囊还可以如本领域技术人员已知的那样进行包衣,以改变或维持活性成分的溶解。
本文提供的用于口服给药的药物组合物可以以液体和半固体剂型提供,包括乳剂,溶液剂,混悬剂,酏剂和糖浆剂。乳液是两相体系,其中一种液体以小球的形态分散在另一种液体中,其可以是水包油或油包水。乳剂可以包括药学上可接受的非水性液体或溶剂,乳化剂和防腐剂。混悬剂可以包括药学上可接受的悬浮剂和防腐剂。水性醇溶液可包括药学上可接受的缩醛,例如低级烷基醛的二(低级烷基)缩醛,例如乙醛二乙基缩醛;和具有一个或多个羟基的水混溶性溶剂,例如丙二醇和乙醇。酏剂是澄清、甜味和水醇溶液。糖浆是糖的浓缩水溶液,例如蔗糖,并且还可以含有防腐剂。对于液体剂型,例如,聚乙二醇中的溶液可以用足够量的药学上可接受的液体载体例如水稀释,以方便地测量给药。
其它有用的液体和半固体剂型包括但不限于含有本文提供的活性成分的那些,和二烷基化的单或聚亚烷基二醇,包括1,2-二甲氧基甲烷,二甘醇二甲醚,三甘醇二甲醚,四甘醇二甲醚,聚乙二醇-350-二甲醚,聚乙二醇-550-二甲醚,聚乙二醇-750-二甲醚,其中350、550和750是指聚乙二醇的近似平均分子量。这些制剂可以进一步包含一种或多种抗氧化剂,例如丁基化羟基甲苯(BHT),丁基化羟基苯甲醚(BHA),没食子酸丙酯,维生素E,氢醌,羟基香豆素,乙醇胺,卵磷脂,脑磷脂,抗坏血酸,苹果酸,山梨醇,磷酸,亚硫酸氢盐,焦亚硫酸钠,硫代二丙酸及其酯,和二硫代氨基甲酸盐。
本文提供的用于口服给药的药物组合物还可以以脂质体,胶束,微球或纳米系统的形态提供。
本文提供的用于口服给药的药物组合物可以以非泡腾或泡腾,颗粒和粉末的形态提供,以重构成液体剂型。用于非泡腾颗粒或粉末的药学上可接受的载体和赋形剂可包括稀释剂,甜味剂和润湿剂。用于泡腾颗粒或粉末中的药学上可接受的载体和赋形剂可包括有机酸和二氧化碳源。
在某些实施方式中,药物组合物配制为固体口服剂型。在某些实施方式中,将药物组合物配制成液体口服剂型。在某些实施方式中,单位剂型作为在药学上可接受的溶剂中的悬浮液提供,所述溶剂包括但不限于水,牛奶,碳酸饮料,果汁,苹果酱,婴儿食品或婴儿配方奶粉。
在某些实施方式中,本文提供了药物组合物,其包含3-[5-(2-氟-苯基)-[1,2,4]噁二唑 -3-基]苯甲酸的药学上可接受的盐和一种或多种额外的药学上可接受的赋形剂。在一个实施方式中,将药物组合物配制成颗粒。在另一个实施方式中,一种或多种赋形剂选自聚葡萄糖,甘露醇,泊洛沙姆,聚乙二醇,羟乙基纤维素,交联聚维酮,人工香草调味剂和硬脂酸镁。
本文还提供了包含约25%重量的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]-苯甲酸的药学上可接受的盐;约1%重量的胶体二氧化硅;和一种或多种额外的药学上可接受的赋形剂的药物组合物。在一个实施方式中,将药物组合物配制成颗粒。在另一个实施方式中,一种或多种赋形剂选自聚葡萄糖,甘露醇,泊洛沙姆,聚乙二醇,羟乙基纤维素,交聚维酮,人工香草香料和硬脂酸镁。
本文进一步提供了药物组合物包含约25%重量的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3- 基]-苯甲酸的药学上可接受的盐,约25.65%重量的聚葡萄糖,约26.4%重量的甘露醇,约3.7%重量的泊洛沙姆,约10%重量的聚乙二醇,约1.5%重量的羟乙基纤维素,约5%重量的交聚维酮,约0.75%重量的人工香草香料,约1%重量的胶体二氧化硅,和约1%重量的硬脂酸镁。在一个实施方式中,药物组合物被制成颗粒剂。
本文进一步提供了药物组合物,包含约130mg的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3- 基]-苯甲酸的药学上可接受的盐,约133.38mg的聚葡萄糖,约137.28mg的甘露醇,约19.24mg的泊洛沙姆,约52mg的聚乙二醇,约7.8mg的羟乙基纤维素,约26mg的交聚维酮,约3.9mg的人工香草香料,约5.2mg的胶体二氧化硅,和约5.2mg的硬脂酸镁。在一个实施方式中,药物组合物被制成颗粒剂。
本文进一步提供了药物组合物,包含约205mg的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3- 基]-苯甲酸的药学上可接受的盐,约210.33mg的聚葡萄糖,约216.48mg的甘露醇,约30.34mg的泊洛沙姆,约82mg的聚乙二醇,约12.3mg的羟乙基纤维素,约41mg的交聚维酮,约6.15mg的人工香草香料,约8.2mg的胶体二氧化硅,和约8.2mg的硬脂酸镁。在一个实施方式中,药物组合物被制成颗粒剂。
本文进一步提供了药物组合物,包含约330mg的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3- 基]-苯甲酸的药学上可接受的盐,约338.58mg的聚葡萄糖,约348.48mg的甘露醇,约48.84mg的泊洛沙姆,约132mg的聚乙二醇,约19.8mg的羟乙基纤维素,约66mg 的交聚维酮,约9.9mg的人工香草香料,约13.2mg的胶体二氧化硅,和约13.2mg的硬脂酸镁。在一个实施方式中,药物组合物被制成颗粒剂。
本文进一步提供了药物组合物,包含约405mg的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3- 基]-苯甲酸的药学上可接受的盐,约415.53mg的聚葡萄糖,约427.68mg的甘露醇,约59.94mg的泊洛沙姆,约162mg的聚乙二醇,约24.3mg的羟乙基纤维素,约81mg 的交聚维酮,约12.15mg的人工香草香料,约16.2mg的胶体二氧化硅,和约16.2mg 的硬脂酸镁。在一个实施方式中,药物组合物被制成颗粒剂。
本文进一步提供了药物组合物,包含约505mg的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3- 基]-苯甲酸的药学上可接受的盐,约518.13mg的聚葡萄糖,约4533.28mg的甘露醇,约74.74mg的泊洛沙姆,约202mg的聚乙二醇,约30.3mg的羟乙基纤维素,约101mg 的交聚维酮,约15.15mg的人工香草香料,约20.2mg的胶体二氧化硅,和约20.2mg 的硬脂酸镁。在一个实施方式中,药物组合物被制成颗粒剂。
在某些实施方式中,单位剂型包含约35至约1,400,约125至约1,000,约250至约1,000或约500至约1,000mg的化合物1。
在某些实施方式中,单位剂型包含约35,约50,约70,约100,约125,约140,约175,约200,约250,约280,约350,约500,约560,约700,约750,约1,000 或约1,400mg的化合物1。
在某些实施方式中,将本文提供的药物组合物配制成颗粒。在某些实施方式中,本文提供的药物组合物包装在小包中。在某些实施方式中,本文提供的药物组合物包装在热密封的层压铝包装中。在某些实施方式中,本文提供的药物组合物包装在儿童安全包中。在某些实施方式中,本文提供的药物组合物包装在小包中,其包含聚对苯二甲酸乙二醇酯,聚乙烯,铝箔,粘合剂和密封膜的层。在某些实施方式中,本文提供的药物组合物包装在瓶中,包括但不限于高密度聚乙烯(HDPE)瓶。
在某些实施方式中,将本文提供的药物组合物配制为用于重构的颗粒。在某些实施方式中,将本文提供的药物组合物配制为用于重构为口服悬浮液的颗粒。
在某些实施方式中,本文提供的药物组合物在与药学上可接受的溶剂一起给药之前重构,所述药学上可接受的溶剂包括但不限于水,牛奶,碳酸饮料,汁,果汁,婴儿食品或婴儿配方奶粉;或半固体流体,包括但不限于半固体乳制品,酸奶,布丁,苹果酱,大豆,水果和谷物基产品。
在某些实施方式中,本文提供的药物组合物在用水给药之前重构。在一个实施方式中,通过在含有化合物1的瓶中直接加入约10mL水以在悬浮液的总体积中达到约25mg /mL的浓度来进行250mg单位剂型化合物1的重构。
在某些实施方式中,药学上可接受的盐是镁盐,钾盐,钠盐,氨丁三醇盐,L-赖氨酸盐,L-精氨酸盐,N-甲基葡糖胺盐或L-组氨酸盐。
5.4.3.肠胃外剂型和给药
本文提供的包含化合物1的药物组合物可以通过注射,输注或植入肠胃外施用,用于局部或全身施用。本文所用的肠胃外施用包括静脉内,动脉内,腹膜内,鞘内,心室内,尿道内,胸骨内,颅内,肌内,滑膜内,膀胱内和皮下施用。
本文提供的用于肠胃外给药的药物组合物可以配制成适于肠胃外给药的任何剂型,包括溶液,悬浮液,乳剂,胶束,脂质体,微球,纳米系统和适合于在液体中的溶液或悬浮液的固体形态。这样的剂型可以根据药学科学领域的技术人员已知的常规方法制备(参见Remington:The Science and Practice of Pharmacy,如上)。
用于肠胃外给药的药物组合物可以包括一种或多种药学上可接受的载体和赋形剂,包括但不限于水性载体,水混溶性载体,非水性载体,抗微生物剂或防止微生物生长的防腐剂,稳定剂,溶解度增强剂,等渗剂,缓冲剂,抗氧化剂,局部麻醉剂,悬浮和分散剂,湿润剂或乳化剂,络合剂,掩蔽剂或螯合剂,冷冻保护剂,冻干保护剂,增稠剂, pH调节剂和惰性气体。
合适的水性载体包括但不限于水,盐水,生理盐水或磷酸盐缓冲盐水(PBS),氯化钠注射液,林格注射液,等渗葡萄糖注射液,无菌水注射液,葡萄糖和乳酸林格注射液。合适的非水性载体包括但不限于植物来源的固定油,蓖麻油,玉米油,棉籽油,橄榄油,花生油,薄荷油,红花油,芝麻油,大豆油,氢化植物油,氢化大豆油和椰子油的中链甘油三酯,和棕榈种子油。合适的水混溶性载体包括但不限于乙醇,1,3-丁二醇,液体聚乙二醇(例如聚乙二醇300和聚乙二醇400),丙二醇,甘油,N-甲基-2- 吡咯烷酮,N,N-二甲基乙酰胺和二甲基亚砜。
合适的抗微生物剂或防腐剂包括但不限于苯酚,甲酚,水合物,苄醇,氯丁醇,对羟基苯甲酸甲酯和丙酯,苯扎氯铵(例如苄索氯铵),EDTA二钠,聚季铵盐-1,聚六亚甲基双胍,对羟基苯甲酸甲酯和丙酯,和山梨酸。合适的等渗剂包括但不限于氯化钠,硼酸,甘露醇,山梨醇,海藻糖,甘油和葡萄糖。合适的缓冲剂包括但不限于硼酸盐,磷酸盐和柠檬酸盐。合适的抗氧化剂是本文所述的那些,包括亚硫酸氢盐和焦亚硫酸钠。合适的悬浮剂和分散剂是本文所述的那些,包括羧甲基纤维素钠,羟丙基甲基纤维素和聚乙烯吡咯烷酮。合适的乳化剂是本文所述的那些,包括聚氧乙烯失水山梨醇单月桂酸酯,聚氧乙烯失水山梨醇单油酸酯80和油酸三乙醇胺。合适的掩蔽剂或螯合剂包括但不限于EDTA。合适的pH调节剂包括但不限于氢氧化钠,盐酸,柠檬酸和乳酸。合适的络合剂包括但不限于DEAE-C,DEAE-D或环糊精,包括α-环糊精,β-环糊精,羟丙基-β-环糊精,磺丁基醚-b-环糊精和磺丁基醚7-b-环糊精(
当将本文提供的药物组合物配制用于多剂量施用时,多剂量胃肠外制剂必须含有抑菌或抑真菌浓度的抗微生物剂。所有胃肠外制剂必须是无菌的,如本领域已知和实践的。
在一个实施方式中,用于肠胃外施用的药物组合物作为即用型无菌溶液提供。在另一个实施方式中,药物组合物作为无菌干燥可溶性产品提供,包括冻干粉剂和皮下片剂,在使用前用载体重构。在另一个实施方式中,药物组合物作为即用型无菌悬浮液提供。在另一个实施方式中,药物组合物作为无菌干燥不溶性产物提供,在使用前用载体重构。在另一个实施方式中,药物组合物作为即用型无菌乳剂提供。
本文提供的用于肠胃外给药的药物组合物可以配制为立即释放或调节释放剂型,包括延迟释放,持续释放,脉冲释放,控制释放,靶向释放和程序释放形态。
本文提供的用于肠胃外给药的药物组合物可以配制为悬浮液,固体,半固体或触变液体,用于作为植入的储库给药。在一个实施方式中,本文提供的药物组合物分散在固体内基质中,其被不溶于体液但允许药物组合物中的活性成分扩散通过的外部聚合物膜包围。
合适的内基质包括但不限于聚甲基丙烯酸甲酯,聚甲基丙烯酸丁酯,增塑或未增塑聚氯乙烯,增塑尼龙,增塑聚对苯二甲酸乙二醇酯,天然橡胶,聚异戊二烯,聚异丁烯,聚丁二烯,聚乙烯,乙烯-乙酸乙烯酯共聚物,橡胶,聚二甲基硅氧烷,硅氧烷碳酸酯共聚物,亲水性聚合物如丙烯酸和甲基丙烯酸的酯的水凝胶,胶原,交联的聚乙烯醇和交联的部分水解的聚乙酸乙烯酯。
合适的外聚合物膜包括但不限于聚乙烯,聚丙烯,乙烯/丙烯共聚物,乙烯/丙烯酸乙酯共聚物,乙烯/乙酸乙烯酯共聚物,硅橡胶,聚二甲基硅氧烷,氯丁橡胶,氯化聚乙烯,聚氯乙烯,氯乙烯和乙酸乙烯酯共聚物,亚乙烯氯,乙烯和丙烯,离聚物聚对苯二甲酸乙二醇酯,丁基橡胶表氯醇橡胶,乙烯/乙烯醇共聚物,乙烯/乙酸乙烯酯/乙烯醇三元共聚物和乙烯/乙烯氧基乙醇共聚物。
5.4.4.粒径
本文提供了具有约2μm至约12μm的容重平均粒径D(4,3)的化合物1形态。本文还提供了具有约1μm至约3μm的表面重平均粒径D(3,2)的化合物1形态。本文进一步提供了具有D
5.4.5.试剂盒
本文提供的药物组合物可以使用本领域技术人员公知的包装材料作为制品提供。药物包装材料的实例包括但不限于泡罩包装,瓶,管,吸入器,泵,袋,小瓶,容器,注射器,滴眼器,以及适合于所选制剂和预期给药和治疗模式的任何包装材料。
本文提供了试剂盒,当由医师使用时其可以简化对受试者进行适当量的活性成分的给药。在某些实施方式中,本文提供的试剂盒包括本文提供的药物制剂的容器和剂型。
在某些实施方式中,试剂盒包括在包含本文所述的一种或多种其它治疗剂的容器中的包含本文提供的药物制剂的剂型的容器。
本文提供的试剂盒还可以包括用于施用活性成分的装置。这样的装置的实例包括但不限于注射器,无针注射器滴注袋,贴片,滴眼剂和吸入器。
本文提供的试剂盒可进一步包括可用于施用活性成分的药学上可接受的载体。例如,如果活性成分以必须重新配制用于胃肠外给药的固体形态提供,则试剂盒可以包含合适载体的密封容器,其中活性成分可以溶解以形成无颗粒的无菌溶液,其为适合于肠胃外给药或可以重构为用于口服给药的混悬剂。药学上可接受的载体的实例包括但不限于:水性载体,包括但不限于注射用水USP,氯化钠注射液,林格注射液,葡萄糖注射液,葡萄糖和氯化钠注射液和乳酸林格注射液;水混溶性载体,包括但不限于乙醇,聚乙二醇和聚丙二醇;和非水性载体,包括但不限于玉米油,棉籽油,花生油,芝麻油,油酸乙酯,肉豆蔻酸异丙酯和苯甲酸苄酯。
5.5.使用方法
本文提供了用于治疗、预防或控制通过调节提前翻译终止或无义介导的mRNA降解而缓解的疾病的方法,包括对患有通过调节提前翻译终止或无义介导的mRNA降解而缓解的疾病的患者给药有效量的本文提供的药物组合物或有效量的本文提供的 3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的盐。
本文进一步提供了用于治疗、预防或控制无义突变相关疾病的方法,包括对患有无义突变相关疾病的患者给药有效量的本文提供的药物组合物或有效量的本文提供的 3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的盐。
本文进一步提供了用于治疗、预防或控制提前终止密码子相关疾病的方法,包括对患有提前终止密码子相关疾病的患者给药有效量的本文提供的药物组合物或有效量的本文提供的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的盐。
在某些实施方式中,本文提供了用于治疗、预防或控制与表现出提前翻译终止和/或无义介导的mRNA降解的基因相关的任何疾病的方法。在一个实施方式中,该疾病部分归因于由提前终止密码子导致的基因的缺乏表达。可能表现出提前翻译终止和/或无义介导的mRNA降解的基因和与提前翻译终止和/或无义介导的mRNA降解相关的疾病发现于美国专利申请号60/390,747,其公开内容在此全文引入作为参考。
在某些实施方式中,本文提供了用于产前治疗、预防或控制有倾向或疑似在基因中存在无义突变相关疾病的胚胎或胎儿基因中无义突变相关疾病的方法,例如那些本文描述的。在一个实施方式中,对妊娠妇女给药本文提供的药物组合物,活性成分通过她穿过妊娠妇女的胎盘到达胚胎或胎儿。在某些实施方式中,本文提供的药物组合物通过口服或肠胃外对妊娠妇女给药。
与提前翻译终止和/或无义介导的mRNA降解相关的眼部疾病或病症或通过其抑制而改善的眼部疾病或病症包括但不限于:无虹膜,无脉胳膜,肾缺损综合征,莱伯先天性黑蒙,色素性视网膜炎,巴比二氏综合征或Usher综合征。
本文进一步提供了用于在有需要的受试者(例如人)内产生有效量的由包含无义突变的核酸序列编码的功能性通读蛋白的方法,该方法包括对受试者给药有效量的本文提供的药物组合物或有效量的本文提供的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的盐。在一个特别的实施方式中,核酸序列是与眼病相关的基因。在某些实施方式中,眼病是无虹膜,无脉胳膜,肾缺损综合症,莱伯先天性黑朦,色素性视网膜炎,巴比二氏综合征,青光眼,小窝发育不全,白内障,Usher综合征,中枢听觉处理困难,脉络膜视网膜变性,先天性晶状体混浊,升高的眼内压,渗出性血管性视网膜病变,青光眼,虹膜发育不全,角膜病(角膜变性),视神经发育不全,视网膜脱离,次级斜视或晶状体血管膜。在另一具体实施方式中,眼病是2A型Usher综合征。在一些实施方式中,核酸序列是PAX6基因,REP1基因,CHD7基因,PAX2基因或BBS2基因。功能性通读蛋白的生产可通过体外分析和/或在动物模型中进行评价。例如,抑制提前翻译终止和 /或无义介导的mRNA降解的化合物可以使用本领域技术人员已知的技术进行鉴定。参见,例如,美国公开号2005/0233327,2005年10月20日公开,名称为“Methods for Identifying Small Molecules that Modulate PrematureTranslation Termination and Nonsense Mediated mRNA Decay”;美国专利号6,458,538,名称为“Methods of Assaying for Compounds that Inhibit PrematureTranslation Termination and Nonsense Mediated RNA Decay”;美国公开号2003/0008317,2003年1月9日公开,名称为“Methods ofAssaying for Compounds that InhibitPremature Translation Termination and Nonsense Mediated RNA Decay”;和国际申请公开号WO 2004/010106,名称为“Methods of Assaying for Compounds that InhibitPremature Translation Termination and Nonsense Mediated RNA Decay”,其各自在此全文引入作为参考。特别的,可以使用基于细胞的和无细胞的分析来鉴定抑制提前翻译终止和/或无义介导的mRNA降解的化合物。
在某些实施方式中,由本文提供的方法治疗、预防或控制的疾病包括与基因中的无义突变相关的眼病,所述方法包括对有需要的受试者给药有效量的本文提供的药物组合物或有效量的本文提供的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的盐。在一个特别的实施方式中,与基因中的无义突变相关的眼部病症是无虹膜,无脉络膜,肾缺损综合症,莱伯先天性黑朦,色素性视网膜炎,巴比二氏综合征,青光眼,小窝发育不全,白内障,Usher综合征,中枢听觉处理困难,脉络膜视网膜变性,先天性晶状体混浊,升高的眼内压,渗出性血管性视网膜病变,青光眼,虹膜发育不全,角膜病(角膜变性),视神经发育不全,视网膜脱离,次级斜视或晶状体血管膜。在另一具体实施方式中,与基因中的无义突变相关的眼部病症是2A型Usher综合征。
在一个特别的实施方式中,按照该方法预防和/或治疗的眼病是无义突变相关眼部病症。可以按照该方法预防和/或治疗的眼病的例子包括无虹膜,无脉络膜,肾缺损综合症,莱伯先天性黑朦,色素性视网膜炎,巴比二氏综合征,青光眼,小窝发育不全,白内障,Usher综合征,中枢听觉处理困难,脉络膜视网膜变性,先天性晶状体混浊,升高的眼内压,渗出性血管性视网膜病变,青光眼,虹膜发育不全,角膜病(角膜变性),视神经发育不全,视网膜脱离,次级斜视和晶状体血管膜。在一个特别的实施方式中,所述 Usher综合征是2A型Usher综合征。
在某些实施方式中,通过本文提供的方法治疗,预防或控制的疾病是无虹膜。在某些实施方式中,本文所述的药物组合物或活性剂与另一种治疗无虹膜的疗法组合使用。在具体实施方式中,除了本文所述的药物组合物或活性剂之外使用的疗法是缩瞳剂,β- 阻断剂,拟交感神经药,碳酸酐酶抑制剂或前列腺素类似物。在具体实施方式中,用本文所述的药物组合物或活性剂治疗无虹膜导致以下一种,两种或更多种效果:(i)减少或改善无虹膜的严重性;(ii)延迟无虹膜发作;(iii)抑制无虹膜的进展;(iv)减少受试者的住院治疗;(v)减少受试者的住院时间;(vi)改善受试者的生活质量;(vii) 减少与无虹膜相关的症状的数量;(viii)降低或改善与无虹膜相关的症状的严重性; (ix)减少与无虹膜相关的症状的持续时间;(x)防止与无虹膜相关的症状的复发;(xi) 抑制无虹膜症状的发展或发病;和/或(xii)抑制与无虹膜症相关的症状的进展。无虹膜的症状包括白化病,晶状体异位,自发性晶状体脱位,青少年环,圆锥形角膜;白内障,青光眼,眼球震颤,斜视,视神经发育不全,失明,不透明眼核,视力障碍,以及虹膜不存在或部分不存在。用于测定治疗与无义突变相关的无虹膜的药剂的有效性的动物模型描述于Hill,R.等人,1991,“Mouse Small eyeresults from mutations in a paired-like homeobox-containing gene,”Nature 354(6354):522-525和Gregory-Evans,C.等人,Postnata manipulation of Pax6 dosagereverses congenital tissue malformation defects,”J.Clin.Invest. Doi:10.1172/JCI70462,二者在此全文引入作为参考。
在一个实施方式中,所述无虹膜是家族无虹膜。在另一个实施方式中,所述无虹膜是偶发性无虹膜。
在一个实施方式中,所述无虹膜是与WAGR(Wilms肿瘤-无虹膜-生殖器异常-阻滞)综合征或Gillespie综合征相关的症状。
在某些实施方式中,通过本文提供的方法治疗,预防或控制的疾病是无脉络膜。在某些实施方式中,本文所述的药物组合物或活性剂与另一种治疗无脉络膜的疗法组合使用。在具体实施方式中,用本文所述的药物组合物或活性剂治疗无脉络膜导致以下一种,两种或更多种效果:(i)减少或改善无脉络膜的严重性;(ii)延迟无脉络膜发作;(iii) 抑制无脉络膜的进展;(iv)减少受试者的住院治疗;(v)减少受试者的住院时间;(vi) 改善受试者的生活质量;(vii)减少与无脉络膜相关的症状的数量;(viii)降低或改善与无脉络膜相关的症状的严重性;(ix)减少与无脉络膜相关的症状的持续时间;(x) 防止与无脉络膜相关的症状的复发;(xi)抑制无脉络膜症状的发展或发病;和/或(xii) 抑制与无脉络膜症相关的症状的进展。无脉胳膜的症状包括夜盲症,周边视觉丧失,和中心视觉丧失。
在某些实施方式中,通过本文提供的方法治疗,预防或控制的疾病是肾缺损综合症。在某些实施方式中,本文所述的药物组合物或活性剂与另一种治疗肾缺损综合症的疗法组合使用。在具体实施方式中,用本文所述的药物组合物或活性剂治疗肾缺损综合症导致以下一种,两种或更多种效果:(i)减少或改善肾缺损综合症的严重性;(ii)延迟肾缺损综合症发作;(iii)抑制肾缺损综合症的进展;(iv)减少受试者的住院治疗;(v)减少受试者的住院时间;(vi)改善受试者的生活质量;(vii)减少与肾缺损综合症相关的症状的数量;(viii)降低或改善与肾缺损综合症相关的症状的严重性;(ix) 减少与肾缺损综合症相关的症状的持续时间;(x)防止与肾缺损综合症相关的症状的复发;(xi)抑制肾缺损综合症症状的发展或发病;和/或(xii)抑制与肾缺损综合症症相关的症状的进展。肾缺损综合症的症状包括视神经发育不良,巩膜葡萄肿,视网膜变薄,近视和视神经囊肿。
在某些实施方式中,通过本文提供的方法治疗,预防或控制的疾病是色素性视网膜炎。在某些实施方式中,本文所述的药物组合物或活性剂与另一种治疗色素性视网膜炎的疗法组合使用。在具体实施方式中,用本文所述的药物组合物或活性剂治疗色素性视网膜炎导致以下一种,两种或更多种效果:(i)减少或改善色素性视网膜炎的严重性; (ii)延迟色素性视网膜炎发作;(iii)抑制色素性视网膜炎的进展;(iv)改善受试者的生活质量;(v)减少与色素性视网膜炎相关的症状的数量;(vi)降低或改善与色素性视网膜炎相关的症状的严重性;(vii)减少与色素性视网膜炎相关的症状的持续时间; (viii)防止与色素性视网膜炎相关的症状的复发;(ix)抑制色素性视网膜炎症状的发展或发病;和/或(x)抑制与色素性视网膜炎症相关的症状的进展。色素性视网膜炎的症状包括杆退化,夜视丧失,隧道视觉和失明。
在某些实施方式中,通过本文提供的方法治疗,预防或控制的疾病是巴比二氏综合征。在某些实施方式中,本文所述的药物组合物或活性剂与另一种治疗巴比二氏综合征的疗法组合使用。在具体实施方式中,用本文所述的药物组合物或活性剂治疗巴比二氏综合征导致以下一种,两种或更多种效果:(i)减少或改善巴比二氏综合征的严重性; (ii)延迟巴比二氏综合征发作;(iii)抑制巴比二氏综合征的进展;(iv)改善受试者的生活质量;(v)减少与巴比二氏综合征相关的症状的数量;(vi)降低或改善与巴比二氏综合征相关的症状的严重性;(vii)减少与巴比二氏综合征相关的症状的持续时间; (viii)防止与巴比二氏综合征相关的症状的复发;(ix)抑制巴比二氏综合征症状的发展或发病;和/或(x)抑制与巴比二氏综合征症相关的症状的进展。巴比二氏综合征的症状包括视锥细胞营养不良,视力丧失和夜盲。
在某些实施方式中,通过本文提供的方法治疗,预防或控制的疾病是Usher综合征。在某些实施方式中,本文所述的药物组合物或活性剂与另一种治疗Usher综合征的疗法组合使用。在具体实施方式中,用本文所述的药物组合物或活性剂治疗Usher综合征导致以下一种,两种或更多种效果:(i)减少或改善Usher综合征的严重性;(ii)延迟 Usher综合征发作;(iii)抑制Usher综合征的进展;(iv)改善受试者的生活质量;(v) 减少与Usher综合征相关的症状的数量;(vi)降低或改善与Usher综合征相关的症状的严重性;(vii)减少与Usher综合征相关的症状的持续时间;(viii)防止与Usher 综合征相关的症状的复发;(ix)抑制Usher综合征症状的发展或发病;和/或(x)抑制与Usher综合征症相关的症状的进展。Usher综合征的症状包括夜视减弱。在一个特别的实施方式中,Usher综合征是2A型Usher综合征。
在某些实施方式中,本文提供的方法包括在产前全身性给药本文提供的药物组合物或本文提供的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的盐,所述给药在24小时内按照下式的三个剂量进行:1X,1X,2X,其中X是特定的活性剂初始剂量(例如,4mg/kg,7mg/kg,10mg/kg或20mg/kg)。在一个特别的实施方式中,本文提供的药物组合物或本文提供的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的盐在每个24小时周期连续给药 3次,剂量为活性剂约2mg/kg至约6mg/kg(例如,4mg/kg),约2mg/kg至约6mg/kg(例如,4mg/kg)和约6mg/kg至约10mg/kg(例如,8mg/kg),给药持续数天、数周、数月或数年。在另一具体实施方式中,本文提供的药物组合物或本文提供的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的盐在每个24小时周期连续给药3次,剂量为活性剂约5 mg/kg至约9mg/kg(例如,7mg/kg),约5mg/kg至约9mg/kg(例如,7mg/kg)和12mg/kg 至约16mg/kg(例如,14mg/kg),给药持续数周、数月或数年。在一个特别的实施方式中,本文提供的药物组合物或本文提供的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的盐在每个24小时周期连续给药3次,剂量为约8mg/kg至约12mg/kg(例如,10mg/kg),约8mg/kg至约12mg/kg(例如,10mg/kg)和约18mg/kg至约22mg/kg(例如,20mg/kg),给药持续数天、数周、数月或数年。在一个特别的实施方式中,本文提供的药物组合物或本文提供的3-[5-(2-氟-苯基)-[1,2,4]噁二唑-3-基]苯甲酸的盐在每个24小时周期连续给药3次,剂量为约18mg/kg至约22mg/kg(例如,20mg/kg),约18mg/kg至约22mg/kg (例如,20mg/kg)和约38mg/kg至约42mg/kg(例如,40mg/kg),给药持续数天、数周、数月或数年。在每个给药活性剂的24小时周期内,优选以大约6,6,和12小时的间隔给药3次(例如,早饭后~7:00AM,午饭后~1:00PM,和晚饭后~7:00PM)。连续产前治疗优选用于治疗、预防或控制眼病。
在某些实施方式中,本文提供的方法包含包括维持患者中化合物1的血浆浓度大于:约0.1μg/mL,约0.5μg/mL,约2μg/mL,约5μg/mL,约10μg/mL,约20μg/mL,约 25μg/mL,约40μg/mL,约50μg/mL,约100μg/mL,约150μg/mL,约200μg/mL,约250μg/mL或约500μg/mL至少约2,2.5,3,3.5,4,4.5,5,6,8,12或24小时或更久。化合物1在血浆中的水平可以通过例如高效液相色谱(HPLC)检测。
在另一个实施方式中,本文提供的方法包括维持患者中化合物1的血浆浓度为约0.1 μg/mL至约500μg/mL,约2μg/mL至约40μg/mL,约2μg/mL至约20μg/mL,约2μg/mL 至约10μg/mL或约10μg/mL至约20μg/mL至少约2,2.5,3,3.5,4,4.5,5,6,8, 12或24小时或更久。
应当理解,给予有需要的患者的药物组合物或活性剂的量是或可以基于所述患者的实际重量或所述患者群体的平均重量来计算(例如白人男性,白人女性,非洲裔美国男性,非洲裔美国女性,亚洲男性或亚洲女性,包括成人和儿童)。
6.实施例
下述实施例通过说明而非限制方式给出。说明书和实施例中使用下述缩写:
6.1.盐/共晶形成物
基于化合物1的溶解度,pKa和化学结构,下表1列举的盐/共晶形成物一起选择用于盐的制备。
表1:盐/共晶形成物
表1
6.2.选择的盐/共晶的表征概述
表2:选择的盐/共晶的表征(术语盐#指所指类型的第一或第二盐的形成)
表2
1)以mg/mL给出值
2)在0→85%r.h范围的wt%质量变化。
3)由PXRD估计的结晶度:+++=高,++=良好,+=低
4)几种水合物的强的迹象
6.3.蒸发实验
游离酸和各盐/共晶形成物的储液在选定的溶剂中制备(参见表3,其中浓度显示为 mol/L,术语″N/A″表示未制备特定储液)。溶解在水中的L-精氨酸,L-组氨酸,L-赖氨酸,氢氧化钾和氢氧化钠的储液也各自制备为浓度0.050mol/L。
室温下在N
表3
6.4.粉浆实验
选择第二套溶剂用于相平衡(粉浆)实验。在蒸发实验残余物中添加0.05mL溶剂。室温下在Eppendorf Thermo-Mixer上震荡MTP 3天。室温下在N
6.5.结晶实验
除非另有说明,否则表4中显示的所有实验在外界实验条件下进行。使用Fluka,Aldrich或ABCR分析级溶剂。使用前所有溶剂(除了水)用孔径3或
试验方法:
表4:结晶实验细节
表4
6.6.放大实验
6.6.1.镁盐1和2(Mg)
在放大实验中,发现了结晶和无定形的形态。
镁盐1通过从MeOH/CH
镁盐2通过从THF/H
6.6.2.钾盐1(K)
钾盐1通过从THF/H
6.6.3.钠盐1(Na)
钠盐1通过从EtOH/H
6.6.4.氨丁三醇盐1(TRO)
氨丁三醇盐1通过从丙酮/MeOH中蒸发进行制备。拉曼光谱见图7。图8中显示的PXRD图表明为晶体形态。
拉曼光谱和
在拉曼光谱中观察到带移。氨丁三醇的一些特征带在同一波范围出现;然而,在盐或溶剂化物中这些带漂移了。
类似的,在
图10显示了所有由游离酸和氨丁三醇制备的样品的PXRD图谱。所有图谱具有很多共同的反射,一种或其它在一个或多个图中缺失。在不同图形之间观察到在相同2θ位置的反射的高强度变化。在所有样品是相同的相纯材料的情况下这将表明存在强的偏好性定向效应。更可能的是这是由于不同混合比例的两种或多种形态。然而,偏好性定向效应可能使情况更为复杂。
6.6.5.L-赖氨酸盐1(LYS)
L-赖氨酸盐1通过从THF/H
6.6.6.L-精氨酸盐(ARG)
L-精氨酸盐1通过从EtOH/H
6.6.7.L-组氨酸盐1(HIS)
L-组氨酸盐1通过从THF/H
6.7.钾,钠,镁,L-赖氨酸和氨丁三醇盐的表征
6.7.1.FT-拉曼,PXRD和
钾,钠,镁,L-赖氨酸和氨丁三醇盐通过FT-拉曼,PXRD和
6.7.2.元素分析
通常,选定样品的元素分析符合样品的分子式。对于L-赖氨酸盐1,EMA确认了单(化学计量1∶1,盐/共晶形成物:游离酸)的存在。在钾盐的情况下,通过EMA观察到单盐的脱水物。这与DVS检测相符。对于钠盐1,EMA显示了1.5水每单盐的水合物形成。这高于DVS检测得到的结果,后者显示在起始材料中没有水。对于镁盐2,EMA 显示制备了半盐的四水合物(0.5∶1,盐形成物∶游离酸)而不是单盐。
对于氨丁三醇盐1无法确定精确的化学计量。显然样品包含化合物1(
表5:钾盐1的元素分析
分子式:C
表6:钠盐1的元素分析
分子式:C
表7:氨丁三醇盐1的元素分析
化合物1:C
氨丁三醇:C
表8:L-赖氨酸盐1的元素分析
分子式:化合物1:C
表9:镁盐2的元素分析
分子式:C
6.8.DVS
对钾盐1,钠盐1,氨丁三醇盐1,L-赖氨酸盐和镁盐2的样品进行了DVS检测(50%→0%→95%→50%r.h.)。
在图17中钾盐的DVS显示了~6wt.%的质量损失,因为湿度降低至0%r.h.(平衡未达到)然后从0%到35%连续的水吸收,回收了原始质量。~5wt.%的水释放将对应一个化学计量的水的损失。由于湿度进一步增至80%r.h.,更多的水被缓慢吸收(~1.5wt.%质量变化),从80%至95%r.h.观察到约3wt.%的快速水吸收(达到平衡)。当再次降低相对湿度后,水含量降低并保持在比原始质量稍高的值(~1wt.%)。在0%r.h.附近的表现显著表明存在溶剂化物或去溶剂化的水合物形态。
在图18中钾盐的DVS显示近乎分步模式的水吸收,表明多种水合物的形成。在将湿度从50%降低至0%r.h.并再次提高至50%r.h.后,样品显示可逆的重量损失和2wt.%的重量增长。从50%至62%r.h.观察到一个步骤中约10wt.%的水吸收(脱水物形成)。在第二步骤中随着湿度增至80%r.h.(平衡未达到),更多的水(~6wt.%对应三水合物形成)被吸收。在95%r.h.更多水被吸收至总量20wt.%(对应四水合物形成)。将相对湿度降低至50%r.h.后,水含量降低并维持在~16wt.%,高于原始质量(14wt.%将对应三水合物),但在此实验中平衡未达到。在DVS检测前和后记录了FT-拉曼谱。所述谱清楚地显示钠盐样品被转化至新形态。
DVS检测后对所述盐进行的FT-拉曼研究确认了样品被转化为新的形态。
在图19中氨丁三醇盐的DVS显示在湿度降低至0%r.h.并随后提升至80%r.h.时不显著的质量变化。从80%至95%r.h.样品可逆吸收~25wt.%(平衡达到)。在70%r.h.以下观察到进一步重量损失至低于原始质量3wt.%的值。
在图20中L-赖氨酸盐的DVS显示几乎可逆的水吸收和释放。当湿度增至95%r.h.(~2wt.%质量变化,达到平衡)时水被吸收。当再次降低相对湿度后,水含量降低并几乎恢复至原始质量。
在图21中镁盐的DVS显示几乎可逆的水吸收和释放。当湿度从50%降至0%r.h.并再次增至50%r.n.时样品显示~13wt.%的可逆的质量变化(平衡未达到)。在较高湿度下未检测到显著的质量变化。观察到的质量变化符合对应半盐四水合物Mg
6.9.水溶性测定
将每种盐悬浮在水中并在25℃和500rpm下振荡24小时。将所得悬浮液过滤(0.1μm过滤器)。通过FT-拉曼分析所获得的固体残渣。测量滤液的pH,并通过HPLC测定游离酸的浓度。值列于表中。镁盐2的溶解度显著较低。所述盐以镁∶游离酸1∶1的化学计量从溶液中沉淀。EMA结果对应化学计量为镁∶游离酸0.5∶1的半盐。
对制备时和水溶性测定后的样品测量的FT-拉曼光谱显示在图22至图26中。在对L-赖氨酸和氨丁三醇的盐测量的FT-拉曼光谱中,没有观察到新的形态。对钾盐测量的 FT-拉曼光谱显示轻微的带移,表明水的吸收。在镁盐的光谱中观察到轻微的带移和痕量的氢氧化镁。在钠盐上测量的光谱显示不同的形态。
对制备时和水溶性测定之后的样品测量的PXRD图在图27至图31中显示。对钾和镁盐测量的PXRD图没有显示新的形态。L-赖氨酸盐的PXRD图显示相同的形态,但在水中处理后,反射更强和更尖,并且该图显示不同的样品定向。钠盐的PXRD图谱显示与拉曼光谱一致的不同形态。
表10:钾,钠,氨丁三醇,L-赖氨酸和镁盐的水溶性
6.10.仪器和一般检测条件
6.11.微粒化的和未微粒化的化合物1的比较平衡溶解度研究
实验材料包括:1)微粒化的化合物1;2)未微粒化的化合物1;3)乙酸,冰的;4)三乙胺;5)乙腈,HPLC级;6)10mL注射器;和7)0.45μmPTFE注射过滤器。
用于溶解度研究的介质包括:1)pH 1.0包括含有0.5%十二烷基硫酸钠(SLS)的0.1N 盐酸HCl;和2)pH 7.4包含0.1 M磷酸盐缓冲盐水(PBS)。
用于溶解度研究的设备包括:1)Waters 2795分离模块;2)Axiovert 200显微镜;且 3)分析级天平。
表3和表4中提供了用于溶解度研究的HPLC条件。
表3:溶解度研究的HPLC条件
表4:用于溶解度研究的HPLC梯度
溶解度测量程序包括以下步骤:1)称量和混合约100mg微粒化化合物1和100mL 含有0.5%SLS的0.1 N HCl到琥珀色瓶1中;2)称量约100mg的微粒化化合物1和100 mL PBS到琥珀瓶2中;3)将约100mg的未微粒化的化合物1和100mL的具有0.5% SLS的0.1N HCl称重并混合到琥珀色瓶3中;4)称量和混合约100mg的未微粒化的化合物1和100mL的PBS到琥珀色瓶4中;5)使用多用途旋转器将所有样品在它们各自的琥珀色瓶中混合2小时;4)在5分钟,10分钟,30分钟,60分钟,90分钟,120 分钟取样;5)过滤样品和6)使用HPLC分析滤液。对于每个时间点,使用具有针连接的过滤器的10mL注射器和使用注射器顶部0.45μm PTFE注射器过滤器来抽取10 mL样品。将收集的第一份9mL样品放回原始琥珀色瓶中,然后将剩余的1mL转移至 HPLC小瓶中用于分析。
微粒化的和未微粒化的化合物1的溶解度研究结果见表5。图32和图33分别提供了微粒化和未微粒化的化合物1在含0.5%SLS和PBS的0.1 N HCl中的溶解度曲线的图示。
表5:微粒化的和未微粒化的化合物1的时间-浓度溶解度数据
在显微镜下观察和分析化合物1的微粒化和非微粒化批次,以获得颗粒的平均长度和平均宽度的估计值。作为该方法的一部分,使用称为IPLab 3.7的程序,在Axiovert200显微镜下分析来自每种类型的化合物1的5种不同的样品,并且估计粒度测量值。分析结果提供在表6中。图34和图35提供了未微粒化的和微粒化的化合物1样品在偏振光下的图像。
表6:估计的微粒化的和未微粒化的化合物1的平均粒径数据
在两种介质中,化合物1的溶解度表现出达到相同的值。在pH 1介质中,在约30 分钟达到平衡。在pH 7.4介质中,在约2小时达到平衡溶解度。
在pH 7.4介质中,动力学溶解度的差异是显著的,表明小颗粒确实对增强化合物1药物物质溶解具有显著影响。
6.12.眼用剂型
表15提供了作为溶液的眼用剂型,其包含化合物1组合氨丁三醇用作阳离子改性剂。
表16提供了作为溶液的眼用剂型,其包含化合物1组合组氨酸用作阳离子改性剂。
表17提供了作为溶液的眼用剂型,其包含化合物1组合赖氨酸用作阳离子改性剂。
表18提供了作为溶液的眼用剂型,其包含化合物1组合DEAE-葡聚糖用作阳离子改性剂。
表19提供了作为溶液的眼用剂型,其包含化合物1组合羟丙基-环糊精用作阳离子改性剂。
6.13.体内试验
进行两个研究以评价多种组织(包括眼睛)中化合物1/代谢物的浓度,然后对Sprague Dawley和Long Evans大鼠单剂量给药放射性标记的化合物1(
Sprague Dawley大鼠:作为定量全身放射自显影(QWBA)研究的一部分,对从Charles River获得的4只雄性和4只雌性Sprague Dawley大鼠(白化病)施用单次口服管饲剂量50mg/kg的
单独饲养动物并随意提供认证的啮齿动物饮食和水。在剂量施用前将动物驯化8天。设定动物室的环境控制以维持温度为18至26℃,相对湿度为50±20%,以及12小时光 /12小时黑暗循环。12小时黑暗循环可能已被中断以适应研究程序。动物在给药当天在给药后4小时禁食过夜。在给药时,动物体重为204至260g,并且为约9至11周龄。在给药后1、4、24和72小时用过量的氟烷处死一只动物/性别/时间点,收集尸体用于通过全身放射自显影术(WBA)进行分析。眼睛和相关组织中
表20:在对Sprague Dawley大鼠单次口服施用
BLQ=定量限以下(<0.768μg当量
Long Evans大鼠:在定量全身放射自显影(QWBA)研究中,向从Harlan获得的8 只雄性Long Evans大鼠(部分色素沉着)施用单次口服管饲剂量的50mg/kg
单独饲养动物,随意提供认证的啮齿动物饮食和水。在剂量施用前使动物适应3天。设定动物室的环境控制以维持温度为18至26℃,相对湿度为50±20%,以及12小时光/12小时黑暗循环。根据需要,中断12小时暗循环以适应研究程序。动物在给药当天在给药后4小时禁食过夜。在给药时,动物体重160至178g并且为约7周龄。在给药后 0.5、1、2、4、8、24、72和168小时,在异氟醚麻醉下通过放血(心脏穿刺)处死一个动物/时间点。眼睛和相关组织中
表21:在对Long Evans大鼠单次口服施用
BLQ=定量限以下(<0.457μg当量
6.14.无虹膜的无义突变小鼠模型
在由Gregory-Evans及其同事开发的在小鼠PAX6基因中含有天然存在的无义突变的无虹膜小鼠模型(半显性小眼模型(PAX6
将化合物1皮下施用于PAX6突变体和野生型小鼠10天(出生后第4-14天)或作为眼用悬浮液制剂(0.9%氯化钠,1%吐温80,1%粉末状化合物1,1%羧甲基纤维素) 局部施用,每天两次,共46天(出生后第14-60天)。在治疗之前,突变体眼睛显示角膜增厚,其中未发育晶状体附着于角膜的晶状体茎的表现,和睫状缘处异常内折叠 (in-folding)的视网膜增厚(图36A)。在未处理的突变小鼠组中,观察到视网膜和异常的小晶状体的进行性内折叠。用皮下化合物1的治疗校正了视网膜内折叠,并将晶状体尺寸增加70%(图36A和图37)。
在将化合物1作为眼用悬浮液制剂(0.9%氯化钠,1%吐温80,1%粉末化合物1,1%羧甲基纤维素)直接局部施用于眼中后,获得了额外的成功结果。在未处理的眼中观察到的晶状体和视网膜缺陷在化合物1处理的突变小鼠中逆转,并且非常类似于野生型小鼠(图36B)。角膜的组织学检查显示角膜增厚减少。视网膜显示对光刺激的增加的反应。通过酶联免疫吸附测定(ELISA)检测,与野生型小鼠相比,用化合物1处理导致角膜和视网膜上皮蛋白裂解物中PAX6蛋白增加90%(图36C)。在PAX6 (PAX6
作为对小鼠中视敏度的影响的测试,检测了视动跟踪响应,其是通过视网膜-脑回路介导的行为反应。未处理的突变小鼠显示有限的跟踪反应。用化合物1处理的小鼠显示出与野生型小鼠相似的空间频率阈值的显著改善(图36D)。
化合物1显示能抑制PAX6中的无义密码子,允许合成全长PAX6蛋白并导致与疾病相关的先天性眼睛异常的逆转。这表明化合物1具有成为无虹膜的有希望的治疗剂的潜力。
6.15.无虹膜的诊断
通过需要裂隙灯检查,眼底检查,虹膜荧光素血管造影,光学相干断层扫描和高频超声生物显微镜的临床检查来诊断无虹膜。表22提供了诊断技术的概述。
表22.用于鉴定无虹膜的眼睛异常的诊断技术
进行测序分析以鉴定引起疾病的突变。分析PAX6编码区以确定缺失/重复并检测PAX6外显子或全基因缺失。所进行的遗传测试在表2中提供。
表23通过表型和家族史的无虹膜的遗传测试
应当理解,虽然为了说明的目的在本文中描述了本发明的具体实施例,但是本文所描述的本发明的范围不限于本文所公开的具体实施例。这些实施例旨在说明本发明的几个方面。任何等效的实施方式意图在本发明的范围内。实际上,除了本文显示和描述的那些之外,本发明的各种修改对于本领域技术人员来说从前述描述中将变得显而易见,所述修改也意图在本发明的范围内。
- 1,2,4-噁二唑苯甲酸的药物组合物和盐
- 1,2,4‑噁二唑苯甲酸的药物组合物和盐
