一种理化联合制备低致敏乳蛋白肽的方法
文献发布时间:2023-06-19 11:34:14
技术领域
本发明涉及蛋白质加工技术领域,尤其涉及一种乳蛋白经物理处理结合定向酶解制备低致敏乳蛋白肽的方法。
背景技术
牛乳含3.3%-3.5%的蛋白质,其所含的乳蛋白几乎含有机体所有的必需氨基酸,是母乳最好的替代品,但乳蛋白中的酪蛋白、β-乳球蛋白和α-乳白蛋白等为过敏原,容易致使婴幼儿过敏。目前,牛乳过敏的发病率高达2%-7.5%,严重影响婴幼儿的生长发育,甚至威胁其生命。所以,乳蛋白除敏研究,对开发低致敏乳制品具有重要且深远的意义。目前,常用的乳制品加工技术如热处理、发酵、酶处理等,在加工过程中,都会改变乳蛋白的抗原性。此外,高压、糖基化、辐照、微波、高强度超声波等加工技术可以令蛋白内部结构展开或者氢键断裂、蛋白聚合、抗原表位掩盖或者暴露,因而也可以改变乳蛋白的抗原性。由于蛋白质通常具有四级结构,乳蛋白加工过程中,虽然能够将其表面的抗原掩盖或者除去,但也容易将其隐含的抗原暴露,引入新的致敏问题,故乳蛋白致敏问题一直都无法完全解决。
制备低致敏乳蛋白的技术在国外应用较早,产业化程度高。目前在中国市场上销售的低致敏婴幼儿配方乳粉几乎100%被发达国家公司控制,因此低致敏乳蛋白制备技术是中国食品产业,特别是关系到我国婴幼儿食品安全营养健康的一项卡脖子技术。
发明内容
本发明要解决的技术问题是提供一种乳蛋白物理处理与定向酶解相结合,制备低致敏乳蛋白肽的方法。
为解决上述技术问题,本发明的目的是通过以下技术方案实现的:
一种理化联合制备低致敏乳蛋白肽的方法,包括依次执行的以下步骤:
步骤一:将乳蛋白与纯净水充分搅拌混匀,并通过超声波发生器和/或微波发生器处理5-30min后得到乳蛋白液,
步骤二:调整所述乳蛋白液pH至1-3,加入胃蛋白酶,在36-38℃条件下酶解1-2h;
步骤三:接着调整pH至6.5-7.5,升温至47-53℃后,加入木瓜蛋白酶酶解1-4h;
步骤四:最后纯化得到低致敏乳蛋白肽;
所述低致敏乳蛋白肽的分子量小于等于10000Da。
进一步地,在所述步骤三中,木瓜蛋白酶酶解完成后,继续将pH调节至7.5-8.5,加入胰蛋白酶和/或胰凝乳蛋白酶,然后在47-53℃条件下酶解1-2h。
进一步地,所述乳蛋白在所述乳蛋白溶液中的质量百分比浓度为10%-50%。
进一步地,所述胰蛋白酶的添加量为乳蛋白添加量的0.15-0.25%,所述胰凝乳蛋白酶的添加量为乳蛋白添加量的0.15%-0.25%。
进一步地,所述胃蛋白酶的添加量为乳蛋白添加量的0.25-0.35%;所述木瓜蛋白酶的添加量为乳蛋白添加量的0.25%-0.35%。
进一步地,所述超声波发生器的超声波频率为22-28KHz、功率400-600W;所述微波发生器的微波频率2300-2700MHz、功率200-400W。
进一步地,超声波或微波处理时,始终控制温度小于等于65℃。
进一步地,所述纯化的方法为陶瓷膜超滤,滤膜孔径为1-10nm。
进一步地,低致敏乳蛋白肽的分子量小于等于3000Da。
进一步地,所述低致敏乳蛋白肽经过77-83℃喷雾干燥后保存。
本发明的有益效果在于:经过超声波和/或微波处理后,先模拟人体蛋白质消化,使得乳蛋白水解形成暴露特定抗原表位的多肽,然后使用木瓜蛋白酶对多肽进行进一步的适度水解,尽可能多地消除人体消化过程乳蛋白水解所呈现的抗原特性,最后纯化筛选出特定分子量的对人体致敏性最低的多肽。
添加的胰蛋白酶和/或胰凝乳蛋白酶进一步模拟人体肠道消化,对多肽进行进一步的深度水解,增加水解产物产率,但尽可能地避免水解过程暴露其他抗原表位。
超声波或微波处理,一方面可以使乳蛋白在水中形成均匀的悬液,利于酶与底物充分接触,另一方面使得乳蛋白自身进行适当的解链,利于酶切位点向酶暴露。温度控制在65℃以下,避免受温度影响而暴露其它抗原表位。
附图说明
为了更清楚地说明本发明实施例技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
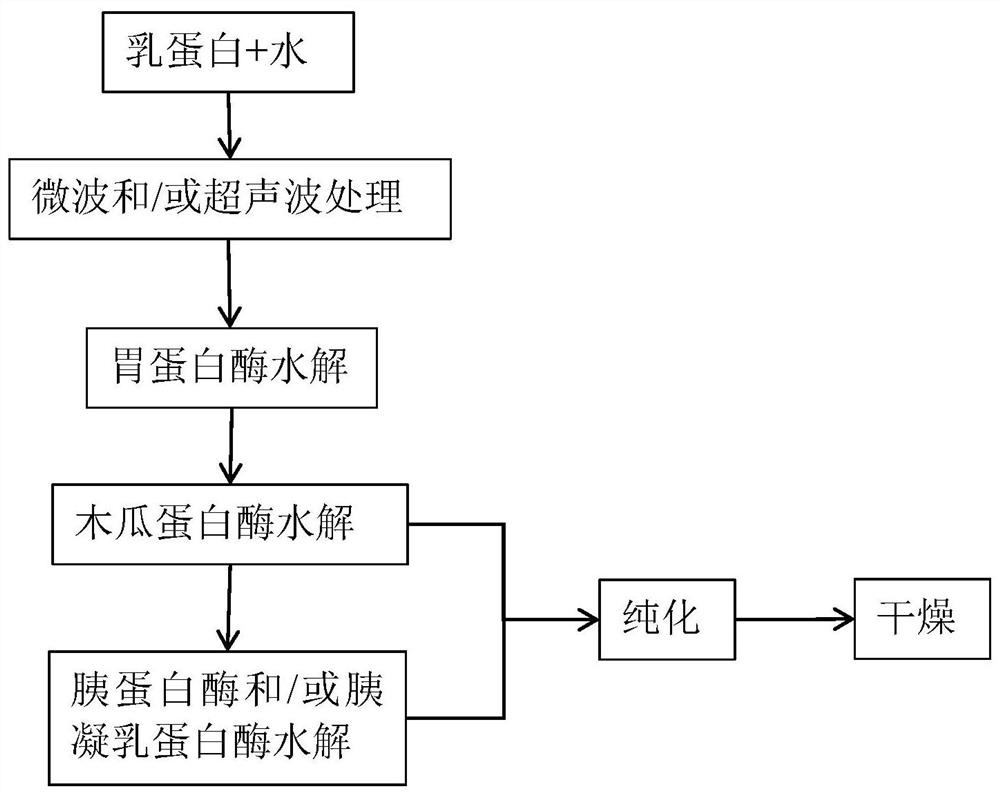
图1为本发明一种理化联合制备低致敏乳蛋白肽的方法的工艺流程图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述。
实施例1
请参阅图1,一种理化联合制备低致敏乳蛋白肽的方法,包括依次执行的以下步骤:
步骤一:将100g粉末状的乳蛋白与900mL纯净水充分搅拌混匀;控制温度不超过65℃的条件下,使用频率为25KHz、功率为500W的超声波发生器处理5min,得到乳蛋白液;温度超过65℃时,停止处理并停止计时,降至40℃以下时恢复超声波处理并继续计时,超声波处理的累计计时达5min后停止超声波处理;
步骤二:调整所述乳蛋白液pH至1-3,加入0.25g胃蛋白酶,在36-38℃条件下酶解1.5h;
步骤三:接着调整pH至6.5-7.5,升温至47-53℃后,加入0.25g木瓜蛋白酶酶解1.5h;继续将pH调节至7.5-8.5,加入0.15g胰蛋白酶,然后在47-53℃条件下酶解1.5h得到酶解液A;
步骤四:使用滤膜孔径为10nm的陶瓷膜进行纯化,得到低致敏乳蛋白肽;所述低致敏乳蛋白肽的分子量小于等于10000Da;
步骤五:所述低致敏乳蛋白肽经过77-83℃喷雾干燥后得到97.38g低致敏乳蛋白肽A,产率为97.38%。
实施例2
请参阅图1,一种理化联合制备低致敏乳蛋白肽的方法,包括依次执行的以下步骤:
步骤一:将200g粉末状的乳蛋白与900mL纯净水充分搅拌混匀;控制温度不超过65℃的条件下,使用频率为25KHz、功率为500W的超声波发生器处理10min得到乳蛋白液;温度超过65℃时,停止处理并停止计时,降至40℃以下时恢复超声波处理并继续计时,超声波处理的累计计时达10min后停止超声波处理;
步骤二:调整所述乳蛋白液pH至1-3,加入0.5g胃蛋白酶,在36-38℃条件下酶解1h;
步骤三:接着调整pH至6.5-7.5,升温至47-53℃后,加入0.5g木瓜蛋白酶酶解1h;继续将pH调节至7.5-8.5,加入0.3g胰蛋白酶和0.3g胰凝乳蛋白酶,然后在47-53℃条件下酶解1h得到酶解液B;
步骤四:使用滤膜孔径为10nm的陶瓷膜进行纯化,得到低致敏乳蛋白肽;所述低致敏乳蛋白肽的分子量小于等于10000Da;
步骤五:所述低致敏乳蛋白肽经过77-83℃喷雾干燥后得到199.12g低致敏乳蛋白肽B,产率为99.56%。
实施例3
请参阅图1,一种理化联合制备低致敏乳蛋白肽的方法,包括依次执行的以下步骤:
步骤一:将300g粉末状的乳蛋白与900mL纯净水充分搅拌混匀;控制温度不超过65℃的条件下,使用频率为25KHz、功率为500W的超声波发生器处理20min,得到乳蛋白液;温度超过65℃时,停止处理并停止计时,降至40℃以下时恢复超声波处理并继续计时,超声波处理的累计计时达20min后停止超声波处理;
步骤二:调整所述乳蛋白液pH至1-3,加入0.9g胃蛋白酶,在36-38℃条件下酶解1.5h;
步骤三:接着调整pH至6.5-7.5,升温至47-53℃后,加入0.9g木瓜蛋白酶酶解2h;继续将pH调节至7.5-8.5,加入0.45g胰蛋白酶和0.45g胰凝乳蛋白酶,然后在47-53℃条件下酶解1.5h得到酶解液C;
步骤四:使用滤膜孔径为10nm的陶瓷膜进行纯化,得到低致敏乳蛋白肽;所述低致敏乳蛋白肽的分子量小于等于10000Da;
步骤五:所述低致敏乳蛋白肽经过77-83℃喷雾干燥后得299.28g低致敏乳蛋白肽C,产率为99.76%。
实施例4
请参阅图1,一种理化联合制备低致敏乳蛋白肽的方法,包括依次执行的以下步骤:
步骤一:将400g粉末状的乳蛋白与900mL纯净水充分搅拌混匀;控制温度不超过65℃的条件下,使用频率为25KHz、功率为500W的超声波发生器处理30min,得到乳蛋白液;温度超过65℃时,停止处理并停止计时,降至40℃以下时恢复超声波处理并继续计时,超声波处理的累计计时达30min后停止超声波处理;
步骤二:调整所述乳蛋白液pH至1-3,加入1.2g胃蛋白酶,在36-38℃条件下酶解2h;
步骤三:接着调整pH至6.5-7.5,升温至47-53℃后,加入1.2g木瓜蛋白酶酶解3h;继续将pH调节至7.5-8.5,加入0.8g胰蛋白酶和0.8g胰凝乳蛋白酶,然后在47-53℃条件下酶解2h得到酶解液D;
步骤四:使用滤膜孔径为10nm的陶瓷膜进行纯化,得到低致敏乳蛋白肽;所述低致敏乳蛋白肽的分子量小于等于10000Da;
步骤五:所述低致敏乳蛋白肽经过77-83℃喷雾干燥后得394.76g低致敏乳蛋白肽D,产率为98.69%。
实施例5
请参阅图1,一种理化联合制备低致敏乳蛋白肽的方法,包括依次执行的以下步骤:
步骤一:将500g粉末状的乳蛋白与900mL纯净水充分搅拌混匀;控制温度不超过65℃的条件下,使用频率为25KHz、功率为500W的超声波发生器处理20min,接着使用频率为2450MHz、功率为300W的微波发生器处理20min,得到乳蛋白液;温度超过65℃时,停止处理并停止计时,降至40℃以下时恢复超声波处理或微波处理并继续计时,超声波处理的累计计时达20min后停止超声波处理,微波处理的累计计时达20min后停止;
步骤二:调整所述乳蛋白液pH至1-3,加入1.75g胃蛋白酶,在36-38℃条件下酶解2h;
步骤三:接着调整pH至6.5-7.5,升温至47-53℃后,加入1.75g木瓜蛋白酶酶解4h;继续将pH调节至7.5-8.5,加入1.25g胰蛋白酶和1.25g胰凝乳蛋白酶,然后在47-53℃条件下酶解2h得到酶解液E;
步骤四:使用滤膜孔径为10nm的陶瓷膜进行纯化,得到低致敏乳蛋白肽;所述低致敏乳蛋白肽的分子量小于等于10000Da;
步骤五:所述低致敏乳蛋白肽经过77-83℃喷雾干燥后得489.15g低致敏乳蛋白肽E,产率为97.83%。
实施例6
请参阅图1,一种理化联合制备低致敏乳蛋白肽的方法,包括依次执行的以下步骤:
步骤一:将300g粉末状的乳蛋白与900mL纯净水充分搅拌混匀;控制温度不超过65℃的条件下,使用频率为25KHz、功率为500W的超声波发生器处理20min,接着使用频率为2450MHz、功率为300W的微波发生器处理20min,得到乳蛋白液;温度超过65℃时,停止处理并停止计时,降至40℃以下时恢复超声波处理或微波处理并继续计时,超声波处理的累计计时达20min后停止超声波处理,微波处理的累计计时达20min后停止;
步骤二:调整所述乳蛋白液pH至1-3,加入0.75g胃蛋白酶,在36-38℃条件下酶解2h;
步骤三:接着调整pH至6.5-7.5,升温至47-53℃后,加入0.75g木瓜蛋白酶酶解3h;继续将pH调节至7.5-8.5,加入0.6g胰蛋白酶和0.6g胰凝乳蛋白酶,然后在47-53℃条件下酶解2h得到酶解液F;
步骤四:使用滤膜孔径为10nm的陶瓷膜进行纯化,得到低致敏乳蛋白肽;所述低致敏乳蛋白肽的分子量小于等于10000Da;
步骤五:所述低致敏乳蛋白肽经过77-83℃喷雾干燥后得298.74g低致敏乳蛋白肽F,产率为99.58%。
实施例7
请参阅图1,一种理化联合制备低致敏乳蛋白肽的方法,与实施例6的差异在于,步骤四中:使用滤膜孔径为3nm的陶瓷膜对酶解液F进行纯化,得到低致敏乳蛋白肽;所述低致敏乳蛋白肽的分子量小于等于3000Da;
步骤五:所述低致敏乳蛋白肽经过77-83℃喷雾干燥后得109.65g低致敏乳蛋白肽G,产率为36.55%。
产物分析方法
对实施案例1-7的产物进行水解程度分析、IgE抗原性分析和过敏原性分析。
1.水解乳蛋白肽水解程度分析
采用SDS-PAGE方法,以水解前乳蛋白为对照,以低分子量蛋白标准参照,对上述实施例1-6中的酶解液A-F进行分析,确认水解后大部分的蛋白肽的分子量在10000Da以下。
将实施例1-6中,过滤后大于10000Da部分肽混合后,经过77-83℃喷雾干燥后得乳蛋白肽H。
2.水解乳蛋白肽IgE抗原性分析
选用市售β-乳球蛋白检测试剂盒(竞争性酶联免疫法检测试剂盒,含β-乳球蛋白特异抗体IgE),分别对乳蛋白、低致敏乳蛋白肽A-G、乳蛋白肽H进行测试,操作按照市售β-乳球蛋白检测试剂盒操作说明书进行。测试后进行抗原性降低率分析,分析结果详见表1。
选用市售α-乳白蛋白检测试剂盒(竞争性酶联免疫法检测试剂盒,含α-乳白蛋白特异抗体IgE),分别对乳蛋白、低致敏乳蛋白肽A-G、乳蛋白肽H进行测试,操作按照市售α-乳白蛋白检测试剂盒操作说明书进行。测试后进行抗原性降低率分析,分析结果详见表1。
选用市售酪蛋白检测试剂盒(间接酶联免疫吸附法检测试剂盒,含酪蛋白特异抗体IgE),分别对乳蛋白、低致敏乳蛋白肽A-G、乳蛋白肽H进行测试,操作按照市售酪蛋白检测试剂盒操作说明书进行。测试后进行抗原性降低率分析,分析结果详见表1。
抗原性降低率分析方法为:先测量各孔双波长(特征波长490nm,非特征波长630nm)吸光值,然后进行抗原性降低率分析。其中,各孔实际的双波长吸光值差=OD490-OD630,抗原性降低率计算公式为:
抗原性降低率%=(S0-S)/S0×100
式中:S为水解乳蛋白肽样品的双波长吸光值差,S0为未水解乳蛋白阳性对照的双波长吸光值差。
人I型速发型超敏反应一般是由IgE介导的,水解乳蛋白分别与相应β-乳球蛋白IgE、α-乳白蛋白IgE和酪蛋白IgE的抗原性测定,结果间接反映其致敏性。
表1 IgE抗原性检测结果
从表1中可以看出,使用本申请方法能显著降低乳蛋白中的α-乳白蛋白、β-乳球蛋白和酪蛋白等抗原性,间接表明其过敏原性降低。
3.水解乳蛋白肽致敏原性分析
采用模式生物斑马鱼方法。用超纯水将低致敏乳蛋白肽A-G、乳蛋白肽H、乳蛋白分别配制成10mg/ml的样品检测组,共9组;用超纯水将特异性致敏化合物C 48/80配制成10mg/ml的阳性对照组;以超纯水作为溶剂对照组。然后根据以下方法构建斑马鱼类过敏检测模型后,用酶标仪测定各个实验组的吸光度值OD405,并计算相应的肥大细胞类胰蛋白酶(Tryptase)表达水平,结果详见表2。
取5对斑马鱼亲本交配,按照Westerfield的方法孵化胚胎。将处于最佳处理阶段的斑马鱼置于解剖显微镜下观察,挑取发育正常的斑马鱼移入96孔微孔板中。
Tryptase相对表达水测定。将上述样品检测组、阳性对照组和溶剂对照组等各实验组进行斑马鱼血管显微注射,每尾斑马鱼注射10nl(相当于0.1μg/尾)。注射完成后,将斑马鱼转移到96孔板中,每孔2尾斑马鱼,100μl反应液(30mg/ml BAPNA),每个实验组处理6个孔。各实验组28℃反应24小时,反应结束后,使用多功能微孔分析仪检测各实验组的OD405值。根据各实验组的OD405值,对Tryptase相对表达水平和致敏原性降低百分比进行分析,分析结果详见表2。其中,Tryptase相对表达水平计算公式如下:
Tryptase相对表达水平(%)=(样品检测组吸光值/溶剂对照组吸光值-1)×100
水解乳蛋白肽相对未水解的乳蛋白致敏性降低率按以下公式计算:
致敏原性降低%=(V乳蛋白组-V水解乳蛋白肽组)/V乳蛋白组*100
式中,V为斑马鱼Tryptase相对表达水平%。
表2水解乳蛋白肽对斑马鱼致敏性检测结果
肥大细胞是类过敏反应的主要效应细胞,激活的肥大细胞数量与过敏程度相关。类胰蛋白酶(Tryptase)是肥大细胞内预先合成的中性蛋白酶,肥大细胞被过敏原激活脱颗粒后,类胰蛋白酶会转化成具有活性的构象并被释放到细胞外,在波长405nm有最大吸收值,故Tryptase相对表达量可作为类过敏反应的标志。斑马鱼的肥大细胞,其结构与功能与哺乳类动物相似,参与机体的免疫反应和过敏反应。
从表2中可知,利用本发明方法制备得到的低致敏乳蛋白肽A-G在斑马鱼类过敏检测模型测定中的表达水平与溶剂对照组相比,没有统计学意义,即低致敏乳蛋白肽A-G不能诱导过敏反应;而使用本发明同样超声/微波、酶解条件制备得到的乳蛋白肽,在分子量高于10000Da时,具有一定的抗原性,能够诱导过敏反应的产生,但较之未经本发明方法处理前的乳蛋白样品,其抗原性得到极大地降低。采用本申请方法处理得到的蛋白肽,其致敏原性降低80%以上;小于等于3000Da的多肽致敏原性降低90%以上。
综上所述,本发明提供的一种理化联合制备低致敏乳蛋白肽的方法,经过超声波和/或微波处理后,先模拟人体蛋白质消化,使得乳蛋白水解形成暴露特定抗原表位的多肽,然后使用木瓜蛋白酶对多肽进行进一步的水解,尽可能多地消除人体消化过程乳蛋白水解所呈现的抗原特性,接着使用胰蛋白酶和/或胰凝乳蛋白酶进一步强化消化水解,最后纯化筛选出特定分子量的对人体致敏性最低的多肽。通过该方法处理后得到的蛋白肽中,不含过敏原α-乳白蛋白、β-乳球蛋白和酪蛋白,且由于水解过程及其接近正常人体消化过程,可以避免过多暴露除过敏原α-乳白蛋白、β-乳球蛋白、酪蛋白外的抗原表位,所得的多肽整体的致敏性也得到了很好地改善——其致敏原性降低80%以上,小于等于3000Da的多肽致敏原性降低90%以上。此外,多肽的产率高。该低致敏乳蛋白肽可用于生产低致敏婴幼儿配方食品、婴幼儿辅助食品,或者其它特殊膳食用食品、特殊医学用途配方食品。纯化时,滤出的大于10000Da部分水解肽能够加入至下批次的生产当中去继续水解,原料不浪费。
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到各种等效的修改或替换,这些修改或替换都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以权利要求的保护范围为准。
- 一种理化联合制备低致敏乳蛋白肽的方法
- 一种低致敏低腥味鱼蛋白低聚肽及其工业化制备方法和应用
