一种苯磺酸贝托斯汀药物组合物及其制备方法
文献发布时间:2023-06-19 11:40:48
技术领域
本发明属于医药技术领域,涉及一种苯磺酸贝托斯汀药物组合物及其制备方法。
背景技术
苯磺酸贝托斯汀(Bepotastine Besilate)其化学名为(+)-(S)-4-(4-(4-氯苯基-2-吡啶甲氧基)哌啶)丁酸苯磺酸盐,化学结构如下:
临床上贝托斯汀是以苯磺酸贝托斯汀作为活性成分上市销售,苯磺酸贝托斯汀是贝托斯汀的苯磺酸盐,是一种具有抗组胺活性的药物,可用于治疗鼻炎等过敏性疾病,以及湿疹、皮炎、痒疹、皮肤瘙痒、荨麻疹等皮肤疾病。
苯磺酸贝托斯汀为日本田边(Tanabe Seiyaku)公司和日本宇部(UbeIndustries)公司联合开发的组胺H1受体拮抗剂,2000年在日本首次上市,2006年,ISTA制药公司获得了苯磺酸贝托斯汀滴眼液在北美的授权,2007年,该公司又获得了田边公司口服使用该药物在北美的授权。
目前现有技术中公开了苯磺酸贝托斯汀片剂及其制备方法,如中国专利CN201711025980.0公开了一种苯磺贝托斯汀药物组合物的制备方法,具体公开了上述药物组合物包括片剂,胶囊剂,颗粒剂;目前致力于研究苯磺酸贝托斯汀的新制剂,例如中国专利201410082772.4公开了苯磺酸贝他斯汀鼻腔喷雾剂等。
而微球(microsphere)是指药物溶解或分散在高分子材料基质中形成的粒径为1~1000μm的微小球状实体;粒径在10~1000nm之间的微球也被称为纳米球。微球技术作为一种新型给药技术,首先通过调节和控制药物的释放速度实现长效的目的,同时又能保护药物免遭破坏,掩盖药物的不良口味,减少给药次数和药物刺激,降低毒性和副作用,提高疗效。此外,微球还与某些细胞组织有特殊亲和性,能被器官组织的网状内皮系统所内吞或被细胞融合,集中于靶区逐步扩散释出药物或被溶酶体中的酶降解而释出药物。
微球可以供注射(静注、肌注)、口服、滴鼻、皮下埋植或是关节腔给药使用,能够开发出更为广泛的给药途径。除现有技术报道的口服缓控释制剂外,微球制剂也可作为苯磺酸贝托斯汀长效制剂的一种选择。
发明内容
为解决上述技术问题,增加苯磺酸贝托斯汀的给药途径,提高患者顺应性,本发明提供了一种苯磺酸贝托斯汀药物组合物。所述的药物组合物为微球,该微球包封率高,粒径大小均匀,质量稳定,制备工艺简单,还具有长效释放效果,具有预料不到的技术效果。
为实现上述目的,本申请采用以下技术方案:
一种苯磺酸贝托斯汀药物组合物,所述药物组合物含有苯磺酸贝托斯汀和高分子载体,两者的重量比为:1:6-8。
在一些实施方案中,所述的药物组合物为微球。
在一些实施方案中,所述的高分子载体为聚乳酸-羟基乙酸共聚物。
在一些实施方案中,所述制备方法保护以下步骤:
(1)称取处方量的苯磺酸贝托斯汀,溶入有机溶剂中作为分散相;
(2)称取处方量的高分子载体和乳化剂,溶入乙醇水溶液中作为连续相;
(3)将分散相缓慢滴加至连续相中,在涡旋的条件下加入致孔剂,超声乳化,形成水包油型乳化液;
(4)向步骤(3)所得乳化液中加入冻干保护剂,真空冷冻干燥即得。
在一些实施方案中,所述的乳化剂选自多元醇脂肪酸酯、硬脂酸钠中的一种或多种。
在一些实施方案中,所述的致孔剂选自碳酸氢铵溶液。发明人发现,在制备微球的过程中添加碳酸氢铵溶液作为致孔剂,可以制备多孔微球。并且在制备多孔微球的过程中真空冷冻干燥的条件也尤为重要,直接影响形成的多孔大小以及均一性,进而会影响微球的缓释效果。
在一些实施方案中,所述的碳酸氢铵溶液的浓度为3%-5%。
在一些实施方案中,所述的冻干保护剂选自海藻糖、葡萄糖、甘露醇、山梨醇、羟乙基淀粉一种或多种。
在一些实施方案中,所述冻干保护剂选自山梨醇与羟乙基淀粉的组合。发明人发现,在真空冷冻干燥过程中添加冻干保护剂尤为重要,能够避免药物在干燥过程中损耗,提高微球的载药量。优选的,所述冻干保护剂选自山梨醇与羟乙基淀粉的组合物,其制备得到的微球载药量最好。
在一些实施方案中,所述的真空冷冻干燥条件为:于5℃进箱,保持1小时,降温至-40~℃预冻4h,缓慢升温至-20℃真空干燥6h;缓慢升温至0℃真空干燥6h;继续升温至20℃真空干燥2h;继续升温至30℃真空干燥2h。
进一步,所述真空冷冻干燥工艺优选为:于5℃进箱,保持1小时,降温至-40~℃预冻4h,启动真空泵,将干燥箱真空度抽到1-5Pa,缓慢升温至-20℃真空干燥6h;将干燥箱真空度抽到10-15Pa,缓慢升温至0℃真空干燥6h;将干燥箱真空度抽到15-20Pa,继续升温至20℃真空干燥2h;将干燥箱真空度抽到1-5Pa,继续升温至30℃真空干燥2h。发明人还发现,在本发明的真空冷冻干燥技术中,真空的压力大小对实验的结果非常重要。在真空干燥前期和后期,适于真空度较低,在中期适于真空度较高,更利于形成均一的多孔微球,提高载药量,从而影响药物的缓释效果。
进一步,发明人还发现,在本发明的部分实施方式中,海藻酸钠与羧甲基壳聚糖作为表面带有相反电荷的物质,二者通过静电作用力,能够形成聚电解质复合物,本发明在制备的乳化液中添加海藻酸钠和羧甲基壳聚糖溶液,能够在缓释微球表面形成聚合物络合交替包覆层,从而进一步提高缓释微球的缓释性能,并且引入生物相容性好的羧甲基壳聚糖涂层,使得纳米微球在酸性条件下,羧甲基壳聚糖的溶解性不好以保护载药内层。
有益效果:
1.本申请选择聚乳酸-羟基乙酸共聚物作为高分子载体制备微球,高分子聚乳酸-羟基乙酸共聚物是具有优良的生物相容性和生物降解性的聚合物,中间产物乳酸也是体内正常糖代谢的产物,不会在重要器官聚集,因此聚乳酸-羟基乙酸共聚物作为药物载体得到了广泛的研究和应用。
2.本发明人通过大量实验筛选了苯磺酸贝托斯汀与聚乳酸-羟基乙酸共聚物的最佳配比,使得本发明制备的微球中活性物质与高分子聚合物的相容性好,当两者重量比过高或过低时,都会对产品的均匀释放存在一定的影响。
3.本申请微球的制备方法简单,不需要分离纯化,制备过程中添加致孔剂,制备得到的缓释微球为多孔微球,微球粒径均一、药物含量高,能有效延长药物在体内的作用时间,降低给药频率。
4.本发明制备方法中采用真空冷冻干燥技术,真空的压力大小对实验的结果非常重要。在真空干燥前期和后期,适于真空度较低,在中期适于真空度较高,更利于形成均一的多孔微球,提高包封率和载药量。
附图说明
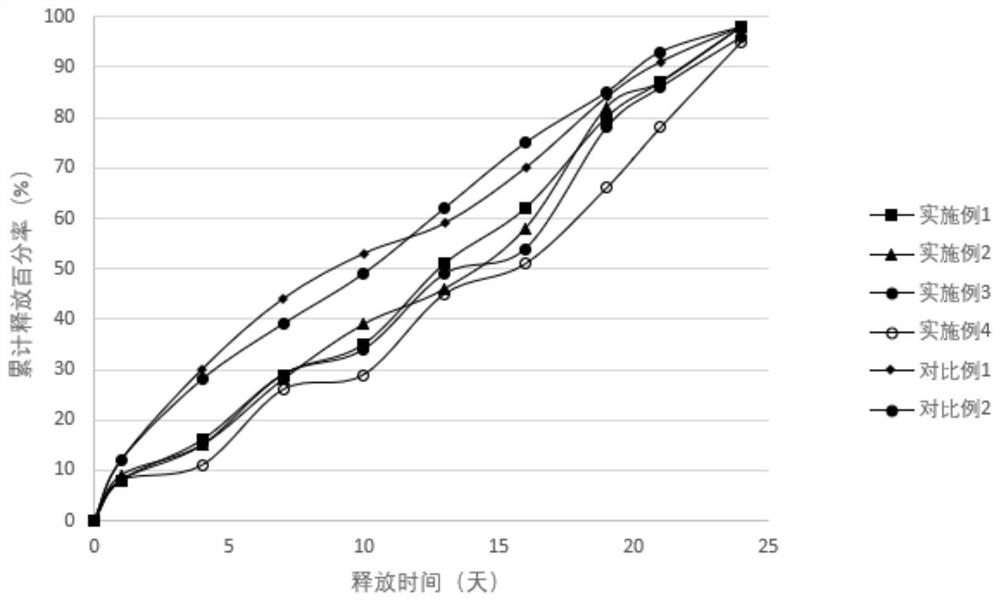
图1是本发明制备的苯磺酸贝托斯汀微球的体外累计释放曲线对比图。
具体实施方式
下面结合实施例和附图对本发明进行详细描述,但下列实施例不应看作对本发明范围的限制。
实施例1
(1)称取5g苯磺酸贝托斯汀,溶入20mL乙酸乙酯中作为分散相;
(2)称取30g聚乳酸-羟基乙酸共聚物和3g多元醇脂肪酸酯,溶入80mL乙醇水溶液中作为连续相;
(3)将分散相缓慢滴加至连续相中,在涡旋的条件下加入到8mL的3%的碳酸氢铵溶液,超声乳化30min,形成水包油型乳化液;
(4)向步骤(3)所得乳化液中加入3ml浓度为30mg/mL冻干保护剂,真空冷冻干燥即得。其中,冻干保护剂选自海藻糖与羟乙基淀粉的组合物(重量比1:0.5)。
所述真空冷冻干燥工艺为:于5℃进箱,保持1小时,降温至-40~℃预冻4h,启动真空泵,将干燥箱真空度抽到1-5Pa,缓慢升温至-20℃真空干燥6h;将干燥箱真空度抽到10-15Pa,缓慢升温至0℃真空干燥6h;将干燥箱真空度抽到15-20Pa,继续升温至20℃真空干燥2h;将干燥箱真空度抽到1-5Pa,继续升温至30℃真空干燥2h。缓慢升温速率为:2℃/min。
微球中磺酸贝托斯汀的包封率为87.5%,载药量11.2%。
实施例2
(1)称取5g苯磺酸贝托斯汀,溶入20mL乙酸乙酯中作为分散相;
(2)称取40g聚乳酸-羟基乙酸共聚物和4g聚乙烯醇,溶入100mL乙醇水溶液中作为连续相;
(3)将分散相缓慢滴加至连续相中,在涡旋的条件下加入到10mL的3%的碳酸氢铵溶液,超声乳化30min,形成水包油型乳化液;
(4)向步骤(3)所得乳化液中加入4ml浓度为30mg/mL冻干保护剂,真空冷冻干燥即得。其中,冻干保护剂选自甘露醇与羟乙基淀粉的组合物(重量比1:0.5)。
所述真空冷冻干燥工艺为:于5℃进箱,保持1小时,降温至-40~℃预冻4h,启动真空泵,将干燥箱真空度抽到1-5Pa,缓慢升温至-20℃真空干燥6h;将干燥箱真空度抽到10-15Pa,缓慢升温至0℃真空干燥6h;将干燥箱真空度抽到15-20Pa,继续升温至20℃真空干燥2h;将干燥箱真空度抽到1-5Pa,继续升温至30℃真空干燥2h。缓慢升温速率为:4℃/min。
微球中磺酸贝托斯汀的包封率为87.1%,载药量11.5%。
实施例3
(1)称取5g苯磺酸贝托斯汀,溶入20mL乙酸乙酯中作为分散相;
(2)称取35g聚乳酸-羟基乙酸共聚物和3g聚乙烯醇,溶入80mL乙醇水溶液中作为连续相;
(3)将分散相缓慢滴加至连续相中,在涡旋的条件下加入到8mL的3%的碳酸氢铵溶液,超声乳化30min,形成水包油型乳化液;
(4)向步骤(3)所得乳化液中加入5ml浓度为30mg/mL冻干保护剂,真空冷冻干燥即得。其中,冻干保护剂选自甘露醇与羟乙基淀粉的组合物(重量比1:1)。
所述真空冷冻干燥工艺为:于5℃进箱,保持1小时,降温至-40~℃预冻4h,启动真空泵,将干燥箱真空度抽到1-5Pa,缓慢升温至-20℃真空干燥6h;将干燥箱真空度抽到10-15Pa,缓慢升温至0℃真空干燥6h;将干燥箱真空度抽到15-20Pa,继续升温至20℃真空干燥2h;将干燥箱真空度抽到1-5Pa,继续升温至30℃真空干燥2h。缓慢升温速率为:3℃/min。
微球中磺酸贝托斯汀的包封率为87.8%,载药量11.9%。
实施例4
(1)称取5g苯磺酸贝托斯汀,溶入20mL乙酸乙酯中作为分散相;
(2)称取38g聚乳酸-羟基乙酸共聚物和3g多元醇脂肪酸酯和聚乙烯醇的组合物(重量比为1:2),溶入80mL乙醇水溶液中作为连续相;
(3)将分散相缓慢滴加至连续相中,在涡旋的条件下加入到8mL的3%的碳酸氢铵溶液,超声乳化30min,形成水包油型乳化液;
(4)向步骤(3)中的乳化液中加入10mL的4%的海藻酸钠-羧甲基壳聚糖水溶液(海藻酸钠:羧甲基壳聚糖的重量比为2:1),超声乳化20min,形成乳化液;
(5)向步骤(4)所得乳化液中加入5ml浓度为30mg/mL冻干保护剂,真空冷冻干燥即得。其中,冻干保护剂选自甘露醇与羟乙基淀粉的组合物(重量比1:0.5)。
所述真空冷冻干燥工艺为:于5℃进箱,保持1小时,降温至-40~℃预冻4h,启动真空泵,将干燥箱真空度抽到1-5Pa,缓慢升温至-20℃真空干燥6h;将干燥箱真空度抽到10-15Pa,缓慢升温至0℃真空干燥6h;将干燥箱真空度抽到15-20Pa,继续升温至20℃真空干燥2h;将干燥箱真空度抽到1-5Pa,继续升温至30℃真空干燥2h。缓慢升温速率为:3℃/min。
微球中磺酸贝托斯汀的包封率为87.5%,载药量12.2%。
对比例1
对比例1同实施例1,不同之处在于步骤(3)中未添加碳酸氢铵溶液,制备得到微球。
测得微球中磺酸贝托斯汀的包封率为86.9%,载药量6.5%。
对比例2
对比例2同实施例1,不同之处在于真空冷冻干燥工艺不同,本对比例的真空冷冻干燥工艺为:于5℃进箱,保持1小时,降温至-40~℃预冻4h,启动真空泵,将干燥箱真空度抽到15-20Pa,保持真空度不变,缓慢升温至-20℃真空干燥6h,缓慢升温至0℃真空干燥6h,继续升温至20℃真空干燥2h,继续升温至30℃真空干燥2h。缓慢升温速率为:3℃/min。
测得微球中磺酸贝托斯汀的包封率为85.9%,载药量7.9%。
实验例1包封率与载药量测定
取1mg实施例和对比例微球置于10mL容量瓶中,用氯仿超声破乳,定容,摇匀,过0.22μm的滤膜,进样1μl,计算苯磺酸贝托斯汀的总药量;另外取1mg苯磺酸贝托斯汀微球加入丙酮,过滤取滤液,除去丙酮后,用氯仿定容至10mL,摇匀,过0.22μm的滤膜,进样1μL,测定游离苯磺酸贝托斯汀的总含量。
按下列公式计算包封率与载药量:
包封率=苯磺酸贝托斯汀微球中所含的药量/苯磺酸贝托斯汀微球中包封与未包封的总药量×100%;
载药量=苯磺酸贝托斯汀微球所含药物量/苯磺酸贝托斯汀微球的总重×100%。
实验例2冻干保护剂的筛选
本实验主要针对冻干保护剂进行筛选,其制备方法同实施例1,不同之处在于所用冻干保护剂不同,详见表1:
表1
研究结果表明:在真空冻干过程中添加冻干保护剂尤为重要,能够避免药物在干燥过程中损耗,提高微球的载药量。优选的,所述冻干保护剂选自山梨醇与羟乙基淀粉的组合物,其制备的微球载药量最好。
实验例3微球释放度测定
精密称取干燥的含药微球0.100g置于10ml具塞试管中,以pH为7.4的磷酸盐缓冲液(含0.05%的十二烷基硫酸钠)10ml为释放介质,置于恒温水域摇床中,在震荡速度lOOrpm、温度37℃±0.5℃条件下进行微球的体外释放度测定。分别在0小时、1天、4天、7天、10天、13天、16天、19天、21天、24天各取0.5ml释放介质用于高效液相色谱法测定苯磺酸贝托斯汀的含量,并补充新鲜的释放介质。
图1为本申请实施例和对比例所制备的苯磺酸贝托斯汀微球制剂的体外累计释放曲线对比图。由图1可以看出,较对比例而言,本发明实施例制备的苯磺酸贝托斯汀微球制剂具有良好的释放效果,7天内累计释放量均小于30%,其释放周期为24天。
以上所述,仅是本发明的较佳实施例,并非对本发明作任何形式上的限制,任何熟悉本专业的技术人员,在不脱离本发明技术方案范围内,依据本发明的技术实质,对以上实施例所作的任何简单的修改、等同替换与改进等,均仍属于本发明技术方案的保护范围之内。
- 一种苯磺酸贝托斯汀药物组合物及其制备方法
- 一种苯磺酸贝托斯汀的制备方法
