用于治疗骨髓纤维化的化合物
文献发布时间:2023-06-19 18:30:43
相关申请的交叉引用
本申请要求于2019年12月26日提交的标题为“COMPOUNDS FOR THE TREATMENT OFMYELOFIBROSIS”的美国临时专利申请No.62/953,654的权益,其内容在此通过引用并入本文。
技术领域
本发明涉及用GSK-3β抑制剂(例如3-(5-氟苯并呋喃-3-基)-4-(5-甲基-5H-[1,3]间二氧杂环戊烯并[4,5-f]吲哚-7-基)吡咯-2,5-二酮),任选地与JAK抑制剂(例如鲁索替尼(ruxolitinib))组合来治疗骨髓纤维化的方法。
背景技术
骨髓纤维化(myelofibrosis,MF)由于作为真正的恶性肿瘤和骨髓纤维化过度的混合而是致命的。尽管JAK2抑制剂提供了显著的临床益处,但其疾病缓解活性是有限的,并且需要与其他靶向药剂合理的组合,特别是在其中存活期短的MF中。
因此,仍然需要改进的MF治疗。
发明概述
化合物3-(5-氟苯并呋喃-3-基)-4-(5-甲基-5H-[1,3]间二氧杂环戊烯并[4,5-f]吲哚-7-基)吡咯-2,5-二酮(下文中称为“9-ING-41”)是具有抗肿瘤活性的小分子和强效选择性的GSK-3β抑制剂(Pal 2014;Ugolkov 2016;Ugolkov 2017)。其通过下调NF-κB来发挥作用并且降低NF-κB靶基因周期蛋白D1、Bcl-2、抗凋亡蛋白(XIAP)和B细胞淋巴瘤-超大型(B-cell lymphoma-extra large,Bcl-XL)的表达,从而导致在多种实体瘤细胞和淋巴瘤细胞系以及患者来源异种移植物(patient derived xenograft,PDX)模型中抑制肿瘤生长。NF-κB在癌细胞中具有组成性活性并且促进抗凋亡分子的表达。NF-κB激活在已经变得具有化学抗性和放射抗性的癌细胞中是特别重要的,因此认为GSK-3β的抑制可克服人癌症中NF-κB介导的化学抗性。
已发现9-ING-41可用于治疗某些形式的癌症,例如骨髓纤维化。
因此,在一个方面中,本发明提供了通过向患者施用治疗有效量的GSK-3β抑制剂(例如9-ING-41)或其可药用盐在患者中治疗骨髓纤维化的方法。
因此,在另一个方面中,本发明提供了通过向患者施用与治疗有效量的JAK抑制剂(例如鲁索替尼或菲卓替尼(fedratinib))或其可药用盐组合的治疗有效量的GSK-3β抑制剂(例如9-ING-41)或其可药用盐在患者中治疗骨髓纤维化的方法。
附图简述
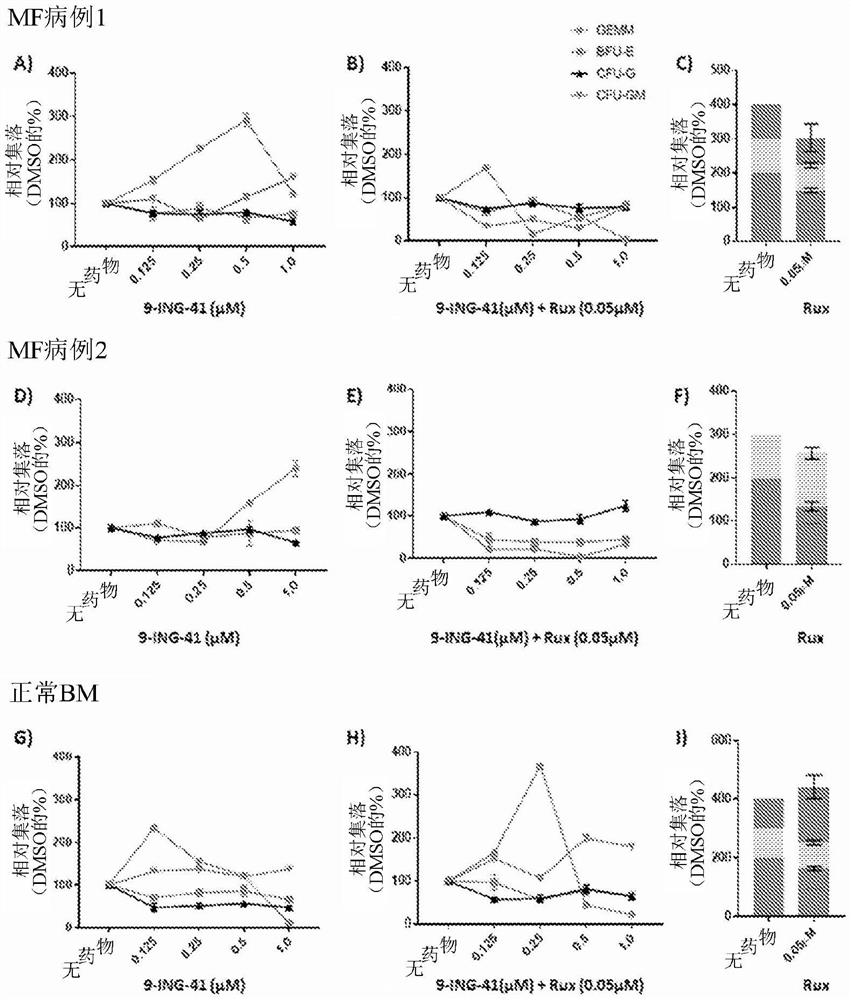
图1A-1I示出了在单独或与鲁索替尼(0.05μM)组合的9-ING-41情况下相对于%DMSO(未处理)按集落类型绘制的造血集落生长频率。图1A示出了MF病例1:仅9-ING-41。图1B示出了MF病例1:9-ING-41+鲁索替尼。图1C示出了MF病例1:仅鲁索替尼。图1D示出了MF病例2:仅9-ING-41。图1E示出了MF病例2:9-ING-41+鲁索替尼。图1F示出了MF病例2:仅鲁索替尼。图1G示出了正常骨髓(Bone Marrow,BM):仅9-ING-41。图1H示出了正常BM:9-ING-41+鲁索替尼。图1I示出了正常BM:仅鲁索替尼。集落类型如下:CFU-GM=粒细胞/单核细胞(灰色),CFU-G=粒细胞(黑色),BFU-E=红系细胞(erythroid)(红色),GEMM=原始粒细胞/红系细胞/巨噬细胞/单核细胞(蓝色)。数据表示为未处理(仅DMSO)的百分比并且按集落类型和处理来绘制。误差棒表示标准偏差。数据来自Terra Lasho,Mayo Clinic,Rochester,MN。
图2A-2F示出了在MF(n=2)和正常骨髓(n=1)中,在9-ING-41单独和与亚治疗水平的鲁索替尼(0.05μM)组合的情况下GEMM的集落频率比较(按DMSO中GEMM(%)计)。集落作为未处理(DMSO)的百分比绘制。图2A示出了MF病例1:DMSO、仅鲁索替尼、仅9-ING-41和9-ING-41+鲁索替尼。图2B示出了MF病例1:分别是DMSO、仅鲁索替尼、仅9-ING-41和9-ING-41+鲁索替尼的代表性集落形态。图2C示出了MF病例2:DMSO、仅鲁索替尼、仅9-ING-41和9-ING-41+鲁索替尼。图2D示出了MF病例2:分别是DMSO、仅鲁索替尼、仅9-ING-41和9-ING-41+鲁索替尼的代表性集落形态。图2E示出了正常骨髓(BM):DMSO、仅鲁索替尼、仅9-ING-41和9-ING-41+鲁索替尼。图2F示出了MF病例2:分别是DMSO、仅鲁索替尼、仅9-ING-41以及9-ING-41+鲁索替尼的代表性集落形态。照片尺寸代表2mm×2mm区域。数据来自Terra Lasho,MayoClinic,Rochester,MN。
发明详述
1.
骨髓纤维化(MF)是一种特征在于克隆性造血无效、脾肿大、骨髓纤维化和倾向于转化成急性白血病的骨髓增殖性肿瘤(Scheiber 2019)。JAK2、CALR和MPL中突变的发现集中在激活的JAK-STAT信号传导作为MF的主要驱动因素上。两种JAK抑制剂已被FDA批准用于治疗患有晚期MF的患者。然而,单独的JAK抑制在大多数患者中不足以长期缓解且提供适度的(如果有的话)持续的疾病缓解作用。实现对JAK抑制剂的持续充分的暴露是最佳治疗结果的关键因素,但是不良事件(特别是骨髓抑制)导致大多数患者剂量减少或中断。因此,具有独立于直接JAK-STAT抑制的作用模式的抗肿瘤药剂是特别令人感兴趣的,因为其是可使病理性纤维化消退的药剂——即一种最近已被证明在MF中具有临床价值的方法(Verstovsek 2015)。
糖原合酶激酶-3(glycogen synthase kinase,GSK-3)是丝氨酸(S)/苏氨酸(T)(ST)激酶,其最初被描述成是代谢(特别是糖原生物合成)的关键调节剂(Woodgett 1990)。此后,已表明其通过调节大量且多样化数目的底物在多种疾病过程(包括癌症、免疫病症、代谢病症、胸膜纤维化和神经系统病症)中发挥作用(Boren 2017;Farghaian 2011;Gao2011;Wang 2011a;Klamer 2010;Henriksen 2010)。GSK-3具有两种普遍表达且高度保守的同种型(糖原合酶激酶-3α(GSK-3α)和糖原合酶激酶-3β(GSK-3β)),其同时具有共有和特有的底物,以及功能性效应。GSK-3存在于所有真核生物中。其是许多信号传导途径(包括对Wnt、G蛋白偶联受体和受体酪氨酸激酶的细胞响应)的关键调节剂。GSK-3在细胞中通常具有组成性活性,并且通过其活性的抑制来进行调节。与其他蛋白激酶不同,GSK-3更喜欢已致敏的底物,即预先被另外激酶磷酸化的底物(Doble 2003)。
在癌症中,许多焦点放在GSK-3β在肿瘤进展中的作用,并且其对癌基因(β-联蛋白、周期蛋白D1和c-Myc)、细胞周期调节剂(例如p27Kip1)以及上皮-间质转化调节剂(例如锌指蛋白SNAI1、Snail)的调节已被广泛描述(Doble 2007;Gregory 2003;An 2008;Lin2000;Wang 2013)。最近,已表明GSK-3β的异常过表达通过对促存活的活化B细胞的核因子κ-轻链增强子(NF-κB)和c-Myc途径以及对肿瘤坏死因子(TNF)-相关凋亡诱导配体(tumornecrosis factor(TNF)-related apoptosis-inducing ligand,TRAIL)以及p53介导的凋亡机制(Liao 2003;Tan 2005)的不同作用来在多种实体瘤(包括胰腺癌、卵巢癌、结肠癌和胶质母细胞瘤)中促进肿瘤生长和化学治疗抗性(Ougolkov 2005;Fu 2011;Shakoori2005;Mai2009;Miyashita 2009a)。因此,GSK-3β是人恶性肿瘤中潜在的非常重要的治疗靶标。
虽然GSK-3是一种ST蛋白激酶,其最初被描述成是参与糖原代谢的关键酶(Woodgett 1990;Welsh 1993),但是现在还已知其调节广泛多种的细胞功能,从糖原代谢到细胞周期调节和增殖不等(Cohen 2001)。GSK-3通过磷酸化发挥其功能,从而调节许多代谢、信号传导和结构蛋白的功能(Cohen 2001)。其也与多种人疾病的发病机制有关,所述人疾病包括II型糖尿病、阿尔茨海默病(Alzheimer’s disease)、双相障碍、炎症、胸膜纤维化和癌症(Boren 2017;Pal 2014)。在哺乳动物中,GSK-3有两种高度同源的形式(GSK-3-α和GSK-3β)(Cohen 2001),这二者均表现出激酶活性(Woodgett 1990)。尽管历史上GSK-3β由于其使促癌分子(例如c-Myc(Sears 2000)、周期蛋白D1(Diehl 1998)和β-联蛋白(Hart1998))磷酸化,从而靶向这些分子以进行泛素-蛋白酶体降解的能力而被认为是潜在的肿瘤抑制子,但最近的报道表明GSK-3是癌细胞增殖和存活的正调节剂(Wang 2011a;Wang2013;Ougolkov 2005;Shakoori 2005;Pal 2014;Bilim 2009;Cao 2006a;Carter 2014;Dickey 2011;Duffy 2014;Gaisina 2009;Hilliard 2011;Kotliarova 2008;Kunnimalaiyaan 2007;Miyashita 2009b;Naito 2010;Ougolkov 2006a;Ougolkov 2008;Ougolkov 2007;Ougolkov2006b;Shin 2014;Wang 2011;Wang 2011b;Wang 2009;Wang2008;Zeng 2014;Zhu 2011),并且促进了GSK-3特异性抑制剂作为治疗靶标的发展。
GSK-3β先前被描述成是人胰腺癌、结肠癌、膀胱癌和肾癌细胞以及慢性淋巴细胞白血病中的潜在抗癌靶标(Shakoori 2005;Bilim 2009;Gaisina 2009;Naito 2010;Ougolkov 2006a;Ougolkov 2007)。最近的研究表明,GSK-3β也是胶质母细胞瘤、神经母细胞瘤、甲状腺癌、卵巢癌、结直肠癌、肺癌和前列腺癌中有前景的治疗靶标(Miyashita2009a;Pal2014;Carter 2014;Dickey 2011;Duffy 2014;Hilliard 2011;Kotliarova2008;Kunnimalaiyaan 2007;Shin 2014;Wang 2009;Zeng 2014;Zhu 2011;Cao2006b)。基于马来酰亚胺的强效GSK-3β抑制剂9-ING-41被确定为化学抗性人乳腺癌中靶向治疗的候选剂(Ugolkov 2016)。其抗增殖活性涉及G0-G1期和G2-M期阻滞,即一种在肾细胞癌细胞系中细胞周期分析中很明显的机制(Pal 2014)。
NF-κB被认为是最重要的转录因子之一,并且其激活在促进人癌症进展、转移和化学抗性中发挥必不可少的作用(Aggarwal 2004;Tas 2009)。已表明GSK-3β在这种背景下具有相反的作用,即一方面抑制Wnt/β-联蛋白信号传导,但另一方面通过NF-κB途径维持细胞存活和增殖(Shakoori2005)。最近的数据表明,GSK-3β部分通过调节NF-κB介导的抗凋亡分子的表达来正调节人癌细胞存活(Bilim 2009)。小鼠中GSK-3β基因的破坏导致由于肝细胞凋亡和大量肝变性而引起的胚胎致死(embryonic lethality),即一种类似于核因子κ-B激酶亚基β(IKKβ)基因抑制剂或NF-κB p65的破坏的表型(Hoeflich 2000)。这些发现表明GSK-3β与NF-κB途径激活之间存在关联,并且支持GSK-3β作为人癌症中的候选治疗靶标。
9-ING-41是具有抗肿瘤活性的小分子的强效选择性GSK-3β抑制剂(Pal 2014;Ugolkov 2016;Ugolkov 2017)。其通过下调NF-κB来发挥作用并且降低NF-κB靶基因周期蛋白D1、Bcl-2、抗凋亡蛋白(XIAP)和B细胞淋巴瘤-超大型(Bcl-XL)的表达,从而导致在多种实体瘤细胞和淋巴瘤细胞系以及患者来源异种移植物(PDX)模型中抑制肿瘤生长。NF-κB在癌细胞中具有组成性活性并且促进抗凋亡分子的表达。NF-κB激活在已经变得具有化学抗性和放射抗性的癌细胞中是特别重要的,因此认为GSK-3β的抑制可克服人癌症中NF-κB介导的化学抗性。
已发现9-ING-41可用于治疗某些形式的癌症,例如骨髓纤维化。
在一些实施方案中,本发明提供了用于在患者中治疗骨髓纤维化的方法,其包括向患者施用治疗有效量的GSK-3β抑制剂(例如9-ING-41)或其可药用盐。
在一些实施方案中,本发明提供了用于治疗骨髓纤维化的GSK-3β抑制剂(例如9-ING-41)或其可药用盐。
在一些实施方案中,本发明提供了GSK-3β抑制剂(例如9-ING-41)或其可药用盐治疗骨髓纤维化的用途。
在一些实施方案中,本发明提供了GSK-3β抑制剂(例如9-ING-41)或其可药用盐在制备用于治疗骨髓纤维化的药物中的用途。
在一些实施方案中,本发明提供了用于在患者中治疗实体瘤的方法,其包括向患者施用与JAK抑制剂(例如鲁索替尼)或其可药用盐组合的治疗有效量的GSK-3β抑制剂(例如9-ING-41)或其可药用盐。
在一些实施方案中,本发明提供了用于治疗骨髓纤维化的药物组合,其包含GSK-3β抑制剂(例如9-ING-41)或其可药用盐和JAK抑制剂(例如鲁索替尼)或其可药用盐。
在一些实施方案中,本发明提供了包含以下的药物组合治疗骨髓纤维化的用途:GSK-3β抑制剂(例如9-ING-41)或其可药用盐和JAK抑制剂(例如鲁索替尼)或其可药用盐。
在一些实施方案中,本发明提供了GSK-3β抑制剂(例如9-ING-41)或其可药用盐在制备用于与JAK抑制剂(例如鲁索替尼)或其可药用盐组合治疗骨髓纤维化的药物中的用途。
在一些实施方案中,本发明提供了药盒,其包含9-ING-41或其可药用盐和鲁索替尼或其可药用盐。
在一些实施方案中,本发明提供了用于治疗骨髓纤维化的药盒,其包含9-ING-41或其可药用盐和鲁索替尼或其可药用盐。
在一些实施方案中,本发明提供了包含9-ING-41或其可药用盐和鲁索替尼或其可药用盐的药盒治疗骨髓纤维化的用途。
2.
本文中使用的“9-ING-41”是指3-(5-氟苯并呋喃-3-基)-4-(5-甲基-5H-[1,3]间二氧杂环戊烯并[4,5-f]吲哚-7-基)吡咯-2,5-二酮,其具有以下结构:
本文中使用的术语“可药用盐”是指在合理医学判断的范围内适用于与人和低等动物的组织接触而没有过度毒性、刺激性、变应性应答等并与合理的收益/风险比相称的那些盐。可药用盐是本领域公知的。例如,S.M.Berge et al.在J.Pharmaceutical Sciences,1977,66,1–19(通过引用并入本文)中详细描述了可药用盐。本发明化合物的可药用盐包括来源于合适的无机酸和碱以及有机酸和碱的那些。可药用的无毒酸加成盐的一些实例是与无机酸(例如盐酸、氢溴酸、磷酸、硫酸和高氯酸)或与有机酸(例如乙酸、草酸、马来酸、酒石酸、柠檬酸、琥珀酸或丙二酸)或通过使用本领域中使用的其他方法(例如离子交换)形成的氨基盐。另一些可药用盐包括己二酸盐、藻酸盐、抗坏血酸盐、天冬氨酸盐、苯磺酸盐、苯甲酸盐、硫酸氢盐、硼酸盐、丁酸盐、樟脑酸盐、樟脑磺酸盐、柠檬酸盐、环戊烷丙酸盐、二葡萄糖酸盐、十二烷基硫酸盐、乙磺酸盐、甲酸盐、富马酸盐、葡庚糖酸盐、甘油磷酸盐、葡糖酸盐、半硫酸盐、庚酸盐、己酸盐、氢碘化物、2-羟基-乙磺酸盐、乳糖醛酸盐(lactobionate)、乳酸盐、月桂酸盐、月桂基硫酸盐、苹果酸盐、马来酸盐、丙二酸盐、甲磺酸盐、2-萘磺酸盐、烟酸盐、硝酸盐、油酸盐、草酸盐、棕榈酸盐、扑酸盐、果胶酸盐(pectinate)、过硫酸盐、3-苯基丙酸盐、磷酸盐、新戊酸盐、丙酸盐、硬脂酸盐、琥珀酸盐、硫酸盐、酒石酸盐、硫氰酸盐、对甲苯磺酸盐、十一酸盐、戊酸盐等。
来源于合适碱的盐包括碱金属、碱土金属、铵盐和N
除非另有说明,否则本文中所述的结构还意在包括该结构的所有异构体形式(例如,对映体、非对映体和几何(或构象)形式);例如,对于每个不对称中心的R和S构型,Z和E双键异构体以及Z和E构象异构体。因此,本发明化合物的单一立体化学异构体以及对映体、非对映体和几何(或构象)混合物均在本发明的范围内。除非另有说明,否则本发明化合物的所有互变异构体形式均在本发明的范围内。另外,除非另有说明,否则本文描述的结构还意在包括区别仅在于存在一个或更多个同位素富集原子的化合物。例如,包括将氢替换为氘或氚或将碳替换为富
本文中使用的术语“约”或“大约”具有给定值或范围的20%以内的含义。在一些实施方案中,术语“约”是指在给定值的20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%或1%以内。
本文中使用的术语“治疗”及其变化形式是指本文中所述的疾病或病症或者其一种或更多种症状的逆转、减轻、其发生的延迟或其进展的抑制。在一些实施方案中,可以在一种或更多种症状发生之后施用治疗。在另一些实施方案中,可以在没有症状的情况下施用治疗。例如,治疗可在症状发作之前施用于易感个体(例如,根据症状史和/或根据遗传或其他易感因素)。在症状消退之后也可以继续治疗,例如以预防或延迟其复发。
本文中使用的术语“患者”意指动物,优选哺乳动物,并且最优选人,优选至少18岁龄。
3.
在一些实施方案中,本发明提供了在患者中治疗骨髓纤维化的方法,其包括向所述患者施用治疗有效量的糖原合酶激酶-3β(GSK-3β)抑制剂或其可药用盐。在一些实施方案中,GSK-3β抑制剂是9-ING-41或其可药用盐。
在一些实施方案中,GSK-3β抑制剂或其可药用盐以约1mg/kg至约50mg/kg施用于患者。在一些实施方案中,GSK-3β抑制剂或其可药用盐以约5mg/kg至约15mg/kg施用于患者。在一些实施方案中,向患者施用约9mg/kg的GSK-3β抑制剂或其可药用盐。
在一些实施方案中,GSK-3β抑制剂或其可药用盐在28天的治疗周期期间每周一次施用于患者。在一些实施方案中,GSK-3β抑制剂或其可药用盐在28天的治疗周期期间每周两次施用于患者。在一些实施方案中,GSK-3β抑制剂或其可药用盐在一周的第1天和第4天施用于患者。在一些实施方案中,GSK-3β抑制剂或其可药用盐静脉内施用于患者。
在一些实施方案中,治疗骨髓纤维化的方法还包括向患者施用治疗有效量的JAK抑制剂或其可药用盐。在一些实施方案中,JAK抑制剂选自帕克替尼(pacritinib)、莫洛替尼(momelotinib)、菲卓替尼和鲁索替尼、或其可药用盐。在一些实施方案中,JAK抑制剂是鲁索替尼或其可药用盐。
在一些实施方案中,JAK抑制剂或其可药用盐以约1mg至约50mg施用于患者。在一些实施方案中,JAK抑制剂或其可药用盐以以下量施用于患者:对于血小板计数≥20,000/mL的患者,以约5mg每天两次;或者对于血小板计数≥50,000/mL的患者,以约10mg每天两次;或者对于血小板计数≥100,000/mL的患者,以约15mg每天两次;或者对于血小板计数≥200,000/mL的患者,以约20mg每天两次。
在一些实施方案中,JAK抑制剂或其可药用盐在28天的治疗周期期间每天两次施用于患者。在一些实施方案中,JAK抑制剂或其可药用盐经口施用于患者。
在一些实施方案中,本发明提供了用于在患者中治疗骨髓纤维化的方法,其包括向患者施用治疗有效量的9-ING-41或其可药用盐。
在一些实施方案中,本发明提供了在患者中治疗骨髓纤维化的方法,其包括向患者施用与治疗有效量的JAK抑制剂或其可药用盐组合的治疗有效量的糖原合酶激酶-3β(GSK-3β)抑制剂或其可药用盐。在一些实施方案中,GSK-3β抑制剂是9-ING-41或其可药用盐。
在一些实施方案中,GSK-3β抑制剂或其可药用盐以约1mg/kg至约50mg/kg施用于患者。在一些实施方案中,GSK-3β抑制剂或其可药用盐以约5mg/kg至约15mg/kg施用于患者。在一些实施方案中,向患者施用约9mg/kg的GSK-3β抑制剂或其可药用盐。
在一些实施方案中,GSK-3β抑制剂或其可药用盐在28天的治疗周期期间每周一次施用于患者。在一些实施方案中,GSK-3β抑制剂或其可药用盐在28天的治疗周期期间每周两次施用于患者。在一些实施方案中,GSK-3β抑制剂或其可药用盐在一周的第1天和第4天施用于患者。在一些实施方案中,GSK-3β抑制剂或其可药用盐静脉内施用于患者。
在一些实施方案中,JAK抑制剂选自帕克替尼、莫洛替尼、菲卓替尼和鲁索替尼、或其可药用盐。在一些实施方案中,JAK抑制剂是鲁索替尼或其可药用盐。
在一些实施方案中,JAK抑制剂或其可药用盐以约1mg至约50mg施用于患者。在一些实施方案中,JAK抑制剂或其可药用盐以以下量施用于患者:对于血小板计数≥20,000/mL的患者,以约5mg每天两次;或者对于血小板计数≥50,000/mL的患者,以约10mg每天两次;或者对于血小板计数≥100,000/mL的患者,以约15mg每天两次;或者对于血小板计数≥200,000/mL的患者,以约20mg每天两次。
在一些实施方案中,JAK抑制剂或其可药用盐在28天的治疗周期期间每天两次施用于患者。在一些实施方案中,JAK抑制剂或其可药用盐经口施用于患者。
在一些实施方案中,本发明提供了在患者中治疗骨髓纤维化的方法,其包括向患者施用治疗有效量的9-ING-41或其可药用盐。
在一些实施方案中,9-ING-41或其可药用盐以约5mg/kg至约15mg/kg施用于患者。在一些实施方案中,向患者施用约9mg/kg的9-ING-41或其可药用盐。在一些实施方案中,9-ING-41或其可药用盐在28天的治疗周期期间于每周的第1天和第4天静脉内施用于患者。
在一些实施方案中,治疗骨髓纤维化的方法还包括向患者施用治疗有效量的鲁索替尼或其可药用盐。在一些实施方案中,鲁索替尼或其可药用盐以约1mg至约50mg经口施用于患者。在一些实施方案中,鲁索替尼或其可药用盐以以下量经口施用于患者:对于血小板计数≥20,000/mL的患者,以约5mg每天两次;或者对于血小板计数≥50,000/mL的患者,以约10mg每天两次;或者对于血小板计数≥100,000/mL的患者,以约15mg每天两次;或者对于血小板计数≥200,000/mL的患者,以约20mg每天两次。
在一些实施方案中,本发明提供了在患者中治疗骨髓纤维化的方法,其包括向患者施用与治疗有效量的鲁索替尼或其可药用盐组合的治疗有效量的9-ING-41或其可药用盐。
在一些实施方案中,9-ING-41或其可药用盐以约1mg/kg至约50mg/kg施用于患者。在一些实施方案中,9-ING-41或其可药用盐以约5mg/kg至约15mg/kg施用于患者。在一些实施方案中,向患者施用约9mg/kg的9-ING-41或其可药用盐。在一些实施方案中,9-ING-41或其可药用盐在28天的治疗周期期间于每周的第1天和第4天静脉内施用于患者。
在一些实施方案中,鲁索替尼或其可药用盐以以下量经口施用于患者:对于血小板计数≥20,000/mL的患者,以约5mg每天两次;或者对于血小板计数≥50,000/mL的患者,以约10mg每天两次;或者对于血小板计数≥100,000/mL的患者,以约15mg每天两次;或者对于血小板计数≥200,000/mL的患者,以约20mg每天两次。
在一些实施方案中,本发明提供了药盒,其包含9-ING-41或其可药用盐和鲁索替尼或其可药用盐。在一些实施方案中,所述药盒包含在治疗骨髓纤维化的方法中使用所述药盒的一组说明。在一些实施方案中,在药盒中提供的该组说明可以适当地写在例如纸上或药盒包装上,或者在其他方面作为用于在互联网上查找说明的合适的代码(例如QR码)或网站地址链接提供。
在一些实施方案中,通过抑制肿瘤的进一步生长来治疗肿瘤。在一些实施方案中,通过将肿瘤尺寸(例如,体积或质量)相对于治疗之前的肿瘤尺寸减少至少5%、10%、25%、50%、75%、90%或99%来治疗肿瘤。在一些实施方案中,通过将患者中肿瘤量相对于治疗之前的肿瘤量减少至少5%、10%、25%、50%、75%、90%或99%来治疗肿瘤。
提供以下实施例仅出于举例说明目的并且不应解释为以任何方式限制本发明。
实施例
可用于本发明方法的化合物包括9-ING-41,其描述于美国专利8,207,216(Kozikowski et al.)中,通过引用整体并入。
为了研究9-ING-41(单独和与鲁索替尼组合)对MF生长和增殖的作用,使用来自患有先前未经治疗MF的患者和正常骨髓的原代细胞进行离体集落测定。实验旨在评估治疗和未经治疗两种情况下存在于血液中的干细胞/祖细胞的数目、尺寸和形态。
在存在仅DMSO、仅9-ING-41或者9-ING-41和鲁索替尼(0.05uM)组合的情况下,将来自MF患者和来自健康患者(对照)的骨髓的外周血单个核细胞一式两份平板接种于含有细胞因子的甲基纤维素中。在十天之后对集落进行计数,并且计算集落生长频率、分布和形态。在添加9-ING-41之后,红系细胞(BFU-E)、粒细胞(CFU-G)和粒细胞/单核细胞(CFU-GM)集落的存在在比例上保持相同,然而与正常相比,MF病例中更原始的粒细胞/红系细胞/巨噬细胞/单核细胞(GEMM)集落生长相对于9-ING-41浓度增加,如图1(例如,图1A、1D和1G)和图2(例如,图2A、2C和2E)中所示。
这表明9-ING-41对GSK3β抑制的选择性原始增殖和/或分化作用。9-ING-41与鲁索替尼(以亚治疗水平50nM)的组合处理显示出以剂量依赖性方式消除了这种效应,如图1(例如,图1B、1E和1H)和图2(例如,图2A、2C和2E)中所示。使用单独亚治疗浓度0.05μM鲁索替尼(用于组合实验)对集落尺寸的作用的比较示于图1中(例如,图1C、1F和1I)。
出人意料地,观察到未经9-ING-41处理的集落形态与经9-ING-41处理的集落的形态显著不同。相对于正常骨髓,在MF病例1和2中,在未处理(DMSO)和添加仅鲁索替尼(0.05μM)的情况下,集落显示出彼此类似且不规则和杂乱无章,如图2(例如,图2B和2D)中所示。当用单独9-ING-41处理细胞时,MF病例1和2中存在非常大的、完全分化的原始集落增多,并且观察到正常骨髓中集落尺寸适度增大。在鲁索替尼与9-ING-41组合的情况下,在MF病例1和2中,原始集落的尺寸和存在显著降低,并且出现了正常、看起来健康的集落(小巧的、圆形尺寸且与正常骨髓集落相关)。
目的:
主要:评价作为单一治疗和与鲁索替尼组合的9-ING-4在患有骨髓纤维化的患者中的效力。
次要:
1)评价9-ING-41对骨髓纤维化的作用;
2)评价9-ING-41对脾体积的作用;
3)评价9-ING-41对贫血的作用;
4)评价9-ING-41对总症状评分(total symptom score,TSS)的作用,如通过骨髓纤维化症状评估表(Myelofibrosis Symptom Assessment Form,MFSAF)版本4.0专栏评估;以及
5)评估9-ING-41的药代动力学和药效学。
探索性目标包括a)通过EORTC QLQ-C30问卷来测量生活品质;b)等位基因负荷(JAK2V617F、钙网蛋白[CALR]、MPLW515L/K);c)细胞遗传响应;d)炎性细胞因子测量;以及e)外周血流式细胞术。
终点:
效力终点如下:
1)响应率(response rate,RR),其定义为根据修订的针对MF的IWG-MRT和ELN响应标准(2013)具有完全响应(Complete Response,CR)、部分响应(Partial Response,PR)或临床改善(Clinical improvement,CI)的患者的百分比;
2)响应持续时间(Duration Of Response,Dor),其定义为从记录肿瘤响应到疾病进展的时间;
3)无进展存活(Progression-Free Survival,PFS),其定义为从研究招募直至目标肿瘤进展或死亡的时间;以及
4)总存活(Overall Survival,OS),其定义为从研究进入到因任何原因死亡的时间
将通过Kaplan-Meier方法(中位数、95%CI、事件数、删失数(number censored)和Kaplan-Meier图)来总结事件发生时间(time-to event)终点(DoR、PFS和OS)。将自患者签署研究知情同意书之日开始到最终施用9-ING-41之后30天结束的时期期间监测不良事件。接受任何剂量(任何量)的9-ING-41的所有患者均包括在安全性数据的总结和列表中。总体安全性谱和耐受性将通过研究药物的类型、频率、严重程度、时机、持续时间、以及与不良事件和实验室异常的关系来表征。
研究设计
这是一项在患有晚期骨髓纤维化的患者中进行的对作为单一药剂或与鲁索替尼组合的9-ING-41的开放标签、多中心非随机化的2期研究。治疗将由每周两次静脉内(IV)输注作为单一药剂或与鲁索替尼组合的9-ING-41组成。
研究群体/患者资格-纳入标准
患者必须满足所有以下标准才有资格进入该研究:
1)能够理解并且自愿签署书面知情同意书,并且愿意且能够遵守方案要求,包括计划访视、治疗计划、实验室测试和其他研究程序;
2)年龄≥18岁;
3)具有原发性MF、PPV-MF或PET-MF的记录诊断,如由世界卫生组织分类所定义,且DIPSS plus评分≥4;
4)在研究进入时无资格或不愿意经受干细胞移植;
5)根据当地实验室参考范围,具有指定参数内的实验室功能(可重复):
-绝对中性粒细胞计数(absolute neutrophil count,ANC)≥100/mL;血小板≥20,000/mL
-转氨酶(AST/ALT)和碱性磷酸酶≤正常上限(upper limit of normal,ULN)3倍(≤ULN 10倍,则认为是MF相关的);胆红素≤ULN 1.5倍(除非患者患有吉尔伯特综合征(Gilbert’s Syndrome))
-血清淀粉酶和脂肪酶≤ULN 1.5倍;
6)具有足够的体能状态(performance status,PS):东部协作肿瘤学组(EasternCo-operative Oncology Group,ECOG)PS 0至2;
7)在首剂9-ING-41之前以指定的最小间隔接受了以下治疗/程序中任一者的最终剂量(除非研究者和研究医学协调者认为所述治疗/程序将不会危及患者安全或者干扰研究进行):
-化学治疗、免疫治疗或全身放射治疗,最长14天,或者≥5个半衰期(以较短者为准)
-全身麻醉手术——7天;
8)待接受9-ING-41加鲁索替尼的患者必须已经尝试≥12周的鲁索替尼治疗,并且需要剂量减少/中断和/或响应不充分。经研究者与研究医学协调者同意,患有明显进行性疾病的患者可在尝试鲁索替尼治疗少于12周持续时间的情况下招募到研究中。
9)有生育潜能的女性必须在首次研究治疗72小时内进行阴性基线血液或尿妊娠测试。女性在研究参与期间既不能母乳哺育也不能打算受孕,并且必须同意在研究参与期间和中止研究治疗之后的接下来100天内使用有效的避孕方法(生育控制的激素方法或屏障方法或者真正的禁欲)。
10)有生育潜能伴侣的男性患者必须采取适当的避孕措施,以避免自筛查起直至中止研究治疗之后的100天内生育孩子,并且使用适当的屏障避孕或者真正的禁欲。
11)不得接受任何其他研究产品
研究群体/患者资格-排除标准
满足以下标准中任一者的患者没有资格进入本研究:
1)妊娠或正在哺乳期;
2)已知对9-ING-41的任何组分或其制剂中使用的赋形剂过敏;
3)在外周血或骨髓活检中具有>10%的未成熟细胞(blast);
4)在首剂9-ING-41的12周内发生了心肌梗死;
5)具有被研究者或研究医学协调者认为会妨碍研究参与的任何医学和/或社交状况;
6)被认为是弱势群体的成员(例如,囚犯);或者
7)在整个研究过程中禁止草本制剂/药物。这些草本药物包括但不限于圣约翰草(St.John’s wort)、Kava、麻黄(ma huang)、银杏(Gingko biloba)、脱氢表雄酮(DHEA)、育亨宾(yohimbe)、锯棕榈(saw palmetto)和人参(Ginseng)。患者应在研究治疗的首剂之前至少7天停止使用大麻素(cannabinoid)或草本制剂/药物。
9-ING-41的施用
9-ING-41将作为单一药剂或与鲁索替尼组合以9.3mg/kg的剂量在28天的周期于每周的第1天和第4天施用。
所有患者应在每个周期给药之前72小时内称重,以确保他们不会经历相对于用于计算9-ING-41剂量的先前体重的大于10%的体重减轻或增加。根据体重变化重新计算剂量的决定应符合当地实践,然而在体重变化>10%时,则必须使用最新记录的体重重新计算剂量。
9-ING-41+鲁索替尼的施用
9.3mg/kg 9-ING-41将与鲁索替尼一起在28天的周期持续期间在第1天和第4天每周两次通过静脉内输注施用,所述鲁索替尼以最小为以下的最后先前耐受剂量进行:
对于血小板计数≥20,000/mL的患者,5mg PO每天两次;
对于血小板计数≥50,000/mL的患者,10mg PO每天两次;
对于血小板计数≥100,000/mL的患者,15mg PO每天两次;或者
对于血小板计数≥200,000/mL的患者,20mg PO每天两次。
如果患者具有血小板计数≥50,000/mL的基线3/4级贫血,则初始鲁索替尼的剂量可减少5mg PO每天两次。如果紧接研究进入之前的最后耐受鲁索替尼剂量小于以上剂量,则在与医学监测者讨论之后,可将鲁索替尼的初始研究剂量(on-study dose)减少至该剂量。
在每个治疗周期之后,如果响应被认为是不充分的,则可将鲁索替尼剂量以5mgPO每天两次的增量提高至最大25mg PO每天两次。当因除血小板减少之外的任何原因而中止治疗时,则考虑将鲁索替尼的剂量以5mg每周每天两次逐渐减少。
只要患者不具有临床上显著的进行性疾病和/或不可接受的毒性以及只要研究者认为患者从治疗中受益,患者就将继续研究药物的方案。如果患者撤回同意或者发生研究终止,则治疗也可停止(见第2.7.1节)。
安全性评价
将在整个研究中评估安全性,包括通过记录和监测不良事件(AE)(CTCAE v5)、生命体征(血压、脉搏、呼吸速率和体温)、体格检查结果、血清化学和血液学实验室值、尿分析、ECG以及伴随药物使用。除了研究评估方案中详述的那些之外,应进行符合最佳患者护理的相关评估,并且将其记录在研究病例记录表中。
效力评价
将根据2013年修订的针对MF的IWG-MRT和ELN响应标准来评价响应。只有可评价的患者才会被考虑用于效力测量。接受至少一个9-ING-41治疗周期的所有患者将被认为可评价响应。除了研究评估方案中详述的那些之外,应进行符合最佳患者护理的相关评估,并且在适当的情况下将其记录在研究病例记录表中。
将在筛查、治疗和随访期间进行护理标准评估,直至记录疾病进展、患者开始新的抗癌治疗、患者撤回其对研究参与的同意或者患者在最后一剂研究药物之后完成12个月的随访期,以先发生者为准。记录到响应的患者将需要在4至8周后进行评估,以根据护理标准确定响应。
统计学注意事项
Simon 2阶段优化模型将基于效力用于招募。
对于单一药剂9-ING-41治疗,将治疗多达10名可完全评价的患者,并且如果没有患者出现响应,则将关停研究组。否则,将增加19名另外的可完全评价的患者,总共29名患者。如果在29名患者中观察到4个或更多响应,则结论将是该方案值得进一步研究。当20%目的响应率(备择假设)相对于5%零假设响应率进行测试时,这种设计产生了0.05的I型错误率和80%的效力。
对于9-ING-41加鲁索替尼治疗,将治疗多达10名可完全评价的患者,并且如果没有患者出现响应,则将关停研究组。否则,将增加19名另外的可完全评价的患者,总共29名患者。如果在29名患者中观察到4个或更多响应,则结论将是该方案值得进一步研究。当20%目的响应率(备择假设)相对于5%零假设响应率进行测试时,这种设计产生了0.05的I型错误率和80%的效力。
将有或没有响应的患者的比例与分子、细胞生成生物标志物和可被评估为潜在的诊断或预后特征的信号的其他生物标志物的基线水平一起制成表格。由于这是开放标签的2期肿瘤学研究,因此描述性统计数据将用于所有安全性和药代动力学参数。分类变量将通过频率分布(患者的数目和百分比)进行总结,连续变量将通过平均值、标准偏差、中位数、最小值、最大值进行总结,以及事件发生时间变量将使用Kaplan-Meier方法和图针对估计的中位时间进行总结。主要目标是评估效力,如通过响应率所评估。还将评估DoR、PFS和OS,并且通过Kaplan-Meier方法(中位数、95%CI、事件数、删失数和Kaplan-Meier图)总结这些事件发生时间终点。
经历至少一个AE的患者频率将通过身体系统和根据监管活动医学词典(MedicalDictionary for Regulatory Activities,MedDRA)术语的优选术语来展示。针对每个AE收集的详细信息将包括事件描述、事件持续时间、AE是否严重、严重程度、与研究药物的关系、采取的措施、临床结果以及是否为DLT。AE的严重程度将根据CTCAE v5进行分级。将列出归类为剂量限制的AE。
生命体征和ECG将使用描述性统计数据来总结。将制作总结表来检查实验室测量值随时间的分布。可提供移位表(shift table)来检查实验室毒性的分布。
使用骨髓增殖性肿瘤症状评估表总症状评分(Myeloproliferative NeoplasmSymptom Assessment Form Total Symptom Score,MPN-SAF-TSS)来记录患者报告的疾病症状性负担。患者在筛查/基线之前过去一周内记录10种症状中每一种从0到10的难度级别(0表示没有难度,渐进性难度直至10作为可想象得到的最差的),并且自给药周期开始记录乏力级别。患者报告每次访视之前过去24小时内的乏力级别,0表示无乏力,渐进性恶化以及10表示最差。将按组群和访视来报告每个评分和总评分的描述性统计数据。将按组群来报告每次访视时自基线起变化的描述性统计数据。
将按组群来报告以二元或有序类别报告的具有特定生物标志物的患者的比例。将报告生物性生物标志物与治疗响应之间的非参数相关性。
以上引用的参考文献全部均通过引用并入本文,无论是否具体地并入。
现在已完全描述了本发明,本领域技术人员将理解,本发明可在广泛多个等同的参数、浓度和条件内进行,而不脱离本发明的精神和范围,并且无需过多的实验。
本公开内容还涵盖以下方面:
方面1.在患者中治疗骨髓纤维化的方法,其包括向所述患者施用治疗有效量的糖原合酶激酶-3β(GSK-3β)抑制剂或其可药用盐。
方面2.方面1所述的方法,其中所述GSK-3β抑制剂是:
方面3.方面1所述的方法,其中所述GSK-3β抑制剂或其可药用盐以约1mg/kg至约50mg/kg施用于所述患者。
方面4.方面1所述的方法,其中所述GSK-3β抑制剂或其可药用盐以约5mg/kg至约15mg/kg施用于所述患者。
方面5.方面1所述的方法,其中向所述患者施用约9mg/kg的所述GSK-3β抑制剂或其可药用盐。
方面6.方面1所述的方法,其中所述GSK-3β抑制剂或其可药用盐在28天的治疗周期期间每周一次施用于所述患者。
方面7.方面1所述的方法,其中所述GSK-3β抑制剂或其可药用盐在28天的治疗周期期间每周两次施用于所述患者。
方面8.方面1所述的方法,其中所述GSK-3β抑制剂或其可药用盐在一周的第1天和第4天施用于所述患者。
方面9.方面1所述的方法,其中所述GSK-3β抑制剂或其可药用盐静脉内施用于所述患者。
方面10.方面1所述的方法,其还包括向所述患者施用治疗有效量的JAK抑制剂或其可药用盐。
方面11.方面10所述的方法,其中所述JAK抑制剂选自帕克替尼、莫洛替尼、菲卓替尼和鲁索替尼、或其可药用盐。
方面12.方面10所述的方法,其中所述JAK抑制剂是鲁索替尼或其可药用盐。
方面13.方面10所述的方法,其中所述JAK抑制剂或其可药用盐以约1mg至约50mg施用于所述患者。
方面14.方面10所述的方法,其中所述JAK抑制剂或其可药用盐以以下量施用于所述患者:
对于血小板计数≥20,000/mL的患者,以约5mg每天两次;或者
对于血小板计数≥50,000/mL的患者,以约10mg每天两次;或者
对于血小板计数≥100,000/mL的患者,以约15mg每天两次;或者
对于血小板计数≥200,000/mL的患者,以约20mg每天两次。
方面15.方面10所述的方法,其中所述JAK抑制剂或其可药用盐在28天的治疗周期期间每天两次施用于所述患者。
方面16.方面10所述的方法,其中所述JAK抑制剂或其可药用盐经口施用于所述患者。
方面17.在患者中治疗骨髓纤维化的方法,其包括向所述患者施用与治疗有效量的JAK抑制剂或其可药用盐组合的治疗有效量的糖原合酶激酶-3β(GSK-3β)抑制剂或其可药用盐。
方面18.方面17所述的方法,其中所述GSK-3β抑制剂是:
方面19.方面17所述的方法,其中所述JAK抑制剂选自帕克替尼、莫洛替尼、菲卓替尼和鲁索替尼、或其可药用盐。
方面20.方面17所述的方法,其中所述JAK抑制剂是鲁索替尼或其可药用盐。
方面21.方面17所述的方法,其中所述GSK-3β抑制剂或其可药用盐以约1mg/kg至约50mg/kg施用于所述患者。
方面22.方面17所述的方法,其中所述GSK-3β抑制剂或其可药用盐以约5mg/kg至约15mg/kg施用于所述患者。
方面23.方面17所述的方法,其中向所述患者施用约9mg/kg的所述GSK-3β抑制剂或其可药用盐。
方面24.方面17所述的方法,其中所述GSK-3β抑制剂或其可药用盐在28天的治疗周期期间每周一次施用于所述患者。
方面25.方面17所述的方法,其中所述GSK-3β抑制剂或其可药用盐在28天的治疗周期期间每周两次施用于所述患者。
方面26.方面17所述的方法,其中所述GSK-3β抑制剂或其可药用盐在一周的第1天和第4天施用于所述患者。
方面27.方面17所述的方法,其中所述GSK-3β抑制剂或其可药用盐静脉内施用于所述患者。
方面28.方面17所述的方法,其中所述JAK抑制剂或其可药用盐以约1mg至约50mg施用于所述患者。
方面29.方面17所述的方法,其中所述JAK抑制剂或其可药用盐以以下量施用于所述患者:
对于血小板计数≥20,000/mL的患者,以约5mg每天两次;或者
对于血小板计数≥50,000/mL的患者,以约10mg每天两次;或者
对于血小板计数≥100,000/mL的患者,以约15mg每天两次;或者
对于血小板计数≥200,000/mL的患者,以约20mg每天两次。
方面30.方面17所述的方法,其中所述JAK抑制剂或其可药用盐在28天的治疗周期期间每天两次施用于所述患者。
方面31.方面17所述的方法,其中所述JAK抑制剂或其可药用盐经口施用于所述患者。
方面32.在患者中治疗骨髓纤维化的方法,其包括向所述患者施用治疗有效量的:
方面33.方面32所述的方法,其中
方面34.方面32或方面33所述的方法,其中向所述患者施用约9mg/kg的
方面35.方面32至34中任一项所述的方法,其中
方面36.方面32至35中任一项所述的方法,其还包括向所述患者施用治疗有效量的鲁索替尼或其可药用盐。
方面37.方面36所述的方法,其中所述鲁索替尼或其可药用盐以以下量经口施用于所述患者:
对于血小板计数≥20,000/mL的患者,在28天的治疗周期期间以约5mg每天两次;或者
对于血小板计数≥50,000/mL的患者,在28天的治疗周期期间以约10mg每天两次;或者
对于血小板计数≥100,000/mL的患者,在28天的治疗周期期间以约15mg每天两次;或者
对于血小板计数≥200,000/mL的患者,在28天的治疗周期期间以约20mg每天两次。
方面38.在患者中治疗骨髓纤维化的方法,其包括向所述患者施用与治疗有效量的鲁索替尼或其可药用盐组合的治疗有效量的:
方面39.方面38所述的方法,其中
方面40.方面38或方面39所述的方法,其中向所述患者施用约9mg/kg的
方面41.方面38至40中任一项所述的方法,其中
方面42.方面38至41中任一项所述的方法,其中所述鲁索替尼或其可药用盐以以下量经口施用于所述患者:
对于血小板计数≥20,000/mL的患者,在28天的治疗周期期间以约5mg每天两次;或者
对于血小板计数≥50,000/mL的患者,在28天的治疗周期期间以约10mg每天两次;或者
对于血小板计数≥100,000/mL的患者,在28天的治疗周期期间以约15mg每天两次;或者
对于血小板计数≥200,000/mL的患者,在28天的治疗周期期间以约20mg每天两次。
方面43.药盒,其包含:
方面44.方面43所述的药盒,其还包含在治疗骨髓纤维化的方法中使用所述药盒的一组说明。
