特异性捕获引物、靶向捕获探针组合物、靶向捕获文库的构建方法及应用
文献发布时间:2023-06-19 19:27:02
技术领域
本发明涉及高通测序文库的靶向捕获领域,具体而言,涉及一种特异性捕获引物、靶向捕获探针组合物、靶向捕获文库的构建方法及应用。
背景技术
目前在靶向检测过程中,一般有两种检测方法,一种是用定量PCR的方式,快速的检测靶向的靶点,这种方式检测比较快速但获得的信息较少,难以获得如低频体细胞突变等信息。另一个种方式是用高通量靶向捕获测序的方式来检测靶向用药检测,高通量靶向捕获测序得好处是检测的比较全面,一次可以检测的内容比较多,缺点是检测的速度没有定量PCR速度快。
在高通量测序的过程中也可以用多重扩增的方式加快检测的速度,但是多重扩增的缺点在于无法消除PCR扩增和测序过程中的产生的错误,所以对发现低频突变的准确性是不能确保准确性,所以急需一种既保持探针捕获文库在建库的过程中能够通过引物分子标签过滤掉PCR和测序过程中产生的错误的优势,又能够实现快速检测的方法。
发明内容
本发明的主要目的在于提供一种特异性捕获引物、靶向捕获探针组合物、靶向捕获文库的构建方法及应用,以解决现有技术中的高通量靶向捕获测序检测所需时间长的问题。
为了实现上述目的,根据本发明的第一个方面,提供了一种特异性捕获引物,该特异性捕获引物的长度为20-35bp,特异性捕获引物的5'端具有生物素修饰,特异性捕获引物的3'端含有2-4个修饰基团,特异性捕获引物的自3'端起第4-6bp位置含有1-3个核糖核苷酸。
进一步地,修饰基团包括间臂修饰基团、磷酸化基团或氨基修饰基团;优选地,间臂修饰基团包括C3 spacer修饰;优选地,特异性捕获引物的3'端含有2个C3 spacer修饰,特异性捕获引物的自3'端起第4-6bp位置含有1个核糖核苷酸。
进一步地,特异性捕获引物包括:SEQ ID NO:2-SEQ ID NO:21所示序列中的任意一种。
为了实现上述目的,根据本发明的第二个方面,提供了一种靶向捕获探针组合物,该靶向捕获探针组合物包括靶向同一目标片段不同区域的多个捕获探针,其中,每个捕获探针选自上述特异性捕获引物。
进一步地,多个捕获探针包括2-7个捕获探针,优选为4-6个;优选地,多个捕获探针均靶向同一单链目标片段的不同区域,多个捕获探针的5'端至3'端的朝向相同;优选地,多个捕获探针之间连续且不重叠。
为了实现上述目的,根据本发明的第三个方面,提供了一种靶向捕获文库的构建方法,该构建方法包括:采用上述靶向捕获探针组合物对预文库进行靶向捕获,获得靶向目标片段的捕获文库。
为了实现上述目的,根据本发明的第四个方面,提供了一种目标片段文库的制备方法,该制备方法包括:利用上述特异性捕获引物、或上述靶向捕获探针组合物,对样本中的目标片段进行特异性捕获和PCR扩增,获得目标片段文库。
进一步地,制备方法包括:将样本与特异性捕获引物混合,样本中的目标片段与特异性捕获引物进行特异性结合,形成特异性结合体系;利用核酸内切酶对特异性结合在目标片段上的特异性捕获引物进行酶切,从而去除特异性捕获引物上的核糖核苷酸和位于核糖核苷酸3'端的区域,以特异性捕获引物的剩余部分为引物进行目标片段扩增,获得目标片段扩增产物;对目标片段扩增产物进行PCR扩增,获得目标片段文库。
进一步地,样本包括FFPE样本或体液;优选地,目标片段包括细胞游离DNA。
进一步地,核酸内切酶包括核酸内切酶RNase H2。
进一步地,利用磁珠对含有生物素的目标片段扩增产物进行纯化。
为了实现上述目的,根据本发明的第五个方面,提供了一种上述特异性捕获引物、或上述靶向捕获探针组合物、或上述构建方法、或上述制备方法,在制备目标片段文库中的应用。
应用本发明的技术方案,利用上述特异性捕获引物,能够通过连续不重叠的特异性捕获引物,通过解除封闭实现延伸的方法,高效特异捕获目标片段,快速、特异、高效的对目标区域进行富集,实现对于目标片段的文库的制备,解决了传统捕获操作繁琐,用时较长的缺点。
附图说明
构成本申请的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
图1示出了根据本发明实施例的制备方法与传统靶向捕获的区别的示意图。
图2示出了根据本发明实施例的制备方法的示意图,其中A示出了特异性捕获引物的结构示意图,B示出了特异性捕获引物与多个位点结合实现高效富集的示意图。
图3示出了根据本发明实施例的多个特异性捕获引物提升捕获效率的示意图。
图4示出了根据本发明实施例的特异性捕获引物的末端封闭提升中靶率的示意图。
图5示出了根据本发明实施例的利用特异性捕获引物实现目标片段扩增富集的示意图。
具体实施方式
需要说明的是,在不冲突的情况下,本申请中的实施例及实施例中的特征可以相互组合。下面将结合实施例来详细说明本发明。
术语解释:
靶向捕获/富集高通量测序:通过探针或引物的形式对目前区域进行筛选性富集的方法,如果是探针捕获,是要先构建好文库再用富集,多重的方法可以通过引物的方式进行直接富集特定区域。
分子标签建库接头:建库接头末端除了有固定的测序接头外,还设计了一段可变的区域,这个区域的目的是用于标记原始模板信息,通过分子标签过滤掉后期PCR扩增和测序过程中产生的错误。
低频体细胞突变:突变分胚系突变和体细胞突变,遗传突变是胚系突变,胚系突变就是三种情况,0%、50%和100%,相对胚系突变,体系胞突变是低频的突变,这里面说的低频突变就是体细胞突变,这种突变往往频率会比较低,所以是低频突变。
如背景技术所提到的,现有技术中的高通量靶向捕获测序检测所需时间较长。在本申请中发明人尝试开发一种能高效快速进行靶向捕获的特异性捕获引物,利用此种特异性捕获引物,即能用于加分子标签建库接头的文库,也能够做到多重扩增一样快速,同时还能做到对于目标片段的特异性的靶向捕获,提升靶向捕获的特异性,因而提出了本申请的一系列保护方案。
在本申请第一种典型的实施方式中,提供了一种特异性捕获引物,特异性捕获引物的长度为20-35bp,该特异性捕获引物的5'端具有生物素修饰,特异性捕获引物的3'端含有2-4个间臂修饰(Spacer修饰)基团,特异性捕获引物的自3'端起第4-6bp位置含有1-3个核糖核苷酸。
在上述特异性捕获引物中,特异性捕获引物的5'端具有生物素修饰,在后续使用过程中,特异性捕获引物与目标片段结合后形成双链结构,利用磁珠能够方便地纯化获得此种带有生物素修饰的双链结构。在特异性捕获引物的3'端含有2-4个Spacer修饰基团,能够保证对于上述双链结构的100%封闭,在封闭没有解除之前,上述双链结构不能以特异性捕获引物为引物发生扩增。在特异性捕获引物的自3'端起第4-6bp位置含有1-3个核糖核苷酸,特异性捕获引物的其他核苷酸位点均为脱氧核糖核苷酸,只有当特异性捕获引物上的所有核苷酸均与目标片段发生特异性结合,上述核糖核苷酸位点才能被酶切降解,核糖核苷酸3'端的脱氧核糖核苷酸以及Spacer修饰基团也一并脱离双链结构,实现对于封闭的接触。
在一种优选的实施例中,特异性捕获引物的3'端含有2个C3 spacer修饰,特异性捕获引物的自3'端起第4-6bp位置含有1个核糖核苷酸。
在一种优选的实施例中,特异性捕获引物包括:SEQ ID NO:2-SEQ ID NO:21所示序列中的任意一种。
在本申请第二种典型的实施方式中,提供了一种靶向捕获探针组合物,该靶向捕获探针组合物包括靶向同一目标片段不同区域的多个捕获探针,其中,每个捕获探针均选自上述特异性捕获引物。
在一种优选的实施例中,多个捕获探针包括2-7个捕获探针,优选为4-6个。
在一种优选的实施例中,特异性捕获引物多个捕获探针均靶向同一单链目标片段的不同区域,特异性捕获引物多个捕获探针的5'端至3'端的朝向相同;优选地,特异性捕获引物多个捕获探针之间连续且不重叠。
上述“5'端至3'端的朝向”,为不同捕获探针结合在同一单链目标片段后的5'端至3'端的方向。朝向相同即表示在与目标片段结合后,捕获探针之间均是以首(5'端)尾(3'端)相近的形式排列,如图2B中所示,多个捕获探针的5'端的朝向相同,均朝向目标序列的3'端方向。上述“连续且不重叠”,表示多个捕获探针理论上与目标片段全部结合后,能够实现首尾相接,实现对目标片段上核苷酸的全部特异性结合。
在本申请第三种典型的实施方式中,提供了一种靶向捕获文库的构建方法,该构建方法包括:采用上述靶向捕获探针组合物对预文库进行靶向捕获,获得靶向目标片段的捕获文库。
上述预文库的制备包括但不限于,提取样本中的DNA并进行末端修复、加A,在修复加A前可根据样本种类和试验目的进行DNA的片段化。对修复后的产物进行接头连接,上述接头包括但不限于普通的通用建库接头或分子标签接头(如UMI)。对连接产物进行纯化后进行PCR扩增,从而获得预文库。上述预文库中为含有样本中DNA信息的文库,同时含有待靶向捕获的目标片段。利用上述构建方法,能够从预文库中对目标片段进行捕获,从而获得靶向目标片段的捕获文库。
在本申请第四种典型的实施方式中,提供了一种目标片段文库的制备方法,该制备方法利用上述特异性捕获引物、或上述靶向捕获探针组合物,对样本中的目标片段进行特异性捕获和PCR扩增,获得目标片段文库;特异性捕获引物的能够与目标片段进行特异性结合。
在一种优选的实施例中,制备方法包括:将样本与特异性捕获引物混合,样本中的目标片段与特异性捕获引物进行特异性结合,形成特异性结合体系;利用核酸内切酶对特异性结合在目标片段上的特异性捕获引物进行酶切,从而去除特异性捕获引物上的核糖核苷酸和位于核糖核苷酸3'端的区域,以特异性捕获引物的剩余部分为引物进行目标片段扩增,获得目标片段扩增产物;对目标片段扩增产物进行PCR扩增,获得目标片段文库。
在一种优选的实施例中,样本包括FFPE样本或体液;优选地,目标片段包括细胞游离DNA。
在一种优选的实施例中,核酸内切酶包括核酸内切酶RNase H2。
在一种优选的实施例中,利用磁珠对含有生物素的目标片段扩增产物进行纯化。
在现有技术中,对于肿瘤患者的FFPE样本的肿瘤靶向治疗位点检测或cfDNA的治疗指导和病情监测,目前比较快速是用定量PCR的方式,这个方式检测快速,但是由于检测方面范围有限,并不能满足日益丰富的靶向治疗和个体精准治疗的全面检测。目前比较流行的方式是用靶向捕获的方式捕获感兴趣的区域,gDNA、FFPE提取的DNA经过超声打断方式打断到200-400bp的片段或cfDNA构建成NGS的测序文库,针对捕获区域设计120bp的探针池,在杂交捕获反应缓冲液条件下进行捕获,一般杂交捕获的时间是16小时,由于这个实验流程比较长,操作比较繁琐。
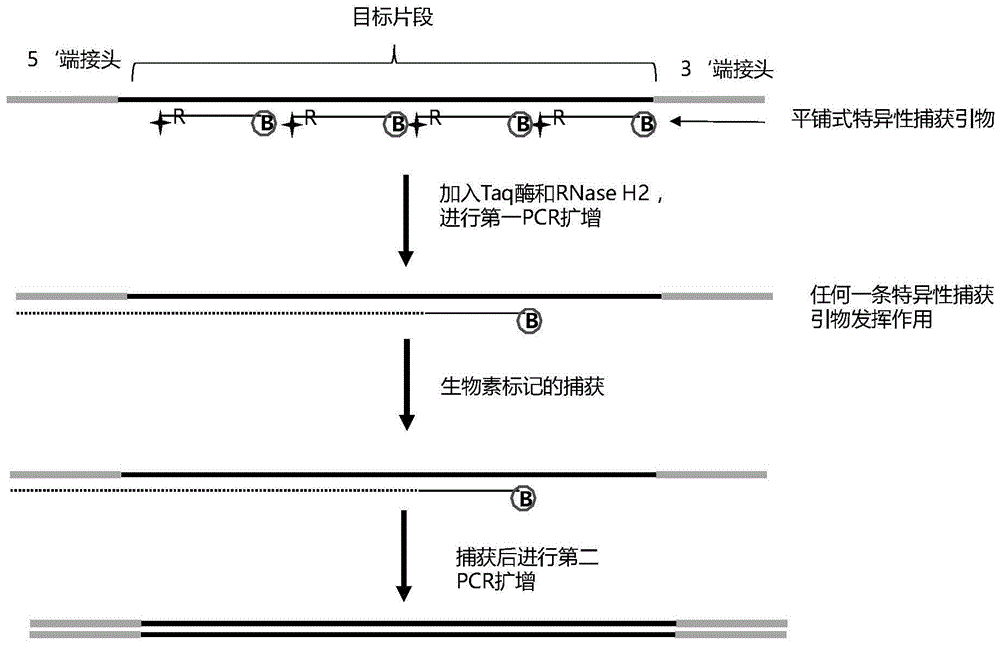
上述目标片段文库的制备方法,利用构建好的样本文库,用带生物素的引入对目标区域进行富集,如图1所示。利用此种制备方法能够富集目标区域,由于用这个是PCR扩增的方式,在这个环节只需要1小时就可以完成操作。
为了实现特异性地在1小时实现靶向富集,本申请中用末端封闭特异的靶向扩增引入实现这个过程。以本申请实施例中所用的具体的引物为例,结构如图2中A所示,引物的5’末端有生物素Biotin修饰,引物的全长有20-35bp,在引物的3’末端有两个C3 cpace修饰进行末端封闭,在3’末端4-6bp位置有一个RNA碱基,就是一个完整的提升特异性的特异性捕获引物的结构。
在高通量靶向富集的过程中,由于文库的插入片段长度在平均在250bp左右,如果按照引物最长的计算35bp,连续的平铺能够容纳6-7个引物,这样只要有一个特异探针发挥作用就会把目标片段捕获下来,如图2中B所示,这里只展示了4个特异探针引物,对于该目标片段的文库的捕获会有4种可能。这种捕获方式通过末端封闭的方式提升捕获的特异性,只有完全匹配的引物才能够被RNase H2酶识别切割(EP 2644709B1)。
在现有技术中,利用单个或成对引物对目标区域的多重扩增富集,由于提升特异性和效率是负相关的关系,因此现有技术中的方法虽能够提高特异性,但捕获效率很低。在本申请中,通过同向连续多个的方式扩增富集,在具有与现有技术相当的特异性的同时,由于是多个特异性捕获引物中只要有一个起作用,目标序列就会捕获下来,多个特异性捕获引物相当于并集的关系,所以解决了低效的问题,同时实现了对于目标序列高特异性和高效率捕获、富集。
在一个文库的插入片段区域可以容纳多个特异性捕获引物结合位点,如图3所示,当一个文库有连续多个靶向引物结合位点,即使单个引物的效能不是100%起作用,只要有一个特异性捕获引物有作用就会把目标片段捕获下来。这种提升了特异性的特异性捕获引物,为了增强靶向捕获的特异性,单个引物的结合效率一定会降低,本发明为了不影响捕获效率,用连续不相互覆盖的同方向排列的方式进行设计,在平均250bp的插入文库片段,平铺性的把捕获特异引物连续方式,如图3所示,一个文库展示了6个特异捕获结合引物,一共可以有6种可能的情况把目标片段捕获下来,仅有①起作用时的结果;②起作用,①可能起作用,③、④、⑤和⑥没有起作用的结果;③起作用,①和②可能起作用,④、⑤和⑥没有起作用的结果;④起作用,①、②和③可能起作用,⑤和⑥没有起作用的结果;⑤起作用,①、②、③和④可能起作用,⑥没有起作用的结果;⑥起作用,①、②、③、④和⑤可能起作用的结果。通过这种多重特异的特异性捕获引物对目标区域的有效富集,避免了这种末端封闭的依赖RNase H2去切割解除限制效率不高的弊病。
在用常规的引物进行靶向富集的时候有一个问题是,富集的特异性会受到影响,由于在基因组上有大量只差几个碱基的区域也会被扩增延伸,所以如果用普通的引物会降低捕获的特异性,如图4所示,当用普通的靶向引物进行扩增,会有一部分非靶向区域的地方被扩增出来。在上述制备方法中,只有完全匹配的结合才能够被RNase H2解除限制后被扩增,这种方式提升了捕获的特异性。由于这种末端限制的特异扩增需要完全匹配后经过RNase H2解除限制的方式势必降低了靶向捕获效率,本发明是通过多个连续不重合的多个靶向引物来解决靶向捕获效率的问题。如图5所示,当多个连续平铺不重叠的特异封闭探针引物可以解决单个捕获效率不高的问题,通过多个特异的捕获探针,只要其中一个起作用就可以捕获下来感兴趣的区域。
如果在检测cfDNA的低频突变时,只要建库时用分子标签接头,就可以去除在后续的PCR扩增和高通量测序过程中积累的突变错误,从而实现准确的低频检测,这样用这种快速的方法可以快速地构建测序文库,便于后续检测肿瘤病人体内的靶向突变指导靶向用药,也可以检测病人的治疗效果,检测病人体内的肿瘤突变基因位点的变化水平,进行病情检测和治疗方案的评估。
在本申请第五种典型的实施方式中,提供了一种上述特异性捕获引物、或上述靶向捕获探针组合物、或上述构建方法、或上述制备方法,在制备目标片段文库中的应用。
上述应用包括非诊断目的的、科研用途的应用。
下面将结合具体的实施例来进一步详细解释本申请的有益效果。
实施例1用特异性捕获引物捕获cfDNA突变检测
步骤一:
用天根生化公司的《血清/血浆游离DNA提取试剂盒》(货号:DP339)提取试剂盒提取1mL血浆中的细胞游离DNA(cfDNA),具体操作见说明书。文库构建用
步骤二:末端修复&加A
1、取出补平加A缓冲液和补平加A酶置于冰上自然融解,混合均匀,瞬时离心备用。
2、按照下表1,在置于冰上的0.2mlPCR管中进行反应体系配制:
表1
3、混合均匀,瞬时离心使全部反应液置于PCR管底部。
4、在PCR仪上启动如下表2所示反应程序,等温度稳定至20℃时将反应管放进PCR仪:
表2
步骤三:接头连接
1、取出连接缓冲液和连接酶置于冰上自然融解,混合均匀,瞬时离心备用。
2、从PCR仪上取出步骤二PCR反应管,置于冰上,按照表3所示体系进行接头连接反应体系配制:
表3
3、混合均匀,瞬时离心使全部反应液置于PCR管底部。
4、在PCR仪上启动如下表4所示反应程序,等温度稳定至20℃时将反应管放进PCR仪:
表4
步骤四:磁珠纯化
1、提前将NanoPrep
2、向步骤三连接体系PCR管加入40μL NanoPrep
3、将PCR管瞬时离心后放置于磁力架上5min至液体完全澄清,使用移液器吸取移弃上清。
4、沿PCR管侧壁缓慢加入150μL 80%乙醇,注意勿扰动磁珠,静置30s,使用移液器吸取移弃上清。
5、重复步骤4一次。
6、将PCR管瞬时离心后放置于磁力架上,使用10μL吸头移去少量残留乙醇,注意勿吸到磁珠。
7、打开PCR管管盖,并于室温静置约5min,至乙醇挥发完全。
注意:切勿过分干燥,否则会降低得率。
8、移出PCR管,向PCR管中加入21μL无菌水,将磁珠悬浮均匀,25℃孵育2min。
9、将PCR管瞬时离心后放置于磁力架上2min至液体完全澄清,使用移液器吸取20μL上清,并转移至1个新的0.2mL PCR管中,置于冰上备用。
步骤五:PCR扩增
1、取出2X高保真扩增酶和标签扩增引物,置于冰上自然解冻,混合均匀,瞬时离心备用。
2、按照以下表5所示体系在置于冰上的PCR管中进行反应体系配制:
表5
将PCR管放入PCR仪中启动以下表6所示程序:
表6
/>
步骤六:文库纯化、定量和质检
1、向PCR管加入60μL的NanoPrep
2、将PCR管瞬时离心后放置于磁力架上5min,至液体完全澄清,使用移液器吸取移弃上清。
3、沿PCR管侧壁缓慢加入150μL 80%乙醇,注意勿扰动磁珠,静置30s,使用移液器吸取移弃上清。
4、重复步骤3一次。
5、PCR管瞬时离心,放置于磁力架上,使用10μL吸头移去少量残留乙醇,注意勿吸到磁珠。
6、打开PCR管管盖,并于室温静置约5min,至乙醇挥发完全。
注意:切勿过分干燥,否则会降低得率。
7、向PCR管加入20μL TE缓冲液,使用移液器将磁珠悬浮均匀,25℃孵育2min。
8、将PCR管瞬时离心后放置于磁力架上2min,至液体完全澄清,使用移液器小心将上清移取至一个新的0.2mL PCR管中进行保存,注意勿吸到磁珠。
9、使用核酸定量荧光计Qubit对文库进行定量。
10、使用Bioanalyzer(Agilent)、Qsep100(Bioptic)等相关片段分析仪器进行文库片段分布检测。
步骤七:特异性PCR扩增捕获
1、以EGFR的20号外显子T790M突变位点为例,说明设计特异性捕获引物的原则和结构。
SEQ ID NO:1为EGFR T790M位点上下游各跨度170-180bp范围的核酸序列,这个选取的因素是cfDNA的主要片段长度是170bp左右。
SEQ ID NO:1:TCCCTGTGCTAGGTCTTTTGCAGGCACAGCTTTTCCTCCATGAGTACGTATTTTGAAACTCAAGATCGCATTCATGCGTCTTCACCTGGAAGGGGTCCATGTGCCCCTCCTTCTGGCCACCATGCGAAGCCACACTGACGTGCCTCTCCCTCCCTCCAGGAAGCCTACGTGATGGCCAGCGTGGACAACCCCCACGTGTGCCGCCTGCTGGGCATCTGCCTCACCTCCACCGTGCAGCTCATCACGCAGCTCATGCCCTTCGGCTGCCTCCTGGACTATGTCCGGGAACACAAAGACAATATTGGCTCCCAGTACCTGCTCAACTGGTGTGTGCAGATCGCAAAGGTAATCAG。
在突变位点上下游各设计6个封闭特异扩增引物,具体序列如下:
SEQ ID NO:2:
Biotin-TCCCTGTGCTAGGTCTTTTGC/rA/GGCAC/C3Spacer//C3Spacer/。
SEQ ID NO:3:
Biotin-CTTTTCCTCCATGAGTACGTATTT/U/GAAAC/C3Spacer//C3Spacer/。
SEQ ID NO:4:
Biotin-AAGATCGCATTCATGCGTCTTCAC/rC/TGGA/C3Spacer//C3Spacer/。
SEQ ID NO:5:
Biotin-GGGTCCATGTGCCCCTCCTTCT/rG/GCCA/C3Spacer//C3Spacer/。
SEQ ID NO:6:
Biotin-ATGCGAAGCCACACTGACGTGC/rC/TCTC/C3Spacer//C3Spacer/。
SEQ ID NO:7:
Biotin-TCCCTCCAGGAAGCCTACGTGAT/rG/GCCA/C3Spacer//C3Spacer/。
SEQ ID NO:8:
Biotin-CGTGGACAACCCCCACGTGTGC/rC/GCCT/C3Spacer//C3Spacer/。
SEQ ID NO:9:
Biotin-TGGGCATCTGCCTCACCTCCACC/rG/TGCA/C3Spacer//C3Spacer/。
SEQ ID NO:10:
Biotin-TCATCACGCAGCTCATGCCCT/U/CGGC/C3Spacer//C3Spacer/。
SEQ ID NO:11:
Biotin-CCTCCTGGACTATGTCCGGGA/rA/CACAA/C3Spacer//C3Spacer/。
SEQ ID NO:12:
Biotin-ACAATATTGGCTCCCAGTACCTG/rC/TCAAC/C3Spacer//C3Spacer/。
SEQ ID NO:13:
Biotin-GTGTGTGCAGATCGCAAAGGTA/rA/TCAG/C3Spacer//C3Spacer/。
注释:
1)Biotin是生物素修饰,用于和磁珠结合;
2)/rA/、/rC/、/rG/和/U/是RNA碱基,在和目标区域完美匹配后可以被RNase H2切割,解除末端封闭后引物的延伸扩增才能进行;
3)/C3Spacer/是末端封闭,加两个就是保证100%封闭,在封闭没有解除之前不能扩增。
2、按照以下表7所示体系在置于冰上的PCR管中进行反应体系配制:
表7
其中,表7中的特异性捕获引物包括SEQ ID NO:2-SEQ ID NO:13组成的组合物。
将PCR管放入PCR仪中启动表8所示以下程序:
表8
3、把步骤2反应完的50μL体系加入清洗过的装有Streptavidin Beads的PCR中,充分混匀在室温孵育10分钟,每2min使用移液器吹吸混匀一次。
4、将PCR管置于磁力架上1min,待液体完全澄清后,使用移液器吸取移弃上清。
5、将PCR管从磁力架上移出,加入150μL TE缓冲液,轻柔吹吸10次混合均匀,瞬时离心,置于磁力架上数分钟,待液体完全澄清,使用移液器移弃上清。
6、重复步骤5两次。
7、按照以下表9所示体系在置于冰上的PCR管中进行反应体系配制:
表9
8、将PCR管放入PCR仪中启动表10所示程序,热盖温度设定为105℃。
表10
文库纯化和定量:
9、PCR扩增完成后,取出PCR管瞬时离心,向PCR管中加入60μL的
10、将PCR管瞬时离心后置于磁力架上5min,待液体完全澄清后,使用移液器吸取移弃上清。
11、沿PCR管侧壁缓慢加入150μL 80%乙醇,注意勿扰动磁珠,静置1min,使用移液器吸取移弃上清。
12、重复步骤11一次。
13、将PCR管瞬时离心后置于磁力架上,使用10μL吸头移去少量残留乙醇,注意勿吸到磁珠。
14、打开PCR管管盖,并于室温静置约2–5min,至乙醇挥发完全。
15、将PCR管从磁力架上移出,加入20-22μL TE缓冲液,用移液器或涡旋混匀仪将磁珠悬浮均匀,25℃孵育2-5min。
16、将PCR管瞬时离心后置于磁力架上1-2min,待液体完全澄清后,使用移液器小心将上清转移至一个新的0.2mL PCR管中并做好标记进行保存,注意勿吸到磁珠。
17、质检。
步骤七共计用时1h;靶向捕获文库的质量,大于80%以上的片段是目标片段,10ng的目标片段中有1500乘覆盖深度的片段被捕获到。
实施例2
试验方法同实施例1,区别在于特异性捕获引物替换为只有一条单项扩增特异扩增引物,比如SEQ ID NO:2至SEQ ID NO:13中的任意一种,如果只用一条引物,可以实现靶向位点的富集,但是由于单条序列的富集效率和位置效应的影响都不如实施例1的效果好。
如果是用成对的特异性捕获引物进行操作(即成对的特异性捕获引物分别结合在目标片段的2条单链上),就没有办法进行通过文库构建的方式引入分子标签接头,会影响低频突变的准确检出,实施例1中的低频检出可以做到0.1%的稳定检出,而如果用特异性成对扩增子的方式1%的突变检测才能确定为真实突变,两者的灵敏度会有10倍的差距。
实施例2的步骤七共计用时1h;靶向捕获文库的质量:大于80%以上的片段是目标片段,10ng的目标片段中有300乘覆盖深度的片段被捕获到。
说明由于单条特异引物存在捕获效率低和位置效应,这种方式不利于低频突变的靶向富集。
实施例3:用特异性捕获引物捕获FFPE突变检测
本实施例和实施例1的建库环节有区别,主要的区别是实施例1建库用的是分子标签接头,对原始模板进行标记,方便后期分子过滤掉PCR扩增和测序过程中引入的假阳性突变,使检测更准确,在实施例2中,建库接头是普通的通用建库接头,由于FFPE本身在固定的时候就有一些低频的突变,同时超声打断或酶切建库的过程中也会引入低频突变,加分子标签接头建库意义不大。
步骤一:
用Qiagen公司的《QIAampDNAFFPE Tissue Kit》(货号:06404)取石蜡切片(5~10μm厚,1×1cm
步骤二:片段化、末端修复&加A
1、取出酶切片段化&末端修复加尾缓冲液常温融解,混合均匀,置于冰上备用。
2、取出酶切片段化&末端修复加尾酶置于冰上自然融解,混合均匀,瞬时离心备用。
3、按照下表11,在置于冰上的0.2mLPCR管中进行反应体系配制。
表11
注意:1)如DNA不足40μL,可用无核酸酶水补足40μL。当样本Input量≤10ng时,加入1μL的增强缓冲液以获得预期片段大小,此时DNA的加入量应≤39μL;
2)酶切片段化&末端修复加尾酶与酶切片段化&末端修复加尾缓冲液配置成Mix加入时,使用移液器连续吹打3-5次,在吸取与释放时应缓慢平稳以确保体积准确。
4、混合均匀,瞬时离心使全部反应液置于PCR管底部。
5、在PCR仪上启动如下表12所示的反应程序,等温度稳定至25℃时将反应管放进PCR仪,25℃的酶切时间如表13所示。
表12
表13
注意:程序运行时热盖温度设置为70℃。
注意:以上酶切时间适用于无降解的血液gDNA样本。如样本质量不同,酶切大小可能有差异,建议按照参考时间上下调整片段化酶切时间。片段化酶切时间不少于10min,酶切时间不足会影响建库效率。
6、将未使用完的试剂放回-20℃保存。
步骤三:接头连接
1、取出DNA连接缓冲液常温融解,混合均匀,置于冰上备用。
注意:DNA连接缓冲液质地粘稠,移液器吸取与释放应缓慢平稳以确保体积准确。
2、取出DNA连接酶置于冰上,混合均匀,瞬时离心备用。
3、从PCR仪上取出步骤二PCR反应管,置于冰上,按照下表14进行反应体系配制:
表14
注意1:为避免接头自连,NadPrep通用截短型接头应先加至步骤二PCR管底部,再加入DNA连接缓冲液和DNA连接酶。
注意2:多样本操作时,为避免因操作缓慢导致接头自连,应按比例预配制DNA连接缓冲液和DNA连接酶的混合液。
步骤四至步骤七和实施例1中的完全相同,本实施例解决的是FFPE通过酶切打断的方式结合本发明的特异快速捕获获取目标片段的突变信息。
步骤七共计用时1h,靶向捕获文库的质量,大于80%以上的片段是目标片段。
实施例4
试验方法同实施例1,区别在于特异性捕获引物替换为:
SEQ ID NO:14:
Biotin-AGGTCTTTTGCAGGCACAGC/U/TTTCC/C3Spacer//C3Spacer/。
SEQ ID NO:15:
Biotin-CATGAGTACGTATTTTGAAACT/rC/AAGA/C3Spacer//C3Spacer/。
SEQ ID NO:16:
Biotin-GCATTCATGCGTCTTCACCTGG/rA/AGGG/C3Spacer//C3Spacer/。
SEQ ID NO:17:
Biotin-CCATGTGCCCCTCCTTCTGG/rC/CACC/C3Spacer//C3Spacer/。
SEQ ID NO:18:
Biotin-CTCCCTCCAGGAAGCCTACGT/rG/ATGG/C3Spacer//C3Spacer/。
SEQ ID NO:19:
Biotin-GCGTGGACAACCCCCACGTGTG/rC/CGCC/C3Spacer//C3Spacer/。
SEQ ID NO:20:
Biotin-GCTGGGCATCTGCCTCACCTC/rC/ACCG/C3Spacer//C3Spacer/。
SEQ ID NO:21:
Biotin-CAGCTCATCACGCAGCTCATG/rC/CCTT/C3Spacer//C3Spacer/。
能够实现对于SEQ ID NO:1等位点的靶向捕获。本实施例的特异性捕获序列针对突变位点上下游各设计4条捕获序列,能够同样实现实施例1的捕获效果。:
从以上的描述中,可以看出,本发明上述的实施例实现了如下技术效果:本发明通过连续不重叠的特异性捕获引物封闭解除延伸的方法,高效特异地捕获目标片段的文库片段,本方法快速、特异、高效的对目标片段进行富集,解决了传统捕获操作繁琐,用时较长的缺点。本发明方法既可以用于构建检测FFPE样本的靶向用药检测的文库的构建,也可以检测cfDNA的肿瘤靶向位点突变水平的文库的构建,对此类文库测序即可实现用药精准检测和病情检测的快速检测。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
