一种PPI多肽抑制剂及其应用
文献发布时间:2023-06-19 19:27:02
技术领域
本发明涉及分子生物学和医药技术领域,具体涉及一种PPI多肽抑制剂及其应用。
背景技术
皮肤老化是由外源性(电离辐射、有毒化学物质、污染物和慢性光照)和内源性(基因编码的激素、细胞和代谢过程)因素共同驱动的结果,导致皮肤结构完整性、生理功能降低,以及外观的渐进性苍老,已成为皮肤众多健康问题中最为关注的问题。
皮肤老化在很大程度上受紫外线辐射累积损伤的影响。人体皮肤经常暴露在阳光的紫外线照射下,其能深入皮肤的真皮层,并在皮肤细胞中引起内源性“光敏化”介导的“氧化应激”,导致“光老化”和皮肤光损伤的早期迹象。80%以上的面部老化均由光老化引起,是导致皮肤老化的主要外因,其症状表现为皮肤粗糙干燥、下垂、松弛、皱纹、肤色丧失、色素沉着、黑色素瘤等。因此,提供足够的光保护以防止由UVR导致的光老化和其他皮肤疾病具有重要意义。
紫外线辐射会导致皮肤中活性氧(ROS)过度产生,并减少抗氧化酶,包括过氧化氢酶和超氧化物歧化酶(SOD)以及谷胱甘肽过氧化物酶(GPx),引发一系列皮肤的氧化损伤事件。紫外线照射诱导丝裂原活化蛋白激酶(MAPKs)和激活蛋白1(AP-1)的激活,MAPK蛋白如细胞外信号调节激酶(ERK)、p38激酶和c-Jun N端激酶(JNK)导致AP-1(c-Jun和c-Fos)转录因子的表达。此外,AP-1活性的增加会诱导MMPs的激活,从而水解Ⅰ、Ⅲ、Ⅴ型胶原蛋白及降解细胞外基质(ECM)。紫外线诱导的ROS生成刺激细胞表面细胞因子和MAPKs的表达。环加氧酶2(COX-2)、肿瘤坏死因子(TNF)-α和白细胞介素(IL)-1β等细胞因子在真皮中组装中性粒细胞并产生MMPs,从而导致ECM降解。同时,核因子kappa B(NF-κB)被激活,并最终参与MMP活化的诱导。因此,阻断这些信号通路和细胞因子便能抑制MMPs活化达到抗光老化的作用。
皮肤细胞配备了复杂的酶促和非酶促抗氧化防御系统,可中和UVR造成的氧化应激并维持细胞稳态。除了主要的自由基清除酶外,一些抗氧化剂或Ⅱ期解毒酶,如血红素加氧酶1(HO-1)、NADPH醌氧化还原酶1(NQO1)和γ-谷氨酸-半胱氨酸连接酶(γ-GCLC),通过其在各种细胞和组织类型中的抗炎、抗凋亡和抗增殖特性参与抗氧化防御机制和解毒机制,对保护皮肤细胞免受ROS介导的氧化应激和致癌作用至关重要。因此,抗氧化酶的激活是一个重要的细胞保护策略,可增强针对环境应激或内源性代谢产生的ROS保护机制。
编码II期/抗氧化酶基因的基础表达和诱导由顺式-作用增强子——抗氧化反应元件(ARE)转录介导。存在于细胞质中的Keap-1/Nrf2(Keap:Kelch样ECH相关蛋白1;Nrf2:核红细胞相关因子2)调节复合物在保护细胞免受氧化、外源性压力和维持细胞稳态方面起核心作用。Nrf2是一种特定的氧化还原转录因子,被认为是中和ROS和恢复细胞氧化还原平衡的中心枢纽,调节各种酶的下游表达,受其抑制剂Keap-1的负调控。在正常生理条件下,Nrf2的活性通过与细胞质中的Keap1结合而受到严格限制。机制研究发现,Keap1作为含Cul3的E3泛素连接酶底物支架,可以诱导Nrf2的泛素-蛋白体降解,只有一小部分Nrf2不受Keap1-Cul3介导的泛素化和降解影响,有助于基础的抗氧化维持。然而在氧化应激条件下,Nrf2与DLG-Keap-1相互作用受到破坏,而Nrf2与ETGE-Keap-1相互作用保持不变。前者相互作用的破坏最终使E3连接酶失活从而抑制了Keap-1介导的Nrf2泛素化,Nrf2的降解迅速减少,导致Keap-1蛋白饱和,新和成的Nrf2可摆脱Keap1并易位至细胞核,与ARE结合并诱导抗氧化剂/II解毒酶的启动子区域,激活下游保护基因的转录,如NADPH醌氧化还原酶1(NQO1)、血红素加氧酶-1(HMOX1)和铁蛋白重多肽1(FTH1)等,进而引起强大的抗毒反应。因此,诱导Nrf2活化被认为是各种基因转录激活的关键。
Nrf2-Keap1二聚体复合物的合适构象对于泛素化过程必不可少,破坏Nrf2-Keap1二聚体复合物相互作用以阻碍Nrf2的泛素化,导致Nrf2的积累和激活。因此,直接和竞争性地破坏Keap1-Nrf2蛋白-蛋白相互作用(PPI)抑制剂的发现已成为激活Nrf2的一种新方法。与经典的亲电Nrf2激活剂相比,PPI抑制剂可以竞争性和选择性的方式与Keap1结合,从而降低不确定的安全风险。基于上述,积极发现激活Nrf2的候选PPI抑制剂,以一种高活性成分的抗光老化产品或药物来来抵御紫外线辐射。
生物活性肽可以较好地与细胞受体相互作用,一定程度上改善皮肤的生理功能,如增强皮肤的通透性和稳定性。此外,多肽具有高安全性、低致敏性,及可控的生产成本。因此,亟需根据Keap1-Nrf2复合物的结构信息设计一种包含所有关键特征的生物活性多肽,利用计算机虚拟筛选策略(包括分子对接、分子动力学模拟、MM/GBSA结合自由能分解)及抗光老化活性评价,从而发现最具抗光老化潜力的PPI抑制剂多肽,预防和延缓皮肤老化,以及减少与年龄相关的皮肤损伤和疾病。
发明内容
有鉴于此,本发明的目的之一在于提供一种PPI多肽抑制剂,本发明的目的之二在于提供一种编码所述多肽抑制剂的核酸,本发明的目的之三在于提供一种包含所述核酸的生物材料,本发明的目的之四在于提供一种所述多肽抑制剂或所述核酸或所述生物材料在制备预防或治疗皮肤光老化的药品或化妆品中的应用;本发明的目的之五在于提供所述多肽抑制剂在制备UVA诱导损伤的抑制剂中的应用。
为达到上述目的,本发明提供如下技术方案:
1、一种PPI多肽抑制剂,所述多肽抑制剂靶向Keap1-Nrf2复合物,所述多肽抑制剂含有ETGE活性基序,其通式为:
A
其中,A
本发明优选的,A
本发明优选的,A
本发明优选的,A
2、编码所述的多肽抑制剂的核酸。
3、包含所述核酸的生物材料,所述生物材料为表达盒、载体、宿主细胞或转基因细胞系。
4、所述的多肽抑制剂在制备预防或治疗皮肤光老化的药品或化妆品中的应用。
本发明优选的,所述多肽抑制剂的使用浓度低于100μM。
本发明优选的,所述多肽抑制剂的使用浓度为4~64μM。
5、、所述的多肽抑制剂在制备UVA诱导损伤的抑制剂中的应用
本发明优选的,所述抑制剂为抑制UVA诱导的MMP-1、MMP-9蛋白的表达。
本发明优选的,所述抑制剂为抑制UVA诱导的MAPK/AP-1激活。
本发明的有益效果在于:本发明提供了一种PPI多肽抑制剂,所述多肽抑制剂含有ETGE活性基序,所述多肽抑制剂的氨基酸序列为:SEQ ID No.4所示的GDGETGEKY或SEQIDNo.7所示的GDAETGELL或SEQ ID No.13所示的GDKETGEWL。所述多肽抑制剂能破坏Nrf2-Keap1二聚体复合物相互作用以阻碍Nrf2的泛素化,导致Nrf2的积累和激活;所述多肽抑制剂具有抗氧化活性,可以减少UVA诱导的细胞内ROS的积累,减弱UVA诱导的基质金属蛋白酶MMP-1、MMP-9蛋白表达量,显著抑制UVA诱导的JNK、P38、ERK的磷酸化,从而抑制AP-1的激活。所述多肽抑制剂在4~64μM的浓度处理下,能消除紫外线诱导对细胞产生的损伤,极大地保护了细胞免受光毒性,可用于制备抗光老化产品或药物抵御紫外线辐射。
附图说明
为了使本发明的目的、技术方案和有益效果更加清楚,本发明提供如下附图进行说明:
图1为Keap1与多肽抑制剂主链的RMSD变化;
图2为pep2007与Keap1的对接结合模式;
图3为pep2007与Keap1的100ns MD模拟分析,(a)MD模拟前(绿色飘带,浅蓝色棍棒)后(绿色飘带,紫红色棍棒)pep2007/Keap1复合物的比对分析;(b)pep2007/Keap1复合物的全局模式图;(c)pep2007与Keap1的特定结合模式;(d)MM/GBSA方法计算关键氨基酸残基的结合自由能贡献;
图4为Keap1与Nrf2的MST分析;
图5为Keap1与多肽抑制剂的MST分析;
图6为不同浓度多肽抑制剂对293T细胞活力的影响;
图7为筛选的多肽对HEK293-ARE细胞中荧光素酶报告基因活性的影响;
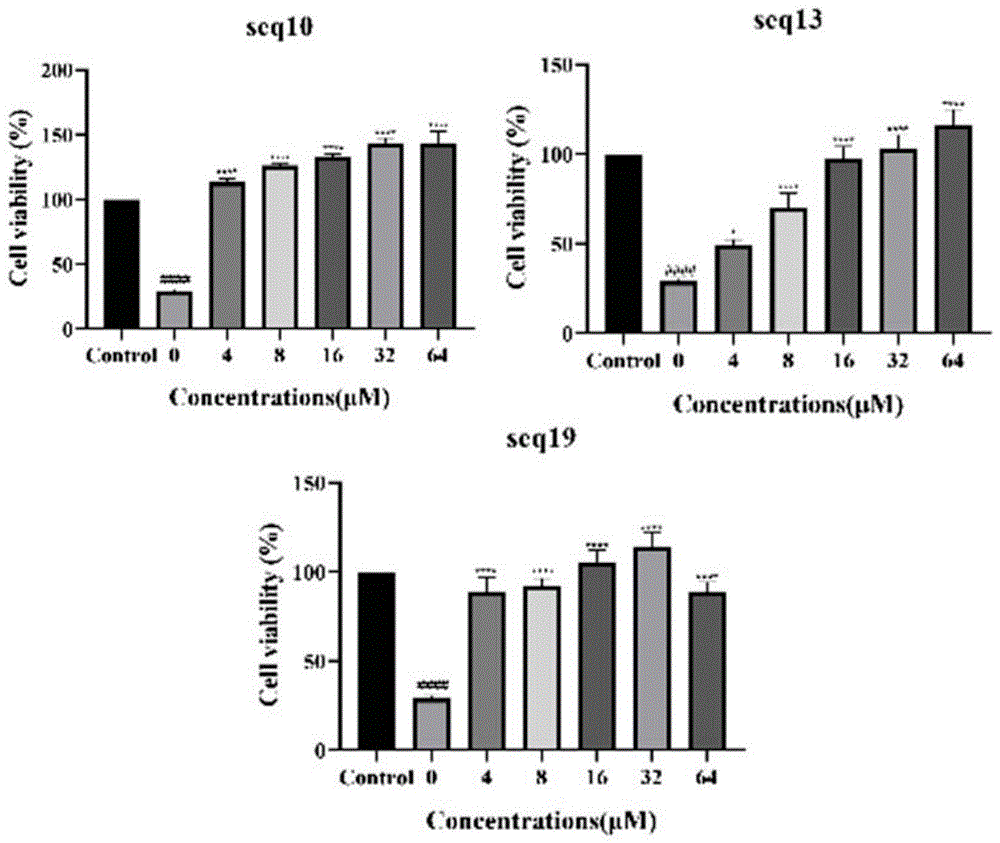
图8为CCK-8法分析抗光老化多肽抑制剂对紫外线损伤HaCat细胞的保护作用(3次或3次以上实验结果以平均值±SD表示,与未处理对照组细胞相比,其统计学意义为:####p<0.0001;与UVA照射对照组细胞相比,统计学意义以*p<0.05,**p<0.01,****p<0.0001表示);
图9为Seq10对UVA照射HaCat细胞内ROS水平的影响(3次或3次以上实验结果以平均值±SD表示,****p<0.0001vs未照射对照组;####p<0.0001vs UVA照射未处理对照组);
图10为Seq13、Seq19对UVA照射HaCat细胞内ROS水平的影响;
图11为Seq10对经UVA照射HaCat细胞MMPs蛋白水平表达的影响(结果表示为三个独立实验的平均值±SD,####p<0.0001vs未处理的对照组;*p<0.05,**p<0.01,****p<0.0001vs UVA照射对照组);
图12为Seq13、Seq19对经UVA照射HaCat细胞MMPs蛋白水平表达的影响;
图13为Seq10对UVA诱导HaCat细胞MAPK/AP-1信号转导的影响(结果表示为三个独立实验的平均值±SD,####p<0.0001vs未处理的对照组;**p<0.01,****p<0.0001vs UVA照射对照组);
图14为Seq13、Seq19对UVA诱导HaCat细胞MAPK/AP-1信号转导的影响。
具体实施方式
下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好的理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
实施例1、计算机虚拟筛选PPI抑制剂多肽策略
一、筛选肽库的建立
Keap1-Nrf2相互作用的结构信息表明,ETGE基序形成的二级结构是Keap1结合的关键。由于其高结合能力和短序列长度,含有ETGE的基序为PPI抑制剂的发现提供了一个良好的起点。对于筛选肽库的建立,我们以ETGE活性基序为模板序列。新的PPI抑制剂序列具有核心序列A
二、受体配体的准备
Keap1-Nrf2复合物的X射线晶体结构于蛋白质数据库(https://www.rcsb.org/)获取,作为分子对接的起始结构。在进行对接计算之前,对蛋白进行必要的结构准备,例如提取配体、去除水分子、金属离子、加氢、修复残基等。使用“Ligand”方式创建Protomol文件,设定对接口袋,而后用于候选分子的对接。利用Tripos力场对所有的多肽进行能量最小化计算以优化结构,生成配体的最低能量构象,并为其加氢,将准备的配体文件进一步用于虚拟筛选。
三、基于分子对接的筛选
本研究使用SYBYL-X 2.1中的对接程序Surflex-Dock GeomX(SFXC)用于构建受体-配体复合物,其中对接分数以评分函数-log
在本研究中,以排列组合的方式,建立了包含2394个多肽库用于基于分子对接的虚拟筛选,以获得具有良好结合的PPI抑制剂。定义Keap1底物结合腔为对接口袋,即选取Tyr334、Ser363、Arg380、Asn414、Arg415、Phe478、Arg483、Ser508、Tyr525、Gln530、Tyr572、Asp573、Phe577关键氨基酸残基共同构成的中心凹槽为活性口袋,使用Surflex-dockGeomX方法通过分子对接进行基于受体的虚拟筛选。对接结果Total-Score打分情况由高到低排序,综合Total-Score、Crash、Polar打分情况,选出具有较高对接分数、空间较好契合度、结合情况较为合理的多肽作为潜在的PPI调节剂,最后,筛选出排名靠前的14条多肽进行生物测定(对接分数列于表1)。
表1抑制剂的序列及对接分数
四、分子动力学模拟
使用AMBER16进行分子动力学(MD)模拟以评估所选化合物结合模式的有效性。基于GeomX对接产生的蛋白质受体-配体复合物的初始构象进行MD模拟。Antechamber工具为配体加载GAFF力场,对载入的Keap1受体,选择AMBER ff99SB力场进行处理。将每个蛋白抑制剂复合物系统浸入在截短的八面体盒子中,其中TIP3P水分子从复合物延伸
使用AMBER16中的PMEMD.mpi和PMEMD.cuda模块进行分子动力学(MD)模拟。在MD模拟开始之前,在系统上使用Sander模块中的最速下降和共轭梯度算法执行几次连续的能量最小化步骤以避免可能的分子碰撞,先
MD分析后,14条多肽中有12条多肽抑制剂与Keap1能够形成稳定结构。结果如图1所示,发现多肽抑制剂复合物的蛋白质主链原子的均方根差(RMSD)为
以pep2007为例,图2显示了pep2007与Keap1的晶体结构对接模式,参与结合口袋的重要残疾包括Arg380、Asn382、Asn387、Arg415、Arg483、Ser508、Tyr525、Tyr572、Phe577,这里描述的所有残基与从Keap1晶体结构获得的信息基本一致。2D对接模式图(图2)显示,上述的重要氨基酸主要通过氢键与Keap1相互作用。经100ns的MD模拟后,多肽抑制剂结构发生了微弱的构象变化(图3,a,对接:蓝色;MD模拟:紫红色),对接后,多肽结构能十分契合的进入Keap1活性口袋(图3,b)。MD模拟揭示的pep2007与Keap1的特异性结合模式如图3,c所示,多肽链上的羧基通过氢键与Tyr334、Arg380、Asn382、Asn387、Arg415、Arg483、Ser508、Gly509、Tyr525结合。为了探索关键氨基酸的贡献,使用MM/GBSA方法进行了结合自由能分解,图3,d显示Tyr334、Arg380、Asn382、Arg415、Arg483由于静电作用的贡献,可以稳定与烷基链的相互作用,然而,极性溶剂化不利于相互作用。
五、MM/GBSA计算
复合物的结合自由能和能量分解计算使用AMBER16中的MM/GBSA方法进行,基于能量分解分析关键氨基酸,理论预测其结合模式。对于保存的MD模拟轨迹,分别采用分子力学/广义玻恩表面积(MolecularMechanics/Generalized Born Surface AreaMM/GBSA)方法来计算受体在不同配体处理下与其的结合能。对于每个系统从90到100ns产生的稳定构象,每200ps提取50个快照计算平均结合能。使用公式如下:
ΔE
其中ΔE
多肽抑制剂的结合自由能分析结果如表2所示,pep2007、pep2208对与Keap1相互作用具有更强的结合自由能。对于所有的多肽抑制剂,除了pep234,静电相互作用比范德华力起更重要的作用。此外,所有体系的极性相互作用数值大于非极性相互作用,表明体系中的非极性相互作用更有利于多肽与Keap1的结合。
表2多肽抑制剂与Keap1相互作用的结合自由能ΔE
注:ΔE
六、微量热泳动(MST)
利用微量热泳动研究PPI抑制剂与Keap1之间的相互作用。Keap1蛋白用MonolithHis-Tag Labeling Kit RED tris-NTA二代染料标记。在PBS(补充有0.05%吐温)缓冲液中针对标记的Keap1(50nM)滴定各种浓度的PPI抑制剂(15.25nM-500μM),将样品吸入毛细管中,并在环境温度下使用40% LED/红外激光功率、Medium MST power测量热泳。使用MO.Affinity Analysis软件(NanoTemper Technologies GmbH,Munich,Germany)处理数据,分析结合常数。
使用MST方法来检测上述多肽抑制剂与Keap1蛋白是否存在相互作用。结果显示(图5)了筛选的多肽与Keap1之间有不同程度的亲和力,根据记录的数据进行了稳态分析,从拟合的饱和结合曲线计算的解离常数(Kd)分别为75.2nM(Seq10)、6.36μM(Seq13)、9.86nM(Seq19),Keap1-Nrf2两个蛋白相互作用的Kd为33.1nM(图4),结果说明纳摩尔级的多肽与Keap1具有非常强的结合能力。
实施例2、PPI抑制剂多肽抗光老化活性评价
一、细胞活力测定
293T细胞使用含有10%胎牛血清和1%青霉素/链霉素的DMEM培养基,HaCat细胞在补充有10%胎牛血清和1%青霉素/链霉素的1640培养基中,均于37℃和5% CO
使用CCK-8测定法评估PPI抑制剂对细胞的毒性。将293T细胞以5×10
存活率(%)=[(Ae-Ab)/(Ac-Ab)]×100%
Ae是处理后细胞的吸光度;Ac是未经处理细胞的吸光度;Ab是没有细胞的培养基的吸光度。通过非线性回归拟合计算IC50值。
CCK8检测了抗光老化多肽抑制剂对细胞的存活生长影响,以Control组作为参照比值,在HEK293细胞开展细胞活性检测实验,测得的OD值与细胞活性成正比。图6为筛选的多肽抑制剂对HEK293细胞活性影响结果图,结果显示,在用多肽抑制剂处理24h后,与Control(0μM)组相比,多肽抑制剂在100μM以内对细胞没有毒性,并能够显著地促进细胞增殖,但在100μM时存在多肽处理的细胞活力增殖无显著性差异,故综合显著性分析,选择低于100μM以内的浓度进行后续实验。
二、双荧光素酶报告基因检测
构建抗氧化药物293T-ARE细胞筛选模型用于PPI抑制剂的进一步筛选,利用Dual-Luciferase Reporter Assay System(Promega,UK)用于测定瞬时转染细胞中的报告基因活性。293T细胞在转染前24h以2×10
试验中,同时设置不转染的空白对照组、转染细胞不经药物处理的对照组,以及转染细胞经tBHQ处理的阳性对照组,每个组设置6个平行样。数据一式三份,并表示为相对于对照的诱导倍数。
实验组比值=(实验组F-背景F)/(实验组R-背景R)
对照组比值=(对照组F-背景F)/(对照组R-背景R)
表达倍数=实验组比值/对照组比值
背景F:未转染细胞+萤火虫萤光素酶检测试剂;背景R:未转染细胞+萤火虫萤光素酶检测试剂+海肾萤光素酶检测试剂;实验组:转染细胞经实验化合物处理(即实验组F和实验组R);对照组:转染细胞不经处理,用以标准化结果(即对照组F和对照组R)。
使用Nrf2/ARE荧光素酶报告试验评价筛选的多肽对Nrf2的细胞激活效应。采用20μM的多肽抑制剂对转染的HEK293-ARE细胞进行处理,同样浓度的t-BHQ作为阳性对照。如图7所示,14条多肽抑制剂均表现出或强或弱的活性,经Seq10、Seq11、Seq13、Seq16、Seq17、Seq19、Seq20处理后荧光素酶活性显著升高5倍以上。通过双荧光素酶报告基因检测,结果表明,这些多肽抑制剂在细胞水平上促进了Nrf2的转录活性,显著增强了Nrf2-ARE系统的激活。
三、UVA辐射与细胞活力测定
为检测多肽抑制剂对UVA诱导HaCat细胞损伤的保护作用,使用CCK8试剂测定细胞活力。HaCat细胞按照1×10
结果如图8所示,与未经处理的对照细胞相比,UVA照射显著降低了HaCat细胞的细胞活力,而使用不同浓度(4μM、8μM、16μM、32μM、64μM)多肽抑制剂的预处理则减轻了辐射诱导的细胞死亡。经5J/cm
四、DCFH
为观察多肽抑制剂是否具有抗氧化能力来减轻HaCat细胞中UVA介导的ROS产生,使用2’,7’-二氯荧光素二乙酸酯(DCFH
结果如图9-10所示,与对照细胞相比,单独的UVA照射引起细胞内的ROS水平是空白对照组的10倍左右,两者比较差异具有高度统计学意义(P<0.0001),提示UVA照射可以诱导HaCat细胞内产生ROS。然而,用8μM、16μM、32μM的多肽抑制剂处理后细胞内的ROS水平可呈剂量依赖性显著下降,同UVA照射对照组相比差异具有统计学意义。因此,多肽抑制剂处理后可以减少UVA诱导HaCat细胞内ROS的积累,表现出抗氧化活性。
五、蛋白质免疫印迹(Western blot)检测基质金属蛋白酶MMPs蛋白水平以及JNK、P38、ERK的磷酸化水平
为了研究抗光老化多肽抑制剂对紫外线诱导的光老化影响,评估了MAPKs的磷酸化水平。实验分为三组:无UVA照射的对照组;给予UVA照射的对照组;给予UVA照射的药物组。对照组:含有0.1%DMSO的完全培养基培养;药物组:培养液中含有不同浓度(8μM,16μM,32μM)的多肽抑制剂。HaCat细胞以3×10
具体而言,上述步骤获得的蛋白样品中加入5XSDS Loading Buffer,混匀,备用。将SDS-PAGE凝胶按照常规方法制备完成后,放入电泳槽中,倒入适量的1×电泳缓冲液,拔去梳子,将准备好的样品及蛋白Marker加样至SDS-PAGE凝胶的各泳道中,用80V恒压跑胶30min,而后调节电压至120V恒压跑胶100min。电泳完毕后,湿转至PVDF膜。用快速封闭液室温封闭15-30min,根据蛋白大小将封闭完成的膜剪成条状,在4℃条件下,一抗(兔抗人MMP-1抗体、兔抗人MMP-9抗体、兔抗人JNK抗体、兔抗人P-JNK抗体、兔抗人P38抗体、兔抗人P-P38抗体、兔抗人ERK抗体、兔抗人P-ERK抗体、兔抗人GAPDH抗体、鼠抗人α-Tubulin抗体)孵育过夜,次日,将孵完一抗的膜置于1×TBST中,洗膜4次,每次5min,然后室温孵育二抗1h,二抗孵育完成后,洗膜4次,每次5min。使用增强化学发光(ECL)底物分析印迹,并通过LAS-4000发光图像分析仪成像,ImageJ软件定量分析目的蛋白条带的灰度,以内参基因作矫正计算蛋白的相对表达量,GraphPad进行统计分析。
抗光老化抑制剂下调UVA诱导的MMP-1、MMP-9蛋白表达
如图11-12所示,与未经UVA照射空白对照组相比,UVA照射对照组细胞内的MMP-1、MMP-9蛋白水平显著增加,表明UVA照射可以诱导HaCat细胞MMP-1、MMP-9蛋白的表达。UVA照射的细胞用多肽处理后MMP-1、MMP-9的分泌明显减少,其中Seq10、Seq19的抑制作用最为显著,表明多肽抑制剂能够减弱UVA诱导的基质金属蛋白酶MMP蛋白表达。
抗光老化多肽抑制剂抑制UVA诱导的MAPK/AP-1激活
如图13-14所示,与未经照射的对照组相比,UVA照射显著增加了JNK、P38、ERK的磷酸化水平,紫外线诱导的活性氧生成激活了MAPK信号通路。但是紫外线照射后,用多肽抑制剂处理能够显著抑制JNK、P38、ERK的磷酸化,从而抑制AP-1的激活,而不影响JNK、P38、ERK的总表达。其中,最大浓度的处理显示了对磷酸化的最大抑制。上述表明抗光老化多肽抑制剂下调了UVA刺激的MAPK磷酸化。
以上所述实施例仅是为充分说明本发明而所举的较佳的实施例,本发明的保护范围不限于此。本技术领域的技术人员在本发明基础上所作的等同替代或变换,均在本发明的保护范围之内。本发明的保护范围以权利要求书为准。
