一种覆盆子多糖及其制备方法与应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及功能食品、保健品或药物制造技术领域,具体涉及一种覆盆子多糖及其制备方法与应用。
背景技术
覆盆子(Rubus chingii Hu.)在世界范围内广泛栽培,特别是在亚洲、欧洲和北美洲。由于覆盆子极高的营养和药用价值,在中国已被认定为药食同源物种。作为传统中药,覆盆子具有益肾固精缩尿、养肝明目等功效。近年来,覆盆子也被报道具有抗氧化、抗炎、降糖减脂的作用。覆盆子作为一味使用历史悠久的中药,发掘其潜在新功效非常有意义和价值。
目前,关于覆盆子的功能成分主要集中于酚类、类黄酮、三萜、矿物质、维生素、类胡萝卜素和有机酸等。值得注意的是,植物多糖也具有极好的健康促进作用,比如抗炎、免疫调节、抗肿瘤、减肥、降血糖等等。覆盆子多糖目前主要报道具有抗氧化、非酶糖基化抑制、α-淀粉酶抑制和巨噬细胞激活等作用。有关覆盆子多糖新成分、新结构和新功能方面的研究较少,而作为极具开发价值的植物多糖应该更加深入的研究和开发。
饮食习惯与人类健康和疾病息息相关,不同地区有着不同饮食风俗习惯使得在各种疾病发病率上有所差异。现如今,高脂肪摄入在人们的饮食中越来越盛行,但是已被视为一种非常不健康的生活方式,因为高脂饮食不仅仅导致肥胖,还会诱发多种慢性疾病,包括糖尿病、非酒精性脂肪肝、心血管疾病、肿瘤等等。目前,高脂饮食诱发结肠炎症和氧化应激相关的研究较少,如何有效预防和治疗结肠炎症和氧化应激也是临床上面临的巨大难题。
发明内容
为了解决现有技术存在的技术缺陷,本发明提供了一种覆盆子多糖及其制备方法与应用,可以有效地降低高脂饮食导致的结肠炎症和氧化应激症状。
本发明采用的技术解决方案是:一种覆盆子多糖,所述的覆盆子多糖包括阿拉伯糖、半乳糖、半乳糖醛酸和葡萄糖醛酸组成的多糖糖链结构,多糖糖链结构为:由→3,6)-β-Galp(1→和→5)-α-Araf(1→形成主链,支链主要由α-Araf(1→连接在→3,6)-β-Galp(1→的3位构成,其中,所述的半乳糖醛酸和葡萄糖醛酸含量为14.2%,多糖糖链的结构式如下:
式中,Ara为阿拉伯糖残基;Gal为半乳糖残基。
一种覆盆子多糖的制备方法,其特征在于,包括以下步骤:
(1)原料预处理:取干燥未成熟覆盆子果实粉碎,过筛,在乙醇中浸泡去除植物色素,干燥得覆盆子粉末;
(2)提取:将覆盆子粉末与乙醇在室温下混合,向混合液中加入预热蒸馏水,用超声波装置超声处理,最后,离心得到上清液;
(3)浓缩:将上清液在真空旋转蒸发器中浓缩;
(4)醇沉:加入无水乙醇,静置,离心并收集沉淀;
(5)脱蛋白:沉淀溶于蒸馏水,用Sevage试剂去除蛋白质;
(6)干燥:真空冷冻干燥,得到覆盆子粗多糖(RCP);
(7)分离纯化:用去离子水制备RCP溶液,上样到DEAE seplife FF纤维素色谱柱上,用0、0.1、0.2和0.3M NaCl溶液进行线性梯度洗脱,得到RCP1、RCP2、RCP3和RCP4四个馏分;
(8)脱盐:将主要组成成分RCP1用a透析袋过滤脱盐;
(9)收集:将脱盐后的RCP1装入Sephacryl S-400HR色谱柱,以0.5mL/min的流速加入蒸馏水,收集得到pRCP;
(10)干燥:将pRCP溶液真空冷冻干燥得到pRCP粉末。
所述的步骤(2)中超声处理的功率为70%、超声处理的温度为76℃下处理时间为14min。
所述的步骤(3)浓缩中将上清液在42℃真空旋转蒸发器中浓缩到原来体积的1/4。
所述的步骤(5)中Sevage试剂为体积比为4:1的氯仿与正丁醇。
所述的步骤(3)和步骤(5)中离心转速均为3000g,离心时间均为10min。
一种覆盆子多糖在制备改善高脂饮食诱发结肠炎症和氧化应激药物上的应用。
本发明的有益效果是:本发明提供了一种覆盆子多糖及其制备方法与应用,覆盆子多糖是一种具有表面光滑和多孔层状结构的多糖,经高效阴离子交换色谱分析,探明了覆盆子多糖的单糖成分主要由阿拉伯糖和半乳糖组成,分别占比39.76%和39.43%,另外还含有8.56%半乳糖醛酸和5.64%葡萄糖醛酸,可以有效地降低高脂饮食导致的结肠炎症和氧化应激症状,在抗炎和抗氧化功能食品、保健品或者药物中具有良好的应用前景。
附图说明
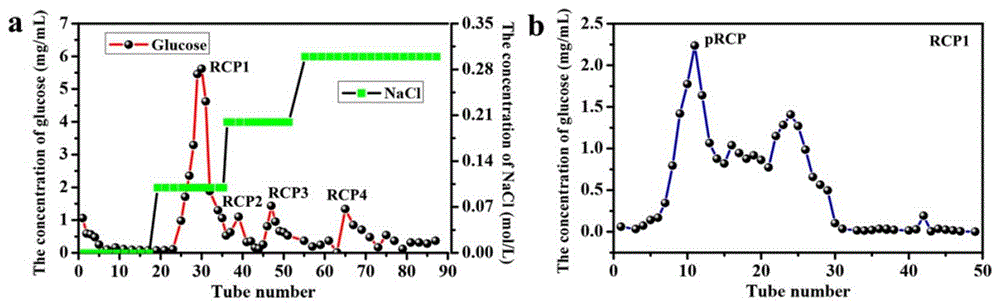
图1为覆盆子多糖分离纯化:(a)覆盆子多糖经DEAE seplife FF纤维素层析柱和NaCl溶液洗脱分离出RCP1,RCP2,RCP3和RCP4等4个组分;(b)采用Sephacryl S-400HR柱将主要组分RCP1进一步纯化得纯化覆盆子多糖(pRCP)。
图2为单糖成分分析:(a)标准样品;(b)覆盆子多糖。
图3为覆盆子多糖傅里叶变换红外光谱FT-IR分析图。
图4为覆盆子多糖一维核磁共振波谱分析图:(a)
图5为覆盆子多糖二维核磁共振波谱分析图:(a)COSY;(b)NOESY;(c)HSQC;(d)HMBC。
图6为覆盆子多糖表面形态结构图。
图7为覆盆子多糖改善高脂饮食诱导的结肠炎症和氧化应激:结肠促炎因子(a,IL-6;b,IL-1β;c,TNF-α)、抗氧化应激指标(d,Sod1;e,Nqo1;f,Nrf2)和促氧化应激指标(g,Acox1;h,Nox2;i,Nox4)表达水平变化;结肠(j)8-OHDG免疫组化及其(k)定量结果;结肠(l)4-HNE免疫组化及其(m)定量结果。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整的描述,显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获的所有其他实施例,都属于本发明保护的范围。
实施例1:
一)覆盆子粗多糖提取方法的优化
(1)原料:取干燥未成熟覆盆子果实。
(2)原料预处理:将未成熟的覆盆子果实粉碎,通过60目筛,在80%乙醇中室温浸泡2h去除植物色素,干燥得覆盆子粉末。
(3)最优提取方法:将5g覆盆子粉末与20mL 28%乙醇在室温下混合30min。向混合液中加入75mL的76℃预热蒸馏水。用超声波装置在70%功率、76℃
下超声处理14min。最后,离心(3000g,10min)得到上清液。
(4)浓缩:将上清液在42℃真空旋转蒸发器中浓缩到原来体积的1/4。
(5)醇沉:加入4倍体积的无水乙醇,4℃静置12h,离心(3000g,10min),得到沉淀;
(6)脱蛋白:沉淀溶于蒸馏水,用Sevage试剂(氯仿/正丁醇,4:1,v/v)去除蛋白质;
(7)干燥:真空冷冻干燥48h,得到覆盆子粗多糖(RCP)。
二)覆盆子多糖分离纯化
(1)分离纯化:用去离子水制备RCP溶液(20mg/mL),上样到DEAE seplife FF纤维素色谱柱上,用0、0.1、0.2和0.3M NaCl溶液进行线性梯度洗脱,如图1a所示,得到RCP1、RCP2、RCP3和RCP4四个馏分。
(2)脱盐:将主要组分(RCP1)用3000Da透析袋过滤脱盐。
(3)收集:将脱盐后的RCP1装入Sephacryl S-400HR色谱柱,以0.5mL/min的流速加入蒸馏水,如图1b所示,收集得到纯RCP(pRCP)。
(4)干燥:将pRCP溶液真空冷冻干燥得到pRCP粉末。
(5)采用苯酚硫酸法和考马斯亮蓝法测定提取样本中多糖和蛋白质含量,如表1所示,pRCP中多糖含量达44.61%,未检测到蛋白质。
表1分离纯化覆盆子多糖和蛋白质含量。
a
三)覆盆子多糖(pRCP)的分子量测定
色谱条件:采用凝胶色谱-示差-多角度激光光散射系统,示差检测器为OptilabT-rEX(Wyatt technology,CA,USA),激光光散射检测器为DAWN HELEOSⅡ(Wyatttechnology,CA,USA),根据多糖性质,采用合适分子量范围的凝胶排阻色谱柱,包括OhpakSB-805HQ(300×8mm),Ohpak SB-804HQ(300×8mm)和Ohpak SB-803HQ(300×8mm),柱温设置为45℃,进样量为100μL,流动相为0.1M NaNO
表2覆盆子多糖分子量和多分散指数。
a
四)覆盆子多糖(pRCP)的单糖组成分析
样本制备:将约5mg pRCP粉末称入密封管中,与1mL三氟乙酸(TFA,2M)溶液,在121℃下水解2h,并用氮气干燥。pRCP水解物用甲醇洗涤三次,用氮气干燥。干燥后的水解产物再溶解于无菌水中,经0.22μm微孔过滤膜过滤至样管中以备分析。
色谱条件:采用Thermo ICS5000离子色谱系统(ICS5000,Thermo FisherScientific,USA)和电化学检测器对pRCP单糖组分进行分析检测。运用Dionex
如图2a所示,其中单糖标准品依次出峰顺序为:岩藻糖、阿拉伯糖、鼠李糖、半乳糖、葡萄糖、木糖、甘露糖、果糖、核糖、半乳糖醛酸、古罗糖醛酸、葡萄糖醛酸和甘露糖醛酸。
如图2b所示,覆盆子多糖(pRCP)中单糖组成包括岩藻糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、半乳糖醛酸和葡萄糖醛酸。定量分析结果如表3所示,pRCP的单糖成分主要由阿拉伯糖和半乳糖组成,分别占比39.76%和39.43%,另外还含有8.56%半乳糖醛酸和5.64%葡萄糖醛酸。
表3覆盆子多糖单糖组成及其比例。
五)覆盆子多糖(pRCP)的FT-IR分析
样本制备及分析:称取pRCP样本2mg和溴化钾200mg,混合压制成片,对照样本采用溴化钾粉末压片而成。分别置于傅里叶变换红外光谱仪(Nicolet iZ-10)扫描分析,仪器分辨率4.00cm
结果如图3所示,吸收带在3600-3200cm
六)覆盆子多糖(pRCP)的甲基化分析
样本制备:将覆盆子多糖pRCP样本(10mg)完全溶解在DMSO溶液中,用碘甲烷甲基化,然后加入蒸馏水结束反应,随后混合物用蒸馏水透析48h,氮气干燥。这些步骤重复进行三次,确保pRCP完全甲基化。然后在甲基化多糖中加入三氟乙酸(TFA,2M),在121℃下反应90min。多糖在室温下用NaBH
色谱条件:采用GC-MS(Agilent 7890A;Agilent Technologies,USA)和BPX-70色谱柱对上述样本进行分析。进样量为1μL,分流比为10:1,载气为高纯氦气,柱温箱的初始温度为140℃保持2.0min,然后以3℃/min程序升温至230℃,保持3min。
结果如表4可得,pRCP分子结构中t-Ara(f)、3-Ara(f)、5-Ara(f)和2,5-Ara(f)的摩尔百分比分别为23.059、2.997、11.156和2.446%。pRCP主要糖苷键为t-Gal(p)、3-Gal(p)、4-Gal(p)、6-Gal(p)和3,6-Gal(p),比例分别为3.477、4.362、5.367、5.782和18.344%。此外,pRCP还由t-Gal(p)-UA和4-Gal(p)-UA组成,比例分别为0.386和8.051%。
表4覆盆子多糖甲基化和键合类型分析。
七)覆盆子多糖(pRCP)的核磁共振分析
样本制备:将pRCP样品(10mg)溶解于0.5mL D
仪器分析:采用布鲁克500MHz核磁共振谱仪对pRCP样本进行分析,核磁探头为QXI
采用一维氢谱解析多糖结构中糖苷键的构型问题,如图4a所示,pRCP样品氢谱信号主要集中在3.2~5.4ppm之间,在4.4-5.4ppm异头信号区共识别8个偶合信号峰,表明pRCP中至少含有8种糖残基,分别标记为残基A、B、C、D、E、F、G和H。与
综合一维和二维核磁共振谱图分析pRCP糖残基存在多种连接方式:糖残基A的H1(5.25ppm)与残基D的C4(84.01ppm)以及残基B的C3(80.22ppm)均有偶合信号。糖残基B的H1(4.54ppm)与残基B的C6(69.40ppm)存在偶合信号;残基B的C1(103.37ppm)与残基E的H6(3.66ppm)有偶合信号。糖残基C的H1(5.10ppm)与残基D的C4(84.01ppm)以及残基C的C5(67.03ppm)均有偶合信号;残基C的C1(107.64ppm)与残基B的H6(3.95ppm)有偶合信号。糖残基D的H1(5.20ppm)与残基C的C5(67.03ppm)以及残基F的C4(81.52ppm)均有偶合信号。糖残基E的H1(4.51ppm)与残基B的C6(69.40ppm)存在偶合信号。糖残基F的H1(5.17ppm)与残基B的C3(80.22ppm)存在偶合信号。结合NOESY谱图进一步判断验证该多糖中各残基的连接顺序,糖残基A的H1与残基D的H4、残基B的H3均存在交叉峰;糖残基B的H1与残基B的H6、残基E的H6均存在交叉峰;糖残基C的H1与残基C的H5、残基D的H4均存在交叉峰;糖残基D的H1与残基F的H4存在交叉峰;糖残基E的H1与残基B的H6、残基E的H6均存在交叉峰。上述结果与HMBC谱基本一致。
表5覆盆子多糖核磁共振碳氢信号归属。
综合一维和二维核磁共振分析,推断pRCP主要是由→3,6)-β-Galp(1→和→5)-α-Araf(1→形成主链,支链主要由α-Araf(1→连接在残基B的3位构成,因此推测pRCP可能的结构为:
式中,Ara为阿拉伯糖残基;Gal为半乳糖残基。
八)覆盆子多糖(pRCP)表面形态结构观察
样本制备:pRCP样品过100目筛,称取约10mg样品于载物台上,压紧,铺均匀,上机检测。
样本分析:采用高分辨率场发射扫描电子显微镜(HITACHI Regulus 8100)观察pRCP的表面形态结构,技术参数包括:二次电子分辨率,0.8nm(加速电压15kV),1.1nm(着陆电压1kV)
实施例2:
动物实验:雄性C57BL/6小鼠,6周龄,体重18-22g,购自北京维通利华实验动物技术有限公司。将所有小鼠饲养于温州医科大学实验动物中心无特定病原体SPF级动物房(温度:22±2℃;湿度:45±3%;亮/暗周期:12/12h)。在实验期间,小鼠自由饮水及进食。所有动物实验均按照《实验动物护理和使用指南》执行,并经温州医科大学动物伦理委员会批准。适应性1周后,将小鼠随机分为3组,包括正常饮食组(Chow)、高脂饮食组(HFD)和高脂饮食结合pRCP干预组(pRCP)。pRCP组小鼠每日上午9:00灌胃无菌水配制的pRCP溶液,Chow和HFD组小鼠以相同的方式灌胃同等剂量无菌水以减少灌胃操作对小鼠产生影响。干预12周后,收集小鼠结肠组织,采用实时定量PCR分析和免疫组化测定小鼠结肠组织炎症和氧化应激指标。
实验结果:相对于Chow组小鼠,HFD组小鼠结肠组织中炎症因子IL-6(图7a)、IL-1β(图7b)和TNF-α(图7c)的表达水平显著升高,但是这些炎症因子水平在pRCP组小鼠结肠中显著降低。相对于Chow组小鼠,HFD组小鼠结肠中抗氧化指标表达水平包括Sod1(图7d)、Nqo1(图7e)和Nrf2(图7f)显著降低,而pRCP可以使其恢复到正常水平。此外,摄入HFD后小鼠结肠中促氧化指标Acox1(图7g)和Nox2(图7h)的表达水平显著升高,而pRCP干预后HFD小鼠结肠中促氧化指标水平显著降低。相对于Chow和HFD组,另一个促氧化指标Nox4的表达水平在pRCP组小鼠结肠组织中也表现出轻微但不显著的下降(图7i)。免疫组化结果显示,相对于Chow组小鼠,HFD组小鼠结肠中DNA氧化损伤的生物标志物8-OHDG(图7j和7k)和脂质过氧化的生物标志物4-HNE(图7l和7m)的蛋白水平均显著升高,pRCP干预后氧化应激指标显著下降并恢复正常水平。上述结果表明本专利提供的pRCP具有缓解高脂饮食导致的结肠炎症和氧化应激的能力。
各位技术人员须知:虽然本发明已按照上述具体实施方式做了描述,但是本发明的发明思想并不仅限于此发明,任何运用本发明思想的改装,都将纳入本专利专利权保护范围内。
以上所述仅是本发明的优选实施方式,本发明的保护范围并不仅局限于上述实施例,凡属于本发明思路下的技术方案均属于本发明的保护范围。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理前提下的若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
