一种用于检测猴痘病毒的环介导等温扩增引物组合及其应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于生物学检测技术领域,具体涉及一种用于检测猴痘病毒的环介导等温扩增引物组合及其应用。
背景技术
猴痘是由猴痘病毒(Monkeypox virus,MPXV)感染引起的急性人兽共患传染病。猴痘病毒最早是1958年在哥本哈根的实验猴体内分离得到,是一种重要的动物源性感染病原,严重影响公共卫生安全。
猴痘病毒为双链DNA病毒,与天花病毒同属痘病毒科。猴痘病毒具有与正痘病毒一致的典型形态,外形为圆角砖形或卵圆形,大小为200-400nm。砖形或卵圆状,外被脂蛋白膜或封套,中间具有两个含蛋白质的侧体,有1个厚膜核心,核心内含很大的双链DNA基因体。猴痘病毒的基因组为双链DNA,长约197kb,基因组末端包含一个相同但方向相反的末端反向重复序列。该病毒包含190个开放阅读框,其中4个位于末端反向重复序列中。
猴痘感染的症状与天花相似,俗称“猴天花”,其临床表现如发热、头痛、淋巴结肿大、咳嗽和全身极度疼痛。同时会出现全身性的红斑和/或皮疹,随后发展为躯干部、脸部以及手掌和脚掌的丘疹,丘疹再发展成为囊疱,随后形成脓疱并结痂,通常皮疹出现十天后结痂脱落。病情的严重程度依宿主种类的不同而存在差异。猴痘病毒可通过直接接触患者或者被感染的动物,或通过患者的体液传播。
猴痘病毒主要分布在中非和西非热带雨林地区。自1980年以来,刚果民主共和国的猴痘已经增加了14倍。发病率从每万人不到1例上升到每万人约14例。2020年刚果有近4600个疑似病例。2022年4月29日,一名英国居民在地方性流行该病的尼日利亚旅行时表现出猴痘症状。此人随后于5月4日返回英国,将此次爆发的病毒输入该国。在5月中旬,伦敦地区出现该病毒的社区传播。目前已有75个国家(美国、加拿大、西班牙、意大利等国)和地区向世界卫生组织报告了超过1.6万例病例,包括5例死亡病例。7月23日,世界卫生组织紧急宣布猴痘疫情已构成“国际关注的突发公共卫生事件”。至今,我国尚未发现本病,值得高度警惕,防止该病毒从国外传入。
猴痘病毒是继天花病毒之后最重要的痘病毒,基于目前全球分离到的MPXV基因组比较分析,可将其分为西非和刚果盆地的2个进化支:刚果盆地分离毒株与西非毒株的核苷酸序列一致性达95%,而这两个地区各自的分离毒株间则高达99%。刚果盆地流行株相对西非流行株毒力强,并且在人群中有相对较高的传染性。
现有技术中,猴痘病毒的检测方法主要包括病毒培养分离,酶联免疫检测,PCR检测,荧光定量PCR检测等检测技术。
病毒培养技术用收集的样本与细胞共培养,通过观察细胞病变或其他方法检测病毒的扩增来确定样本中是否有病毒感染。此方法虽然是病毒感染检测的“金标准”,但只能检测样本中具有感染能力的病毒颗粒,灵敏度不足。由于操作程序复杂,对实验场地和设备有生物安全等级要求,检测过程长(至少要一周以上),不能用于现场检测,对不同病毒的检测结果不同。
基于抗体的酶联免疫检测,直接、间接荧光检测以及胶体金快速检测均利用抗原与抗体之间的特异结合,通过偶联显色基团的抗体实现对病原体的可视化检测。抗体检测不依赖大型设备,而且检测结果可在30分钟以内得到。但抗体检测由于没有信号放大的过程,灵敏性比分子检测低,且结果容易出现假阳性及假阴性。由于新抗体制备周期较长,该方法很难用于新出现病毒的检测,而且对于由抗原漂变产生的新病毒亚型的检测能力也值得怀疑。
病原的核酸分子检测通过聚合酶对病原的核酸分子进行扩增,然后利用荧光、电泳等方法对反应过程或产物进监测,根据反应是否进行或产物是否出现来判定病原是否出现。与普通PCR相比,定量PCR可以实现病毒的定量检测,而且反应过程可以实时监测,还可以确定样品中病原的量,灵敏度也高于普通PCR。但基于PCR的方法都需要热循环仪等设备,对检测场地也有要求,定量PCR还需要专门训练,这些都限制了PCR相关技术在快速检测中的应用。
NASBA是一种恒温、连续的酶介导的核酸扩增技术,该技术同时使用T7RNA聚合酶、反转录酶与核糖核酸酶通过转录与反转录过程的交替进行实现模板的扩增,但该技术需要通过分子信标等荧光探针实现结果的检测,因而需要特殊设备,且主要用于RNA模板的检测。由于结果检测需要专门的设备,该技术主要用实验室检测,很难用于现场检测。除了NASBA外还有SDA,HAD,RCA等恒温扩增技术可能用于病原检测。
LAMP(Loop-mediated isothermal amplification,环介导的等温扩增)是于2000年首次报道并在其后经过不断改进形成的一种等温,连续,快速,高特异和可视化检测的核酸扩增方法。但是目前难以找到合适的、较广谱的LAMP扩增引物,国内外还没有MPXV的LAMP检测产品出现。因此,提供一种采用环介导等温扩增(LAMP)快速检测猴痘病毒的方法具有重要的应用价值。
发明内容
针对现有技术存在的不足,本发明的目的在于提供一种用于检测猴痘病毒的环介导等温扩增引物组合及其应用。本发明经过广泛而深入的研究和试验,首次揭示一种猴痘病毒的环介导等温扩增检测方法。经过比较筛选,找到了针对MPXV特异性良好的引物,所述引物针对含有MPXV以外的核酸不发生特异性扩增。本发明的检测方法可良好地应用于鉴定MPXV成分,并且具有良好的再现性、灵敏度。
为达到此发明目的,本发明采用以下技术方案:
第一方面,本发明提供一种用于检测猴痘病毒的环介导等温扩增引物组合,所述引物组合为特异性扩增猴痘病毒N4R基因的引物组合;所述引物组合包括外引物、内引物和环引物;
所述外引物包括MPXV-F3和MPXV-B3;所述MPXV-F3的核苷酸序列如SEQ ID NO:1所示,所述MPXV-B3的核苷酸序列如SEQ ID NO:2所示。
优选地,所述内引物包括MPXV-FIP和MPXV-BIP;所述MPXV-FIP的核苷酸序列如SEQID NO:3所示,所述MPXV-BIP的核苷酸序列如SEQ ID NO:4所示。
优选地,所述环引物包括MPXV-LF和MPXV-LB;所述MPXV-LF的核苷酸序列如SEQ IDNO:5所示;所述MPXV-LB的核苷酸序列如SEQ ID NO:6所示。
MPXV-F3(SEQ ID NO:1):GCGAATAAGACAGTGCGATT。
MPXV-B3(SEQ ID NO:2):TCATACAGAACATCTACAGGAT。
MPXV-FIP(SEQ ID NO:3):
GACCAAAGATCGAGGTCGTCGATGGAGTCGGTAGATTTCATG。
MPXV-BIP(SEQ ID NO:4):
TGGATTAGGTGTTGACTGTTATGTTCACAAATTGGTTCAAGGAGAA。
MPXV-LF(SEQ ID NO:5):GAAACTGCTCATCGACAGC。
MPXV-LB(SEQ ID NO:6):CTAGAACCAGTTGTTGACAGGA。
本发明通过对大量MPXV基因组序列的分析,找到了在很多MPXV病毒基因组中相对保守的序列区段,基于此进行引物的筛选,获得一类可特异性鉴定MPXV的引物,其对于MPXV的DNA发生特异性扩增,而对其它病毒的核酸不发生特异性扩增。
LAMP是近年来发展的一种新颖和较成熟的等温核酸扩增技术。与PCR方法相比,LAMP不需要热循环仪(PCR仪),且由于LAMP反应中DNA聚合酶发挥聚合作用,改变离子数量进而改变可视化指示剂的PH值,使粉色反应液变成黄色。整个反应过程快速,颜色改变清晰,扩增产物通过肉眼观察即可判定结果;因此LAMP适合于现场、战时野外或条件较差的实验室进行快速检测。
LAMP技术以其快速、准确和操作简便等优点在核酸的科学研究、病原微生物鉴定和转基因食品检测等领域得到了日益广泛的应用。总体而言,LAMP法是一种简便、快速、高特异的基因扩增法,不需要特殊的试剂和仪器设备,采用该方法能建立起总成本低廉的检测体系。
本发明采用环介导等温扩增(LAMP)快速检测技术,设计三对针对目的序列的片段区域的引物,利用链置换聚合酶和扩增产物自身形成的可与引物结合的颈环结构实现目的片段的循环扩增,最终产物为一系列不同长度的目的序列的串联长链。该扩增方法的产物可通过肉眼显色观察,快速地判断待测样品是否含有MPXV。同时还可应用荧光素来进行结果观察。在反应过程中加入SYTO9荧光染料(一种嵌入染料),可用于通过荧光测量实时跟踪LAMP反应。可用实时荧光计的
本发明所设计的引物还可以用放射性同位素、生物素、酶、荧光素或其他化学发光物质进行标记。利用本发明的引物进行LAMP反应,可通过肉眼显色观察,快速地判断待测样品是否含有MPXV。
第二方面,本发明提供一种LAMP扩增体系,所述扩增体系包括:用于扩增的缓冲体系以及第一方面所述的用于检测猴痘病毒的环介导等温扩增引物组合。
第三方面,本发明提供一种基于环介导等温扩增的猴痘病毒检测试剂盒,所述检测试剂盒包括第一方面所述的用于检测猴痘病毒的环介导等温扩增引物组合。
优选地,所述检测试剂盒还包括反应预混液、荧光染料或猴痘病毒质粒阳性质控品中任意一种或者至少两种的组合。
优选地,所述反应预混液包括酶、dNTPs或酶缓冲液中任意一种或者至少两种的组合。
优选地,所述酶包括Bst2.0 DNA聚合酶和热启动反转录酶。
优选地,所述荧光染料包括绿色荧光核酸染料SYTO 9或pH敏感的酚红染料。
优选地,所述猴痘病毒质粒阳性质控品为为插入病毒序列第190765-191264位片段的质粒载体,所述病毒序列的编号为GenBank:ON602722.2。
本发明中,所述试剂盒中还可含有鉴定MPXV的使用说明书和/或标准操作程序。
第四方面,本发明提供一种检测猴痘病毒的方法,所述方法包括:
(a)采用第一方面所述的用于检测猴痘病毒的环介导等温扩增引物组合对待测样品进行等温扩增;
(b)采用荧光检测法、浊度检测法或凝胶电泳检测法检测扩增结果,根据扩增情况判断所述待测样品中是否存在猴痘病毒。
本发明中,反应过程可以使用实时浊度来检测反应进程,也可以通过其他方法检查反应产物,包括琼脂糖凝胶电泳或添加钙黄绿素、孔雀石绿或羟基萘酚蓝等指示剂。
优选地,步骤(a)中,所述等温扩增的反应体系包括反应预混液和扩增引物混合液。
优选地,所述等温扩增的反应体系中酶的终浓度为0.2-0.4U/μL,例如可以是0.2U/μL、0.25U/μL、0.3U/μL、0.35U/μL或0.4U/μL等。
优选地,所述等温扩增的反应体系中MPXV-F3和MPXV-B3的终浓度为0.1-0.4μM,例如可以是0.1μM、0.2μM、0.3μM或0.4μM等。
优选地,所述等温扩增的反应体系中MPXV-FIP和MPXV-BIP的终浓度为1-2μM,例如可以是1μM、1.2μM、1.4μM、1.6μM、1.8μM或2.0μM等。
优选地,所述等温扩增的反应体系中MPXV-LF和MPXV-LB的终浓度为0.2-0.6μM,例如可以是0.2μM、0.3μM、0.4μM、0.5μM或0.6μM等。
优选地,采用浊度检测法或凝胶电泳检测法检测扩增情况,步骤(a)中,所述等温扩增的反应体系包括反应预混液和扩增引物混合液;所述等温扩增的反应条件为:64-66℃(例如可以是64℃、65℃或66℃等)反应40-60min(例如可以是40min、45min、50min、55min或60min等)。
优选地,采用荧光检测法检测扩增情况,步骤(a)中,所述等温扩增的反应体系包括反应预混液、扩增引物混合液和荧光染料,所述等温扩增的反应体系中荧光染料的终浓度为200-300nM,例如可以是200nM、210nM、230nM、250nM、270nM、290nM或300nM等。
优选地,所述等温扩增的反应条件为:64-66℃(例如可以是64℃、65℃或66℃等),0.8-1.2min(例如可以是0.8min、0.9min、1.0min、1.1min或1.2min等)采集荧光,58-62次循环(例如可以是58、59、60、61或62)。
优选地,步骤(b)中,所述判断的标准为:有特异性扩增产物产生,说明检测样品中存在猴痘病毒;没有特异性扩增产物产生,说明检测样品中不存在猴痘病毒。
优选地,所述方法还包括对阳性对照和阴性对照进行同步检测的步骤。
优选地,所述阳性对照为添加猴痘病毒质粒阳性质控品的组,所述阴性对照为不添加猴痘病毒质粒阳性质控品的组。
作为本发明的优选技术方案(荧光法检测),所述检测猴痘病毒的方法包括:
(a)采用第一方面所述的用于检测猴痘病毒的环介导等温扩增引物组合对待测样品进行等温扩增;
所述等温扩增的反应体系包括:酶、dNTPs、酶缓冲液、MPXV-F3、MPXV-B3、MPXV-FIP、MPXV-BIP、MPXV-LF和MPXV-LB;
所述酶的终浓度为0.2-0.4U/μL;所述MPXV-F3和MPXV-B3的终浓度各自独立的为0.1-0.4μM;所MPXV-FIP和MPXV-BIP的终浓度各自独立的为1-2μM;所述MPXV-LF和MPXV-LB的终浓度各自独立的为0.2-0.6μM;
所述等温扩增的反应条件为:64-66℃反应40-60min;
(b)采用荧光检测法、浊度检测法或凝胶电泳检测法检测扩增结果,根据扩增情况判断所述待测样品中是否存在猴痘病毒;
所述判断的标准为:有特异性扩增产物产生,说明检测样品中存在猴痘病毒;没有特异性扩增产物产生,说明检测样品中不存在猴痘病毒。
作为本发明的优选技术方案(浊度检测法或凝胶电泳检测法检测),所述检测猴痘病毒的方法包括:
(a)采用第一方面所述的用于检测猴痘病毒的环介导等温扩增引物组合对待测样品进行等温扩增;
所述等温扩增的反应体系包括:酶、dNTPs、酶缓冲液、荧光染料、MPXV-F3、MPXV-B3、MPXV-FIP、MPXV-BIP、MPXV-LF和MPXV-LB;
所述酶的终浓度为0.2-0.4U/μL;所述荧光染料的终浓度为200-300nM,所述MPXV-F3和MPXV-B3的终浓度为0.1-0.4μM;所MPXV-FIP和MPXV-BIP的终浓度为1-2μM;所述MPXV-LF和MPXV-LB的终浓度为0.2-0.6μM;
所述等温扩增的反应条件为:64-66℃,0.8-1.2min采集荧光,58-62次循环;
(b)采用荧光检测法、浊度检测法或凝胶电泳检测法检测扩增情况,根据扩增情况判断所述待测样品中是否存在猴痘病毒;
所述判断的标准为:有特异性扩增产物产生,说明检测样品中存在猴痘病毒;没有特异性扩增产物产生,说明检测样品中不存在猴痘病毒。
本发明中,获取待测样品的DNA的方法是本领域技术人员所熟知的技术,例如可采取传统的酚/氯仿/异戊醇法,或者可采用一些商购的DNA提取试剂盒,这类试剂盒是本领域技术人员熟知的。
本发明所述的检测方法可实现快速检测、批量检测MPXV的目的。
第五方面,本发明提供第一方面所述的用于检测猴痘病毒的环介导等温扩增引物组合、第二方面所述的LAMP扩增体系或第三方面所述的基于环介导等温扩增的猴痘病毒检测试剂盒中的任意一种或至少两种的组合在制备检测猴痘病毒的产品中的应用。
本发明所述的数值范围不仅包括上述列举的点值,还包括没有列举出的上述数值范围之间的任意的点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
相对于现有技术,本发明具有以下有益效果:
(1)本发明首次揭示一种可特异性鉴定MPXV的引物,所述引物特异性良好,对于MPXV能够实现特异性扩增,而对于MPXV以外的其它病毒基因组不能特异性扩增。并且,所述引物具有良好的再现性、结果稳定可靠。
(2)利用所述引物或含有所述引物的检测试剂盒,可快速、大批量地检测MPXV,从待测样品中快速准确地区分MPXV,并且所需样品量少,操作简单。
附图说明
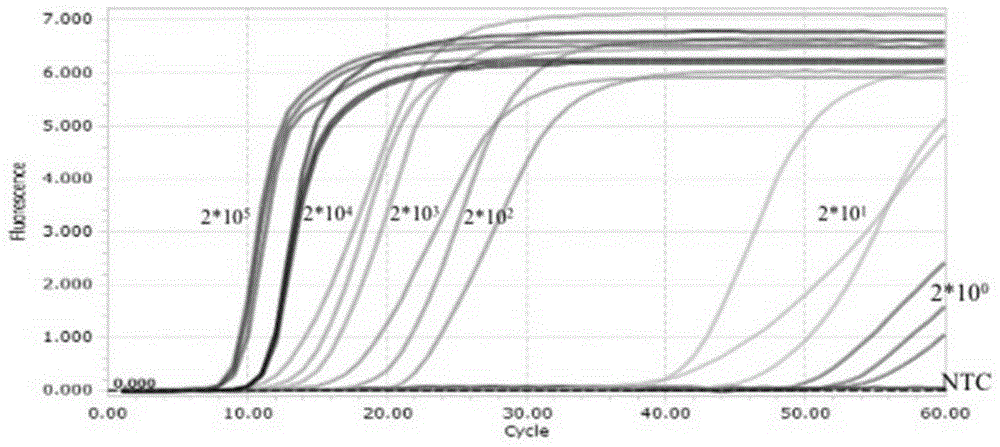
图1是LAMP荧光法实时检测MPXV的灵敏性的结果图;
图2是LAMP目视法检测MPXV的灵敏性的结果图;
图3是荧光法对应管的实时荧光变化曲线图;
图4是目视法对应管的颜色变化的结果图;
图5是LAMP荧光法实时检测MPXV的阳性样本的结果图;
图6是LAMP目视法检测MPXV的阳性样本的结果图。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如J.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。
除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明中。文中所述的较佳实施方法与材料仅作示范之用。
实验材料
猴痘病毒质粒是将病毒序列(GenBank:ON602722.2)第190765-191264位的片段插入pUC57质粒载体中,获自生工生物公司。
Colorimetric LAMP 2X Master Mix(DNA&RNA),购自NEB公司,产品型号为M1800L。
LAMP Kit(DNA&RNA)购自NEB公司,产品型号为E1700L。
SYTO
实验方法
病毒样品及DNA提取
将样本浸入病毒运输液中,待反应前将病毒运输液分装用于核酸提取。用QIAampDNA Mini Kit(Qiagen)提取试剂盒提取样本浸出液中的病毒DNA,并用超纯水洗脱,洗脱液作为反应模板使用。
用于特异性检测样本包括HPV-16,HPV-18,HBV(以上样本均来自广东省第二人民医院馈赠),Vaccinia Virus(VR-1566),HSV-1(VR-1493),HSV-2(VR-734),VZV(VR-1832),MPXV质粒。
临床样本验证包括12份中非猴痘患者临床样本中提取的DNA样本。
LAMP(荧光法)反应过程
(1)在室温下解冻NEB公司WarmStart LAMP Kit里所有要使用的组件并置于冰上,短暂涡旋以混合并离心收集材料。
(2)按表1(荧光法)配制反应体系,并置于反应容器中。
(3)密封反应容器。
(4)65℃,1min采集荧光,60次循环;对于非常低的拷贝目标样品类型或已知会产生较慢扩增时间的反应,可以根据需要延长时间。
表1
LAMP(目视法)反应过程
(1)在室温下解冻NEB公司WarmStart Colorimetric LAMP 2X Master Mix kit里所有要使用的组件并置于冰上,短暂涡旋以混合并离心收集材料。
(2)按表2(目视法)配制反应体系,并置于反应容器中。
(3)密封反应容器。
(4)65℃反应40min;对于非常低的拷贝目标样品类型或已知会产生较慢扩增时间的反应,可以根据需要延长时间。
表2
实施例1引物设计
本实施例提供一种用于检测猴痘病毒的环介导等温扩增引物组合。以MPVX-FRA-2022-TLS67的全基因组序列(获自GenBank:ON602722.2)为参考,进行多重序列比对以及序列分析,寻找保守区域,该靶序列区域为其第5840-6339位和第190765-191264位,将此保守区域从比对结果中截取出来,经重新比对后,进行引物设计。
对设计出的引物用所建立的LAMP检测体系进行筛选,得到符合要求的引物,筛选得到的工作引物如表3所示。
表3
实施例2 LAMP扩增体系
本实施例提供一种LAMP扩增体系,所述扩增体系包括:用于扩增的缓冲体系以及包含在所述扩增体系中的实施例1所述的用于检测猴痘病毒的环介导等温扩增引物组合。
将实施例1中的引物按比例配制为引物混合物,所述引物混合液的终浓度为:
MPXV-F3:0.2μM;MPXV-B3:0.2μM;
MPXV-FIP:1.6μM;MPXV-BIP:1.6μM;
MPXV-LF:0.4μM;MPXV-LB:0.4μM;
或按比例扩大得到引物混合液,每次反应加2μL进反应体系中。
实施例3基于环介导等温扩增的猴痘病毒检测试剂盒
本实施例提供一种基于环介导等温扩增的猴痘病毒检测试剂盒,所述检测试剂盒含有实施例1所述的用于检测猴痘病毒的环介导等温扩增引物组合、反应预混液、荧光染料和猴痘病毒质粒阳性质控品。
所述反应预混液为NEB公司的WarmStart LAMP Kit体系;所述荧光染料为赛默飞公司的SYTO 9。
实施例4 MPXV的LAMP荧光法检测体系建立
本实施例以NEB公司的WarmStart LAMP Kit体系为出发体系,建立MPXV的LAMP荧光法检测体系。
荧光法检测体系中各组分如表1所示,所述引物混合液(PrimerMix)配方参照实施例2。以MPXV为模板用所设计的引物及实验条件组合进行反应,用实时荧光计的
实施例5 MPXV的LAMP目视法检测体系建立
本实施例以NEB公司的WarmStart Colorimetric LAMP 2X Master Mix体系为出发体系,建立MPXV的LAMP目视法检测体系。
目视法检测体系中各组分如表2所示,所述引物混合液(PrimerMix)配方参照实施例2。以MPXV为模板用所设计的引物及实验条件组合进行反应,反应过程如下:65℃反应40min后,目视观察反应管颜色变化。
实施例6 MPXV的LAMP引物组合检测的敏感性
本实施例对实施例1中用于检测猴痘病毒的环介导等温扩增引物组合的敏感性进行检测。
(1)待测样品的准备
MPXV病毒质粒DNA模板获自生工公司。
上述制备的MPXV病毒质粒DNA模板的初始浓度为40ng/μL。将所述MPXV病毒质粒DNA模板进行10倍浓度稀释,具体设置2×10
在检测中设置阴性对照,阴性对照为NTC:no template control,所述阴性对对照中不含有MPXV病毒质粒DNA模板。
荧光法检测的反应体系如表1所示,反应程序为:65℃,1min采集荧光,60次循环。
目视法检测的反应体系如表2所示,反应程序为:65℃反应40min后,目视观察反应管颜色变化。
灵敏度检测结果如图1和图2所示,图1为LAMP荧光法实时检测MPXV的灵敏性的结果图;图2为LAMP目视法检测MPXV的灵敏性的结果图。从图1和图2可知,所述引物组合的检测灵敏度可以达到2×10
实施例7 MPXV的LAMP引物组合的特异性
本实施例对实施例1中用于检测猴痘病毒的环介导等温扩增引物组合的特异性进行检测。
以MPXV及相近种属的DNA为模板,参照实施例4和实施例5建立的反应体系分别对所述模板进行荧光法、目视法检测。
荧光法检测反应体系如表1所示,反应过程为:65℃,1min采集荧光60次循环。
目视法检测反应体系如表2所示,反应过程为:65℃反应40min后,目视观察反应管颜色变化。
特异性反应的模板和LAMP检测结果如表4、图3和图4所示:
表4
图3为荧光法对应管的实时荧光变化曲线,图中NTC代表non template control,图4为目视法对应管的颜色变化的结果图,图中NTC代表non template control。从图3、图4可知,MPXV引物组的特异性良好,对于非MPXV病毒检测结果呈阴性。
实施例8 MPXV的LAMP对样本的检测
本实施例对采集的qPCR阳性MPXV样本12例,用实施例4和实施例5建立的LAMP荧光法检测体系和目视法检测体系进行结果验证,验证LAMP反应的正确性。
荧光法检测的反应体系如表1所示,反应程序为:65℃,1min采集荧光,60次循环。
目视法检测的反应体系如表2所示,反应程序为:65℃反应40min后,目视观察反应管颜色变化。
验证结果如图5和图6所示,图5为LAMP荧光法实时检测MPXV的阳性样本的结果图,图6为LAMP目视法检测MPXV的阳性样本的结果图。从图5和图6的结果可知,经LAMP检测阳性的样本12份,与qPCR的检测结果一致,准确率一致。
综上,本发明通过获得MPXV的全基因组序列(获自GenBank),进行多重序列比对以及序列分析,寻找保守区域,将此保守区域从比对结果中截取出来,经重新比对后,进行引物设计。将设计出的引物用所建立的LAMP检测体系进行一系列实验表明,筛选得到的工作引物能够特异性的检测出MPXV,所述引物具有良好的再现性、结果稳定可靠,具有重要的应用价值。
申请人声明,以上所述仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,所属技术领域的技术人员应该明了,任何属于本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,均落在本发明的保护范围和公开范围之内。
- 一种马铃薯卷叶病毒PLRV的反转录环介导等温扩增RT-LAMP检测试剂
- 基于环介导等温扩增技术检测猴痘病毒的组合物及其应用
- 一种用于检测猪瘟病毒的环介导等温扩增引物组及试剂盒
