非诊断目的检测并区分正痘病毒的方法、其装置及应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于生物医学领域,具体涉及一种非诊断目的检测并区分正痘病毒的方法、其检测装置及应用。
背景技术
猴痘(monkeypox),一种传染性的人畜共患病,属于正痘病毒科,脊椎动物痘病毒亚科,正痘病毒属。猴痘主要流行于中非和西非的热带雨林。自2003年出现于西半球,之后的研究发现猴痘存在两个分支,西非分支(现在的clade IIa,clade IIb)和刚果分支(现在的clade I)。西非分支和刚果分支的序列同源性为99%。西非分支比刚果分支毒力更轻,感染后出现更轻微的皮疹和更少的病灶。有研究表明给严重联合免疫缺陷的BALB/c小鼠腹腔注射西非株与注射刚果株相比,小鼠表现出更长的平均生存时间。
从2022年的1月1日到10月6日,全球实验室确诊的猴痘病例有36412例。2022年的7月23日,世界卫生组织总干事宣布,猴痘构成国际关注的突发公共卫生事件。因此,在当前猴痘流行的局势下,十分有必要开发新的诊断方法快速准确检测和区分猴痘病毒不同分支。
猴痘的实验室诊断十分重要因为感染猴痘后的临床表现与其他“痘样”疾病的临床表现非常相似,例如天花和鸡痘。病毒分离可靠特异,但却有暴露的风险;由于正痘病毒之间的交叉反应,血清学检测容易产生假阳性;PCR反应有很高的灵敏度并且只需要极少的样本量。但传统的PCR方法需要结合限制性片段长度多态性分析或者琼脂糖凝胶电泳,一代测序等技术,耗时费力。因此,快速而灵敏的基于Taqman探针的方法应运而生。
现有的区分猴痘病毒西非株和刚果株的方法主要是利用西非株或者刚果株特异性缺失。比如:利用猴痘病毒西非株C3L基因缺失检测猴痘病毒刚果株,而利用猴痘病毒刚果株G2R基因有3bp缺失检测猴痘病毒西非株;利用西非株A型包涵体蛋白基因比刚果株多453bp,根据传统的聚合酶链式反应结合限制性内切酶方法区分条带大小;利用西非株A型包涵体蛋白基因比刚果株多453bp,设计两条特异性反向引物。主要存在的问题:耗时;需要针对不同的基因;常需要两对引物等;不能在同一个反应里同时检测区分猴痘病毒西非分支和刚果分支。
发明内容
因此,本发明的目的在于克服现有技术中的缺陷,提供一种非诊断目的检测并区分正痘病毒的方法、其检测装置及应用。能同时快速检测并区分猴痘病毒clade I,猴痘病毒clade II以及其他正痘病毒的数字PCR方法,该发明应具有特异性和灵敏性。
在阐述本发明内容之前,定义本文中所使用的术语如下:
术语“PCR”是指:聚合酶链式反应。
术语“dPCR probe Master mix”是指:数字PCR预混液。
术语“clade I”是指:猴痘病毒刚果分支。
术语“clade II”是指:猴痘病毒西非分支。
术语“FAM”是指:羧基荧光素。
术语“CY5”是指:磺基菁5。
术语“HEX”是指:六氯丁二烯荧光素。
术语“BHQ1”是指:黑洞淬灭基团1。
术语“BHQ2”是指:黑洞淬灭基团2。
术语“PUC57载体”是指:重组大肠杆菌PUC57质粒载体。
术语“PBR332载体”是指:PBR332质粒载体,由pSF2124、pMB1及pSC101三个亲本质粒经复杂的重组过程构建而成的。
术语“PUC18载体”是指:PUC18质粒载体,是适合于双脱氧法DNA测序的载体,自身带有抗氨苄青霉素基因,而外源片段不具有。
术语“PUC19载体”是指:PUC19质粒载体,与pUC18质粒载体相比,除了多克隆位点(Multiple Clone Site)部分反向互补外,其它部分完全一样。
术语“PGEM-T”是指:PGEM-T质粒载体。
术语“dPCR反应缓冲液”是指:数字PCR反应缓冲液。
术语“Taq聚合酶”是指:是第一个被发现的热稳定DNA聚合酶,分子量65kD,最初由Saiki等从温泉中分离的一株水生噬热杆菌(thermus aquaticus)中提取获得。
术语“AmpErase酶”是指:是一种26kDa的超纯重组酶,由大肠杆菌中的尿嘧啶N-糖基化酶基因编码,通过插入大肠杆菌宿主直接表达野生型酶。
术语“dATP”是指:脱氧腺苷三磷酸。
术语“dCTP”是指:脱氧胞苷三磷酸。
术语“dGTP”是指:脱氧鸟苷三磷酸。
术语“dTTP”是指:脱氧胸苷三磷酸。
术语“dUTP”是指:脱氧尿苷三磷酸。
为实现上述目的,本发明的第一方面提供了一种非诊断目的检测并区分正痘病毒的方法,所述方法包括以下步骤:
(1)构建质粒,合成上游引物和下游引物;
(2)将步骤(1)中构建的质粒稀释后配置反应体系,所述反应体系包:dPCR probeMaster mix、上游引物、下游引物、探针和模板DNA;和
(3)通过数字PCR法来扩增检测并区分正痘病毒;
其中:所述上游引物的序列如SEQ ID NO:1所示,所述下游引物的序列如SEQ IDNO:2所示。
根据本发明第一方面的方法,所述步骤(2)中,所述步骤(1)中构建的质粒稀释的倍数选自以下一种或多种:2倍、3倍、4倍、5倍、10倍,更优选选自以下一种或多种:2倍、5倍、10倍,进一步优选为10倍或2倍。
根据本发明第一方面的方法,所述步骤(3)中:所述数字PCR法包括:50~80℃3~10min,80~100℃12~20min,80~100℃5~15s,50~80℃20~40s30~45个循环,50~80℃50~70s,优选包括:50~70℃4~8min,90~100℃12~18min,90~100℃10~15s,50~70℃25~35s 30~45个循环,50~70℃55~65s,最优选包括:60℃5min,95℃15min,95℃15s,60℃30s 45个循环,60℃1min。
本发明的第二方面提供了一种用于检测并区分正痘病毒的装置,所述装置包括:
(A)引物合成及质粒构建机构;
(B)反应体系配置机构;和
(C)数字PCR分析机构;
其中,所述反应体系配置机构包括:dPCR probe Master mix、上游引物、下游引物、探针和模板DNA,并且,所述上游引物的序列如SEQ ID NO:1所示,所述下游引物的序列如SEQ ID NO:2所示。
根据本发明第一方面的方法第二方面的装置,其中,所述质粒的载体选自以下一种或多种:PUC57载体、PBR332载体、PUC18载体、PUC19载体、PGEM-T,优选选自以下一种或多种:PUC57载体、PUC18载体、PUC19载体,最优选为PUC57载体。
根据本发明第一方面的方法第二方面的装置,其中,所述探针包括:猴痘病毒clade I探针、猴痘病毒clade II探针、以及至少一种其他正痘病毒探针;
优选地,所述猴痘病毒clade I探针的序列如SEQ ID NO:3所示;
优选地,所述猴痘病毒clade II探针的序列如SEQ ID NO:4所示;和/或
优选地,所述其他正痘病毒探针的序列如SEQ ID NO:5所示。
根据本发明第一方面的方法第二方面的装置,其中,所述dPCR probe Master mix包括:dPCR反应缓冲液、Taq聚合酶、AmpErase酶、dATP、dCTP、dGTP、dTTP、dUTP和叠氮化钠;和/或
所述模板DNA的序列如SEQ ID NO:6和/或SEQ ID NO:7所示。
根据本发明第一方面的方法第二方面的装置,其中:
所述dPCR probe Master mix的用量为10-15μL,优选为10~12μL,最优选为12μL;
所述上游引物的用量为0.5~2.0μL,优选为0.8~1.5μL,最优选为1μL;
所述下上游引物的用量为0.5~2.0μL,优选为0.8~1.5μL,最优选为1μL;
所述猴痘病毒clade I探针、所述猴痘病毒clade II探针和所述其他正痘病毒探针的体积比为1:1:1;和/或
所述模板DNA的用量为3~10μL,优选为5~8μL,最优选为5μL。
本发明的第三方面提供了第二方面所述的装置在制备用于检测并区分正痘病毒的医疗产品中的应用。
根据如前所述第一、二、三方面的方法、装置或应用,所述正痘病毒为猴痘病毒,优选为猴痘病毒西非株和/或猴痘病毒刚果株。
dPCR probe Master mix是一种PCR反应混合液。其中包含脱氧尿苷三磷酸(dUTP),而非掺入到新合成的DNA(扩增子)中的脱氧胸苷三磷酸(dTTP)。在第一个热循环步骤中,反应混合液中包含的AmpErase酶将清除来自先前PCR运行的任何受污染的扩增子。然而,AmpErase酶并不会清除新形成的扩增子,因为它一旦暴露于超过55℃的环境下就会失活。
dPCR probe Master mix包括dPCR反应缓冲液、Taq聚合酶、AmpErase酶、dATP、dCTP、dGTP、dTTP、dUTP、叠氮化钠和专有添加剂。
本发明的突破在于,目前现有技术只能检测猴痘病毒,且要用两个反应分别检测猴痘病毒刚果株(clade I),西非株(clade II),检测猴痘病毒刚果株的引物探针设计在C3L基因上(西非株C3L缺失),检测猴痘病毒西非株的引物探针设计在G2R上(相比西非株,刚果株有3bp缺失);利用西非株或者刚果株特异性缺失设计探针。还有部分现有技术使用传统的聚合酶链式反应(PCR)结合限制性内切酶方法,利用西非株A型包涵体蛋白比刚果株多453bp观察条带大小区分,比较,耗时。另有部分现有技术通过一条上游引物,两条下游引物分别针对西非株和刚果株的A型包涵体蛋白基因,只能做到两个分支的全部检出,不能在同一个反应里区分猴痘病毒西非株和刚果株。
所述正痘病毒包括猴痘病毒以及其他正痘病毒。所述猴痘病毒包括猴痘病毒clade I和clade II。
而本发明可以检测正痘病毒,且在一个反应里同时区分猴痘病毒刚果株(cladeI),西非株(clade II)和其他正痘病毒;引物探针设计在猴痘病毒F3L基因上,利用猴痘病毒西非株和刚果株在F3L基因上邻近的四个突变设计针对西非株和刚果株特异性的探针。利用Taqman探针的多重荧光定量PCR方法,速度快,检测灵敏。通过一对引物,两条探针分别针对猴痘病毒西非株和刚果株F3L基因,能在同一反应里同时区分西非株和刚果株。
本发明能够检测正痘病毒,能够同时检测并区分猴痘病毒西非株(clade II)和刚果株(clade I)以及其他正痘病毒。如果样本中有猴痘病毒西非株核酸,则FAM通道有扩增曲线,其他两通道无扩增曲线;如果样本中有猴痘病毒刚果株核酸,则CY5通道有扩增曲线,其他两通道无扩增曲线;如果样本中有非猴痘的其他正痘病毒核酸,则HEX通道有扩增曲线,其余两通道无扩增曲线。该方法适用范围广,能够检测正痘病毒属成员,并对猴痘病毒分型,具有极高的特异性和较好的灵敏度。
如图2中所示,当投入模板为猴痘病毒西非株(clade II)质粒时,只有FAM通道有扩增曲线,而其余两通道无扩增曲线;当投入模板为猴痘病毒刚果株(clade I)质粒时,只有CY5通道有扩增曲线,而其余两通道无扩增曲线;当投入模板为其他正痘病毒核酸时,如痘苗病毒,只有HEX通道有扩增曲线,而其余两通道无扩增曲线。猴痘西非分支质粒的检测下限为119copies/μL,猴痘刚果株质粒的检测下限为183copies/μL,而痘苗病毒的检测下限为8.6×10
为了进一步检测该方法的灵敏度,本发明进一步用数字PCR进行最低检测限的确定。三个通道的最低检测限由荧光定量PCR的119拷贝数/μL,183拷贝数/μL和8.6×10
用数字PCR技术再次验证了该反应的特异性,并且极大提高反应的灵敏度。数字PCR可直接对样本中的核酸进行定量,定量准确。无需通过标准品绘制标准曲线定量(多重荧光定量PCR需要标准曲线)。
数字PCR的优势:数字PCR技术基于“有限稀释”原理,将含有核酸模板的标准PCR反应体系,平均分配成几万个PCR反应,分配到芯片或微滴中,使每个反应中尽可能含有一个模板分子,进行单分子模板PCR反应。在PCR反应结束后,统计每个微反应单元的扩增信号,经“泊松分布”理论模型计算样本中目标分子的拷贝数。数字PCR的优点在于:(1)通过识别反应后阴阳性微滴数来计算初始样品拷贝数,无需依赖对照样品和标准曲线即可对样品进行绝对定量检测;(2)数字PCR在进行结果判读时仅判断“有/无”微滴状态,完全不依赖于Ct值,阈值线,因而对低丰度样品检测敏感度高;(3)反应体系分配原则可极大程度地降低微单元中抑制分子的浓度,提高复杂背景样品的检测准确性。而荧光定量PCR利用标准质粒对目标核苷酸分子相对定量,定量结果受反应效率和抑制物浓度的影响。
本发明再次验证所设计引物探针的特异性,极大降低检测下限,提高了反应的灵敏度。
本发明的核苷酸序列如SEQ ID NO.1-7所示:
SEQ ID NO:1:5'-ATCCTCTCTCATTGATTTTTCGCGGGA-3'(由于WIPO Sequence无法识别5'-和-3',SEQ ID NO.1以说明书此处记载的序列为准)。
SEQ ID NO:2:5'-TGGAGAAGCGAGAAGTTAATAAAGC-3'(由于WIPO Sequence无法识别5'-和-3',SEQ ID NO.2以说明书此处记载的序列为准)。
SEQ ID NO:3:5'-CY5-TCGTCGGAACTGTACACCATAGTAC-3'BHQ2(由于WIPO Sequence无法识别5'CY5-和-3'BHQ2,SEQ ID NO.3以说明书此处记载的序列为准)。
SEQ ID NO:4:5'-FAM-TCGTTGGAGCTGTAAACCATAGCAC-3'BHQ1(由于WIPO Sequence无法识别5'FAM和-3'BHQ1,SEQ ID NO.4以说明书此处记载的序列为准)。
SEQ ID NO:5:5'-HEX-TCGTCGGAGCTGTACACCATAGCAC-3'BHQ1(由于WIPO Sequence无法识别5'HEX-和-3'BHQ1,SEQ ID NO.5以说明书此处记载的序列为准)。
SEQ ID NO:6:
ATGGAGAAGCGAGAAGTTAATAAAGCTCTGTATGATCTTCAACGTAGTACTATGGTGTACAGTTCCGACGATACTCCTCCTCGTTGGTCTACGACAATGGATGCTGATACACGGCCTACAGATTCTGATGCTGATGCTATAATAGATGATGTATCCCGCGAAAAATCAATGAGAGAGGATAATAAGTCTTTTGATGATGTTATTCCGGTTAAAAAAATTATTTATTGGAAAGGTGTTAACCCTGTCACCGTTATTAATGAGTACTGCCAAATAACTAGGAGAGATTGGTCTTTTCGTATTGAATCAGTGGGGCCTAGTAACTCTCCTACATTTTATGCCTGTGTAGACATTGACGGAAGAGTATTCGATAAGGCAGATGGAAAATCTAAACGAGATGCTAAAAATAATGCAGCTAAATTGGCTGTAGATAAACTTCTTAGTTATGTCATCATTAGATTCTGA。
SEQ ID NO:7:
ATGGAGAAGCGAGAAGTTAATAAAGCTCTGTATGATCTTCAACGTAGTGCTATGGTTTACAGCTCCAACGATACTCCTCCTCGTTGGTCTACGACAATGGATGCTGATACACGGCCTACAGATTCTGATGCTGATGCTATAATAGATGATGTATCCCGCGAAAAATCAATGAGAGAGGATCATAAGTCTTTTGATGATGTTATTCCGGTTAAAAAAATTATTTATTGGAAAGGTGTTAACCCTGTCACCGTTATTAATGAGTACTGTCAAATAACTAGGAGAGATTGGTCTTTTCGTATTGAATCAGTGGGGCCTAGTAACTCTCCTACATTTTATGCCTGTGTAGACATTGACGGAAGAGTATTCGATAAGGCAGATGGAAAATCTAAACGAGATGCTAAAAATAATGCAGCTAAATTGGCTGTAGATAAACTTCTTAGTTATGTCATCATTAGATTCTGA。
本发明的非诊断目的检测并区分正痘病毒的方法可以具有但不限于以下有益效果:
1、本发明能够检测正痘病毒,能够同时检测并区分猴痘病毒西非株(clade II)和刚果株(clade I)以及其他正痘病毒。如果样本中有猴痘病毒西非株核酸,则FAM通道有扩增曲线,其他两通道无扩增曲线;如果样本中有猴痘病毒刚果株核酸,则CY5通道有扩增曲线,其他两通道无扩增曲线;如果样本中有非猴痘的其他正痘病毒核酸,则HEX通道有扩增曲线,其余两通道无扩增曲线。该方法适用范围广,能够检测正痘病毒属成员,并对猴痘病毒分型,具有极高的特异性和较好的灵敏度。
2、为了进一步检测该方法的灵敏度,本发明进一步用数字PCR进行最低检测限的确定。三个通道的最低检测限由荧光定量PCR的119拷贝数/μL,183拷贝数/μL和8.6×10
附图说明
以下,结合附图来详细说明本发明的实施方案,其中:
图1示出了猴痘病毒clade I,clade II以及其他正痘病毒的扩增靶区域的序列比对示意图;MPXV_UK_P2毒株的序列为参考基因组序列。图中显示了参考基因组扩增靶区域在全基因组序列上的核苷酸位置。图中“点”代表与参考基因组序列相同的核苷酸,突变标记为“A”,“T”,“C”或者是“G”。箭头表示上游引物,下游引物和Taqman探针的方向和序列。
图2示出了重荧光定量PCR反应特异性验证;当投入不同类型模板时的扩增曲线;根据图1设计的三条探针的5'端分别带有FAM,CY5或HEX荧光。其中,图2A为当投入梯度稀释的不同拷贝数的西非株质粒时的扩增曲线;图2B为当投入梯度稀释的不同拷贝数的刚果株质粒时的扩增曲线;图2C为当投入以痘苗病毒天坛株核酸为代表的正痘病毒核酸时的扩增曲线;图2D为当投入一个在非洲地区感染猴痘病毒西非株的病例的核酸时的扩增曲线。
图3示出了多重荧光定量PCR反应的灵敏度验证;猴痘病毒不同分支质粒和痘苗病毒的标准曲线坐标为不同稀释梯度质粒的拷贝数的对数值或者是痘苗病毒滴度的对数值,纵坐标为荧光定量PCR的循环阈值;图3中还展示了线性回归方程和R
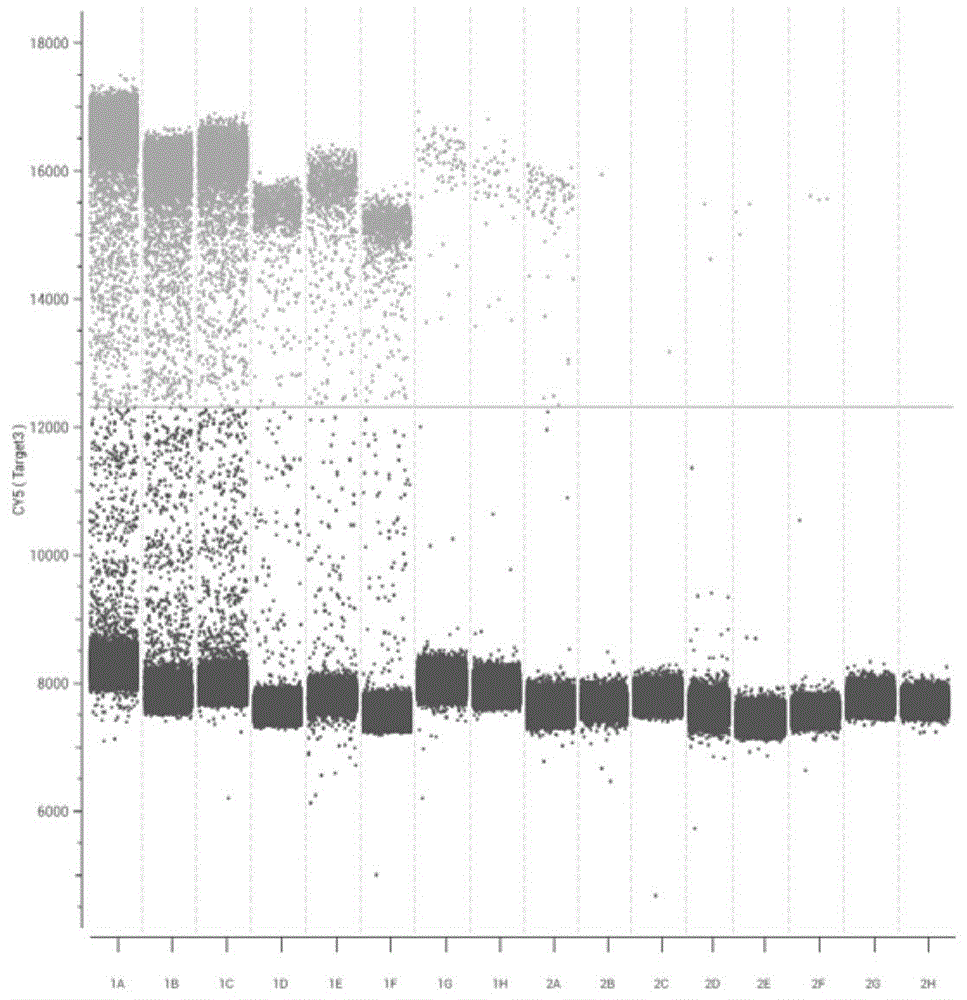
图4示出了猴痘刚果株质粒数字PCR定量检测结果。
图5示出了猴痘西非株质粒数字PCR定量检测结果。
图6示出了痘苗病毒天坛株(其他正痘病毒核酸)数字PCR定量检测结果。
具体实施方式
下面通过具体的实施例进一步说明本发明,但是,应当理解为,这些实施例仅仅是用于更详细具体地说明之用,而不应理解为用于以任何形式限制本发明。
本部分对本发明试验中所使用到的材料以及试验方法进行一般性的描述。虽然为实现本发明目的所使用的许多材料和操作方法是本领域公知的,但是本发明仍然在此作尽可能详细描述。本领域技术人员清楚,在上下文中,如果未特别说明,本发明所用材料和操作方法是本领域公知的。
以下实施例中使用的试剂和仪器如下:
试剂:
2×Taq Pro U+Probe qPCR Mix,购自南京诺唯赞生物科技股份有限公司。
仪器:
数字PCR仪,购自罗氏制药,型号Digital
实施例1序列比对和引物探针设计
从NCBI上下载138条正痘病毒全基因组序列其中包括猴痘病毒clade I,clade II和其他正痘病毒。部分代表性序列比对结果如图1所示。猴痘病毒MPXV_UK_P2毒株的序列为参考基因组序列。在MPXV_UK_P2全基因组46422-46446位置上,猴痘病毒clade I和cladeII相比有四个碱基的差异,而其他正痘病毒与猴痘病毒相比有两个碱基的差异。在此位置设计分别针对于猴痘病毒clade I,clade II和其他正痘病毒的探针,其中,针对猴痘病毒clade I的探针序列为5'CY5-TCGTCGGAACTGTACACCATAGTAC-3'BHQ2,针对猴痘病毒cladeII的探针序列为5'FAM-TCGTTGGAGCTGTAAACCATAGCAC-3'BHQ1,针对其他正痘病毒的探针序列为5'HEX-TCGTCGGAGCTGTACACCATAGCAC-3'BHQ1。在探针上游参考基因组46313-46339的位置,设计猴痘病毒和其他正痘病毒都保守的正向引物序列为5'-ATCCTCTCTCATTGATTTTTCGCGGGA-3'。在探针下游参考基因组46467-46491的位置,设计猴痘病毒和其他正痘病毒都保守的反向引物序列为5'-TGGAGAAGCGAGAAGTTAATAAAGC-3'。在一个体系里,同时加入正向引物,反向引物和三条探针,进而检测并区分不同的猴痘病毒类型或者其他正痘病毒。
图1为猴痘病毒clade I,clade II以及其他正痘病毒的扩增靶区域的序列比对示意图;MPXV_UK_P2毒株的序列为参考基因组序列。图1中显示了参考基因组扩增靶区域在全基因组序列上的核苷酸位置。图中“点”代表与参考基因组序列相同的核苷酸,突变标记为“A”,“T”,“C”或者是“G”。箭头表示上游引物,下游引物和Taqman探针的方向和序列。由图1可知,上下游引物设计在猴痘病毒与其他正痘病毒序列都保守的区域。针对猴痘病毒cladeI和clade II设计的探针序列有相邻的4个核苷酸的差异,而针对其他正痘病毒设计的探针序列与猴痘病毒clade I和clade II各有两个核苷酸的差异。
实施例2:多重荧光定量PCR扩增检测并区分不同类型的猴痘以及其他正痘病毒
本实施例使用实施例1的猴痘病毒clade I的探针序列:5'
CY5-TCGTCGGAACTGTACACCATAGTAC-3'BHQ2;猴痘病毒clade II的探针序列:5'FAM-TCGTTGGAGCTGTAAACCATAGCAC-3'BHQ1;其他正痘病毒的探针序列:5'HEX-TCGTCGGAGCTGTACACCATAGCAC-3'BHQ1。猴痘病毒和其他正痘病毒都保守的正向引物序列:5'-ATCCTCTCTCATTGATTTTTCGCGGGA-3'。猴痘病毒和其他正痘病毒都保守的反向引物序列:5'-TGGAGAAGCGAGAAGTTAATAAAGC-3'。
一个PCR反应20μL的反应体系包括10μL 2×Taq Pro U+Probe qPCR Mix,0.4μL上游引物(引物浓度10μM),0.4μL下游引物(引物浓度10μM),0.4μL猴痘病毒刚果株探针(探针浓度10μM),0.1μL猴痘病毒西非株探针(探针浓度10μM),0.4μL其他正痘病毒探针(探针浓度10μM),2μL模板DNA,6.3μL无菌无酶水。PCR程序包括:37℃2min(污染消化),95℃30s(预变性),45个循环95℃10s,60℃30s(循环反应)。同时打开FAM,CY5和HEX通道。判断标准:如果FAM通道有扩增曲线,则模板为猴痘病毒西非株;如果CY5通道有扩增曲线,则模板为猴痘病毒刚果株;如果HEX通道有扩增曲线,则模板为非猴痘的其他正痘病毒。
图2为多重荧光定量PCR反应特异性验证;当投入不同类型模板时的扩增曲线;根据图1设计的三条探针的5'端分别带有FAM,CY5或HEX荧光。其中,A为当投入梯度稀释的不同拷贝数的西非株质粒时的扩增曲线;B为当投入梯度稀释的不同拷贝数的刚果株质粒时的扩增曲线;C为当投入以痘苗病毒天坛株核酸为代表的正痘病毒核酸时的扩增曲线;D为当投入一个在非洲地区感染猴痘病毒西非株的病例的核酸时的扩增曲线;结果显示,当投入西非株质粒模板时,只有FAM通道有扩增曲线,而其他两通道无扩增曲线;当投入刚果株质粒模板时,只有CY5通道有扩增曲线,而其他两通道无扩增曲线;当投入痘苗病毒天坛株核酸时,只有HEX通道有扩增曲线,而其他两通道无扩增曲线;当投入感染猴痘病毒西非分支核酸时,只有FAM通道有扩增曲线,而其他两通道无扩增曲线。该结果说明本实验具有良好的特异性。
表1中展示了两例真实感染猴痘病毒西非株的病例a和b的多重荧光定量PCR结果,表格中列出三个荧光通道的循环阈值。病例a检测的样本类型有疱疹液,口咽拭子,鼻咽拭子和全血;病例b的样本类型为血清。由表1可知,只有FAM通道有扩增曲线和循环阈值,而其余两通道为阴性,证实该发明的特异性和可用性。
表1两例真实感染猴痘病毒西非株的病例a和b的多重荧光定量PCR结果
实施例3:多重荧光定量PCR最低检测限确定
本实施例使用实施例1的猴痘病毒clade I的探针序列:5'CY5-TCGTCGGAACTGTACACCATAGTAC-3'BHQ2;猴痘病毒clade II的探针序列:5'FAM-TCGTTGGAGCTGTAAACCATAGCAC-3'BHQ1;其他正痘病毒的探针序列:5'HEX-TCGTCGGAGCTGTACACCATAGCAC-3'BHQ1。猴痘病毒和其他正痘病毒都保守的正向引物序列:5'-ATCCTCTCTCATTGATTTTTCGCGGGA-3'。猴痘病毒和其他正痘病毒都保守的反向引物序列:5'-TGGAGAAGCGAGAAGTTAATAAAGC-3'。
3.1质粒构建,扩增和提取
将荧光定量PCR上下游引物扩增的序列基因合成,构建到质粒PUC57载体上,之后用E.coli DH5α感受态细胞进行转化,涂平板,挑选单克隆和大量扩增。用无内毒素的质粒大提试剂盒进行质粒提取,分装,冻存于-20℃备用。
3.2质粒或病毒稀释
提取分装好的质粒用nanodrop进行DNA浓度测定,根据公式copies/ml(拷贝数)=(6.02x 10(23)次拷贝数/摩尔)x(浓度)/(MW g/mol)计算拷贝数。其中猴痘病毒clade I的质粒浓度为638ng/μL,换算得到的拷贝数为1.83×10
3.3多重荧光定量PCR
将浓度梯度稀释的质粒DNA当做PCR扩增的模板,每个浓度做三个复孔,按照实施例2中的方法和程序进行多重荧光定量PCR,得到不同荧光通道的扩增曲线和循环阈值。
3.4最低检测限确定
不同稀释浓度梯度的质粒对应的拷贝数与循环阈值拟合线性回归方程,计算斜率和截距,以及相关系数R
图3为多重荧光定量PCR反应的灵敏度验证;猴痘病毒不同分支质粒和痘苗病毒的标准曲线坐标为不同稀释梯度质粒的拷贝数的对数值或者是痘苗病毒滴度的对数值,纵坐标为荧光定量PCR的循环阈值;图中还展示了线性回归方程和R
实施例4:数字PCR最低检测限确定
本实施例使用实施例1的猴痘病毒clade I的探针序列:5'
CY5-TCGTCGGAACTGTACACCATAGTAC-3'BHQ2;猴痘病毒clade II的探针序列:5'FAM-TCGTTGGAGCTGTAAACCATAGCAC-3'BHQ1;其他正痘病毒的探针序列:5'HEX-TCGTCGGAGCTGTACACCATAGCAC-3'BHQ1。猴痘病毒和其他正痘病毒都保守的正向引物序列:5'-ATCCTCTCTCATTGATTTTTCGCGGGA-3'。猴痘病毒和其他正痘病毒都保守的反向引物序列:5'-TGGAGAAGCGAGAAGTTAATAAAGC-3'。
采用实施例3中构建的西非株质粒和刚果株质粒进行10倍比或者2倍比稀释后按如下体系配置:反应体系包括12μL 2×dPCR probe Master mix,1μL上游引物(引物浓度10μM),1μL下游引物(引物浓度10μM),0.5μL猴痘病毒刚果株探针(探针浓度10μM),0.5μL猴痘病毒西非株探针(探针浓度10μM),0.5μL其他正痘病毒探针(探针浓度10μM),5μL模板DNA,1.5μL无菌无酶水。PCR程序包括:60℃5min,95℃15min,45个循环95℃15s,60℃30s,60℃1min。三个复孔都检出拷贝数即为最终最低检测限。
表2猴痘刚果株质粒数字PCR定量结果
(注:其中N/A代表空值)
表3猴痘西非株质粒数字PCR定量结果
(注:其中N/A代表空值)
表4痘苗病毒天坛株(其他正痘病毒核酸)数字PCR定量结果
(注:其中N/A代表空值)
如表2所示,当投入浓度依次降低的刚果株质粒时,CY5通道的拷贝数逐渐下降,最低检测限为0.484拷贝数/μL。如表3所示,当投入浓度依次降低的西非株质粒时,FAM通道的拷贝数逐渐下降,最低检测限为0.352拷贝数/μL。如表4所示,当投入浓度依次降低的TTV核酸时,HEX通道的拷贝数逐渐下降,最低检测限为0.352拷贝数/μL。相较于现有技术中的检测方法,用数字PCR的方法极大降低了检测下限,大幅度提高了灵敏度。
尽管本发明已进行了一定程度的描述,明显地,在不脱离本发明的精神和范围的条件下,可进行各个条件的适当变化。可以理解,本发明不限于所述实施方案,而归于权利要求的范围,其包括所述每个因素的等同替换。
