聚山梨醇酯类的测定
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于化学领域,具体地涉及生物制剂,尤其是蛋白溶液中聚山梨醇酯类的检测分析方法。
背景技术
聚山梨醇酯类(Polysorbates)是一种常见的兼有疏水/亲水特性的非离子型表面活性剂,化学组成为聚氧乙烯山梨糖醇酐脂肪酸酯。在蛋白药物中使用较多的包括聚山梨醇酯20/80(Polysorbate 20/80),商品名为吐温20/80(Tween 20/80),分子组成为1个环状去水山梨糖醇以及在其3个不同羟基位点上结合的环氧乙烷聚体。
聚山梨醇酯类通常用于蛋白质药物配方,以增加药物的溶解度和稳定性。因为这些表面活性剂存在于最终的药物产物,因此需要对其准确定量。赵威等人公开了加入荧光染料NPN形成胶束基于反相高效液相色谱(RP-HPLC)法测定聚山梨醇酯20的含量(HPLC-荧光法测定贝伐珠单抗注射液中聚山梨醇酯20的含量,中国生物制品学杂志,v.31(03):294-298)。Hu等人(High-performance liquid chromatographic determination ofpolysorbate 80in pharmaceutical suspensions.Journal of Chromatography A,2003,984(2):233-236)公开了水解山梨醇月桂酸酯后基于RP-HPLC法测定游离月桂酸的含量。
CN103403544A公开了一种碱性水解样品之后,比色法测定聚山梨醇酯的方法。
CN104297375A公开了一种碱性水解样品之后,气相色谱法测定聚山梨醇酯80的方法。
发明内容
在一方面,本发明提供一种用于检测样品中的聚山梨醇酯类的方法,其包括
(1)提供包含聚山梨醇酯类的样品;
(2)处理所述样品,以获得经处理的样品部分1和经处理的样品部分2,
其中所述经处理的样品部分1不含所述聚山梨醇酯类,
所述经处理的样品部分2包含所述聚山梨醇酯类;和
(3)对经处理的样品部分2进行检测,以确定所述聚山梨醇酯类的存在或量。
其中所述样品为蛋白样品,优选蛋白溶液,所述蛋白优选抗体,特别是单克隆抗体。
在一个实施方案中,步骤(2)通过沉淀处理完成。
在一个实施方案中,步骤(3)通过HPLC方法检测样品部分2中的聚山梨醇酯类;其包括:
(3-1)样品部分2通过HPLC柱分离为包含聚山梨醇酯类的样品部分2-2和剩余部分2-1;
(3-2)使样品部分2-2进入检测器。
在一个实施方案中,所述HPLC方法包括柱后切换步骤,其包括使HPLC柱洗脱液由柱后阀的以下位置I或排液位置流出:
位置I:连接检测器;
排液位置:连接废料部或流分收集容器,特别是废料部;
其中所述柱后切换步骤使得样品部分2-2由所述位置I流出,而剩余部分2-1由所述排液位置流出。
附图说明
图1.检测流程图。其中柱后阀的端口1与HPLC柱出口连接,端口2与检测器连接,端口6与废料部或流分收集容器连接,通过切换柱后阀,使洗脱液中包含聚山梨醇酯类的流分由端口2流出,并且洗脱液中不包含聚山梨醇酯类的流分由端口6流出。
图2.聚山梨醇酯20检测专属性图谱。经沉淀处理、HPLC分离、柱后阀切换和CAD检测,结果为:与0.2mg/mL的Tween 20标准品相比,不含Tween 20的样品(配制的不含Tween20的辅料溶液以及不含Tween 20的IgG1蛋白溶液)的Tween 20峰面积分别为所述标准品的1.8%和0.7%。配制的含0.2mg/mL的Tween 20的IgG1蛋白溶液的Tween 20峰面积为所述标准品的97.8%。
图3.聚山梨醇酯80检测专属性图谱。经沉淀处理、HPLC分离、柱后阀切换和CAD检测,结果为:与0.40mg/mL的Tween 80标准品相比,不含Tween 80的样品(配制的不含Tween80的辅料溶液以及不含Tween 80的IgG2蛋白溶液)的Tween 80峰面积分别为所述标准品的1.5%和2.1%。配制的含0.40mg/mL的Tween 80的IgG2蛋白溶液的Tween 80峰面积为所述标准品的99.4%。
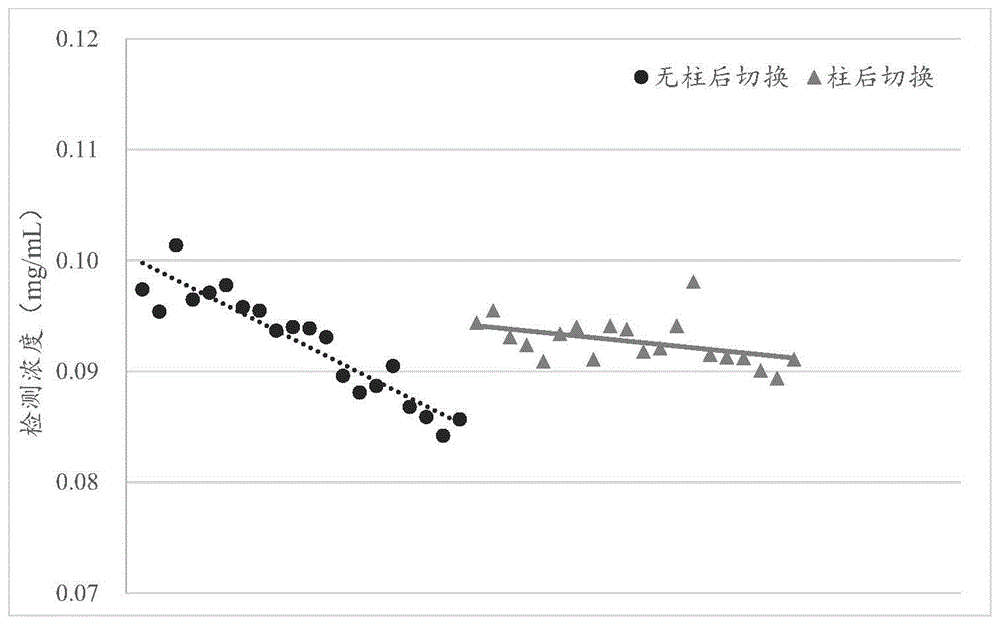
图4.连续检测IgG1蛋白溶液中的Tween 20结果汇总图。
具体实施方式
一般术语和定义
除非另有定义,本文所用所有技术和科学术语与本发明所属领域的普通技术人员通常理解的含义相同。若存在矛盾,则以本申请提供的定义为准。当本文中出现商品名时,意在指代其对应的商品或其活性成分。本文引用的所有专利、已经公开的专利申请和出版物均通过引用并入到本文中。
术语“约”、“大约”当与数值变量并用时,通常指该变量的数值和该变量的所有数值在实验误差内(例如对于平均值95%的置信区间内)或在指定数值的±10%内,或更宽范围内。
术语“任选”或“任选存在”是指随后描述的事件或情况可能发生或可能不发生,该描述包括发生所述事件或情况和不发生所述事件或情况。
表述“包含”或与其同义的类似表述“包括”、“含有”和“具有”等是开放性的,不排除额外的未列举的元素、步骤或成分。表述“由…组成”排除未指明的任何元素、步骤或成分。表述“基本上由…组成”指范围限制在指定的元素、步骤或成分,加上任选存在的不会实质上影响所要求保护的主题的基本和新的特征的元素、步骤或成分。应当理解,表述“包含”涵盖表述“基本上由…组成”和“由…组成”。
除非文中另有说明,单数形式指代如“一种”、“该”,包含复数指代。
术语“一种(个)或多种(个)”或者“至少一种(个)”可以表示一、二、三、四、五、六、七、八、九种(个)或更多种(个)。
当公开了数值范围的下限和上限时,落入该范围中的任何数值和任何包括的范围都被具体公开。特别地,本文公开的值的每个取值范围应理解为表示涵盖于较宽范围中的每个数值和范围。
除非另有说明,或者明显不适用,本文中所用的比例(包括百分比)按重量计。
术语“聚山梨醇酯类”指兼有疏水/亲水特性的非离子型表面活性剂,化学组成为聚氧乙烯山梨糖醇酐脂肪酸酯。其实例包括但不限于聚山梨醇酯20、聚山梨醇酯40、聚山梨醇酯60、聚山梨醇酯80、聚山梨醇酯85或其组合(或混合物)。聚山梨醇酯(Polysorbate)的商品名为吐温(Tween),因此在本文中也可以用吐温(Tween)表示聚山梨醇酯类或相应的特定聚山梨醇酯,如吐温20、吐温40、吐温60、吐温80、吐温85等。
术语“蛋白制剂”指生物学活性成分为蛋白的制剂。合适的抗体配制物通过将具有希望纯度程度的抗体与任选的药物可接受的载体、赋形剂或稳定剂混合而获得,形式为冻干的配制物或者溶液。优选地,制剂为溶液形式。
术语“CAD检测器”是指电喷雾检测器(Charged aerosol detector)。其可以商购的,例如Thermo公司生产的那些(比如Thermo U3000 CAD)。在一个实施方案中,CAD检测器参数可以是:Evaporator Temperature:High;Filter:3.6;Data Collection Rate:5;WaitReady:±5。
本文中提及的特定pKa值或范围旨在表示在水溶液中测量的那些。对于本文中未记载的pKa值,可以根据文献报道或通过已知的技术手段方便地确认。当所述液体或溶液不完全由水组成时,本文中提及的特定pH值或范围旨在表示表观pH值。
术语“烷基”是指由碳原子和氢原子组成的直链或支链的饱和的脂肪烃基团,其通过单键与分子的其余部分连接。“烷基”可以具有1-8个碳原子,即“C
术语“亚烷基”,在本文中单独或与其他基团组合使用时,指直链或支链的饱和的二价烃基。例如,术语“C
术语“醇类”溶剂具有1-5个碳原子的醇的溶剂。醇类溶剂包括但不限于甲醇、乙醇、正丙醇、异丙醇、正丁醇、正戊醇或其组合,优选甲醇、乙醇、异丙醇及其组合,特别是异丙醇。
术语“酮类”溶剂是指具有3-5个碳原子的酮,其实例包括但不限于丙酮、2-丁酮、3-甲基-2-丁酮或其组合,特别是丙酮。
本发明的方法
在一方面,本发明涉及一种用于检测样品中的聚山梨醇酯类的方法,其包括
(1)提供包含聚山梨醇酯类的样品;
(2)处理所述样品,以获得经处理的样品部分1和经处理的样品部分2,
其中所述经处理的样品部分1不含所述聚山梨醇酯类,
所述经处理的样品部分2包含所述聚山梨醇酯类;和
(3)对经处理的样品部分2进行检测,以确定所述聚山梨醇酯类的存在或量。
步骤(1)
在本发明方法中,待检测的样品可以为包含生物学活性物质的样品。生物学活性物质例如指具有生物学活性的分子,例如蛋白、核酸(包括但不限于DNA或RNA,如mRNA、siRNA等)。样品的形式通常为液态,如溶液形式。因此,在生物学活性物质为蛋白的情况下,所述样品又可称为“蛋白溶液”。可用的蛋白的非限制性实例有单克隆抗体、人源化抗体、双特异性抗体、多特异性抗体、抗体-药物缀合物。所述抗体可以是全长IgG抗体。所述全长IgG抗体属于人IgG1、IgG2、IgG3、IgG4同种型。所述全长IgG抗体属于人IgG1同种型。
在一个实施方案中,聚山梨醇酯类包括聚山梨醇酯20、聚山梨醇酯40、聚山梨醇酯60、聚山梨醇酯80、聚山梨醇酯85或其组合(或混合物)。在优选的实施方案中,聚山梨醇酯类为聚山梨醇酯20、聚山梨醇酯80或其组合(或混合物)。在另一优选的实施方案中,聚山梨醇酯类为聚山梨醇酯20或聚山梨醇酯。在一个实施方案中,样品中除了聚山梨醇酯类,还可以包含其他辅料,例如缓冲剂如磷酸盐、柠檬酸盐或其它有机酸盐;抗氧化剂,包括抗坏血酸和甲硫氨酸;防腐剂(如十八烷基二甲基苯甲基氯化铵;氯己双铵;苯扎氯铵,苄索氯铵;苯酚,丁基或苯甲基醇;对羟基苯甲酸烷基酯如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;邻苯二酚;间苯二酚;环己醇;3-戊醇;及间甲酚);低分子量(低于大约10个残基)多肽;蛋白质,如血清白蛋白或明胶;亲水性聚合物如聚乙烯吡咯烷酮;氨基酸如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或者赖氨酸;单糖、二糖或寡糖(由3~10个单糖分子聚合而成),例如葡萄糖、甘露糖或蔗糖;螯合剂,例如如EDTA;糖如蔗糖、甘露醇、海藻糖或者山梨醇;成盐反离子如钠离子。
步骤(2)
在步骤(2)中,通过对待测样品进行处理,将其分为获得经处理的样品部分1(又称为“部分1”)和经处理的样品部分2(又称为“部分2”)。
在本发明的一个实施方案中,步骤(2)的处理可以为沉淀处理。
本发明的方法中,通过进行步骤(2)的处理,可以将确定不含聚山梨醇酯类的部分1与包含聚山梨醇酯类的部分2分离,从而大大减少内容物对聚山梨醇酯类检测的干扰。在一个实施方案中,所述对聚山梨醇酯类检测产生干扰的内容物包括样品中存在的辅料和蛋白。
沉淀处理可以采用本领域已知的蛋白沉淀方法进行。在一个实施方案中,沉淀处理采用加入蛋白沉淀试剂的方法进行,所述蛋白沉淀试剂为盐试剂、有机溶剂或其组合,优选为蛋白沉淀试剂为盐试剂和有机溶剂的组合。在一个实施方案中,盐试剂选自碱金属卤素化物,也可以理解为盐酸的碱金属盐,例如氯化钠或氯化钾,优选氯化钠。在另一个实施方案中,盐试剂选自硫酸盐,例如硫酸钠或硫酸铵,优选硫酸钠。在一个实施方案中,有机溶剂选自醇类溶剂(例如甲醇、乙醇或丙醇)、酮类溶剂(例如丙酮)和腈类溶剂(例如乙腈),优选醇类溶剂,更优选甲醇或乙醇,特别是乙醇。在一个具体实施方案中,蛋白沉淀试剂为乙醇-氯化钠。在一个具体的实施方案中,沉淀处理采用加入乙醇-氯化钠饱和溶液的方法进行。在一个特别具体的实施方案中,蛋白样品与饱和乙醇-氯化钠溶液的体积比为1:1至1:10,例如1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9或1:10,优选为1:3至1:7,特别是1:5。在一个实施方案中,沉淀处理时蛋白样品的浓度为根据实验需要的任何浓度。在一个实施方案中,沉淀处理时蛋白样品的浓度为约1-约500mg/mL。在一个特别的实施方案中,沉淀处理时蛋白样品的浓度为约1-约200mg/mL,优选1-约100mg/mL,特别是约10-约100mg/mL、约10-约80mg/mL、约10-约65mg/mL或约10mg/mL、20mg/mL、约20mg/mL。
优选地,沉淀处理还包括从经处理的样品中去除沉淀物,可以通过任何已知方法,例如过滤或离心,优选离心来完成。
不含聚山梨醇酯类的部分1可以包含干扰聚山梨醇酯类检测的杂质,例如蛋白。
部分1可以为要除去的沉淀物或者其他形式,如溶液、悬浮液等。
部分2包含待测样品中存在的聚山梨醇酯类,其形式可以为沉淀物、溶液、悬浮液等。
应当理解,不同的处理方式可以单独使用,也可以组合使用。因此,在一个实施方案中,步骤(2)中的处理为沉淀处理。还应当理解,当组合使用时,可以根据需要,以合适的顺序进行。
步骤(3)
在步骤(3)中,对经处理的样品部分2进行测定,以确定其中聚山梨醇酯类的存在或含量。
可以对聚山梨醇酯类进行定性检测,以确定其存在。或者,也可以对聚山梨醇酯类进行定量检测,以确定其含量。
色谱方法
在步骤(3)中,可以通过色谱方法(如HPLC)来进行聚山梨醇酯类的检测。
由于在步骤(2)中,将样品分为不含聚山梨醇酯类的部分1以及包含聚山梨醇酯类的部分2,因此只需要对部分进行聚山梨醇酯类的检测,即可确定待测样品中其存在或含量。
本领域技术人应当理解,可以将步骤(2)中获得的包含聚山梨醇酯类的部分2进行处理,以适合步骤(3)中进行的检测,例如溶解、复溶、重悬浮等。
在一个实施方案中,HPLC方法其包括:
(3-1)样品部分2通过HPLC柱分离为包含聚山梨醇酯类的样品部分2-2和剩余部分2-1;
(3-2)使样品部分2-2进入检测器。
在一个实施方案中,由HPLC柱流出的洗脱液经由洗脱液出口,进入检测器、废料部或流分收集容器。在一个实施方案中,洗脱液中包含聚山梨醇酯类的流分(例如样品部分2-2)进入检测器。在另一个实施方案中,洗脱液中不包含聚山梨醇酯类的流分(例如样品部分2-1)进入或不进入检测器,优选不进入检测器。不进入检测器的流分可以进入废料部或流分收集容器,特别是废料部。
在一个实施方案中,固定相为离子交换色谱填料。在一个实施方案中,固定相为阴离子交换色谱填料,优选反相/阴离子交换混合模式(mixed mode)色谱填料(以下称为混合模式填料)。在一个实施方案中,混合模式填料采用聚合物基质。在一个实施方案中,所述聚合物基质的表面被官能团化。在一个实施方案中,所述聚合物基质为间二乙烯基苯和N-乙烯基吡咯烷酮共聚物,其表面被官能团化。在一个实施方案中,所述聚合物基质表面具有如下所示的季胺取代基R:
在一个实施方案中,所述聚合物为季胺取代基R官能团化的间二乙烯基苯和N-乙烯基吡咯烷酮共聚物,其中季胺取代基R官能团含量为0.3毫当量/克。
在一个特别的实施方案中,固定相为Waters Oasis MAX填料。
在一个实施方案中,色谱填料的表面或包括表面在内的一部分或全部是多孔性的。在一个实施方案中,色谱填料的孔径为
在一个实施方案中,色谱填料为球形或近似球形的颗粒。在一个实施方案中,色谱填料粒径为1-100μm,优选1-80μm,更优选3-60μm,例如3μm,4μm,5μm,6μm,7μm,8μm,9μm,10μm,11μm,12μm,13μm,14μm,15μm,20μm,40μm,50μm,60μm。在一个特别的实施方案中,色谱填料粒径为10-50μm,特别是30μm。
在一个实施方案中,步骤(3)采用CAD检测器或ELSD检测器进行检测。在一个实施方案中,步骤(3)采用CAD检测器进行检测。
在一个实施方案中,由进样完成时开始进行计时,时间的值可以记为t。在另一个实施方案中,由HPLC控制软件来进行计时。
在一个实施方案中,色谱柱柱温为约5-60℃,优选约10-60℃,更优选约20-50℃,例如约20℃、约30℃、约40℃或约50℃,特别是约40℃。
在一个实施方案中,上样量不超过色谱柱结合样品的容量(例如填料量*每单位填料的离子交换容量)。在一个实施方案中,样品层中的每一部分的上样量均不超过该部分填料结合样品的容量。在一个实施方案中,HPLC柱的长度和长径比为合适的值,这些值可以由本领域技术人员容易地确定,使得当进样体积为一定体积时,色谱过程的结合相结束时,样品层(结合了样品的填料层)长度不超过10cm,优选不超过6cm,例如不超过5cm,不超过4cm,不超过3cm,不超过2cm,特别是不超过2cm。在一个特别具体的实施方案中,可以采用规格为2.1×20mm的色谱柱。在一个特别具体的实施方案中,进样体积为1mL以下,例如90μL以下、80μL以下、70μL以下、60μL以下、50μL以下、40μL以下、30μL以下,特别是20μL以下,例如20μL。
在一个实施方案中,色谱过程的流速为0.01-100mL/min,优选0.01-10mL/min,更优选0.1-5mL/min,例如约0.5、约0.6、约0.7、约0.8、约0.9、约1、约1.1、约1.2、约1.3、约1.4、约1.5、约2、约3、约4、约5mL/min,特别是约1.0mL/min。
在一个实施方案中,流动相洗脱一个HPLC柱体积的时间为0.001至10min,优选0.01至5min,进一步优选0.05至5min,例如约0.05、约0.051、约0.052、约0.053、约0.054、约0.055、约0.056、约0.057、约0.058、约0.059、约0.06、约0.061、约0.062、约0.063、约0.064、约0.065、约0.066、约0.067、约0.068、约0.069、约0.07、约0.071、约0.072、约0.073、约0.074、约0.075、约0.08、约0.09、约0.1、约0.11、约0.12、约0.13、约0.14、约0.15、约0.2、约0.3、约0.4、约0.5、约0.6、约0.7、约0.8、约0.9、约1、约2、约3、约4、约5min,特别是约0.067min、约0.068min或约0.1min,例如约0.067min。
在一个实施方案中,步骤(3)中色谱以结合-洗脱模式(bind-and-elute mode,或B/E mode)进行,色谱步骤包括:上样(loading)、洗杂(washing)和洗脱(eluting);
一个色谱周期按色谱步骤分为结合相和洗脱相,其中上样和洗杂步骤称为结合相(binding phase或B phase),洗脱步骤称为洗脱相(eluting phase或E phase);
并且
将洗脱相的第约1个至第约75个柱体积的洗脱液作为样品部分2-2,使其进入检测器。
在一个实施方案中,将洗脱相的第约1个至第约65个柱体积;例如由第约1、约2、约3、约4、约5、约6、约7或约8个柱体积开始,至第约32、约33、约34、约35、约36、约37、约38、约39、约40、约41、约42、约43、约44、约45、约46、约47、约48、约49、约50、约51、约52、约53、约54、约55、约56、约57、约58、约59、约60、约61、约62、约63、约64或约65个柱体积,特别是第约8个至第约32个柱体积的洗脱液作为样品部分2-2,使其进入检测器。
在一个实施方案中,流动相洗脱一个HPLC柱体积的时间为约0.067min。在一个实施方案中,将洗脱相的第0-约5min,优选第约0.1-约4.3min;例如由第约0.1、约0.2、约0.3、约0.4、约0.5或约0.6min开始,至约2.1、约2.2、约2.3、约2.4、约2.5、约2.6、约2.7、约2.8、约2.9、约3、约3.1、约3.2、约3.3、约3.4、约3.5、约3.6、约3.7、约3.8、约3.9、约4、约4.1、约4.2、约4.3min;特别是第0.6-2.1min的洗脱液作为样品部分2-2,使其进入检测器。
在一个实施方案中,洗脱液pH值为约1.5至约6,优选约2至约4,例如约2、约2.1、约2.2、约2.3、约2.4、约2.5、约2.6、约2.7、约2.8、约2.9、约3、约3.1、约3.2、约3.3、约3.4、约3.5、约3.6、约3.7、约3.8、约3.9或约4。
在一个实施方案中,结合相的流动相为:
结合相的流动相组成:
溶液A:水,任选地包含酸性剂1;
溶液B:有机溶剂1,任选地包含酸性剂2;
前提是洗脱液包含酸性剂1和酸性剂2中的至少一种;
结合相分离范围:
B的含量为约5%-40%,其余为A;
其中,B的含量随时间变化保持不变或梯度变化;酸性剂1和2独立地是无机酸或有机酸。应当理解,包含多个等度洗脱阶段时,该洗脱过程可以理解为梯度洗脱。
在一个实施方案中,HPLC方法还在上样步骤之前包括柱平衡步骤,其中
流动相组成:
溶液A和溶液B如上所述;
平衡范围:B的含量为约5%-40%,其余为A;其中,A和B的含量随时间变化保持不变。
在一个实施方案中,有机溶剂1选自醇类溶剂,优选乙醇或异丙醇,更优选异丙醇。
在一个实施方案中,HPLC方法结合相的洗脱液的分离范围为:
B的含量为约5%-约40%,优选约10%-约35%,更优选约15%-约25%,特别是约20%,其余为A。
在一个实施方案中,酸性剂1为有机酸。在一个实施方案中,酸性剂1具有R
在一个实施方案中,基于洗脱液的总体积,酸性剂1和酸性剂2的量之和为约0.05%至约1%,优选为约0.1%至约1%,例如约0.1%、约0.2%、约0.3%、约0.4%、约0.5%、约0.6%、约0.7%、约0.8%、约0.9%、约1%,更优选为约0.3%至约1%,特别是0.5%。在另一个实施方案中,酸性剂1和酸性剂2的量之和为约0.01M至约0.5M,优选约0.01M至约0.3M,更优选约0.05M至约0.15M,例如约0.05M、约0.06M、约0.07M、约0.08M、约0.09M、约0.1M、约0.11M、约0.12M、约0.13M、约0.14M、约0.15M,进一步优选约0.08M至约0.13M,特别是约0.1M或约0.11M。
在一个实施方案中,洗脱相的洗脱液为:
洗脱液C:水,任选地包含酸性剂3;
洗脱液D:有机溶剂2,任选地包含酸性剂4;
前提是洗脱液包含酸性剂3和酸性剂4中的至少一种;
结合相分离范围:
D的含量为约15%-100%,其余为C;
其中,D的含量随时间变化保持不变或梯度变化;酸性剂3和4独立地是无机酸或有机酸。应当理解,包含多个等度洗脱阶段时,该洗脱过程可以理解为梯度洗脱。
在一个实施方案中,在洗脱相的全部或大部分时间中,洗脱液为:
洗脱液D:有机溶剂2,任选地包含酸性剂4。
所述大部分时间是指色谱时间的约50%以上、约60%以上、约70%以上、约80%以上、约90%以上或约95%以上,例如约50%、约60%、约70%、约80%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约99%或约100%。在一个实施方案中,所述大部分时间是指色谱时间的约95%以上。
在一个实施方案中,洗脱液D与上述溶液B相同,其中有机溶剂2与有机溶剂1相同,酸性剂4与酸性剂2相同。在一个实施方案中,洗脱液C与上述溶液A相同,其中酸性剂3与酸性剂1相同。
在另一个实施方案中,一个色谱周期的流动相为:
流动相组成:
溶液A:水,任选地包含酸性剂1;
溶液B:有机溶剂1,任选地包含酸性剂2;
前提是洗脱液包含酸性剂1和酸性剂2中的至少一种;
分离范围:
第1步:洗脱约30个柱体积或以上,B的含量为约20%,其余为A;
第2步:洗脱约32个柱体积或以上,B的含量为约100%;
其中,有机溶剂1、酸性剂1和2如上文所述。
在一个实施方案中,在第1步和第2步之间还包括第1-1步:
第1-1步:洗脱约1个柱体积或以上,B的含量由约20%梯度变化至约100%,其余为A。
在一个实施方案中,第1步洗脱约35个柱体积或以上,优选约40个柱体积或以上,例如约40、约41、约42、约43、约44、约45、约46、约47、约48、约49、约50、约51、约52、约53、约54、约55个柱体积或以上。
在一个实施方案中,将第2步的第约1个至第约75个柱体积的洗脱液作为样品部分2-2,使其进入检测器。在一优选的实施方案中,将洗脱相的第约1个至第约65个柱体积;例如由第约1、约2、约3、约4、约5、约6、约7或约8个柱体积开始,至第约32、约33、约34、约35、约36、约37、约38、约39、约40、约41、约42、约43、约44、约45、约46、约47、约48、约49、约50、约51、约52、约53、约54、约55、约56、约57、约58、约59、约60、约61、约62、约63、约64或约65个柱体积,特别是第约8个至第约32个柱体积的洗脱液作为样品部分2-2,使其进入检测器。
在一个实施方案中,流动相洗脱一个HPLC柱体积的时间为约0.067min。
在另一个实施方案中,一个色谱周期的流动相为:
流动相组成:
溶液A:水,任选地包含酸性剂1;
溶液B:有机溶剂1,任选地包含酸性剂2;
前提是洗脱液包含酸性剂1和酸性剂2中的至少一种;
分离范围:
第1步:洗脱约3.4min,B的含量为约20%,其余为A;
第2步:洗脱约2.1min或以上,B的含量为约100%;
其中,有机溶剂1、酸性剂1和2如上文所述。
在一个实施方案中,在第1步和第2步之间还包括第1-1步:
第1-1步:洗脱约0.1min,B的含量由约20%梯度变化至约100%,其余为A。
在一个实施方案中,可以使第0-4.4min由洗脱液出口流出的流分进入检测器、废料部或流分收集容器,使第4.4-5.0min由洗脱液出口流出的流分进入检测器,并且使第5.0-10.0min由洗脱液出口流出的流分进入检测器、废料部或流分收集容器。
在一个特别的实施方案中,约3.2-约8.7min由洗脱液出口流出的流分进入检测器。在另一个特别的实施方案中,约4.0-约5.5min由洗脱液出口流出的流分进入检测器。
柱后切换
在一个实施方案中,HPLC方法包括柱后切换步骤,其包括使HPLC柱洗脱液由柱后阀的以下位置I或排液位置流出:
位置I:连接检测器;
排液位置:连接废料部或流分收集容器,特别是废料部;
其中所述柱后切换步骤使得样品部分2-2由所述位置I流出,而剩余部分2-1由所述排液位置流出。
在一个实施方案中,柱后阀具有至少三个端口,其中第一端口与HPLC柱出口连接,第二端口为所述位置I,与检测器连接;其他端口中包括至少一个排液端口,所述排液端口为所述排液位置,与废料部或流分收集容器连接;
柱后切换步骤包括切换柱后阀,以使样品部分2-2由第一端口流出,并且样品部分2-1由排液端口流出。
在一个实施方案中,柱后阀具有四个端口。
在另一个实施方案中,设置两个时间点,其分别为第一切换点和第二切换点,使第0min至第一切换点由洗脱液出口流出的流分进入废料部或流分收集容器,使第一切换点至第二切换点由洗脱液出口流出的流分进入检测器,并且使第二切换点之后由洗脱液出口流出的流分进入废料部或流分收集容器。在一个实施方案中,第一切换点和第二切换点由上文所述色谱方法中,使进入检测器的时间段来确定。在另一个实施方案中,第一切换点在0-4.4min之间。在一优选的实施方案中,第一切换点在1-4.4min之间,优选1.5-4.4min,更优选2-4.4min,特别是3-4.4min之间,例如约3.0、约3.1、约3.2、约3.3、约3.4、约3.5、约3.6、约3.7、约3.8、约4.0、约4.1、约4.2、约4.3或约4.4min。在一个实施方案中,第二切换点在5.0-10.0min之间,优选5.0-9.0min,特别是5.5-9.0min之间,例如5.5、约5.6、约5.7、约5.8、约5.9、约6.0、约6.1、约6.2、约6.3、约6.4、约6.5、约6.6、约6.7、约6.8、约6.9、约7.0、约7.1、约7.2、约7.3、约7.4、约7.5、约7.6、约7.7、约7.8、约7.9、约8.0、约8.1、约8.2、约8.3、约8.4、约8.5、约8.6、约8.7、约8.8、约8.9或约9.0min。
在一个实施方案中,柱后阀为四通阀、五通阀、六通阀或具有更多端口的阀。在一个实施方案中,柱后阀为六通阀。在一个实施方案中,六通阀第一端口与HPLC柱出口连接,第二端口为与检测器连接,第三端口与废料部或流分收集容器连接。在一个实施方案中,柱后阀为两位四通阀、两位五通阀或两位六通阀,当阀处于第一位置时,第一端口与第二端口连通,当阀处于第二位置时,第一端口与第三端口连通。柱后阀为两位六通阀的一个示例如图1所示,其中数字1标出第一端口,数字2标出第二端口,数字6标出第三端口。
有益效果
聚山梨醇酯类通常用于蛋白药物的制备,因为这些表面活性剂存在于最终的药物产物,因此需要对其准确定量。由于生物制药产品通常含有高蛋白浓度,聚山梨醇酯是不均一的物质,由不同的山梨醇和脂肪酸聚合而成,而且无紫外吸收特性。现有技术检测方法通常需要很长的样品制备过程,并且通量较小、耐用性较差。通过广泛的研究,本发明人发现了优异的检测分析方法,例如主要体现在以下一个或多个方面。1)稳定性高,适用性广:本发明的方法可稳定应用于不同的蛋白剂型。2)准确性高,抗干扰强:蛋白质和其它辅料成分对检测方法的稳定性和准确性无干扰。3)简单易用:样品制备简单,经处理后的样品稳定,耐用性好。4)成本低。
特别地,发明人出人意料地发现,利用柱后切换技术通过阀来改变色谱柱、检测器、洗脱液出口之间的连接,控制检测器接收特定时间的洗脱液,可以提高连续进样检测的稳定性,有利于生产,并可以实现高通量检测。
实施例
以下实例仅是对当前公开的主题的说明,不应以任何方式视为限制。实施例中所用的仪器和试剂都是可以商购或自行制备的。
1.仪器配置:
2.样品前处理
用饱和乙醇-氯化钠溶液沉淀蛋白。蛋白样品与饱和乙醇-氯化钠溶液的体积比为1:5,沉淀完取上清,进行氮吹和复溶。
根据仪器配置和条件,对复溶后的样品进行聚山梨醇酯20/80检测。
实施例1:检测聚山梨醇酯20方法验证
1.相关溶液配制
1.1流动相配制
流动相A(0.5%甲酸水):量取980mL超纯水至量筒中,加入5mL甲酸,用超纯水定容至1L;转移至溶剂瓶,2-8℃保存,有效期1个月。
流动相B(0.5%甲酸异丙醇):量取980mL异丙醇至量筒中,加入5mL甲酸,用异丙醇定容至1L;转移至溶剂瓶,2-8℃保存,有效期1个月。
1.2乙醇-氯化钠饱和溶液
移取45mL无水乙醇于离心管,加入氯化钠,搅拌至有大量氯化钠析出为止(约需要5g)。
1.3对照品储备液(1.0mg/mL Tween 20)
称取100mg Tween 20于100mL容量瓶中,加入适量超纯水超声溶解后定容至100mL。标记,分装至15mL离心管中,-80℃保存,有效期6个月。
1.4标准曲线配制
1.5样品信息
其中IgG1蛋白溶液基质为水。
1.6样品前处理
分别取200μL供试品于2mL离心管中,加入800μL乙醇-氯化钠饱和溶液,充分混匀,再加入200μL乙醇-氯化钠饱和溶液小心清洗内壁(可根据实际需求,调整加入的供试品和乙醇-氯化钠饱和溶液的体积,满足体积比为1:5即可),以13000rpm转速离心10min,将上清液全部取出,设置氮吹温度为40℃,采用氮气吹扫法将上清液吹干,加入200μL超纯水,震荡至完全溶解,离心。得供试品溶液(经样品处理后的不含Tween 20的辅料溶液、不含Tween20的IgG1蛋白溶液以及含Tween 20的IgG1蛋白溶液)
2.仪器配制及参数设置
2.1仪器:Thermo U3000 CAD
2.2色谱柱:Waters Oasis MAX 30μm,2.1×20mm
2.3柱温:40℃
2.4柱后阀切换参数:通道1连接色谱柱柱后,通道2接入检测器,通道6接入废液,在MSV Time Program中,设置0.00-3.20min,接入废液,3.21-8.70min,接入检测器,8.70-12.00min,接入废液,检测流程如图1:
2.5自动进样器:8℃;进样体积:20μL
2.6CAD检测器参数:Evaporator Temperature选择High;Filter 3.6;DataCollection Rate5;Wait Ready±5;
2.7泵参数设定:流速1.0mL/min;梯度洗脱;停止时间12.0min;压力上限300bar;压力下限0bar。
2.8洗脱梯度
3.方法验证
3.1专属性
按上述液相条件,分别进样经处理的不含Tween 20的辅料溶液,不含Tween 20的IgG1蛋白溶液,以及含Tween 20的IgG1蛋白溶液和0.2mg/mL的Tween 20标准品,结果见下表,叠图见图2。1和2号样品与4号样品Tween 20峰面积的百分比分别为1.8%和0.7%,说明样品中存在的辅料和蛋白对方法干扰较小。
/>
3.2线性分别制备不同浓度的Tween 20标准品溶液进行检测(0.05mg/mL、0.10mg/mL、0.20mg/mL、0.30mg/mL、0.40mg/mL、0.50mg/mL),以Tween 20理论浓度为X轴,峰面积为Y轴,计算二项式拟合方程及决定系数r
3.3准确度
用Tween 20对照品储备溶液、不含Tween 20的IgG1蛋白溶液和不含Tween 20的辅料溶液分别按比例配制(专属性已经验证干扰较小),得到低(0.05mg/mL)、中(0.20mg/mL)、高(0.50mg/mL)三个浓度水平的样品溶液,高、低浓度水平的样品平行制备3份,各进样1次,分别以0.05mg/mL、0.20mg/mL和0.50mg/mL的浓度值为理论值,检测结果为实际值,计算回收率,结果详见下表。各浓度回收率均在98.8%-114.0%之间,准确度较好。
*回收率=测定含量/理论含量*100
3.4重复性
用Tween 20对照品储备溶液、不含Tween 20的IgG1蛋白溶液和不含Tween 20的辅料溶液分别按比例配制(专属性已经验证干扰较小),得到0.20mg/mL浓度水平的样品溶液,平行制备6份,各进样1次,计算6针样品溶液Tween 20含量的RSD值,结果见下表,6针重复性样品的RSD为2.7%,说明该方法重复性良好。
3.5耐用性
以含0.20mg/mL Tween的IgG1蛋白溶液为供试品,置于8℃样品盘,分别在0h、24h和48h时间点进样1针,考察含0.20mg/mL Tween的IgG1蛋白溶液稳定性,结果见下表,24h、48h与0h的RD值分别为0.0%和4.9%,说明含0.20mg/mL Tween的蛋白样品在8℃条件下放置48h稳定。
实施例2:检测聚山梨醇酯80
1.相关溶液配制
1.1流动相配制
流动相A(0.5%甲酸水)
量取980mL超纯水至量筒中,加入5mL甲酸,加适量超纯水至1L;转移至溶剂瓶,2-8℃保存,有效期1个月。
流动相B(0.5%甲酸异丙醇)
量取980mL异丙醇至量筒中,加入5mL甲酸,加适量异丙醇至1L;转移至溶剂瓶,2-8℃保存,有效期1个月。
1.2乙醇-氯化钠饱和溶液
移取45mL无水乙醇于离心管,加入氯化钠,搅拌至有大量氯化钠析出为止(约需要5g)。
1.3对照品储备液(1.0mg/mL Tween 80)
称取100mg Tween 80于100mL容量瓶中,加入适量超纯水超声溶解后定容至100mL。标记,分装至15mL离心管中,-80℃保存,有效期6个月。
1.4标准曲线配制
1.5样品信息
其中IgG2蛋白溶液基质为水。
1.6样品前处理
分别取200μL供试品(于2mL离心管中,加入800μL乙醇-氯化钠饱和溶液,充分混匀,再加入200μL乙醇-氯化钠饱和溶液小心清洗内壁(可根据实际需求,调整加入的供试品和乙醇-氯化钠饱和溶液的体积,满足体积比为1:5即可),以13000rmp转速离心10min,将上清液全部取出,设置氮吹温度为40℃,采用氮气吹扫法将上清液吹干,加入200μL超纯水,震荡至完全溶解,离心。得供试品溶液(经样品处理后的不含Tween 80的辅料溶液、不含Tween80的IgG2蛋白溶液以及含Tween 80的IgG2蛋白溶液)。
2.仪器配制及参数设置
2.1仪器:Thermo U3000 CAD
2.2色谱柱:Waters Oasis MAX 30μm,2.1×20mm
2.3柱温:40℃
2.4柱后阀切换参数:通道1连接色谱柱柱后,通道2接入检测器,通道6接入废液,在MSV Time Program中,设置0.00-3.20min,接入废液,3.01-8.50min,接入检测器,8.51-12.00min,接入废液,检测流程如图1所示。
2.5自动进样器:8℃;进样体积:20μL
2.6CAD检测器参数:Evaporator Temperature选择High;Filter 3.6;DataCollection Rate5;Wait Ready±5;
2.7泵参数设定:流速1.0mL/min;梯度洗脱;停止时间12.0min;压力上限300bar;压力下限0bar。
2.8洗脱梯度
3.实验结果
3.1专属性
按上述液相条件,分别进样经处理的不含Tween 80的辅料溶液,不含Tween 80的IgG2蛋白溶液,以及含Tween 80的IgG2蛋白溶液和0.40mg/mL的Tween 80标准品,结果见下表,叠图见图3。1和2号样品与4号样品Tween 80峰面积的百分比分别为1.5%和2.1%,说明样品中存在的辅料和蛋白对检测方法干扰较小。
3.2线性
分别制备不同浓度的Tween 80标准品溶液进行检测(0.10mg/mL、0.20mg/mL、0.40mg/mL、0.60mg/mL、0.80mg/mL),以Tween 80理论浓度为X轴,峰面积为Y轴,计算二项式拟合方程及决定系数r
经试验验证,本发明的液相检测法可适用于聚山梨醇酯20/80含量的检测,通用性好。
实施例3:检测IgG1蛋白溶液中的聚山梨醇酯20
1.样品信息
2.取供试品分别在无柱后切换和有柱后切换条件下连续进样20针,由结果可知在柱后切换条件下,连续进样检测得到的聚山梨醇酯20检测结果更稳定。检测结果汇总图如图4所示。
